硒治疗自身免疫性甲状腺疾病的荟萃分析
房方 卫红艳 王坤玲 朱梅
·荟萃分析·
硒治疗自身免疫性甲状腺疾病的荟萃分析
房方 卫红艳 王坤玲 朱梅
目的评价元素硒治疗自身免疫性甲状腺疾病(AITD)的有效性和安全性。方法通过5个数据库(MEDLINE,Cochrane Central Register of Controlled Trials,中国期刊全文数据库,中国生物医学文献数据库和维普数据库)检索所有研究元素硒治疗AITD的随机对照试验(RCT)。由两名研究者独立筛选文献、提取数据和进行结果的统计分析。将结果数据形式一致的同类临床试验的结果进行荟萃分析,对不能荟萃分析的数据进行描述性分析。共纳入30项RCT,涉及2 963例AITD患者。结果(1)与对照组相比,硒治疗组桥本甲状腺炎患者甲状腺过氧化物酶抗体(TPOAb)和甲状腺球蛋白抗体(TgAb)水平明显下降[标准化均数差(SMD)=-1.35, 95%CI: -1.93~-0.67,P<0.000 01和SMD=-0.92,95%CI: -1.53~-0.31,P<0.01]。(2)硒治疗组与对照组相比,Graves病患者促甲状腺激素受体抗体(TRAb)水平降低(均数差=-2.5,95%CI:-2.99~-2.01,P<0.000 01)。(3)元素硒可以降低Graves病患者血清游离T3(FT3)和游离T4(FT4)水平(均数差=-1.57,95%CI: -2.56~ -0.58,P<0.001和均数差=-3.74,95%CI: -5.65~ -1.82,P=0.000 01),但对桥本甲状腺炎患者FT3、FT4和促甲状腺激素的作用不明显(P均>0.05)。结论对AITD患者使用200 μg/d的元素硒治疗3~12个月,能够有效降低抗甲状腺自身抗体(TPOAb, TgAb和TRAb)的水平,并具有较好的安全性。
硒;自身免疫性甲状腺疾病;桥本甲状腺炎;Graves病
自身免疫性甲状腺疾病(AITD)是指血清中存在针对抗甲状腺的自身抗体,甲状腺中存在浸润淋巴细胞的一组器官特异性自身免疫性疾病[1]。目前AITD的治疗方法主要是针对甲状腺功能亢进症(甲亢)和甲状腺功能减退症(甲减)的治疗,而抑制自身免疫反应、降低甲状腺自身抗体仍无理想的方法。糖皮质激素和免疫抑制剂虽然可以减轻自身免疫反应,但其严重的不良反应限制了此类药物的广泛应用。
硒是人体必需的微量元素,是多种酶活性部位的基本组成成分,具有重要的生物学功能。甲状腺是人体硒含量最高的器官,硒蛋白是甲状腺滤泡上皮细胞所表达的多种功能性酶的重要组成成分,包括谷胱甘肽过氧化物酶(GPx)、脱碘酶、硫氧还蛋白还原酶、硒蛋白P等。硒不仅能够抗氧化而维持甲状腺细胞膜完整性、调节甲状腺激素代谢,还可以有效地提高机体的免疫功能,抑制甲状腺组织的自身免疫反应和慢性炎性反应的发生[2-4]。
目前国内、外已有多项关于硒治疗AITD的研究发表,但因大多样本量较小而无法为临床应用提供可靠的证据,因此关于AITD治疗的指南和专家共识中并未将硒纳入。本文旨在通过对多项随机对照试验(RCT)的结果进行荟萃分析而提高结果的可靠性,为硒治疗AITD在临床的广泛应用提供更有力的证据。
1 资料与方法
1.1 纳入和排除标准 纳入标准:受试对象为AITD患者,干预措施为含元素硒的化合物,研究类型为RCT。排除标准:评价硒联合其他药物疗效的试验;试验组与对照组基线不平衡的研究;受试对象除AITD外合并其他疾病的研究;研究生毕业论文而未经发表的研究。保留对照组所用药物与试验组中与硒联合的药物相同的试验,语种限定为中文和英文。
1.2 文献检索 本文共检索两个英文数据库(MEDLINE,Cochrane Central Register of Controlled Trials)和3个中文数据库(中国期刊全文数据库,中国生物医学文献数据库和维普数据库),所有检索均从建库至2015年4月。英文检索词包括:selenium,selenite,selenomethionine,selenium yeast,autoimmune thyroid disease,autoimmune thyroiditis,Hashimoto′s thyroiditis,Graves′ disease, postpartum thyroiditis,euthyroid thyroiditis,atrophic thyroiditis,painless thyroiditis;中文检索词包括:硒,亚硒酸盐,硒代蛋氨酸,硒酵母,自身免疫性甲状腺疾病,自身免疫性甲状腺炎,桥本甲状腺炎,格雷夫斯病,产后甲状腺炎,甲状腺功能正常的甲状腺炎,萎缩性甲状腺炎,无痛性甲状腺炎。
1.3 文献筛选 由两名研究者独立筛选文献。首先阅读检索到的所有文献的标题和摘要,排除明显不符合纳入标准的文献,对可能符合纳入标准的文献进一步阅读全文,根据纳入和排除标准确定是否纳入。如存在分歧,由两人讨论解决,如不能达成共识,则咨询第三位研究者。
1.4 数据提取和方法学质量评价 对于符合纳入标准的文献,由两名研究者使用自拟数据提取表,独立提取数据并交叉审核。提取内容包括:(1)一般资料:题目、作者姓名、发表日期和文献来源。(2)研究特征:研究对象的基本特征、各组受试者的基线可比性及干预措施。(3)结局指标:包括甲状腺自身抗体[甲状腺过氧化物酶抗体(TPOAb),甲状腺球蛋白抗体(TgAb),促甲状腺激素受体抗体(TRAb)]和甲状腺功能[游离T3(FT3),游离T4(FT4),促甲状腺激素(TSH)]。如遇分歧通过讨论或根据第三位研究人员的意见协商解决。按照Cochrane系统评价员手册5.0.2(Handbook 2008 Chapter 8.5)提供的RCT方法学质量评价标准评价纳入的RCT的方法学质量。每项研究的整体质量也依据Cochrane系统评价员手册5.0.2(Handbook 2008 Table 8.7.a)提供的方法进行评价。参照Jadad质量评分标准,将关键条目定义为:是否使用恰当的方法生成随机序列,是否使用盲法,是否存在并妥善处理不完整资料[5]。
1.5 统计学处理 数据分析方法参照Cochrane系统评价员手册5.0.2(Handbook 2008 Chapter 9),并使用由Cochrane协作网提供的Review Manager 5.0.25版软件。本研究所提取数据均为连续性变量,其结果以均数差和95%CI的形式表示。如果研究间的测量单位不统一,则以标准化均数差(SMD)的形式来表示。计算效应量时采用两组治疗前、后的变化量,可根据作者直接提供或者受试者治疗前后的数据运用特定公式(Handbook 2008 Chapter 16.1.3)计算得出。当各研究结果可进行合并时,实施荟萃分析,计算总体效应量时以固定效应模型为基础。通过卡方检验来对各研究进行异质性检验,当P<0.10时,各研究间异质性有统计学意义。各研究间由异质性而非抽样误差所造成的效应量偏差的百分比用I2来表示,其可对异质性大小进行定量描述。若找到异质性可能的来源,则进行亚组分析;如果不能找到异质性来源,则使用随机效应模型;如不能实施荟萃分析(按荟萃分析标准格式给出数据的研究小于两项),则使用描述性分析方法。当基于同一研究的不同文献提供了同一测量结果时,荟萃分析中的受试人数不重复累加。
2 结果
2.1 文献检索结果及纳入文献特征 初检出相关文献1 547篇(MEDLINE 843篇,Cochrane 52篇,中国生物医学文献数据库279篇,中国期刊全文数据库 174篇,维普数据库199篇),去除重复文献后,剩余文献1 278篇。经阅读题目和摘要,有1 215篇被排除,阅读剩余文献全文后,又有32篇因不符合纳入标准被排除,另有一篇文章所述结果各项指标的平均值均与既往已发表的另一篇研究完全相同,故排除此研究[6]。最终,共有30篇文献被纳入到此系统评价中。提取出纳入文献的基本特征(表1,表2)[6-35]。包含24项桥本甲状腺炎相关研究及6项Graves病相关研究。未发现有关于其他AITD(如产后甲状腺炎、萎缩性甲状腺炎、无痛性甲状腺炎等)的文献符合纳入标准。30项研究中共涉及2 963例AITD患者,其中2 428例桥本甲状腺炎及535例Graves病患者。

表1 纳入桥本甲状腺炎相关随机对照试验的基本特征
注:空格项目表示文献中未提供该信息;L-T4:左甲状腺素片;未完,续表见封3

表2 纳入Graves病相关随机对照试验的基本特征
注:空格项目表示文献中未提供该信息
2.2 纳入研究整体质量评价 有6项研究发生偏倚的风险较低[7,17,20-21,27,30]。有8项研究发生偏倚的风险中等[8-9,11-12,15,23-24,35]。其余16项研究发生偏倚的风险较高[6,10,13-14,16,18-19,22,25,26,28-29,31-34]。
2.3 干预措施的疗效评价
2.3.1 TPOAb 共有15项相关研究包含18个研究组报道了TPOAb且其数据可用于荟萃分析。结果显示,与对照组相比,硒可以显著降低桥本甲状腺炎患者的TPOAb水平(SMD=-1.35;95%CI:-1.93~-0.76,P<0.000 01,图1);另有4篇文献所提供的数据形式无法与其他文献的数据合并进行荟萃分析[15,19,23,27]。但其结果均提示与对照组相比,补充硒治疗可以降低桥本甲状腺炎患者的TPOAb水平(P<0.05);有4篇文献没有提供关于此参数的数据[10,17,20,29]。在Graves病相关研究中,共有2项研究报道了TPOAb且其数据可用于荟萃分析,与对照组相比,元素硒的使用使Graves病患者的TPOAb水平明显下降(均数差=-21.38; 95%CI: -25.64~ -17.13,P<0.000 01,图2)。另有1项研究所提供的数据形式无法与其他文献的数据合并进行荟萃分析,结果提示服用元素硒可降低血TPOAb水平,但与对照组相比,组间差异没有统计学意义(P>0.05)[32]。有3项研究没有提供关于此参数的数据[30-31,35]。
2.3.2 TgAb 共有11项相关研究包含14个研究组报道了TgAb且其数据可用于荟萃分析。与对照组相比,硒可以降低桥本甲状腺炎患者的TgAb水平(SMD=-0.92; 95%CI:-1.53 ~-0.31,P<0.01,图3);另有5篇文献所提供的数据形式无法与其他文献的数据合并进行荟萃分析,但其结果均提示与对照组相比,补充硒治疗可以降低桥本甲状腺炎患者的TgAb水平(P<0.05)[13,15,19,22,27]。有5篇文献没有提供关于此参数的数据[12,17,23,28-29]。在Graves病相关研究中,只有2项研究报道了TgAb,且因其所提供的数据形式不统一,故无法进行荟萃分析[32-33]。其中一项研究结果提示应用元素硒治疗组与对照组相比,可明显降低TgAb水平(P<0.01)[33]。另一项研究结果提示服用元素硒可降低血TgAb水平,但与对照组相比,差异没有统计学意义(P>0.05)[32]。另有3项研究没有提供关于此参数的数据[30-31,35]。

注:HT:桥本甲状腺炎;TPOAb:甲状腺过氧化物酶图1 硒治疗对HT患者血TPOAb水平的影响

注:TPOAb:甲状腺过氧化物酶抗体图2 硒治疗Graves病患者对TPOAb的影响
2.3.3 TRAb 共有3项Graves病相关研究报道了TRAb,结果表明,硒治疗组较对照组可明显降低TRAb水平(均数差=-2.5,95%CI:-2.99 ~-2.01,P<0.000 01,图4);另有2项研究没有提供关于此参数的数据[30-31]。
2.3.4 FT3共有10项桥本甲状腺炎相关研究包含13个研究组报道了FT3水平。与对照组相比,元素硒可轻度升高桥本甲状腺炎患者FT3水平,但差异无统计学意义(SMD=0.12,95%CI:-0.15 ~0.40,P>0.01,图5);在Graves病相关研究中,共有3项研究报道了FT3。与对照组相比,使用硒治疗可以使Graves病患者FT3水平下降(均数差= -1.57;95%CI: -2.56~ -0.58,P<0.01,图6)。
2.3.5 FT4在桥本甲状腺炎相关研究中,共有13篇包含16个研究组评价了FT4水平的变化。结果显示,硒治疗组较对照组可轻度升高FT4水平,但无统计学意义(SMD=0.35,95%CI: -0.07~0.78,P>0.01,图7)。有3项Graves病相关研究报道了FT4。与对照组相比,硒治疗可以显著降低FT4水平(均数差=-3.74,95%CI:-5.65~-1.82,P=0.000 01,图8)。

注:HT:桥本甲状腺炎;TgAb:甲状腺球蛋白抗体图3 硒治疗对HT患者TgAb的影响

注:TRAb:促甲状腺激素受体抗体图4 硒治疗对Graves病患TRAb的影响

注:HT:桥本甲状腺炎图5 硒治疗对HT患者血游离T3的影响

图6 硒治疗对Graves病患者血游离T3的影响
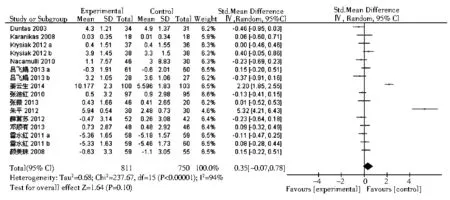
注:HT:桥本甲状腺炎图7 硒治疗对HT患者血游离T4的影响

图8 硒治疗对Graves病患者血游离T4的影响
2.3.6 TSH 共有13项相关研究包含15个研究组,以及2项Graves病相关研究评价了TSH水平的变化。结果均表明,硒治疗组与对照组相比,TSH水平的变化不具有统计学意义(SMD=-0.13,95%CI: -0.30~0.04,P>0.01和均数差=0.7,95%CI: -0.40~ 1.79,P>0.01),见图9,图10。
3 讨论
本荟萃分析共纳入30篇AITD相关研究,包括24篇桥本甲状腺炎及6篇Graves病相关研究,涉及2 963例AITD患者。结果表明,元素硒可以显著降低AITD患者甲状腺相关自身抗体(包括TPOAb、TgAb和TRAb)的水平,降低Graves病患者血清FT3和FT4水平,但对患者FT3、FT4和TSH的作用不明显。

注:HT:桥本甲状腺炎;TSH:促甲状腺激素图9 硒治疗对HT患者血TSH的影响

注:TSH:促甲状腺激素图10 硒治疗对Graves病患者血TSH的影响
甲状腺组织中的GPx是抗氧化系统的重要组成部分,可清除有毒的过氧化物(如H2O2)。而元素硒是GPx的重要组成元素,因此在硒缺乏状态下,体内堆积的过多H2O2会导致甲状腺组织的破坏,从而使大量甲状腺球蛋白和甲状腺过氧化物酶释放入循环中,引起自身免疫反应,导致AITD的发生[3-4]。与本研究补充元素硒能够有效降低AITD患者抗甲状腺自身抗体(包括TPOAb, TgAb和TRAb)水平的结论是一致的。
本研究中元素硒的使用可以降低Graves病患者血清FT3和FT4水平,但对患者FT3、FT4和TSH的作用不明显。考虑到可供纳入荟萃分析的硒治疗Graves病相关研究数目甚少(仅2~3篇),且样本量均较小、总体质量不高,因此目前尚无足够证据证实元素硒在治疗AITD中对血清甲状腺激素水平的影响的有效性。这与检索到的3篇既往关于硒治疗HT的荟萃分析文章的结论是一致的[4,36-37]。
纳入研究所使用的含元素硒的药物种类包括亚硒酸钠、硒代蛋氨酸和硒酵母,从各研究结果比较可以看出,各种类药物间疗效无明显区别。绝大多数研究治疗中使用元素硒剂量为200 μg/d,疗程3~12个月。总体不良反应较轻,仅有极个别受试者出现上腹部不适、皮疹等症状,且所出现不良反应与服用元素硒间的相关性并不明确。由此推测,在临床实践中,AITD患者接受200 μg/d的元素硒治疗3~12个月,具有较好的安全性。
本文对评价元素硒治疗AITD的研究进行了系统而广泛的检索,不仅涵盖了桥本甲状腺炎相关研究,还纳入了Graves病相关研究,而这是既往已发表的相关荟萃分析文章所未涉及的。本研究结果表明,元素硒可以显著降低AITD患者甲状腺相关自身抗体(包括TPOAb、TgAb和TRAb)水平,从而保护甲状腺组织,改善AITD病情。但因所纳入的部分研究没有对具体的随机分组方式进行详细描述,且部分研究没有提及是否使用盲法及分配隐藏、没有详细描述对不完整资料的处理方式和是否存在选择性报告偏倚,因此所纳入研究的总体方法学质量在一定程度限制了本文的结果作为临床证据的可靠性。在今后的研究中,应该有更多大样本、高质量的RCT来为硒治疗AITD的有效性和安全性提供依据。
[1] Tomer Y. Mechanisms of autoimmune thyroid diseases: from genetics to epigenetics[J]. Annu Rev Pathol,2014,9:147-156. DOI: 10.1146/annurev-pathol-012513-104713.
[2] 张怡, 袁卫红. 硒与自身免疫性甲状腺疾病[J]. 国际放射医学核医学杂志, 2012, 36(6):376-379. DOI: 10.3760/cma.j.issn.1673-4114.2012.06.013.
[3] Duntas LH. Selenium and the thyroid: a close-knit connection[J].J Clin Endocrinol Metab,2010,95(12):5180-5188. DOI: 10.1210/jc.2010-0191.
[4] 金晶, 胡耀敏, 刘伟. 硒治疗自身免疫性甲状腺炎的系统评价[J]. 上海交通大学学报(医学版), 2010, 30(11):1356-1360. DOI: 10.3969/j.issn.1674-8115.2010.11.009.
[5] Jadad AR, Moore RA, Carroll D, et al. Assessing the quality of reports of randomized clinical trials: is blinding necessary[J]. Control Clin Trials, 1996,17(1):1-12.
[6] 朱平, 周冬梅, 李伟. 硒制剂治疗桥本甲状腺炎伴甲减患者30例临床疗效[J]. 中国老年学杂志, 2012, 32(8):1710-1711. DOI: 10.3969/j.issn.1005-9202.2012. 08.082.
[7] Gärtner R, Gasnier BC, Dietrich JW,et al. Selenium supplementation in patients with autoimmune thyroiditis decreases thyroid peroxidase antibodies concentrations[J]. J Clin Endocrinol Metab,2002,87(4):1687-1691.
[8] Duntas LH, Mantzou E, Koutras DA. Effects of a six month treatment with selenomethionine in patients with autoimmune thyroiditis[J].Eur J Endocrinol,2003,148(4):389-393.
[9] Gärtner R, Gasnier BC. Selenium in the treatment of autoimmune thyroiditis[J].Biofactors,2003,19(3-4):165-170.
[10] 王栋钢, 雷培芸, 杨咏梅, 等. 硒对儿童桥本甲状腺炎的影响[J]. 广东微量元素科学, 2004, 11(2):34-36.
[11] Turker O, Kumanlioglu K, Karapolat I,et al. Selenium treatment in autoimmune thyroiditis: 9-month follow-up with variable doses[J].J Endocrinol,2006,190(1):151-156.
[12] Karanikas G, Schuetz M, Kontur S, et al. No immunological benefit of selenium in consecutive patients with autoimmune thyroiditis[J].Thyroid,2008,18(1):7-12. DOI: 10.1089/thy.2007.0127.
[13] 颜美珠, 王曙, 缪婕, 等. 硒在桥本甲状腺炎中的作用[J]. 中华内分泌代谢杂志, 2008, 24(2):194-195. DOI:10.3321/J.ISSN.1000-6699.2008.02.026.
[14] Bonfig W, Gärtner R, Schmidt H. Selenium supplementation does not decrease thyroid peroxidase antibody concentration in children and adolescents with autoimmune thyroiditis[J].SciWorld J,2010,10:990-996. DOI: 10.1100/tsw.2010.91.
[15] Nacamulli D, Mian C, Petricca D, et al. Influence of physiological dietary selenium supplementation on the natural course of autoimmune thyroiditis[J].Clin Endocrinol (Oxf),2010,73(4):535-539. DOI: 10.1111/j.1365-2265.2009.03758.x.
[16] 张洁红, 张彤, 段敏虹, 等. 硒对成人桥本甲状腺炎的影响[J]. 中国实用医刊, 2010, 37(9):40-41. DOI: 10.376/cma.j.issn.1674- 4756.2010.09.018.
[17] Krysiak R, Okopien B. The effect of levothyroxine and selenomethionine on lymphocyte and monocyte cytokine release in women with Hashimoto′s thyroiditis[J].J Clin Endocrinol Metab,2011,96(7):2206-2215.DOI: 10.1210/jc.2010-2986.
[18] 雷水红, 蔡霞, 李经, 等. 硒联合抑亢丸、甲巯咪唑治疗桥本甲状腺炎性甲亢的疗效观察[J]. 山东医药, 2011, 51(37):88-89.
[19] Anastasilakis AD, Toulis KA, Nisianakis P,et al. Selenomethionine treatment in patients with autoimmune thyroiditis: a prospective, quasi-randomised trial[J].Int J Clin Pract,2012,66(4):378-383. DOI: 10.1111/j.1742-1241.2011.02879.x.
[20] Bhuyan AK, Sarma D, Saikia UK. Selenium and the thyroid: a close-knit connection[J].Indian J Endocrinol Metab,2012,16(Suppl 2):S354-S355. DOI: 10.4103/2230-8210.104090.
[21] Krysiak R, Okopien B. Haemostatic effects of levothyroxine and selenomethionine in euthyroid patients with Hashimoto′s thyroiditis[J].Thromb Haemost,2012,108(5):973-980. DOI: 10.1160/TH12-04-0275.
[22] 薛冀苏, 幸思忠. 补硒治疗对桥本氏甲状腺炎的临床观察研究[J]. 当代医学, 2012, 18(12):90-91. DOI: 10.3969/j.issn.1009-4393.2012.12.062.
[23] 朱琳, 白雪, 腾卫平, 等. 硒对自身免疫性甲状腺炎自身抗体的影响[J]. 中华医学杂志, 2012, 92(32):2256-2260. DOI: 10.3760/cma.j.issn.0376-2491.2012.32.008.
[24] 邓顺有, 陈小燕, 吴琳英, 等. 硒对甲状腺功能正常的桥本甲状腺炎的影响研究[J]. 中国全科医学, 2013, 16(7C):2483-2485. DOI: 10.3969/j. issn.1007-9572.2013.07.089.
[25] 吕飞娟, 杨燕玲, 许景生, 等. 亚硒酸钠治疗桥本甲状腺炎的临床观察[J]. 临床军医杂志, 2013, 41(1):35-41.DOI:10.3969/j.issn.1671-3826.2013.01.018.
[26] 张薇, 王俊芳, 李京丽, 等. 硒对桥本甲状腺炎患者TPOAb及TGAb水平的影响[J]. 中国医学创新, 2013, 10(14):13-14. DOI: 10.3969/j.issn.1674-4985.2013.14.007.
[27] Eskes SA, Endert E, Fliers E,et al. Selenite supplementation in euthyroid subjects with thyroid peroxidase antibodies[J]. Clin Endocrinol (Oxf),2014,80(3):444-451. DOI: 10.1111/cen.12284.
[28] 姜云生. 硒酵母治疗桥本病100例分析[J]. 吉林医学, 2014, 35(11):2303-2304.
[29] 曾秀琴, 马卫英. 硒酵母降低桥本甲状腺炎相关抗体滴度的疗效观察[J]. 实用糖尿病杂志, 2014, 10(2):57-58.
[30] Claudio M, George JK, Gerasimos EK, et al. Selenium and the course of mild Graves′ orbitopathy[J]. N Engl Med, 2011, 364(20):1921-1931.DOI:10.1056/NEJMoa1012985.
[31] 杜映红, 毛睿睿. 硒联合甲巯咪唑治疗Graves′病患者的临床研究[J]. 湖南中医药大学学报, 2013, 33(12):73-108. DOI: 10.3969/j.issn.1674-070X.2013.12.042.073.01.
[32] 王俊芳, 张薇, 李京丽, 等. 硒对Graves′病患者血清TPOAb、TGAb水平的影响[J]. 中西医结合心脑血管病杂志, 2013, 11(4):502-503.DOI:10.3969/j.issn.1672-1349.2013.04.062.
[33] 朱翠颜, 王筱菁, 邓承宗. 硒对弥漫性毒性甲状腺肿自身免疫抗体的影响[J]. 吉林医学, 2013, 34(16):3147-3148.DOI:10.3969/j.issn.1004-0412.2013.16.039.
[34] 黄珊, 谢珊, 冼碧霞. 微量元素硒对弥漫性甲状腺肿的影响及其护理探讨[J]. 海南医学, 2014, 25(10):1546-1547. DOI: 10.3969/j.issn.1003-6350.2014.10.0601.
[35] 赖景雄. 硒酵母片联合甲巯咪唑治疗Graves′病疗效观察[J]. 药物流行病学杂志, 2014, 23(8):472-474.
[36] Toulis KA, Anastasilakis AD, Tzellos TG,et al. Selenium supplementation in the treatment of Hashimoto′s thyroiditis: a systematic review and a meta-analysis[J].Thyroid,2010,20(10):1163-1173. DOI:10.1089/thy.2009.0351.
[37] van Zuuren EJ, Albusta AY, Fedorowicz Z, et al. Selenium supplementation for Hashimoto′s thyroiditis[J].Cochrane Database Syst Rev,2013,6:CD010223. DOI: 10.1002/14651858.CD010223.pub2.
Ameta-analysisofseleniuminthetreatmentofautoimmunethyroiddiseases
FangFang,WeiHongyan,WangKunling,ZhuMei.
DepartmentofEndocrinology,TheGeneralHospital,TianjinMedicalUniversity,Tianjin300052,China
Correspondingauthor:ZhuMei,Email:meichuqin@163.com
ObjectiveTo assess the effectiveness and safety of selenium in the treatment of autoimmune thyroid diseases (AITD).MethodsFive databases (MEDLINE, Cochrane Central Register of Controlled Trials, CBM, CNKI and VIP) were searched for all randomized controlled trial (RCT) which investigating the effectiveness of selenium in the treatment of AITD. Two authors independently selected studies, extracted data and analyzed the results. Meta-analyses were performed when more than one study with sufficient similarity provided data on an outcome. Thirty RCTs were included involving 2 963 patients with AITD.Results(1) Compared with control group, serum thyroid peroxidase antibody (TPOAb)and thyroglobulin antibody (TgAb) were reduced in patients with Hashimoto′s thyroiditis treated with selenium[standardized mean difference (SMD) =-1.35(95%CI:-1.93 to -0.67,P<0.000 01) , -0.92(95%CI:-1.53 to -0.31,P<0.01), respectively]. (2) Compared with control group, the concentration of thyrotropin receptor antibody (TRAb) was significantly decreased in patients of Graves′ disease treated with selenium [mean difference (MD)=-2.5, 95%CI-2.99 to -2.01,P<0.000 01]. (3) Serum concentrations of free T3(FT3) and free T4(FT4) were significantly reduced in patients of Graves′ disease treated with selenium (MD=-1.57, 95%CI:-2.56 to -0.58,P<0.001 and MD=-3.74, 95%CI:-5.65 to -1.86,P=0.000 01), but serum FT3, FT4and thyroid stimulating hormone in patients of Hashimoto′s thyroiditis treated with selenium were not significantly decreased(allP>0.05).ConclusionSelenium supplementation of 200 μg/d for 3 to 12 months in patients with AITD can effectively decrease the concentration of anti-thyroid autoimmune antibodies (including TPOAb, TgAb and TRAb), and have safety profile.
Selenium;Autoimmune thyroid disease;Hashimoto′s thyroiditis;Graves′ disease
10.3760/cma.j.issn.1673-4157.2016.04.09
300052 天津医科大学总医院内分泌科
朱梅,Email:meichuqin@163.com
2015-08-24)

