铜胁迫对轮叶黑藻无菌苗生理代谢的影响
母丹丹汝双燕李 涛赵进东
(1. 中国科学院水生生物研究所, 武汉 430072; 2. 中国科学院大学, 北京 100049)
研究简报
铜胁迫对轮叶黑藻无菌苗生理代谢的影响
母丹丹1,2汝双燕1,2李 涛1赵进东1
(1. 中国科学院水生生物研究所, 武汉 430072; 2. 中国科学院大学, 北京 100049)
随着工农业生产的发展, 向环境中排放的重金属日趋增加, 土壤、地表水、地下水受到的污染日趋严重。所谓重金属是指原子量大于铁或密度大于5.0 g/cm3的金属, 如汞、镉、铅、铜、镍、锌等, 采矿、冶金、化工、石油、电镀等多种工业行业的生产废水均含有重金属元素。而重金属废水是对环境危害最严重和对人类危害最大的工业废水[1]。铜作为一种重要的高毒性重金属污染物, 关于其对自然水体或模拟的人工水体毒害的研究国内已有一些报道[2—4]。沉水植物作为水体生态系统中行驶重要生态和环境功能的初级生产者, 具有很强的修复重金属污染水体的潜力[5]。轮叶黑藻是一种广泛分布于我国各个湖泊的沉水植物, 其在改善水质、维持水质稳定以及增加生物多样性方面具有良好的生态效益, 水质、温度、溶解氧、营养盐状况都会影响黑藻的生长与存活[6]。铜元素是轮叶黑藻所必需的微量元素, 摄入过多的铜会使轮叶黑藻生长受到抑制甚至死亡。过量的重金属离子的吸收和富集对水生植物产生怎样的影响?曾阿妍[7]发现黑藻对Cu2+有较好的净化能力, 随着培养溶液中的铜离子浓度的逐渐增加, 黑藻中的叶绿素含量逐渐降低。周长芳等[8]在Hoagland培养基中加入CuSO4以模拟水体Cu2+污染环境, 研究重金属对水花生各项生理指标的影响, 发现水花生可溶性蛋白随Cu2+浓度的升高而直线下降。徐勤松等[9]发现重金属Cd、Zn单一及复合污染都使水车前细胞内的保护酶SOD、POD和CAT活性比例失调, 植物体内活性氧的产生和清除失衡, 这都导致植物的生理代谢紊乱, 从而加速植物的衰老和死亡。
目前已报道的研究[10—13]所采用的材料大都为自然生长的植株, 取材受季节的限制, 实验结果在一定程度上会受到其他生物尤其是水体内的微生物的影响。微生物可以调控植物性状表达, 影响植物的性能, 进而影响各种生态系统功能[14]。为了消除以上影响, 本文以轮叶黑藻无菌苗为材料, 研究了Cu2+胁迫条件下轮叶黑藻无菌苗的光合色素、ATP 酶的活性以及抗氧化系统等生理功能的变化, 为进一步研究植物应对重金属逆境胁迫的响应机制提供参考。
1 材料与方法
1.1 实验材料
轮叶黑藻无菌苗培养方法[15]: 选取生长健壮的轮叶黑藻, 用碱性洗涤剂浸泡0.5h, 然后在自来水冲洗1h, 在无菌工作间, 取带腋芽的健壮茎置于培养皿中, 用75%乙醇灭菌30s, 无菌水反复冲洗3次, 用0.1%的氯化汞消毒2min, 再用无菌水反复冲洗5次。将消毒处理后的轮叶黑藻茎剪成5—10 mm长, 辨认形态学上端后, 置于MS(Murashige Skoog Medium)固体培养基[含0.5 mg/L的6-氨基嘌呤(6-BA), 0.1 mg/L的萘乙酸(IAA), pH5.8—6.0]诱导芽分化。7d左右茎间侧芽萌发, 15d左右长至1.0 cm,然后转入1/2MS (NH4NO3、KNO3、CaCl2·2H2O、MgSO4·7H2O、KH2PO4减半)液体继代培养基(含0.5 mg/ L的6-BA, 0.1 mg/L的IAA, pH 5.8—6.0)继代培养15d后,转入1/2 MS液体继代培养基(含0.1 mg/L 的IAA, pH 5.8—6.0)进行生根培养以得到完整的无菌苗, 时长为7d。整个组培过程在培养室进行, 培养温度为(25±2)℃,每天光照12h, 光照强度为40 μe/(m2·s)。
铜标准溶液的配制[16]: 将3.9 g CuSO4·5H2O溶于少量水中, 滴入少量硫酸, 移入1000 mL容量瓶中, 用水稀释至刻度, 摇匀, 灭菌保存。此溶液含铜1.0 mg/mL。
1.2 实验设计
选取生长状况一致的轮叶黑藻无菌苗在无铜1/2MS液体培养基中预培养3d, 然后分别加入已灭菌的CuSO4·5H2O(AR)标准液至铜离子浓度为0、0.5、1.0、5.0和10.0 mg/L, 整个毒害实验都在全封闭培养箱中完成, 条件同培养黑藻无菌苗时一致。第3—4d时, 在相同的时间段内取出无菌苗, 去离子水洗净、揩干, 鲜重(FW)下进行各项指标测定, 实验重复3次。
1.3 实验方法
光合特征指标的测定 光合色素含量的测定采用Lichtenthaler[17]的方法, 通过紫外-可见分光光度计测量分析。
可溶性蛋白含量的测定 采用考马氏亮蓝G-250法[18]进行。
Na+K+-ATP酶(Na+K+-ATPase)和Ca2+Mg2+-ATP 酶(Ca2+Mg2+-ATPase)活性测定 使用南京建成生物工程研究所购买的ATP酶试剂盒测定。
SOD、POD和CAT 活性的测定 取材置于预冷的研钵中, 加入0.05 mol/L的磷酸缓冲液(pH7.8), 冰浴,研磨, 10000 r/min, 低温离心20min, 取上清液。SOD、CAT活性用一般分光光度法; POD活性用愈创木酚法[19]测定。
数据分析 运用excel分析各测定指标与处理浓度间的相关性(r)并绘制图, 用相关系数r表示, 各指标与Cu2+浓度进行相关系数统计; 以 P<0.05为显著相关,P<0.01为极显著相关。由SPSS19.0统计软件对个数据均值进行单因素方差分析, 完成数值间的差异性分析; 以P<0.05为差异显著, P<0.01为差异极显著。结果以“均值±标准差”表示。本文图表中的不同小写字母表示数值之间差异显著(P<0.05), 相同字母表示差异不显著(P>0.05)。
2 结果
2.1 Cu2+对轮叶黑藻无菌苗光合色素含量的影响
随着Cu2+浓度的增加, 各种光合色素的含量均呈现下降的趋势(图 1)。最高浓度为10 mg/L时, 叶绿素a(Chl.a)、叶绿素b (Chl.b)、类胡萝卜素(Car)的含量依次降为对照组的48.1%、80.1%和9.5%。可见, Chl.a、Chl.b和Car的含量下降趋势整体上保持一致。经相关性及显著性分析, Chl.a、Car与Cu2+浓度均呈现极显著负相关(相关系数分别为r= -0.82, r= -0.90; P<0.01), Chl.b与Cu2+浓度呈现显著负相关(相关系数为r=-0.54;P<0.05)。对于Chl.a, 对照组与0.5 mg/L Cu2+处理组无显著性差异(P>0.05), 与其他组均有显著性差异(P<0.05);对于Chl.b, 对照组与0.5 和1.0 mg/L Cu2+处理组无显著性差异(P>0.05), 与5.0 和10.0 mg/L Cu2+处理组之间有显著性差异(P<0.05)。对于Car, 对照组与0.5 和1.0 mg/L Cu2+处理组无显著性差异(P>0.05), 与5.0和10.0 mg/L Cu2+处理组有显著性差异(P<0.05)。
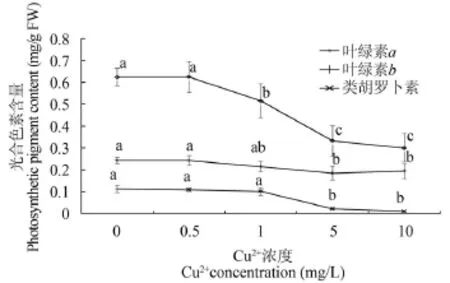
图 1 在Cu2+胁迫下轮叶黑藻无菌苗光合色素的含量变化Fig. 1 Effect of Cu2+stress on photosynthetic pigments contents in sterile seedlings of Hydrilla
2.2 Cu2+对轮叶黑藻可溶性蛋白含量变化的影响
在Cu2+胁迫下, 可溶性蛋白含量随着Cu2+浓度的增大呈现下降趋势(图 2), 在1.0 mg/L Cu2+处理时呈现回升趋势, 为对照组的93.7%; 而后随着处理浓度的加大, 可溶性蛋白含量也呈现骤降的趋势。经相关性分析可知,轮叶黑藻无菌苗可溶性蛋白的含量与Cu2+处理浓度呈极显著负相关(相关系数为r= -0.88, P<0.01); 显著性分析显示对照组和0.5、1.0 mg/L Cu2+处理组之间无显著性差异(P>0.05), 而与5.0、10.0 mg/L Cu2+处理组之间存在显著性差异, (P<0.05)。
2.3 Cu2+胁迫下轮叶黑藻无菌苗Na+K+-ATP酶、Ca2+Mg2+-ATP酶活性的变化
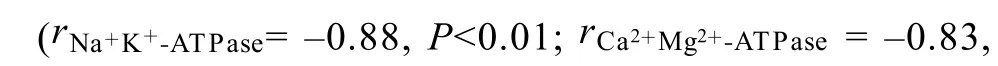
2.4 Cu2+胁迫对轮叶黑藻无菌苗SOD、POD和CAT活性的影响

图 2 Cu2+胁迫下轮叶黑藻无菌苗可溶性蛋白的含量变化Fig. 2 Effect of Cu2+stress on soluble protein in sterile seedlings of Hydrilla
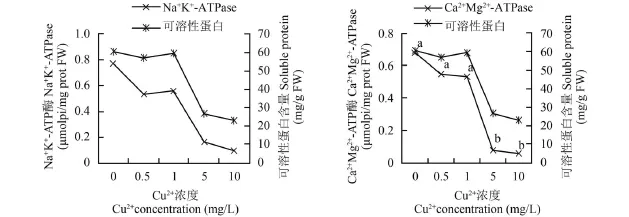
图 3 Cu2+对 Na+K+-ATPase和 Ca2+Mg2+-ATPase的影响Fig. 3 Effect of Cu2+stress on Na+K+-ATPase and Ca2+Mg2+-ATPase activity of Hydrilla
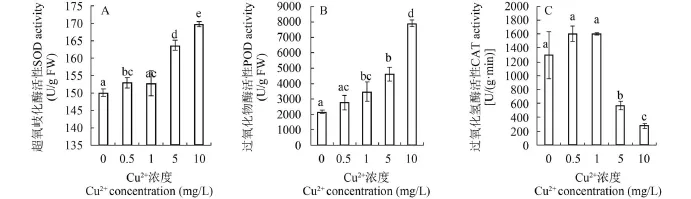
图 4 Cu2+对轮叶黑藻SOD、POD、CAT活性的影响Fig. 4 Effect of Cu2+stress on SOD, POD, CAT activity of Hydrilla
随着Cu2+浓度升高, SOD和POD的活性表现为上升,在Cu2+浓度为10.0 mg/L 时达到最大, 为对照组的1.1倍和3.6倍(图 4A、B); CAT的活性随Cu2+处理浓度升高均表现为先升后降趋势, 分别在Cu2+浓度为0.5 mg/L时达到峰值, 为对照组的1.2倍, 之后酶活性下降, 降为对照组21.5% (图 4C)。对数据进行相关性分析发现, SOD和POD活性变化与Cu2+处理浓度呈极显著正相关(相关系数为rSOD= 0.96, rPOD= 0.98, P<0.01); CAT活性与 Cu2+处理浓度呈极显著负相关(相关系数为rCAT= -0.90,P<0.01); 差异性分析显示, SOD活性对照组与1 mg/L Cu2+处理组无显著性差异(P>0.05), 与0.5、5.0和10.0 mg/ L Cu2+处理组存在显著性差异(P<0.05, 图 4)。POD活性对照组与0.5 mg/L Cu2+处理组无显著性差异(P>0.05), 与其他Cu2+处理组均存在显著性差异(P<0.05, 图 4B);CAT活性对照组与0.5、1.0 mg/L Cu2+处理组无显著性差异(P>0.05), 与其他Cu2+处理组存在显著性差异(P<0.05,图 4C)。
3 讨论
已有的报道[6—10]使用野外采集的沉水植物作为实验对象, 其实验结果会受到其他因素的干扰。朱丹婷等[6]在研究光强、温度、总氮浓度对黑藻生长的影响时, 也选择非无菌的材料, 且未灭菌的营养液可能存在其他共生植物; 张饮江等[12]选择了金鱼藻, 伊乐藻和苦草3种沉水植物研究去除水体中镉的效果, 实验所选择的水体为开放水体, 自然光照, 研究对象可能会受到不同程度的外界影响。本实验以轮叶黑藻无菌苗作为实验对象进行重金属胁迫研究, 尽可能的控制或排除其他不稳定因素的影响, 如光照、共生植物、水的运动以及人为作用等的干扰, 选择生长时间, 状况一致的无菌苗作为受试材料,在可控的环境中进行试验。
叶绿素含量与光合速率、营养状况等密切相关, 测定叶绿素的含量是表征植物生长状况重要标志[20]。本实验轮叶黑藻光合色素随着处理浓度的增加而下降, 这与徐勤松等[9]、曾阿研等[7]的研究结果一致。轮叶黑藻在Cu2+胁迫下, 0 Cu2+处理组与0.5 mg/L Cu2+处理组植物叶片仍旧鲜绿, 1.0 mg/L处理组植物叶片部分失绿, 而5.0、10.0 mg/L浓度组植物叶片几乎全部失绿变黑, 甚至死亡。谷巍等[21]用不同浓度的Hg2+和Cd2+溶液处理轮叶狐尾藻, Cd2+胁迫时, 植物叶片和茎出现黑色斑点, Hg2+胁迫时叶片和茎均褪绿, 未出现斑点。电镜观察显示, 叶细胞受毒害后, 染色质呈絮凝状, 膜系统解体、核糖体消失。由此可见, 重金属离子胁迫后, 沉水植物叶绿体的结构受到破坏, 光合色素含量下降, 进而影响植物正常的光合作用, 代谢紊乱。
植物在逆境或者衰老的情况下, 蛋白质合成速度减缓, 含量下降[22]。在本实验中, 可溶性蛋白含量随着Cu2+浓度的增大呈现下降趋势, 与贾荣等[23]以菹草无菌苗为材料在铜胁迫下可溶性蛋白含量的变化所得的结论基本一致。轮叶黑藻无菌苗在Cu2+浓度低于1.0 mg/L时,可溶性蛋白含量差异不显著, 这与植物本身的抗逆性反应有关; 而高于1.0 mg/L时, 植物的抗逆程度遭致破坏,无法正常维持内部环境的稳定, 因此无法满足自生生存需要, 导致死亡。
机体在缺氧及疲劳等状态下, ATP酶受到损伤, 活力
[1]Zhao S D. Marine heavy metals pollution and its poison effect on algae [J]. Journal of Qingdao Education College, 1999, 1: 41—43 [赵素达. 海洋重金属污染及其对海藻的毒害作用. 青岛教育学院学报, 1999, 1: 41—43]
[2]Wang A L, Song Z H, Cheng S J. The toxic effects of Cu2+on the duckweed [J]. Journal of Qingdao University of Science and Technology, 2004, 25(1):18—20 [王爱丽,宋志慧, 程守敬. Cu2+对浮萍的毒性作用. 青岛科技大学学报, 2004, 25(1): 18—20]
[3]Jia X Y, Chen Z W. The effects of Cu, Cd on superoxide activities in Carassius Auratus [J]. Acta Hydrobiologica Sinica, 2003, 27(3): 323—325 [贾秀英, 陈志伟. 铜、镉对鲫组织超氧化物歧化酶活性的影响. 水生生物学报,2003, 27(3): 323—325]
[4]Xu Q S , Shi G X, Wang X, et al. Generation of active oxygen and change antioxidant enzyme activity in Hydrilla verticillata under Cd2+, Cu2+and Zn2+stress [J].下降[19]。本实验结果显示: Na+K+-ATPase、Ca2+Mg2+-ATPase含量都随着Cu2+浓度的增加而下降。Na+K+-ATPase作为细胞中首位重要的离子泵, 主要负责Na+、K+离子的转运, 以响应细胞内各类生物化学反应, 进而维持体液内环境的稳态。Ca2+Mg2+-ATPase在金属离子的吸收中发挥重要作用, 负责植物的矿物元素的吸收和释放。可见, 重金属胁迫导致离子泵转运离子的能力紊乱, 进而影响整个植物生理代谢。
SOD、POD以及CAT是防御过氧化系统的重要保护酶, 能有效消除自由基, 因此SOD、POD和CAT都是反应植物的受损程度的逆境生理指标[24,25]。本研究发现SOD、POD的含量随铜离子浓度上升而上升, CAT的含量在低浓度时上升, 在高浓度Cu2+胁迫下CAT活性的急剧下降, 可能是由于自由基的积累导致。陈霖等[26]通过镍胁迫菹草无菌苗发现, SOD、POD和CAT的活性随镍离子浓度增加, 均表现为先升后降的趋势。这与本研究的结果不一致, 表明不同植物, 不同重金属离子存在不同的污染机制, 其原因有待进一步探讨。
综上所述, 在Cu2+胁迫下, 叶绿体结构受到破坏, 光合色素含量降低, 植物无法进行正常的光合作用; 可溶性蛋白和ATP酶系统的含量减少表明植物内部酶系统受到较大破坏, 无法维持正常的生理活动; Cu2+胁迫也可诱导活性氧等在植物体内大量积累, 抗氧化酶系统能在一定范围内降低体内活性氧的过量积累, 随着Cu2+的增加, 活性氧超过一定范围, 致使抗氧化酶系统负荷过重, 进而导致轮叶黑藻的稳态被破坏。1.0 mg/L的Cu2+浓度是本实验轮叶黑藻的耐受临界点, 超过这个界限, 轮叶黑藻的各项生理机能都遭致严重破坏, 代谢紊乱, 植株不能继续生长。Acta Hydrobiologica Sinica, 2006, 30(1): 107—112 [徐勤松, 施国新, 王学, 等. 镉、铜和锌胁迫下黑藻活性氧的产生及抗氧化酶活性的变化研究. 水生生物学报,2006, 30(1): 107—112]
[5]Su Q S, Yao W Z. Review submerged plant in relation to environment [J]. Agro-environmental Protection, 2002,21(6): 570-573 [苏胜齐, 姚维志. 沉水植物与环境关系评述. 农业环境保护, 2002, 21(6): 570—573]
[6]Zhu D T, Qiao N N, Li M H. Effects of light intensity,temperature, total nitrogen concentration and their interaction on Hydrilla verticillata [J]. Acta Hydrobiologica Sinica, 2011, 35(1): 88—97 [朱丹婷, 乔宁宁, 李铭红. 光强、温度、总氮浓度对黑藻生长的影响. 水生生物学报, 2011, 35(1): 88—97]
[7]Zeng A Y. Study on Cu2+biosorption characteristics of submersed macrophytes and its physiological reaction to environmental stress [D]. Jilin University. 2006 [曾阿妍.沉水植物对重金属Cu2+的吸附特征及其逆境生理研究.吉林大学. 2006]
[8]Zhou C F, Wu G R, Shi G X, et al. The role of antioxidant systems in Cu stress resistance in Alternanthera philoxeroides [J]. Acta Botanica Sinica, 2001, 43(4): 389—394 [周长芳, 吴国荣, 施国新, 等. 水花生抗氧化系统在抵御Cu2+胁迫中的作用. 植物学报, 2001, 43(4): 389—394]
[9]Xu Q S, Shi G X, Zhu H W. Effects of Cd and Zn combined pollution on chlorophyll content and scavenging system of activated Oxygen in Leaves of Ottelia alismoides (L.) [J]. Journal of Ecology, 2003, 22(1): 5—8[徐勤松, 施国新, 周红卫. Cd、Zn复合污染对水车前叶绿素含量和活性氧清除系统的影响. 生态学杂志, 2003,22(1): 5—8]
[10]Xue D F, Li Y X, Li J H, et al. Resistance and affection factors to high concentration of zinc uptake and accumulation by some emergent plants [J]. Ecology and Environmental Sciences, 2009, 18(2): 475—479 [徐德福, 李映雪, 李久海, 等. 几种挺水植物对重金属锌的抗性能力及其影响因素. 生态环境学报, 2009, 18(2): 475—479]
[11]Xue P Y, Li G X, Zhao Q L. Mechanisms of copper uptake by submerged plant Hydrilla verticillata and Myriophyllum spicatum L [J]. Environmental Science, 2014,35(5): 1878—1883 [薛培英, 李国新, 赵全利. 轮叶黑藻和穗花狐尾藻对铜的吸收机制研究. 环境科学, 2014,35(5): 1878—1883]
[12]Zhang Y J, Yi M, Wang C. Research on phytoremediation of cadmium contaminated water by three submerged macrophytes [J]. Journal of Shanghai Ocean University,2012, 21(5): 784—793 [张饮江, 易冕, 王聪. 3种沉水植物对水体重金属镉去除效果的实验研究. 上海海洋大学学报, 2012, 21(5): 784—793]
[13]Shen H, Huang H Z, Zhang H, et al. Compare analysis for phytoremediation of Cd2+contaminated water by three ornamental aquatic plants [J]. Journal of Hydroecology,2008, 1(1): 52—55 [申华, 黄鹤忠, 张皓, 等. 3种观赏水草对水体镉污染修复效果的比较研究. 水生态学杂志,2008, 1(1): 52—55]
[14]Marnie E Rout, Darlene Southworth. The root microbiome influences scales from molecules to ecosystems: The unseen majority [J]. American Journal of Botany, 2013,100(9): 1689—1691
[15]Jiang J H, Zhou C F, An S Q. Vast Propagation of submerged tool species Hydrilla verticillata with tissue culture method [J]. Journal of Lake Sciences, 2008, 20(2): 215—220 [蒋金辉, 周长芳, 安树青. 工具种轮叶黑藻的组织培养与快速繁殖. 湖泊科学, 2008, 20(2): 215—220]
[16]Huang L Z, Zeng G M, Huang D L, et al. Hydrilla verticillata(L. F.) Royle biological adsorption of copper ion and nickel ion [J]. Material Protection, 2010, 43(3): 72—74 [黄灵芝,曾光明, 黄丹莲, 等. 黑藻对铜离子和镍离子的生物吸附性. 材料保护, 2010, 43(3): 72—74]
[17]Long S F, Huang X S, Luo Y X, et al. Wet trapped spleen and stomach syndrome rats tissue Na+K+-ATPase activity of experimental research [J]. Journal of Chengdu University, 2007, 30(3): 36—37 [隆淑芬, 黄秀深, 罗玉熙, 等. 湿困脾胃证大鼠脑组织Na+K+-ATP酶活性的实验研究. 成都中医药大学学报, 2007, 30(3): 36—37]
[18]Huang Y S, Luo G H, Guan W. Peroxidation damage of oxygen free radicals induced by cadmium to plant [J]. Acta Botanica Sinica, 1997, 39(6): 522—526 [黄玉山, 罗广华, 关文. 镉诱导植物的自由基过氧化损伤. 植物学报, 1997, 39(6): 522—526]
[19]Li S, Ai Y W, Ala M S, et al. Astragalus membraneceus total glycosides of exhaustion exercise atpase activity in rat skeletal muscle [J]. Bulletin of Sport Science & Technology, 2010, 18(3): 110—111 [李爽, 艾英伟, 阿拉木斯,等. 黄芪总苷对力竭运动大鼠骨骼肌中ATP酶活性的影响. 体育科技文献通报, 2010, 18(3): 110—111]
[20]Wu W H. Plant Physiology [M]. Beijing: Science Press. 2003, 212—429 [武维华. 植物生理学. 北京: 科学出版社. 2003, 212—429]
[21]Gu W, Shu G X, Han C H, et al. The toxicity damage effect of Hg2+and Cd2+pollution on Myriophyllum verticillatum Linn [J]. China Environmental Science, 2001, 21(4)371—375 [谷巍, 施国新, 韩承辉, 等. 汞, 镉污染对轮叶狐尾藻的毒害. 中国环境科学, 2001, 21(4): 371—375]
[22]Bohm P, Wolterbeek H, Verburg T, et al. The use of tree bark for environmental pollutuin monitoring in the Czech Republic [J]. Environmental Science and Pollution Research, 1998, 102: 243—250
[23]Jia R, Shi G X, Qiao X Q, et al. Hg2+stress on physiolo-gical metabolism in sterile seedlings of Potamogeton crispus L. [J]. Journal Lake Sciences, 2012, 24(6): 899—904[贾荣, 施国新, 乔绪强, 等. 汞胁迫对菹草无菌苗生理代谢的影响. 湖泊科学, 2012, 24(6): 899—904]
[24]Best E P H. Effects of nitrogen on the growth and nitrogenous compounds of Ceratophyllum demersum [J]. Journal Aquatic Botany, 1980, 8(2): 197—206
[25]Lei Z X, Xie Y F. Study on the Purification of eutrophicated water with aquatic macrophytes [J]. Journal of Anhui Agricultural Sciences, 2006, 34(3): 553—554 [雷泽湘, 谢贻发. 大型水生植物对富营养化湖水净化效果的试验研究. 安徽农业科学, 2006, 34(3): 553 —554]
[26]Chen L, Jiang Y, Wang P H, et al. Effect of nickel stress on reactive oxygen species and proline metabolism of Potamogeton crispus L. [J]. Journal Lake Sciences, 2013,25(1): 131—137 [陈霖, 姜岩, 王鹏合, 等. 镍胁迫对菹草活性氧及脯氨酸代谢的影响. 湖泊科学, 2013, 25(1): 131—137]
EFFECT OF COPPER STRESS ON PHYSIOLOGICAL METABOLISM IN STERILE SEEDLINGS OF HYDRILLA VERTICILLATA (L. F.) ROYLE
MU Dan-Dan1,2, RU Shuang-Yan1,2, LI Tao1and ZHAO Jin-Dong1
(1. Institute of Hydrobiology, Chinese Academy of Science, Wuhan 430072, China; 2. University of chinese Academy Sciences, Beijing 100049, China)
轮叶黑藻无菌苗; Cu2+胁迫; 光合色素; 可溶性蛋白; ATP酶; 抗氧化酶系统
Sterile seedlings of Hydrilla verticillata (L. F.); Cu2+stress; Chlorophyll content; Soluble protein; ATPase; Antioxidant enzyme system
10.7541/2016.56
Q948.1
A
1000-3207(2016)02-0419-06
2015-03-05;
2015-07-25
国家水体污染与治理科技重大专项项目(2012ZX07105004)资助 [Supported by Major Science and Technology Project of Water Pollution control and management in China (2012ZX07105004)]
母丹丹(1990—), 女, 羌族; 四川绵阳人; 硕士研究生; 研究方向为藻类基因组学。E-mail: dia_533@163.com
李涛, E-mail: litao@ihb.ac.cn

