喷雾干燥法中药益生元微胶囊的制备及体外控释分析
胡 锐,周广萍,宋维春
(1.海南热带海洋学院,海南三亚 572022;2.海南原漾食品科技有限公司,海南三亚 572022)
喷雾干燥法中药益生元微胶囊的制备及体外控释分析
胡 锐1,周广萍2*,宋维春1
(1.海南热带海洋学院,海南三亚 572022;2.海南原漾食品科技有限公司,海南三亚 572022)
[目的]寻找水产养殖中抗生素替代品。[方法]以优化的中药配方与相应的肠道益生菌群合理配比形成益生元产品,采用喷雾干燥工艺制备中药复合益生菌群微胶囊制剂。对中药益生元微胶囊中益生菌存活率有显著影响的进风温度、出风口温度和进料速度3个因素为自变量,以微胶囊中益生菌的存活率为响应值,设计3因素3水平响应面分析试验,通过响应面分析确定微胶囊包埋的最佳条件,并通过体外模拟进行消化性能分析。[结果]微胶囊包埋的最佳条件为进风口温度187 ℃、出风口温度60 ℃和进料速度为32 mL/min,在此喷雾干燥工艺条件下中药益生元微胶囊中益生菌存活率达到9.42 logCFU/g,最终的微胶囊产品经SEM观察颗粒外形圆整,大小分布均匀且表面光滑。体外释放结果表明,壁材为质量分数1%的海藻酸钠和质量分数3%的明胶,在此工艺条件下制备的中药益生元微胶囊避免其在斜带石斑鱼胃液中快速吸收,减缓其在肠液中释放,确实提高中药益生元微胶囊的靶向性和高效性,进一步体外攻毒试验及H.E染色组织病理切片可观察到微胶囊对于鳗弧菌感染的鱼体受损肝脏器官具有明显疗效。[结论]制备的中药益生元微胶囊在体外模拟试验中具有较好的高效性和可控释放性能,该研究结果可为该微胶囊的市场化推广奠定基础。
中药益生元;微胶囊;斜带石斑鱼;喷雾法;体外控释
斜带石斑鱼(Epinepheluscoioides)生长快,适应性强,肉质鲜美,经济价值和营养价值高,深受市场青睐,是我国重要的优质海产食用鱼类。然而,随着高密度集约化养殖模式的推广,水体污染日益严重,斜带石斑鱼病害情况日益严峻。目前防治鱼病的主要方法是使用抗生素和化学合成药物,但是这类药物的大量使用会导致菌株的耐药性及水产品中的药物残留,从而给人类健康造成危害。因此,寻找低毒高效、安全绿色的水产养殖用抗生素替代品具有重大意义。
目前,应用于水产养殖业的抗生素替代品主要集中在中药添加剂、益生菌群、噬菌体、免疫糖类和药效营养品5类。研究表明,以鱼腥草、金银花、黄芩、紫草等中药制成方剂按一定比例与鱼饲料混合,能显著增强水产动物非特异性免疫功能,提高动物摄食率,改良水产品品质[1-8]。此外,一些研究表明益生菌无论采用何种添加方法都可以有效作用于养殖动物,并能促进其生长、提高免疫系统机能和改良水质[9-11]。李太武等[12]、Park等[13]和黄万红等[14]利用不同噬菌体微生态制剂各自喂养目标养殖模型,发现试验组死亡率显著低于对照组,且抑菌效果明显。石灏等[15]对被溶藻弧菌感染的日本鲟(Charybdisjaponica)注射免疫多糖,发现其超氧化物歧化酶(SOD)和溶菌酶(LZM)活性明显高于对照组(P<0.05)。王高学等[16]采用不同剂量的灰树花多糖来检测其对鲤鱼血清凝集抗体效价的影响,结果发现试验组抗体水平明显高于对照组。庄政等[17]用抗体对试验鳖进行浸泡和口服免疫,结果表明试验组鳖的免疫力大幅提高。但是,上述抗生素替代品存在对饲料加工条件的适应性低、应用局限性、效果的不确定性以及成本较高等问题。此外,现有的鱼类添加剂还存在易溶于水、鱼体摄取率低和浪费严重等现象。
基于中药治疗是通过提高机体免疫力,促进生长来达到“标本兼治”的理念,笔者前期试验以中药黄连、黄芩、黄柏和栀子混合物为药性基质,选用4种斜带石斑鱼肠道益生菌为发酵菌种进行固体发酵制备复合中药益生元。为了提高中药益生元的稳定性、体内释放可控性和靶向性,笔者对中药益生元进行微胶囊化包被,探讨壁材种类和质量配比的选择、微胶囊制备工艺参数的优化,并对中药益生元微胶囊进行体外模拟胃肠释放性能,探究不同壁材微胶囊在胃液中稳定性和肠体中的高效释放性能,并通过体内攻毒试验和H.E染色进行组织病理切片观察。
1 材料与方法
1.1 材料
1.1.1 供试鱼。斜带石斑鱼由海南原漾食品科技有限公司提供。正式试验前,挑选60条平均体质量(14.00±2.33)g、行为活力强、外观无伤痕、摄食快速、体色无异常的同龄健康鱼苗,人工饲养于室内海水循环系统中暂养,并以添加复合中药益生元微胶囊试验饲料和未添加微胶囊试验饲料饱食喂养,使之逐渐适应试验饲料和环境。暂养10 d后,剔除摄食或运动异常的个体,每天正常投食和换水,试验前1 d停止投喂,确保石斑鱼处于空肠状态。
1.1.2 药品、试剂和主要仪器。
1.1.2.1 药品与试剂。枯草芽孢杆菌(BacillussubtilisHY-1)、汉逊德巴利海洋酵母(DebaryomyceshanseniiHY-2)、乳酸杆菌(LacticacidbacteriaHY-3)、光合细菌(ThiocapsaroseopersicinaHY-4)均为海洋热带海洋学院海洋食品工程实验室保存菌种;鳗弧菌(Vibrioanguillarum)购于南方菌种保藏中心;中药黄连、黄芩、黄柏和栀子,购于海南三亚医药广场;明胶、海藻酸钠、普通营养培养基,MRS培养基,均购自国药集团(上海)化学试剂有限公司;酪蛋白酸钠和高熔点油脂(HMF),购于美国Sans Trans公司;胰蛋白酶(来自于猪胰腺)和胃蛋白酶(10 000 NFU/mg),购自美国Kodak公司。
1.1.2.2 主要仪器。搅拌器(德国IKA公司);冷冻离心机(Beckman J-26-XP,美国);涡旋振荡器(德国IKA公司);培养箱(跃进SPX,上海跃进医药光学器械厂);高速匀质器(Model T25-S1,IKA,德国);小型喷雾干燥机(YC-1800,上海雅程仪器设备有限公司);双螺旋挤压机(TN85-E,山东泰诺药业有限公司),扫描电镜phenom Pure(中国科学院大连化学物理研究所)。
1.2 方法
1.2.1 中药益生元的包埋及工艺优化。①将高熔点油脂(HMF)在50 ℃条件下融化,将此HMF加入到预先配制的酪蛋白酸钠溶液(10%,w/w)中,将HMF和酪蛋白酸钠按照1∶4、1∶2、3∶4和1∶1的比例进行加样,整个加样过程中温度控制在40 ℃左右;②将此混合溶液在高速分散器中,以600 r/min的转速分散1 min,再通过高压均质机在20.69 MPa的压力下,均质3遍,最后将得到的乳状液在0 ℃条件下过夜保存。③将准备好的浓缩菌液添加到上述乳状液中(酪蛋白酸钠溶液作为对照),控制其益生菌浓度为108CFU/mL,并且在0 ℃下置于搅拌器中,进行喷雾干燥;④进一步对微胶囊制备过程中喷雾干燥条件的影响因素进行正交试验和响应面分析,以包埋率和喷雾干燥后益生菌存活率为评价指标,探讨其最佳工艺参数。
1.2.2 中药益生元微胶囊表面结构观察。用导电胶将中药益生元微胶囊样品粉末黏在扫描电镜载物台上,用刮刀涂匀,多余颗粒用吹风机除去。然后,将该板在镀金机下镀金2.5 min,使得表面的金层厚度约为8.9 nm,最后将制备好的样品置于扫描电镜下,通过调节样品和探头的距离,来获取样品表面和内部微观结构SEM图。
1.2.3 中药益生元微胶囊体外模拟消化性能分析。
1.2.3.1 人工模拟胃液(Simulated gastric juice,SGJ)的配制[18-19]。取9 mL浓盐酸和10 g胃蛋白酶加至800 mL蒸馏水中混合均匀,调节pH至2.5,用0.22 μm的膜进行过滤灭菌。
1.2.3.2 人工模拟肠液(Simulated intestinal juice,SIJ)的配制[20]。将胰蛋白酶和胆盐均匀地分散于磷酸盐缓冲液中,使其终浓度分别为1.0和4.5 g/L,调节pH至7.4,用0.22 μm的膜进行过滤灭菌。
1.2.3.3 中药益生元微胶囊在模拟胃肠液中的存活试验。将0.5 g中药益生元微胶囊均匀分散于4.5 mL在37 ℃下预热的人工模拟胃液,温育1 h后,快速加入37 ℃下预热的人工模拟肠液,调节pH至7.4,再用磷酸盐缓冲液将体积定容至10 L,并将该混合液置于37 ℃,100 r/min下温育4 h。分别于60、120和240 min时取样,进行益生菌群细胞计数。
按照以下公式计算存活率:

(1)
式中,Nt为在体外人工模拟胃液或人工模拟肠液中孵育一定时间后存活的益生菌浓度(CFU/g),N0为人工模拟胃液或人工模拟肠液中添加的益生菌原始浓度(CFU/g)。
按照以下公式计算释放率:

(2)
式中,Wt为微胶囊起始重量;W0为微胶囊在体外模拟人工模拟胃液(SGI)和人工模拟肠液(SJI)中孵育一定时间后重量。
1.2.4 攻毒试验。每组分别取20尾斜带石斑鱼进行攻毒试验。斜带石斑鱼的致病菌鳗弧菌(Vibrioanguillarum)进行攻毒,攻毒浓度为2.0×106CFU/mL,剂量为30 μL/条,用无菌注射器对鱼体腹腔注射攻毒。攻毒后对照组和空白组分别继续投喂添加微胶囊的试验饲料和空白正常饲料,持续10 d。统计10 d内的累计死亡尾数,按照以下公式计算累计死亡率(Cumulative mortality):累计死亡率(%)=Dt/D0×100,其中D0为攻毒过程中斜带石斑鱼的初始尾数,Dt为累计死亡尾数。
2 结果与分析
2.1 中药益生元微胶囊的最佳制备工艺组合验证 在单因素试验的基础上,采用响应面分析法考察中药益生元微胶囊化过程中中药益生元中的益生菌群存活率与不同的喷雾干燥条件之间的关系,旨在建立它们之间的回归方程,并对模型进行分析,确定喷雾干燥的最佳工艺组合。以进风口温度(℃)、出风温度(℃)和进料速度(mL/min)3个因素为自变量,以中药益生元中益生菌群存活率为响应值,设计3因素3水平响应面分析试验,试验中心组合设计的因素与水平见表1。
通过MATLAB 6.5.0软件的响应面回归过程进行数据分析,建立二次响应面回归模型,并寻求最优响应因子水平,得到以下二次回归方程:

表1 响应面试验中心组合设计的因素与水平

响应面试验中心组合设计及其试验结果如表2所示。从图1~3可以看出,中药益生元微胶囊化工艺参数的最佳组合为:进风口温度187 ℃、出风口温度60 ℃、进料速度为32 mL/min。为了证实预测结果的真实性,在喷雾干燥最佳工艺组合下对壁材为1%海藻酸钠和3%明胶,芯材为质量分数20%的中药益生元进行3次微胶囊化验证试验,所得微胶囊中药益生元益生菌群的存活率分别为8.98 logCFU/mL、9.13 logCFU/mL和9.07 logCFU/mL,与正交试验结果基本一致。

表2 响应面试验中心组合设计及其试验结果

图1 出风口温度和进风口温度对益生菌存活率的影响Fig.1 Effects of air inlet temperature and outlet temperature on the survival rate of probiotics

图2 出风口温度和进料口速度对益生菌存活率的影响Fig.2 Effects of air outlet temperature and feed speed on the survival rate of probiotics

图3 进风口温度和进料口速度对益生菌存活率的影响Fig.3 Effects of air inlet temperature and feed speed on the survival rate of probiotics
2.2 中药益生元微胶囊扫描电镜分析 从图4可以看出,微胶囊颗粒呈有规律的球形,粒径较小,结构均一,外形规则且无黏连现象,其表面存在孔隙凹陷,且紧密相连的粗糙密集结构,据推测这些凹陷结构可能是由于喷雾干燥过程中,在较高的温度和气流的共同作用下微胶囊的结构发生改变所致。此外,在微胶囊的表面可以观察到一层类似包覆膜的膜层结构和部分益生元微生物单细胞,说明中药复合益生元已被成功包埋在微胶囊内。该试验采用壳聚糖-海藻酸钠复凝聚物作为壁材,凝聚物的表面形态与袁毅桦等[20]研究壳聚糖-海藻酸钠的表面形态结构相似。
2.3 同壁材中药益生元微胶囊体外模拟消化性能分析 由表3可知,未微胶囊化的中药益生元饲料添加剂在SGF中0.5 h时,益生菌存活率从9.47 logCFU/g降至3.25 logCFU/g,此后均保持在1.0 logCFU/g左右。以海藻酸钠(Alginate)为壁材的中药益生元微胶囊添加剂,在模拟SGF条件下1 h内释放率达到92.4%,且益生菌存活率低至5.66 logCFU/g,该类壁材制备的微胶囊无法保证益生菌顺利通过消化系统到达肠部,在胃部停留时即快速溶解。以明胶为壁材制备的中药益生元微胶囊,以及以明胶和海藻酸钠按3∶1、1∶1和1∶3配比为壁材的中药益生元微胶囊,均在SGF生理周期及条件下均具有较高的存活率和极低的释放率。

图4 中药益生元微胶囊的扫描电镜观察结果Fig.4 SEM observation results of microcapsule of probiotics and Chinese Herbal Medicine
Table 3 Release rates and survival rates of microcapsules of probiotics and Chinese Herbal Medicine from different wall materials in simulated gastric juice

时间Timeh空白组Blankgroup存活率SurvivalratelogCFU/g释放率Releaserate%明胶Gelatin存活率SurvivalratelogCFU/g释放率Releaserate%明胶+海藻酸钠Gelatin+sodiumalginate(3∶1)存活率SurvivalratelogCFU/g释放率Releaserate%明胶+海藻酸钠Gelatin+sodiumalginate(1∶1)存活率SurvivalratelogCFU/g释放率Releaserate%明胶+海藻酸钠Gelatin+sodiumalginate(1∶3)存活率SurvivalratelogCFU/g释放率Releaserate%海藻酸钠Sodiumalginate存活率SurvivalratelogCFU/g释放率Releaserate%09.47—9.32—9.38—9.35—9.42—9.36—0.53.25—8.563.28.234.38.365.69.096.35.6685.61.01.32—8.043.87.974.97.695.98.786.65.4592.41.50.98—7.665.67.325.77.455.88.687.04.9090.52.00.93—7.466.47.057.57.257.38.577.94.0889.52.50.96—7.406.77.048.37.337.98.548.23.7990.43.00.99—7.417.56.938.57.358.48.499.53.7388.53.51.01—7.387.96.959.76.329.54.7910.73.7289.44.00.87—7.378.66.9110.34.1910.24.7515.73.6989.74.50.92—7.399.56.9211.03.0523.44.6921.23.7189.75.01.03—7.379.76.2711.43.0224.84.6222.83.7390.45.50.96—7.3510.33.8421.83.0625.34.6324.93.7490.26.00.94—7.3610.53.8522.43.0325.64.6625.53.7089.4
从图5和图6可以看出,完全以明胶或明胶和海藻酸钠按一定比例(3∶1、1∶1和1∶3)混合为壁材的微胶囊在SIF条件下均保持极高的益生菌存活率,其中明胶与海藻酸钠的比例为1∶3的微胶囊同时具备极高的释放率,在2.5 h内达到最高值(93.2%),显著高于其他类型壁材制备的微胶囊。
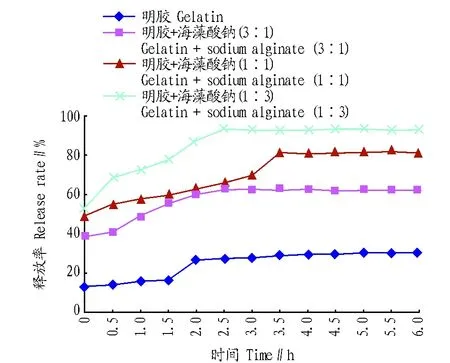
图5 不同壁材的中药益生元微胶囊在人工模拟肠液中释放率的比较Fig.5 Release rate of microcapsules of probiotics and Chinese Herbal Medicine from different wall materials in simulated gastric juice
2.4 斜带石斑鱼感染鳗弧菌后症状及肝组织病理变化 对斜带石斑鱼注射鳗弧菌后,鱼体表点状出血,其中尤以腹部、下颌和鳍较为明显,躯干部皮肤褐色、糜烂或隆起。肠道充血,肝脏、肾脏肿大,肝呈土黄色,点状出血。

图6 不同壁材的中药益生元微胶囊在人工模拟肠液中存活率的比较Fig.6 Survival rate of microcapsules of probiotics and Chinese Herbal Medicine from different wall materials in simulated gastric juice
从图7可以看出,造模前肝组织细胞未见损害,细胞染色正常(图7A);空白饲料喂养,感染鳗弧菌模型组鱼体肝组织病理切片,肝细胞颗粒变性、肝索结构不清晰、间质成分增生、炎性细胞浸润、部分细胞为气球样变、细胞核增大,染色变浅(图7B);饲料中添加中药复合益生元微胶囊喂养,感染鳗弧菌30 d后鱼体肝组织病理切片,该组鱼体肝细胞颗粒变性不明显、肝索结构清晰,仅有少量炎症细胞浸润,细胞核大小及染色正常,该组发生率较模型组差异显著(图7C)(P<0.05)。
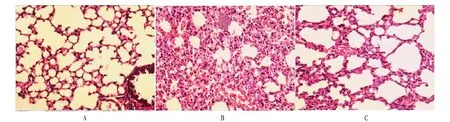
注:A.造模前;B.空白饲料喂养,感染鳗弧菌模型组;C.饲料中添加中药复合益生元微胶囊,感染鳗弧菌30 d后。Note: A. Before modeling; B. Feeding by blank feedstuff; C. Adding microcapsules of probiotics and Chinese Herbal Medicine into the feedstuff, after infection of Vibrio anguillarum for 30 d.图7 空白组和处理组斜带石斑鱼肝组织的HE染色观察结果Fig.7 H.E staining paraffin tissue section of liver tissue of Epine phelus coioides in blank control group and treatment group
3 讨论
前期通过动物模型构建和体外试验数据分析阐明了中药复方制剂与益生菌群协同增效作用机理,并基于双向固体发酵技术,以优化的中药配发和肠道益生菌合理配比构建高效中药益生元。微胶囊技术是将中药益生元包埋于保护性结构中,能够增强它们对消化系统不利影响的抵抗力(胃酸、胆汁、胰酶等),保证有效中药组分和足够活菌数量通过胃到达肠道发挥协同益生作用。
笔者以明胶和海藻酸钠为复合壁材,采用响应面分析法考察不同喷雾干燥工艺同微胶囊中益生菌群存活率间的关系,建立它们之间的回归方程模型,并对模型进行分析,确定喷雾干燥法制备中药益生元微胶囊的最佳工艺参数为:进风口温度187 ℃、出风口温度60 ℃、进料速度为32 mL/min,在此喷雾干燥最佳工艺组合下对壁材为1%海藻酸钠和3%明胶,芯材为质量分数20%的中药益生元进行3次微胶囊化验证试验,所得微胶囊中药益生元益生菌群的存活率分别为8.98 logCFU/mL、9.13 logCFU/mL和9.07 logCFU/mL,与正交试验结果基本一致。通过SEM观察微胶囊的超微结构发现在最佳工艺参数组合下制得的微胶囊壁材包覆粉末,无晶体状,无黏连现象。进一步以鳗弧病原菌攻毒斜带石斑鱼建模,HE病理组织切片能明显观察到优化工艺条件下制备的中药复合益生元微胶囊能有效治疗鳗弧病原菌对鱼体肝脏的损害。
生理学研究表明,药物在胃中的滞留时间约为0.5~2.0 h,在小肠的滞留时间约为2~6 h。因此,该研究将2 h作为检测微胶囊在SGF中释放效果的时间节点,6 h作为检测微胶囊在SIF中消化性能的时间节点。采用优化工艺参数制备的中药益生元微胶囊在SGF中孵育2 h释放率仅为7.9%,益生菌存活率维持在9.0 logCFU/g以上,而将SGF中孵育2 h的微胶囊转移至SIF后3 h内释放率最高可达93.3%,可以有效保护益生菌群和中药活性组分抵抗胃液中胃酸、胆汁和胃蛋白酶的降解作用,提高中药益生元的靶向性和高效性。
在中药益生元微胶囊的壁材构成中,明胶是由胶原蛋白水解得到的一类蛋白质,明胶浓度高低对微胶囊包膜比厚度有决定性作用;若明胶浓度过低,则无法形成一定机械强度和厚度的微胶囊壁,影响中药益生元中益生菌群到达肠道的存活率;若明胶浓度过高,虽然能有效提高益生菌群存活率和包埋率,但是无法及时释放中药活性成分和益生菌群调控斜带石斑鱼生理机能。微胶囊壁材中海藻酸钠是一类以β-1,4-糖苷键连接不同比例GM、MM和GG片段构成的线性聚合物大分子,其分子链上带有羧基,当环境pH高于其解离常数时海藻酸钠带正电荷,环境pH低于其解离常数时,海藻酸钠分子链间会发生聚集作用。因此,海藻酸钠与明胶按1∶3的比例为壁材构建微胶囊在pH 1.2的模拟胃液中,海藻酸盐迅速转化为几乎不溶于水的海藻酸,有效抑制了壁材的溶蚀作用,从而阻止芯材中药益生元的释放,而当外界环境从SGF换到SIF环境时,由于海藻酸钠于芯材内有效成分均带负电荷,因此将互相排斥导致壁材容易被溶蚀,保证了中药益生元微胶囊中有效成分的高效性和靶向性。
4 结论
笔者利用黄连、黄芩、黄柏和栀子作为中药液体培养基发酵培养斜带石斑鱼肠道益生菌群,在发酵过程中中药复方制剂的有效药物成分同益生菌群建立的微生态平衡协同作用,在优化工艺参数和最佳壁材配比条件下制备的中药复合益生元微胶囊具有生物活性高和稳定性强的特点,且对中药益生元中活性成分和益生菌群具有缓释和靶向作用,可为在斜带石斑鱼养殖过程中进一步推广中药益生元微胶囊抗生素替代品奠定基础
[1] 张意敏,刘志刚,卢迈新,等.复方中药对尼罗罗非鱼非特异性免疫功能的影响[J].淡水渔业,2015,45(1):15266-15267.
[2] 丁建英,邵菁,徐建荣,等.复方中药饲料添加剂对克氏原螯虾非特异性免疫功能的影响[J].安徽农业科学,2012,40(31):67-70.
[3] 孙裔雷,王荻,刘红柏.复方中草药对施氏鲟非特异性免疫功能的影响[J].中国农学通报,2015,26(8):51-55.
[4] 凌空,王涵,丁诗华,等.十六种中草药及其复方对大鲵致病性豚鼠气单胞菌的体外抑制作用[J].淡水渔业,2015,45(1):73-79.
[5] 蔺凌云,袁雪梅,潘晓艺,等.4种中草药提取物对水霉的体外抑菌试验[J].安徽农学通报,2015,21(2):11-12,39.
[6] 吴颖瑞,龚庆芳,方宏,等.153种中草药对罗非鱼无乳链球菌和海豚链球菌的抑制活性研究[J].西北农林科技大学学报(自然科学版),2013,41(1):25-32.
[7] 马玲巧,彭晓珍,李大鹏.复方中草药添加剂对施氏鲟肌肉营养成分及品质的影响[J].华中农业大学学报,2015,34(3):111-116.
[8] 刘波,冷向军,李小勤,等.中草药对凡纳滨对虾生长、血淋巴非特异性免疫和肌肉成分的影响[J].上海海洋大学学报,2014,23(4):528-534.
[9] NGAN P T T,PHU T Q.Effects ofBacillusbacteria(B8,B37,B38)on water quality of black tiger shrimp(Penaeusmonodon)cultured tanks[C]//Proceedings of the 4thaquaculture and fisheries coference.[s.l.]:[s.n.],2001:28-41.
[10] LIU K F,CHIU C H,SHIN Y L,et al.Effects of the probioticBacillussubtilisE20 on the survival,development,stress tolerance, and immune status of white shrimp,Litopenacusvannameilarvae[J].Fish & shellfish immunology,2010,28(5):837-844.
[11] ZAPATA A A,LARA FLORES M.Antimicrobial activities of lactic acid bacteria strains isolated from Nile tilapia(Oreochromisniloticus)intestine [J].J Biol Life Sci,2013,4(1):164-171.
[12] 李太武,相建海,刘瑞玉,等.噬菌体防治皱纹盘鲍脓疱病的研究[J].海洋与湖泊,1999,30(4):374-380.
[13] PARK S C,SHIMAMURA I,FUKUNAGA M,et al.Isolation of bacteriophages specific to a fish pathogen,Pseudonlonasplecoglossicida,as a candidate for disease control[J].Application and environmental microbiology,2000,66(4):1416-1422.
[14] 黄万红,陈月忠.对虾发光病生物防治技术的初步研究[J].福建水产,2007,6(2):8-14.
[15] 石灏,徐善良,朱慧,等.免疫多糖对日本蟳抗溶藻弧菌能力的影响[J].河北渔业,2013,5(1):1-5.
[16] 王高学,白冰,崔婧,等.灰树花多糖对鲫鱼免疫功能的影响[J].水产科学,2006,25(1):9-12.
[17] 庄政.嗜水气单胞菌亚单位成分卵黄抗体在鳗鲡养殖中应用[D].福州:福州农林大学,2008.
[18] 沈文英,胡洪国,潘雅娟.温度和pH值对南美白对虾(Penaeusvanmmei)消化酶活性的影响[J].海洋与湖沼,2004,35(6):543-548.
[19] ANNAN N T,BORZA A D,HANSEN L T.Encapsulation in alginate-coated gelatin microspheres improves survival of the probioticBifidobacteriumadolescentis15704 T during exposure to simulated gastro-intestinal conditions[J].Food research international,2008,41(2):184-193.
[20] 袁毅桦.基于壳聚糖与海藻酸钠的改性聚合物的制备结构与性能研究[D].广州:华南理工大学,2012.
Preparation of Probiotics Microcapsule of Chinese Herbal Medicine Using Spray Drying Method and ItsinvitroRelease
HU Rui1, ZHOU Guang-ping2*, SONG Wei-chun1
(1. Hainan Tropical Ocean University, Sanya, Hainan 572022; 2.Hainan Origin Food Technology Co., Ltd., Sanya, Hainan 572022)
[Objective] To find the substitutes for antibiotics in aquaculture. [Method] On the basis of the synergistic effect of probiotics and optimal ingredient pattern of Chinese herbal medicine as the prebiotic products, we used spray drying technology to prepare microcapsule of probiotics and Chinese Herbal medicine. Three factors having significant impacts on the survival rate probiotics in microcapsule were used as the independent variables, which were air inlet temperature, air outlet temperature and feed speed. With survival rate probiotics in microcapsule as the response value, response surface analysis experiment was designed with three factors and three levels. The optimal condition for microcapsule embedding was obtained by response surface analysis. Digestive performance was analyzed byinvitrosimulation. [Result] The optimal condition for microcapsule embedding was 187 ℃ air inlet temperature, 60 ℃ air outlet temperature and 32 mL/min feed speed. Under this condition, survival rate of probiotics in microcapsule reached 9.42 logCFU/g. Scanning Electron Microscopy (SEM) was applied to observe the particle shape, which was even, smooth and round. Theinvitrodrug release test showed that the wall material was 1% alginate and 3% gelatin. Under this technology, the prepared microcapsule could avoid the fast absorption in gastrin ofEpinepheluscoioides, slowed down the release in intestinal juice, and enhanced the targeting and efficiency of microcapsule. The virus challengeinvitrotest and H.E staining tissue pathological slices showed that the microcapsule had obvious curative effects on the fish liver damage infected byVibrioanguillarum. [Conclusion] The prepared microcapsule has relatively high efficiency and controlled release performance duringinvitrotest. This research results lays foundation for the market promotion of this microcapsule.
Probiotics in Chinese Herbal Medicine; Microcapsule;Epinepheluscoioides; Spray drying method; Releaseinvitro
海南省科技兴海项目(XH201417)。
胡锐(1982- ),男,云南玉溪人,副教授,硕士,从事生物化工方面的研究。*通讯作者,工程师,博士,硕士生导师,从事食品工程研究。
2016-09-14
S 963.73
A
0517-6611(2016)29-0089-06

