转染人源Omentin-1、Vaspin妊娠期糖尿病脂肪细胞胰岛素受体底物和磷脂酰肌醇3激酶表达变化
潘宝龙,马润玫
(昆明医科大学,昆明 650031)
转染人源Omentin-1、Vaspin妊娠期糖尿病脂肪细胞胰岛素受体底物和磷脂酰肌醇3激酶表达变化
潘宝龙,马润玫
(昆明医科大学,昆明 650031)
目的 观察转染人源网膜素1(Omentin-1)、内脏脂肪组织源性丝氨酸蛋白酶抑制剂(Vaspin)的妊娠期糖尿病(GDM)脂肪细胞胰岛素受体底物1/2(IRS-1/2)、磷脂酰肌醇3激酶(PI3K)表达变化。方法 复苏、传代及诱导分化GDM前脂肪细胞。构建Omentin-1、Vaspin过表达载体,以3个不同过表达梯度(1.0、2.5、5.0 μg)转染传代脂肪细胞,以无转染组为对照。采用实时荧光定量PCR法检测各组脂肪细胞Omentin-1、Vaspin、IRS-1/2、PI3K mRNA;采用Western blotting法检测各组脂肪细胞Omentin-1、Vaspin、IRS-1/2、PI3K蛋白及酪氨酸磷酸化IRS-1/2;采用[3H]-2-脱氧-D-葡萄糖摄取测定法测算各组脂肪细胞葡萄糖的摄取率。结果 随Omentin-1表达增加,转染人源Omentin-1脂肪细胞中IRS-1、PI3K(P85a)mRNA及蛋白表达增加,IRS-2 mRNA及蛋白表达未发生明显变化,IRS-1酪氨酸磷酸化程度明显升高,IRS-2酪氨酸磷酸化程度未发生明显变化,葡萄糖摄取率上升。随Vaspin表达增加,转染人源Vaspin脂肪细胞IRS-1、IRS-2、PI3K(P85a)mRNA及蛋白表达均未出现明显变化,IRS-1、IRS-2酪氨酸磷酸化程度均未出现明显变化,葡萄糖摄取率变化不明显。 结论 转染人源Omentin-1的GDM脂肪细胞IRS-1和PI3K(P85a)表达升高,葡萄糖摄取率升高;转染人源Vaspin的GDM脂肪细胞无此变化。
妊娠期糖尿病;网膜素1;内脏脂肪组织源性丝氨酸蛋白酶抑制剂;基因转染;胰岛素抵抗;胰岛素受体底物1;胰岛素受体底物2;磷脂酰肌醇3激酶
妊娠期糖尿病(GDM)是在妊娠期首次发生或发现的糖尿病,严重威胁孕妇及其子代健康。至今为止GDM病因不明,众多研究[1,2]一致认为是多种因素共同作用的结果。胰岛素抵抗被认为是GDM的始发因素,是目前公认的GDM发病的病理生理基础之一,而胰岛素信号通路异常是发生胰岛素抵抗的主要原因[3,4]。近年来,来源于脂肪组织的脂肪因子与GDM的关系倍受关注,已成为新的研究热点[5,6]。课题组前期研究发现,在GDM患者血清及体内网膜脂肪组织中,网膜素1(Omentin-1)出现了明显的低表达,而内脏脂肪组织源性丝氨酸蛋白酶抑制剂(Vaspin)出现了明显高表达,提示两者可能与GDM的胰岛素抵抗存在关联。本研究观察了转染人源Omentin-1、Vaspin的GDM脂肪细胞胰岛素受体底物1/2(IRS-1/2)、磷脂酰肌醇3激酶(PI3K)表达变化,IRS-1/2酪氨酸磷酸化水平的变化,以及细胞葡萄糖摄取率的变化,探讨脂肪因子Omentin-1、Vaspin与GDM胰岛素抵抗的内在联系,为研究GDM发病机理和治疗策略提供线索。
1 材料与方法
1.1 材料 高糖杜尔液体培养基(HG-DMEM)及6孔细胞培养板(美国Hyclone),蛋白酶抑制剂(美国Merckmi Lipore),蛋白上样缓冲液(上海Beyotime),聚偏二氟乙烯膜(PVDF膜,0.45 μm,德国Millipore),人源Omentin-1及Vaspin过表达载体(广州复能基因公司)。Thermo CO2培养箱,AIRTECH超净工作台,上海菁华紫外分光光度计(752),美国ABI RT-PCR仪,ABI 96孔定量PCR板,BIO-RAD电泳仪(164-5050)。
1.2 人前脂肪细胞获取及传代培养 GDM患者大网膜前脂肪细胞的获取符合人体试验伦理学标准,经昆明医科大学伦理委员会批准,获得患者的知情同意。将冻存细胞从液态氮中取出,进行复苏和传代,前脂肪细胞获取及上述具体操作方法见课题组报道文献。
1.3 Omentin-1、Vaspin过表达载体构建及转染 由广州复能基因公司协助构建(Omentin-1序列号EX-W1410-Lv105,Vaspin序列号EX-E0540-Lv105)。培养和筛选STBL3大肠杆菌单克隆菌株,经震荡培养和0.2 mL冰冷氯化钙悬浮,将其制作为感受态细胞。分别取1 μL上述质粒,加至制好的感受态细胞中,按照课题组报道文献完成质粒转化、筛选阳性克隆及进一步扩大培养过程。使用粒抽提试剂盒(美国TIANGEN),按照说明书抽提得到过表达载体Omentin-1(0.495 μg/μL),Vaspin(0.601 μg/μL)。诱导GDM人源第3代传代前脂肪细胞,待其分化为成熟脂肪细胞后,将Omentin-1和Vaspin过表达载体分别按照0.0、1.0、2.5、5.0 μg共4个浓度梯度进行转染。每个浓度转染6孔。
1.4 GDM脂肪细胞Omentin-1、Vaspin、IRS-1、IRS-2、PI3K mRNA检测 上述细胞转染48 h后,提取细胞总蛋白和总RNA,用实时荧光定量PCR法分别检测Omentin-1、Vaspin、IRS-1、IRS-2、PI3K的mRNA。将定量PCR 96孔板置于冰上,总反应体系为20 μL(相应上下游引物各1 μL、RNA 1 μL、参比染料ROX 10 μL、蒸馏水7 μL),使用ABI RT-PCR仪,反应条件为95 ℃变性1 min,85 ℃退火45 s,72 ℃延伸2 min,35个循环。结果判读:2-ΔΔCt计算各样本相对拷贝值。以0.0 μg时为对照(设为1.00),其余各浓度以均值的比值表示。
1.5 GDM脂肪细胞Omentin-1、Vaspin、IRS-1、IRS-2、PI3K蛋白检测 采用Western blotting法。细胞裂解液提取法提取细胞总蛋白,沸水浴5 min变性,BCA蛋白定量试剂盒(BCA Protein Assay Kit)测定样品中蛋白含量,计算出相应加样量。根据目的蛋白分子量大小选择和配制合适的SDS-PAGE分离胶和浓缩胶;加样,120 V电泳,待溴酚蓝泳至距离玻璃板下端1 cm位置停止,恒流300 mA转膜(PVDF膜),120 min,5%的牛血清白蛋白室温封闭30 min;将切下的膜室温孵育一抗60 min,PBS洗3次,室温孵育二抗60 min;晾干PVDF膜,进行显影和定影,球面积分扫描仪检测。以β-actin条带为对照(设为1.00),目标蛋白测定值=待测条带/β-actin。
1.6 GDM脂肪细胞酪氨酸磷酸化IRS-1、IRS-2检测 Western blotting法观察转染后脂肪细胞中的IRS-1、IRS-2酪氨酸磷酸化水平。操作步骤基本同1.5。
1.7 GDM脂肪细胞葡萄糖的摄取率计算 脂肪细胞转染48 h后以[3H]-2-脱氧-D-葡萄糖摄取测定法检测葡萄糖摄取率,液体闪烁计数器计数细胞分钟衰变数,BCA法检测蛋白浓度。[3H]-2DG摄取率=计数分钟衰变数×2/蛋白浓度。
2 结果
2.1 不同浓度人源Omentin-1、Vaspin转染后GDM脂肪细胞Omentin-1、Vaspin mRNA及蛋白相对表达量 转染0.0、1.0、2.5、5.0 μg Omentin-1脂肪细胞Omentin-1 mRNA相对表达量分别为1.00、34.11、207.72、1 104.35,蛋白相对表达量分别为0.94、1.99、2.91、4.54。转染0.0、1.0、2.5、5.0 μg Vaspin脂肪细胞Vaspin mRNA相对表达量分别为1.00、7.44、1 105.78、9 543.26,蛋白相对表达量分别为0.91、2.47、4.39、4.97。
2.2 不同浓度人源Omentin-1、Vaspin转染后GDM脂肪细胞IRS-1、IRS-2、PI3K(P85a)的mRNA、蛋白相对表达量 见表1。
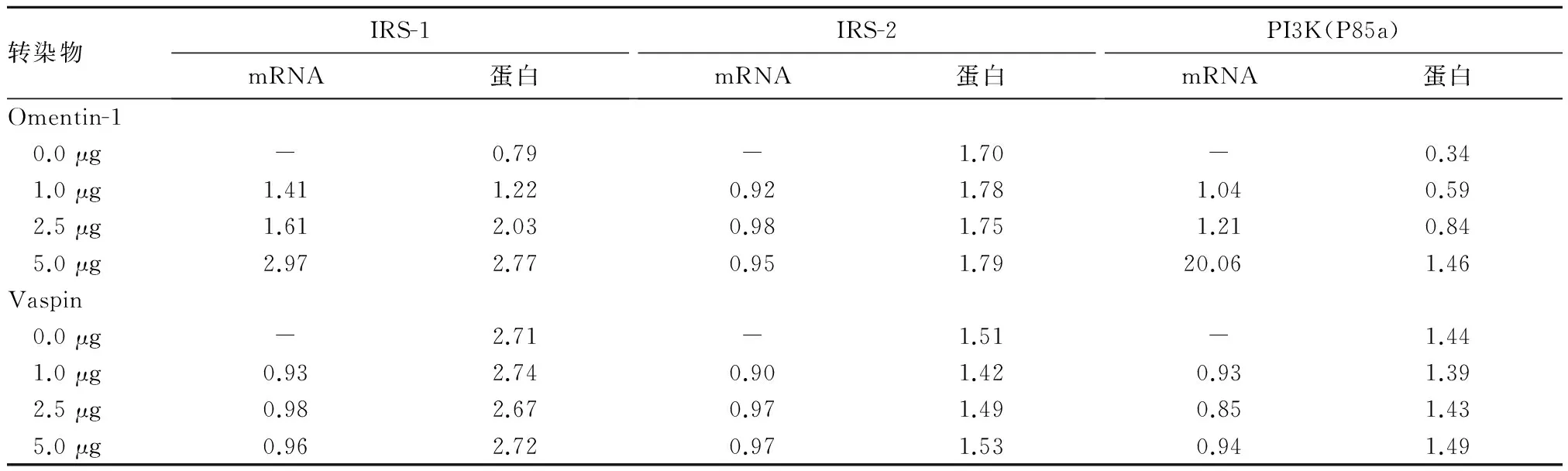
表1 不同浓度人源Omentin-1、Vaspin转染后GDM脂肪细胞IRS-1、IRS-2、PI3K(P85a)的mRNA、蛋白相对表达量
2.3 不同浓度人源Omentin-1、Vaspin转染后GDM脂肪细胞IRS-1、IRS-2酪氨酸磷酸化程度 转染0.0、1.0、2.5、5.0 μg Omentin-1脂肪细胞酪氨酸磷酸化IRS-1水平分别为0.56、0.72、1.51、2.34,IRS-2磷酸化水平分别为1.19、1.04、1.14、0.97。转染0.0、1.0、2.5、5.0 μg Vaspin脂肪细胞酪氨酸磷酸化IRS-1水平分别为0.88、0.79、0.86、0.91,酪氨酸磷酸化IRS-2水平分别为0.92、0.96、0.89、0.87。
2.4 不同浓度人源Omentin-1、Vaspin转染后GDM脂肪细胞葡萄糖摄取率 转染0.0、1.0、2.5、5.0 μg Omentin-1脂肪细胞葡萄糖摄取率分别为1.00、1.21、1.26、1.44,转染0.0、1.0、2.5、5.0 μg Vaspin脂肪细胞葡萄糖摄取率分别为1.00、0.97、0.97、1.01。
3 讨论
因涉及医学伦理学原因,目前对于基因过表达与疾病的关系研究多以体外实验方式进行,尤其对于人脂肪细胞的研究,更多的是采用了小鼠3T3-L1前脂肪细胞[7,8]。啮齿类动物与人类存在明显的遗传学差异,且两者之间的代谢途径也迥然不同,因此,将其作为实验载体往往难以避免潜在的实验缺陷问题,从而影响数据和结论的科学性[9]。课题组在前期成功建立了GDM网膜脂肪细胞原代培养及增殖分化模型,以人源细胞作为研究载体进行后续有关GDM方面的研究更具科学性。并且,以取自GDM网膜组织而培养传代的前脂肪细胞,可能更多地保留了GDM其他的一些基因信息,更真实地模拟了GDM基因环境,使结果更具有说服力。这也是本课题得以顺利进行的基础条件和特点之一。
本研究采用大肠杆菌表达系统,对得到的过表达载体分别以低(1.0 μg)、中(2.5 μg)、高(5.0 μg)3个浓度梯度转染GDM脂肪细胞,而后以实时荧光定量PCR和Western blotting验证相应mRNA及蛋白表达,发现mRNA及蛋白表达水平均随着过表达载体浓度增加而增加,充分说明所构建GDM网膜脂肪细胞原代培养及增殖分化模型真实有效,具有正常生理功能和表达能力,且所构建Omentin-1、Vaspin过表达载体有效,随梯度增加而表达增加。
目前众多研究理论认为,胰岛素抵抗主要由受体后信号传导的异常引起[10,11]。胰岛素受体的信号传导主要经过两个途径,即磷脂酰肌醇3激酶(PI3K)途径和Ras-丝分裂原激活的蛋白激酶(Ras-MAPK)途径。PI3K途径是胰岛素受体信号传导的经典途径,也是胰岛素对代谢调节的主要途径,主要作用于葡萄糖摄取,糖原合成和降解的调节;Ras-MAPK途径主要与基因转录的调控有关,主要作用于细胞生长和分化的调节[12,13]。两条途径相互独立,在一定条件下,也能相互激活。其中,IRS是胰岛素信号通路的关键物质。目前已发现的IRS分子包括四个亚型(IRS-1、IRS-2、IRS-3、IRS-4)。IRS-1是胰岛素信号传导的“船坞”蛋白,目前研究[14]认为IRS-1的表达可能与具有2型糖尿病家族史的患者密切相关,IRS-1表达不足或者磷酸化异常可导致胰岛素抵抗。IRS-2在胰岛素抵抗、2型糖尿病的发生中起着极其重要的作用,一旦IRS-2的表达出现异常,机体将很快出现糖尿病样症状[15]。基于上述理论,本研究对Omentin-1、Vaspin与GDM胰岛素PI3K信号传导途径的关系进行研究。
Omentin分为Omentin-1、Omentin-2,Omentin-1由网膜脂肪组织中的血管基质细胞分泌入血,或作用于周围脂肪细胞发挥其生物学作用。有体外实验报道,重组Omentin-1可促进皮下及网膜脂肪细胞对葡萄糖的摄取,提高胰岛素敏感性,是胰岛素“增敏因子”,但具体机制尚不明确[16]。本课题组先前研究发现,随孕妇体质量增加(BMI值越高)及胰岛素抵抗指数(HOMA)升高,血清Omentin-1水平不断下降,Omentin-1水平与胰岛素抵抗程度呈反比。本研究发现随Omentin-1浓度增加,转染人源Omentin-1脂肪细胞中IRS-1、PI3K(P85a)mRNA及蛋白表达增加,IRS-2 mRNA及蛋白表达未发生明显变化,IRS-1磷酸化程度明显升高,IRS-2磷酸化程度未发生明显变化,葡萄糖摄取率上升。结合课题组前期研究可以认为,Omentin-1与GDM胰岛素抵抗存在紧密的联系,是机体的保护因子,对肥胖、糖尿病等具有拮抗作用,Omentin-1的表达可能通过某种途径激活了IRS-1/PI3K(P85a)信号通路,间接导致了IRS-1和PI3K的活化和表达,并且促进了IRS-1的磷酸化,从而提高脂肪细胞对葡萄糖的摄取,发挥其胰岛素增敏作用,而与IRS-2没有明显关系。
近年来一些研究认为,Vaspin是与肥胖、胰岛素抵抗及2型糖尿病密切相关的脂肪因子之一。2型糖尿病患者由于存在胰岛素抵抗,血糖水平不断增高,血糖的升高可刺激脂肪组织分泌更多Vaspin来提高胰岛素敏感性[17,18]。正常妊娠孕妇血清Vaspin水平则与胰岛素敏感指数无关,GDM对孕妇血清Vaspin水平无影响[19]。课题组前期研究发现产前BMI、TG、FPG、OGTT 2 h是GDM患者血清Vaspin水平的独立预测因子。本研究发现,随Vaspin浓度增加,转染人源Vaspin脂肪细胞IRS-1、IRS-2、PI3K(P85a)mRNA及蛋白表达均未出现明显变化,IRS-1、IRS-2酪氨酸磷酸化程度均未出现明显变化,葡萄糖摄取率变化不明显。认为Vaspin与GDM胰岛素信号传导通路受体下游分子IRS-1、IRS-2、PI3K(P85a)不存在明显关联,Vaspin的升高并不会导致胰岛素抵抗及GDM的发生。Vaspin在GDM血清及网膜脂肪组织中的高表达,很可能只是一种肥胖、GDM糖脂代谢紊乱的补偿机制,仅作为一种肥胖及糖脂代谢紊乱的“生物学标志”,与GDM的胰岛素抵抗的发生没有必然联系。
[1] Murphy A, Shamshirsaz A, Markovic D, et al.Urinary Excretion of Myo-Inositol and D-Chiro- Inositol in Early Pregnancy Is Enhanced in Gravidas With Gestational Diabetes Mellitus[J]. Reprod Sci, 2016,23(3):365-371.
[2] Farren M, Daly N, O′Higgins AC, et al. The interplay between maternal obesity and gestational diabetes mellitus[J]. J Perinat Med, 2015,43(3):311-317.
[3] Perez-Perez A, Guadix P, Maymo J, et al. Insulin and Leptin Signaling in Placenta from Gestational Diabetic Subjects[J]. Horm Metab Res, 2016,48(1):62-69.
[4] Westermeier F, Salomon C, Farias M, et al. Insulin requires normal expression and signaling of insulin receptor A to reverse gestational diabetes-reduced adenosine transport in human umbilical vein endothelium[J]. Faseb J, 2015,29(1):37-49.
[5] Wurst U, Ebert T, Kralisch S, et al. Serum levels of the adipokine Pref-1 in gestational diabetes mellitus[J]. Cytokine, 2015,71(2):161-164.
[6] Ma Q, Fan J, Wang J, et al. High levels of chorionic gonadotrophin attenuate insulin sensitivity and promote inflammation in adipocytes[J]. J Mol Endocrinol, 2015,54(2):161-170.
[7] 聂绪强,杨建文,史海霞,等.IR-3T3-L1脂肪胰岛素抵抗细胞的建立[J].南方医科大学学报,2015,35(1):103-108.
[8] Wang C, Wang L, Li W, et al. Irisin has no effect on lipolysis in 3T3-L1 adipocytes or fatty acid metabolism in HepG2 hepatocytes[J]. Endocrine, 2015,49(1) :90-96.
[9] Abuna RP, De Oliveira FS, Santos Tde S, et al. Participation of TNF-alpha in Inhibitory Effects of Adipocytes on Osteoblast Differentiation[J]. J Cell Physiol, 2016,231(1):204-214.
[10] Ou DL, Lee BS, Lin LI, et al. Vertical blockade of the IGFR-PI3K/Akt/mTOR pathway for the treatment of hepatocellular carcinoma: the role of survivin[J]. Mol Cancer, 2014,13(2):101-109.
[11]Hu F, Liu F. Targeting tissue-specific metabolic signaling pathways in aging: the promise and limitations[J]. Protein Cell, 2014,5(1) :21-35.
[12] Perrin AJ, Gunda M, Yu B, et al. noncanonical control of celegans germline apoptosis by the insulin/igf-1 and ras/mapk signaling pathways[J]. Cell Death Differ, 2013,20(1):97-107.
[13] Leiria LO, Sollon C, Bau FR, et al. insulin relaxes bladder via pi3k/akt/enos pathway activation in mucosa: unfolded protein response-dependent insulin resistance as a cause of obesity-associated overactive bladder[J]. J Physiol, 2013,591(9):2259-2273.
[14] Law NC, Hunzicker-Dunn ME. Insulin Receptor Substrate 1: The Hub Linking Follicle-stimulating Hormone to Phosphatidylinositol-3 Kinase Activation[J]. J Biol Chem, 2015,591(3):1047-1054.
[15] Roncero I, Alvarez E, Acosta C, et al. insulin-receptor substrate-2 ( irs-2) is required for maintaining glucokinase and glucokinase regulatory protein expression in mouse liver[J]. PLoS One, 2013,8(4):e58797.
[16] Greulich S, Chen WJ, Maxhera B, et al. cardioprotective properties of omentin-1 in type 2 diabetes: evidence from clinical and in vitro studies[J]. PLoS One, 2013,8(3):e59697.
[17] Tomasz S, Dominika S, Iwona KS, et al. Long-term Effect of Ileal Transposition on Adipokine Serum Level in Zucker (Orl)-Lepr(fa) Fatty Rats[J]. Obes Surg, 2015,25(10):1848-1857.
[18] Gkiomisi A, Makedou KG, Anastasilakis AD, et al. serum vaspin levels in women with and without gestational diabetes mellitus during pregnancy and postpartum[J]. Cytokine, 2013,61(1):127-132.
[19] Mm WQ, Fan J, Khor S, et al. Serum vaspin levels and vaspin mRNA expression in subcutaneous adipose tissue in women with gestational diabetes mellitus[J]. Eur J Obstet Gynecol Reprod Biol, 2014,182(2):98-101.
Expression changes of IRS-1/2 and PI3K in GDM adipocyte cells after anthropogenic Omentin-1, Vaspin transfection
PANBaolong,MARunmei
(KunmingMedicalUniversity,Kunming650031,China)
Objective To observe the expression changes of insulin receptor substrate-1/2 (IRS-1/2) and phosphatidy inositol 3 kinase (PI3K) in gestational diabetes mellitus (GDM) adipocyte cells after anthropogenic Omentin-1, visceral adipose tissue-derived serine protease inhibitor (Vaspin) transfection. Methods Recoveried, extended and differentiated GDM preadipocyte cells were prepared, and then we built Omentin-1, Vaspin overexpression carrier, and transfected the extended adipose cells with different overexpression levels (1.0, 2.5 and 5.0 μg). Meanwhile, no transfection group was taken as the contrast. Using Q-PCR to detect the mRNA expression of Omentin-1, Vaspin, IRS-1/2 and PI3K (P85a), using Western blotting to detect protein expression of Omentin-1, Vaspin, IRS-1/2 and PI3K (P85a) as well as IRS-1/2 phosphorylation levels, using [3H]-2 -deoxidation-D-glucose uptake assay to detect the rates of glucose uptake in different transfection groups. Results With the increasing Omentin-1 expression, the mRNA and protein expression of IRS-1 and PI3K(P85a) were increased, but those of IRS-2 had no significant changes, IRS-1 phosphorylation increased obviously, IRS-2 phosphorylation had no significant changes, and the glucose uptake rate increased significantly. With the increasing Vaspin expression, all of the mRNA, protein and phosphorylation in IRS-1/2 and PI3K(P85a) had no significant changes, so did the glucose uptake rates. Conclusion In GDM adipocyte cells after anthropogenic Omentin-1 transfection, IRS-1, PI3K(P85a) and glucose uptake rates were increased, but no changes in those of GDM adipocyte cells after anthropogenic Vaspin transfection.
gestational diabetes mellitus; Omentin-1; visceral adipose tissue-derived serine protease inhibitor; gene transfection ; insulin resistance; insulin receptor substrate-1; insulin receptor substrate-2; phosphatidy inositol 3 kinase
国家自然科学基金资助项目(81160082)。
潘宝龙(1973-),男,副主任,副教授,主要从事围产医学的研究。E-mail: pbl1210@126.com
简介:马润玫(1962-),女,主任,教授,主要从事围产医学的研究。E-mail: pbl6916@163.com
10.3969/j.issn.1002-266X.2016.35.003
R714.24
A
1002-266X(2016)35-0009-04
2016-06-12)

