灵芝单、双核菌丝差异研究
叶丽云,鲁 欣,林 强,吴小平
(福建农林大学菌物研究中心,福建福州 350002)
灵芝单、双核菌丝差异研究
叶丽云,鲁 欣,林 强,吴小平
(福建农林大学菌物研究中心,福建福州 350002)
通过菌丝形态特征、生长速度以及多糖和三萜含量的差异分析灵芝单核、双核差异,同时应用高效液相色谱法比较了灵芝单核、双核菌丝指纹图谱,并采用实时荧光定量PCR技术研究三萜关键酶基因表达量。结果显示,双核菌株J-7/AL-2菌丝生长旺盛且整齐,单核菌株菌丝长势较弱。双核菌株的生长速度(0.55 cm/d)明显快于两株单核菌株(p<0.05)。单核菌株J-7多糖含量(42.11 mg/g)较双核菌株高出20.8%。双核菌株三萜含量(42.5 mg/g)显著高于单核菌株30%左右(p<0.05)。高效液相色谱结果显示,双核菌株与两株单核菌株在三萜组分上存在一定的差异,相似度为0.82;两株单核菌株的菌丝三萜组分相似度极高,相似度达0.96。实时荧光定量PCR结果显示,双核菌株的6个三萜关建酶基因的表达量都要显著高于其他两株单核菌株,说明基因表达可能存在协调增效作用。
单核菌丝,双核菌丝,多糖,三萜
灵芝是一种我国传统的药用真菌。随着科研人员对灵芝的研究不断深入,灵芝的营养价值和药理作用也逐渐被开发利用。而灵芝的抗肿瘤、抗HIV、保肝和降血压等药理作用大部分是与灵芝多糖和三萜等活性成分有关[1-5]。面对我国灵芝资源与技术的现状,迫切需要进一步深化灵芝产业开发与应用[6]。
目前生产上获得灵芝多糖和三萜类化合物的主要来源是成熟子实体和液体发酵的菌丝。而传统的段木栽培需要消耗大量的木材资源,而且生产周期比较长,同时易受到外界环境的干扰[7]。近年来食用菌液体深层发酵技术的发展,使得灵芝、虫草、白灵菇等食用菌发酵菌丝体得到应用,通过液体发酵技术来提取灵芝的多糖和三萜的周期较短,且操作简单[8-10]。目前大量的研究主要集中于培养过程中的环境因素,如培养基的配方优化、pH、溶氧和诱导剂的添加等。而对灵芝液体深层发酵中菌种的选育鲜有报道,且传统液体发酵的研究对象均为双核菌株,单核菌株的研究则主要应用于杂交育种领域[11],而对于灵芝单核菌株活性成分的研究鲜有报道。
灵芝三萜的生物合成主要是通过甲羟戊酸途径(mevalonate pathway,MVA pathway)来完成的[12-13]。这个过程是以乙酰辅酶A为底物经过一系列的酶促反应形成异戊烯基焦磷酸(IPP),异戊烯基焦磷酸再经过多步的酶催化反应形成羊毛兹醇,最后由羊毛兹醇经过各种氧化修饰形成不同类型的灵芝酸单体。近些年,Zhao[14]等已经克隆出了一些灵芝三萜合成途径中的关键酶基因,并对其功能进行了验证,包括3-羟基-3-甲基戊二酰辅酶A合酶(HMGS)、3-羟基-3-甲基戊二酰辅酶A转录水平还原酶(HMGR)、焦磷酸甲羟戊酸脱羧酶(MVD)、法尼基焦磷酸合酶(FPS)、鲨烯合酶(SQS)和羊毛兹醇合酶(LS)。通过这六个关键基因的表达情况有助于进一步分析灵芝中三萜含量的差异。
本研究通过对比灵芝单双核菌丝形态特征、生长速度以及液体发酵条件下菌丝多糖和三萜的成分差异,结合高效液相职位图谱及六个关键基因表达量进行对比分析,以期为选育灵芝优质高产菌株提供理论依据,并对灵芝活性成分研究及三萜合成分子机制提供参考。
1 材料与方法
1.1 材料与仪器
供试菌株 由担孢子萌发而来的灵芝单核菌株J-7和AL-2,方法参考柯斌榕等[15],以及它们杂交的双核菌株J-7/AL-2,由福建省种质资源保藏与管理中心提供;固体PDA培养基 200 g马铃薯加入1000 mL水煮沸后用四层纱布过滤,浸出液加入20 g琼脂煮到完全溶解,最后加入20 g葡萄糖搅拌均匀,定容至1000 mL;液体PDA培养基 200 g马铃薯煮沸浸出液加入20 g葡萄糖搅拌均匀,定容至1000 mL;无水乙醇、三氯甲烷、正丁醇、浓硫酸、苯酚、高氯酸、香兰素、冰醋酸、氯化钠等 均为国产分析纯试剂;甲醇、乙腈 色谱纯;Omega植物RNA提取试剂盒 Omega公司;TransScript All-in-One First-Strand cDNA Synthesis SuperMix for qPCR试剂盒 全式金生物技术有限公司;Bio-rad荧光定量试剂盒 伯乐生物有限公司。
分析天平 奥豪斯仪器有限公司;生化培养箱 上海博讯实业有限公司;恒温水浴锅 上海一恒科技有限公司;旋转蒸发仪 上海申工科技有限公司;超声波清洗机 宁波新芝生物科技有限公司;紫外可见分光光度计 北京北分瑞利分析仪器有限公司;超快速分离液相色谱仪 日本岛津;Stepone plus型荧光定量PCR仪 ABI公司;多用电泳仪 北京三恒公司;DNA检测仪 NanoDrop;Tanon凝胶成像系统 上海天能公司;BIO-RAD CFX96 PCR仪 天津钧星瑞科技有限公司。
1.2 实验方法
1.2.1 供试菌株菌落形态观察 将母种接种到PDA斜面活化好后转接到PDA培养基平板的中心,置于生化培养箱中28 ℃培养,在三种菌株中有一株菌丝刚长满平板时进行观察并拍照。
1.2.2 单双核菌株生长速度的测定 取刚长满平板的活化菌株,用9 mm的打孔器在同一圆周的位置上打出相同的菌丝块。无菌操作下将菌丝块接种到倒有PDA培养基的平板中心。将平板置于生化培养箱中28 ℃培养。等到菌丝开始萌发长到1 cm左右,在菌落的边缘划起始生长线,等到生长最快的菌丝快要长满平板时,取出所有平板,在菌落的边缘划终止生长线,采用十字交叉法用尺子测量起始生长线与终止生长线之间的距离,并按照如下公式计算菌丝的生长速度
菌丝生长速度(cm/d)=起始生长线与终止生长线之间的距离(cm)/菌丝生长的天数(d)
1.2.3 菌丝液体培养和收集 取刚长满平板的活化菌株,用9 mm的打孔器在同一圆周的位置上打出相同的菌丝块。无菌操作下取8块菌丝块接种到装有100 mL液体PDA的250 mL三角瓶中,置于生化培养箱中28 ℃静置培养,培养2周后用纱布收集菌丝并除去接种块,用蒸馏水反复洗涤3次,置于60 ℃烘箱中烘干至恒重。
2017 年春节期间该站点监测数据显示, ρ(PM2.5) 、 ρ(PM10) 最大值分别为 142μg/m3、172μg/m3。同时,ρ(PM2.5) /ρ(PM10) 平均值为74.5%,表明春节期间南京市城区细粒子所占比例较大。二次无机离子SNA(NO3-、SO42-、NH4+)共占总离子浓度的81.5%,这表明了大气二次污染较为严重。
1.2.4 灵芝菌丝生物量的测定 于分析天平上准确称量1.2.3中得到烘干菌丝的重量并记录。
1.2.5 灵芝菌丝粗多糖的提取与测定 多糖的提取方法参考胡斌杰等的方法[16]。称取0.1 g的灵芝菌丝粉,90 ℃热水浸提4 h,料液比为1∶20。离心收集上清液,重复提取一次,合并2次提取液。醇沉过夜,然后5000 r/min离心10 min,弃去上清液,所得沉淀用2 mL蒸馏水溶解,最后用sevag法去除蛋白,吸取上层清液用蒸馏水定容至25 mL。采用苯酚-硫酸法测定多糖含量[17]。每组3个重复。
1.2.6 灵芝菌丝总三萜的提取与测定 菌丝三萜的提取参考汤坤鹏的方法[18]。称取0.2 g灵芝菌丝体粉,并加入30 mL的85%乙醇常温浸提2 h,然后进行超声提取0.5 h,功率为150 W。将滤液用旋转蒸发仪60 ℃减压蒸馏去除乙醇,最后用甲醇定容至25 mL。采用香草醛-冰醋酸法[19]测定总三萜含量。每组3个重复。
1.2.7 高效液相色谱检测 以0.1%乙酸水为流动相A和乙腈为流动相B进行梯度洗脱,色谱柱为Inertsustain C18,柱温为40 ℃,流速为0.8 mL/min,检测波长为254 nm,进样量为10 μL。所有检测三萜样品需过0.45 μm的有机滤膜后上机进样检测[20]。在中药色谱指纹图谱相似度评价系统A版中应用平均值法生成对照指纹图谱进行相似度分析。
1.2.8 三萜关键酶基因的表达量的检测 内参基因为GADPH,关键基因HMGS、HMGR、MVD、FPS、SQS、LS引物设计参考Xu[21]等报道,引物设计由上海生工合成。

表1 内参基因与6个目标基因的引物序列
收集液体静置培养2周后的灵芝单、双核菌丝,立即储存于液氮中。使用Omega植物RNA提取试剂盒提取菌丝的总RNA。使用TransScript All-in-One First-Strand cDNA Synthesis SuperMix for qPCR试剂盒合成cDNA。反应体系如表2。扩增程序为42 ℃,15 min;80 ℃,5 s;4 ℃保存。获得的短片段cDNA用于后续的荧光定量。

表2 反转录RNA反应体系

表3 荧光定量PCR反应体系
将六个基因在菌株AL-2中的表达量设为1,其他菌株相对应的表达量根据2-ΔΔT法计算得到[22]。
1.3 数据处理
数据分析采用Excel、SPSS、DPS软件、中药色谱指纹图谱相似度评价系统A版;每个实验处理设计3个重复,结果以平均值±标准偏差表示。
2 结果与分析
2.1 单双核菌株的形态特征
观察单核菌株和双核菌株的菌落形态特征,如图1所示,发现双核菌株和单核菌株之间菌落形态存在明显的差异。双核菌株在平板上的生长速度快于单核菌株。双核菌株J-7/AL-2菌丝生长旺盛且整齐,单核菌株AL-2菌丝长势最弱,且生长边缘比较不规则。而单核菌株J-7的菌丝相对稀疏。
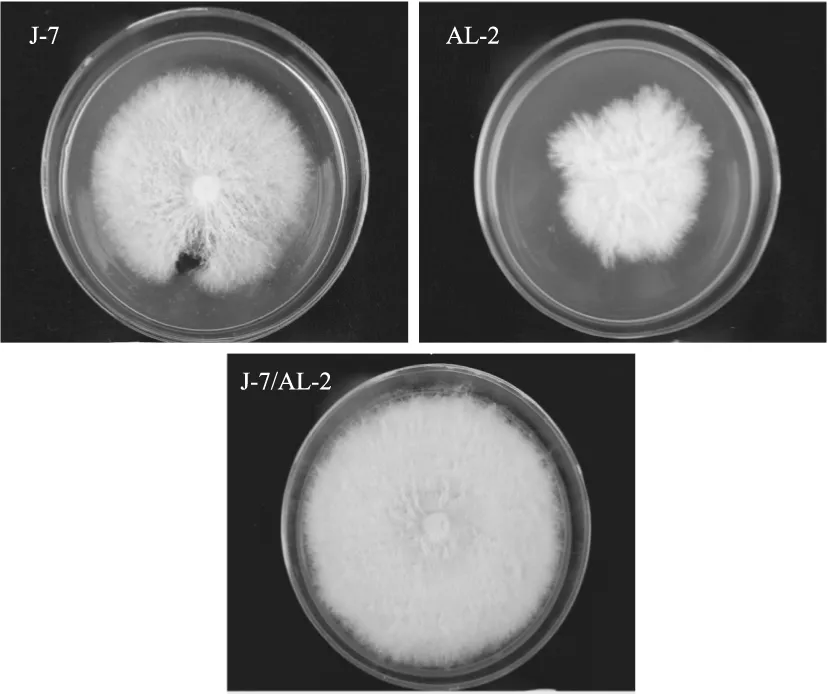
图1 三菌株的菌落形态Fig.1 Mycelial morphology of three strains
2.2 单双核菌株在PDA培养基的生长速度
对单双核菌株的生长速度差异性进行分析结果如图2所示,单双核菌株的生长速度差异显著,且双核菌株的生长速度明显快于两株单核菌株。双核菌株J-7/AL-2的生长速度为0.55 cm/d,是生长速度较慢的单核菌株AL-2的两倍(p<0.05)。
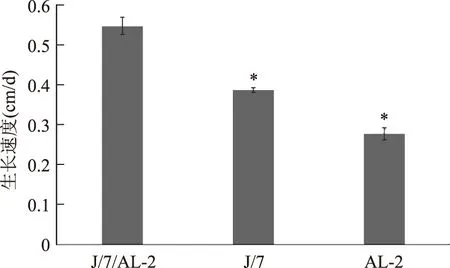
图2 三菌株在PDA培养基上的生长速度Fig.2 The growth rate fo three strains in PDA culture-medium注 *表示与J-7/AL-2有显著差异(p<0.05)。
2.3 灵芝单双核菌丝多糖和三萜含量的比较
比较了灵芝单双核菌株生物量、菌丝多糖和三萜含量的差异,结果如表4所示。在液体静置培养2周后,单双核菌株在液体表面均形成一层白色的菌丝层。双核菌株J-7/AL-2的生物量极显著(p<0.01)高于两株单核菌株,两株单核菌株之间差异不显著。单核菌株J-7的菌丝多糖含量最高,约为42.11 mg/g与其他两株菌株差异极显著(p<0.01),高出双核菌株20.8%。而双核菌株J-7/AL-2与单核菌株AL-2菌丝多糖含量差异不显著。双核菌株J-7/AL-2的总三萜含量显著高于两株单核菌株(p<0.05)。双核菌株的总三萜含量约为42.54 mg/g,比两株单核菌株高出30%左右。
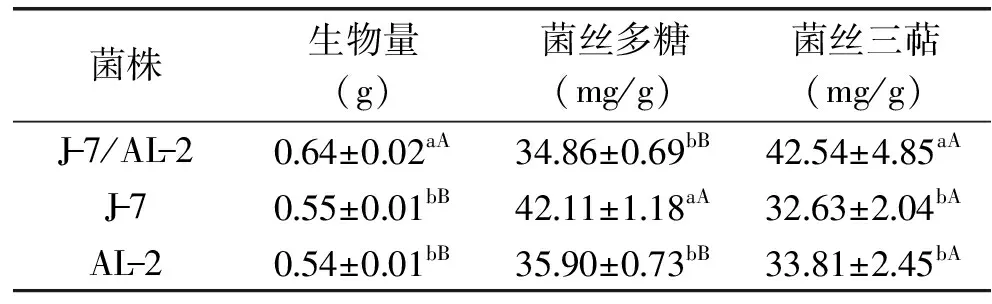
表4 灵芝单双核菌丝多糖和三萜含量比较
注:同列不同小写字母表示显著差异(p<0.05);不同大写字母表示极显著差异(p<0.01)。
2.4 灵芝单双核菌丝三萜指纹图谱分析
图3是单双核菌株液体静置培养下HPLC指纹图谱比较。从图3中可以看出单双核菌株在组分上存在着相似性,同时也存在差异性。不同菌株在相同组分上也存在着表达量的差异。如双核菌株在14.9 min有一个峰,而在两株单核菌株中都未被检测到。表2为单双核菌株液体静置培养三萜相似度比较。从表5中可以看出,液体静置培养方式下双核菌株J-7/AL-2在三萜组分上与两株单核菌株存在一定的差异性。在两株单核菌株的三萜组分相似度很高,达到了96.2%。

图3 三菌株液体静置培养HPLC指纹图谱Fig.3 HPLC fingerprint of three strains in liquid static cultures注:S1为双核菌株J-7/AL-2,S2为单核菌株J-7,S3为单核菌株AL-2,R为对照指纹图谱;表2同。

S1S2S3RS1(J-7/Al-2)10 8260 8160 899S2(J-7)10 9620 983S3(AL-2)10 979R1
2.5 灵芝单双菌丝三萜关键酶基因差异分析
运用荧光定量PCR技术对灵芝双核菌株J-7/AL-2和单核菌株J-7与AL-2在液体静置培养下2周的菌丝三萜关键酶基因表达量进行了分析。结果如图4所示,六个三萜关键酶基因在双核菌株J-7/AL-2中的表达量均显著高于2株单核菌株(p<0.05)。其中HMGS和HMGR的差异最大,双核菌株J-7/AL-2的HMGS基因表达量是单核菌株J-7的13.5倍,同时也是单核菌株AL-2的6.5倍,而双核菌株J-7/AL-2的HMGR基因表达量是单核菌株J-7的10.8倍,同时也是单核菌株AL-2的7倍。而其他四个基因也都存在着显著性差异。这可能与双核菌株中2个细胞核出现了相互作用有关,使得三萜关键酶基因出现了变化,在双核菌株中基因出现了协调增效作用。单核菌株AL-2在HMGS、HMGR和MVD的基因表达量上比单核菌株J-7要高,而在FPS和SQS的基因表达量比单核菌株J-7要低。两个菌株在LS基因的表达量上差异不大。
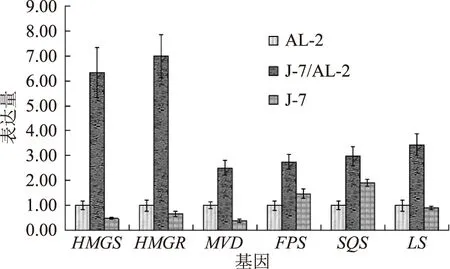
图4 六个三萜关键酶基因在三菌株中的表达情况Fig.4 Expression levels of six triterpene genes in three strains
3 结论
通过比较灵芝单双核菌株生长速度发现双核菌株J-7/AL-2的生长速度为0.55 cm/d显著高于两单核菌株(p<0.05)。单双核菌株的生物量检测结果表明双核菌株的生物量为0.64 g,极显著(p<0.01)高于单核菌株。采用苯酚-硫酸法测定单双核菌株中多糖的含量,测得单核菌株J-7的菌丝多糖含量最高,约为42.11 mg/g与其他两株菌株差异极显著(p<0.01),高出双核菌株20.8%。而双核菌株J-7/AL-2与单核菌株AL-2菌丝多糖含量差异不显著。这与连瑞丽[23]、Niederpruem[24]等报道的单核菌株在产菌丝多糖能力上不弱于双核菌株,有的甚至高于双核菌株的结果相一致。通过香草醛-冰醋酸法检测菌丝中三萜含量发现双核菌株J-7/AL-2的总三萜含量约为42.54 mg/g,比两株单核菌株高出30%左右,显著高于两株单核菌株(p<0.05)。HPLC技术对比单双核菌株的三萜指纹图谱可以看出单双核菌株产三萜组分存在一定的差异,单核菌株之间的三萜组分差异不大。在双核菌株J-7/AL-2中,HMGS、HMGR、MVD、FPS、SQS和LS基因均明显的上调,表明双核菌株在三萜合成能力上得到加强,这与双核菌株在液体培养中总三萜含量均高于单核菌株的研究结果相一致。
[1]Toth JO,Luu B,Ourision G. Les acides ganoderiques tàz:triterpenes cytotoxiques de Ganoderma lucidum(Polyporacée)[J]. Tetrahedron Letters,1983(24):1081-1084.
[2]Toshio M. Studies on fungal polysaccharides X X Ⅶ. Structural examination of a water-soluble anti-tumor polysaccharide of Ganoderma lucidum[J]. Chem Pharm Bull,1981,29(12):3611-3616.
[3]Min BS,Nakamura N,Miyashiro H,et al. Triterpenes from the spores of Ganoderma lucidum and their inhibitory activity against HIV-1 protease[J]. Chem Pharm Bull,1998(46):1607-1612.
[4]Wang MY,Liu Q,Che QW,et al. Effects of triterpeniods from Ganoderma lucidum Karst on three different experimental liver injurey models in mice[J]. Acta Pharm Sin,2002,35(5):326-329.
[5]黄智璇,欧阳蒲月. 灵芝多糖降血糖作用的研究[J]. 食用菌,2009,31(1):60-61.
[6]李钦艳,钟莹莹,陈逸湘,等. 我国灵芝种质资源及生产技术研究进展[J]. 中国食用菌,2016,35(1):8-12,20.
[7]金鑫,刘宗敏,黄羽佳,等. 我国灵芝栽培现状及发展趋势[J]. 食药用菌,2016,24(1):33-37.
[8]Tang YJ,Zhang JJ. Performance analyses of a pH shift and DOT shift integrated fed batch fermentation process for the production of ganoderic acid and Ganoderma polysaccharides by medicinal mushroom Ganoderma lucidum[J]. Bioresource Technol,2009(100):1852-1859
[9]刘高强,赵艳,王晓玲,等. 灵芝多糖的生物合成和发酵调控[J]. 菌物学报,2011,30(2):198-205.
[10]张金霞,陈强,黄晨阳,等. 食用菌产业发展历史、现状与趋势[J]. 菌物学报,2015,34(4):524-540.
[11]申进文,王淑敏,戚元成. 香菇939菌株单核菌丝和双核菌丝多糖产量比较[J]. 园艺学报,2007,34(4):941-946.
[12]Shiao MS. Triterpeniod natural products in the fungus Ganodema lucidum[J]. Journal of the Chinese Chemical Society,1992(39):669-674.
[13]Hirotani M,Asaka I,Furuya T. Investigation of the biosynthesis of 3α-hydroxy triterpenoids,ganoderic acids T and S,by application of a feeding experiment using acetate[J]. Journal of the Chemical Society,1990,10:2751-2754.
[14]Zhao MW,Liang WQ,Zhang DB,et al. Cloning and characterization of Squalene Synthase(SQS)Gene from Ganodema lucidum[J]. J Microbiol Biotechnol,2007,17(7):1106-1112.
[15]柯斌榕,吴小平. 赤芝与无柄灵芝担孢子的萌发特性比较[J]. 食药用菌,2015,23(5):282-287.
[16]胡斌杰,陈金锋,王宫南. 超声波法与传统热水法提取灵芝多糖的比较研究[J]. 食品工业科技,2007(2):190-192.
[17]杨静文,郑洁虹,马乃良,等.灵芝多糖检测鉴定方法[J].现代食品科技,2010,26(7):739-741,663.
[18]汤坤鹏,刘盛荣,吴小平,等. 灰色关联度法筛选适合液体深层发酵灵芝菌株[J]. 核农学报,2015,29(10):1963-1969.
[19]刘海良,宋爱荣,黄芳. 树舌灵芝发酵液中灵芝酸的提取及测定[J]. 食用菌学报,2008,15(3):68-71.
[20]黄生权,姚松君,刘翠玲,等. 不同生长时期的灵芝三萜含量测定及变化规律研究[J]. 现代食品科技,2001,7(8):1015-1019.
[21]Xu JW,Zhao W,Zhong JJ. Production of individual ganoderic acids and expression of biosynthetic genes in liquid static and shaking cultures of Ganoderma lucidum.[J]. Applied Microbiology and Biotechnology,2010,85:941-948.
[22]Livak KJ,Schmittgen TD. Analysis of Relative Gene Expression Data using Real-time Quantitative PCR and the 2-ΔΔTMethod[J]. Methods,2001,25(4):402-408.
[23]连瑞丽,李宇伟,李存法,等. 灵芝单双核菌丝液体发酵产多糖量的比较研究[J]. 郑州牧业工程高等专科学校学报,2012,32(2):14-16.
[24]Niderpruem DJ,Marschall L,Spetch JL. Control of extracellular slime accumulation in monokaryons and resultant dikaryons of Schizophyllum commue[J]. Sabourandin,1977(15):283-295.
Study on the differences of monokaryotic mycelium and dikaryotic mycelium ofGanodermalucidum
YE Li-yun,LU Xin,LIN Qiang,WU Xiao-ping*
(Mycological Research Center of Fujian Agricultural and Forestry University,Fuzhou 350002,China)
The morphological characteristics,growth rate,and the difference of the contents of polysaccharides and triterpenoids of monokaryotic mycelium and dikaryotic mycelium ofGanodermalucidumwere compared. Meanwhile,the fingerprint of triterpenoids ofGanodermalucidumwas analyzed by high performance liquid chromatography(HPLC)method and the expression levels of six triterpeniods enzyme genes were analyzed by real-time quantitative PCR. The result showed that the dikaryotic strain J-7/AL-2 grew vigorously and neatly while monokaryotic strain grew weaker. The growth rate of dikaryotic strain(0.55 cm/d)was significantly faster than that of the two strains with thep<0.05. The content of polysaccharide of monokaryotic strain J-7(42.11 mg/g)was higher than dikaryotic strain out of 20.8%. The content of the triterpenoids(42.5 mg/g)was significantly higher than that of monokaryotic strain about 30% and thep<0.05. The result of HPLC showed that there was a certain difference between the fingerprints of dikaryotic strain and two monokaryotic strains and the similarity was 0.82. But the triterpenoids compounds of two monokaryotic strains had the highest similarity at 0.96. The result of real-time quantitative PCR showed that the expression of six triterpeniods enzyme genes in dikaryotic strain J-7/AL-2 was much more than two monokaryotic strains because of synergistic gene expression effect.
monokaryotic strain;dikaryotic strain;polysaccharide;triterpenoids
2016-04-18
叶丽云(1991-),女,硕士,主要从事食用菌遗传育种研究,E-mail:jhyeliyun@126.com。
*通讯作者:吴小平(1965-),男,博士,教授,从事食用菌教学与研究,E-mail:fjwxp@126.com。
福建省种业创新与产业化工程专项项目(2014S1477-21)。
TS
A
1002-0306(2016)20-0000-00
10.13386/j.issn1002-0306.2016.20.000

