柞蚕微粒子虫在母蛾不同腹节分布的研究
贾 姝 宋 策 赫英姿 刘孝良 于庭洪 赵 翀 左玲玲
(辽宁省蚕业科学研究所,辽宁凤城 118100)
柞蚕微粒子虫在母蛾不同腹节分布的研究
贾 姝 宋 策*赫英姿1刘孝良1于庭洪1赵 翀1左玲玲1
(辽宁省蚕业科学研究所,辽宁凤城 118100)
研究柞蚕微粒子虫在母蛾不同部位的分布,对提高柞蚕制种过程中镜检准确性,确保柞蚕种质量及柞蚕生产安全性具有重要意义。本研究共检测了30只患病母蛾不同腹节的微粒子孢子数量分布情况,发现不同感染程度的母蛾均是第一或第二腹节的微粒子孢子数量最多,说明病原位置主要密集在第一第二腹节;重度感染病蛾,各腹节均可见较多的微粒子孢子,而中度感染和轻微感染母蛾其它腹节微孢子数量相对较少。在柞蚕制种镜检时,点片取样位置不同会影响镜检结果。
柞蚕微粒子虫 母蛾腹节 分布 微粒子病检测
柞蚕微粒子病(Pebrine of Chinese tussah silkworm),又称柞蚕微孢子虫病,俗称锈病、渣子病、底子病等[1],是影响柞蚕生产最为严重的病害之一。其优势病原为柞蚕微粒子虫(NosemapernyiWen et Ding sp. nov.)[2],可通过胚胎垂直传染给子代,给蚕种生产带来毁灭性病害,因而被列为柞蚕种生产中的唯一检疫对象[3]。目前在柞蚕制种过程中,控制柞蚕微粒子病的最有效方法是“镜检法”,即利用显微镜检测柞蚕微孢子虫并淘汰患病蛾卵[4],该法也是控制微粒子病的根本环节[4]。镜检法虽然直观、方便,但该法由于人为、设备和微孢子虫发育阶段等因素,常常会造成漏检,很难保证淘汰的准确性和全面性[5],其中一个重要影响因素就是点片误差,对于轻微感病母蛾,采样不准,未能取到病原,必定会造成漏检,影响蚕种质量[6]。本研究测定了柞蚕微粒子虫在母蛾不同腹节的分布情况,以确定病原相对密集部位,为镜检时准确取样提供依据,以确保镜检准确性,提高微粒子病的控制效果,实现柞蚕产业健康持续发展。
1 材料和方法
1.1 材料
柞蚕微粒子病母蛾
1.2 试验方法
取产完卵的柞蚕微粒子病母蛾30只,置于-20℃冰箱中冷冻保存。用刀片将冷冻的病蛾解剖并收集其第一至第五及末端腹节(雌蛾可见7个腹节,第八至第十腹节形成外生殖器,称为 “生殖节”[2],第七腹节短小,故第六、第七腹节与生殖节合并为末端腹节),称重,加3 mL蒸馏水充分研磨[7],收集滤液经500 r/min,离心1 min,取上清液,再经3000 r/min,4 ℃离心5 min,弃上清,用PBS缓冲液(pH 7.8)悬浮沉淀,再经3000 r/min,4℃离心5 min,重复3次,离心后弃上清,按每1 g重量添加1 mL无菌水混匀沉淀,用血球计数板计数,重复3次。
2 结果与分析
微粒子病蛾的感病程度按计数板上微粒子孢子的密集程度划分为“轻微感染”、“中度感染”、“重度感染”。 “轻微感染”病蛾为每3个视野或以上视野可见1~5个微粒子孢子;“中度感染”病蛾为每个视野或每2个视野可见1~10个微粒子孢子;“重度感染”病蛾为每个视野有10个以上微粒子孢子。
2.1 轻微感染病蛾
测定轻微感染微粒子病母蛾不同腹节的微孢子数量分布如表1所示。结果显示,3、5、6、7、9号病蛾第一腹节的微粒子孢子最多;而1、2、4、8号病蛾第二腹节微孢子最多,这可能与不同微病母蛾的个体差异有关。对于轻微感染的母蛾,部分中间腹节未发现微粒子孢子,而在第五腹节、及末端腹节发现微粒子孢子并且数量相对较多。
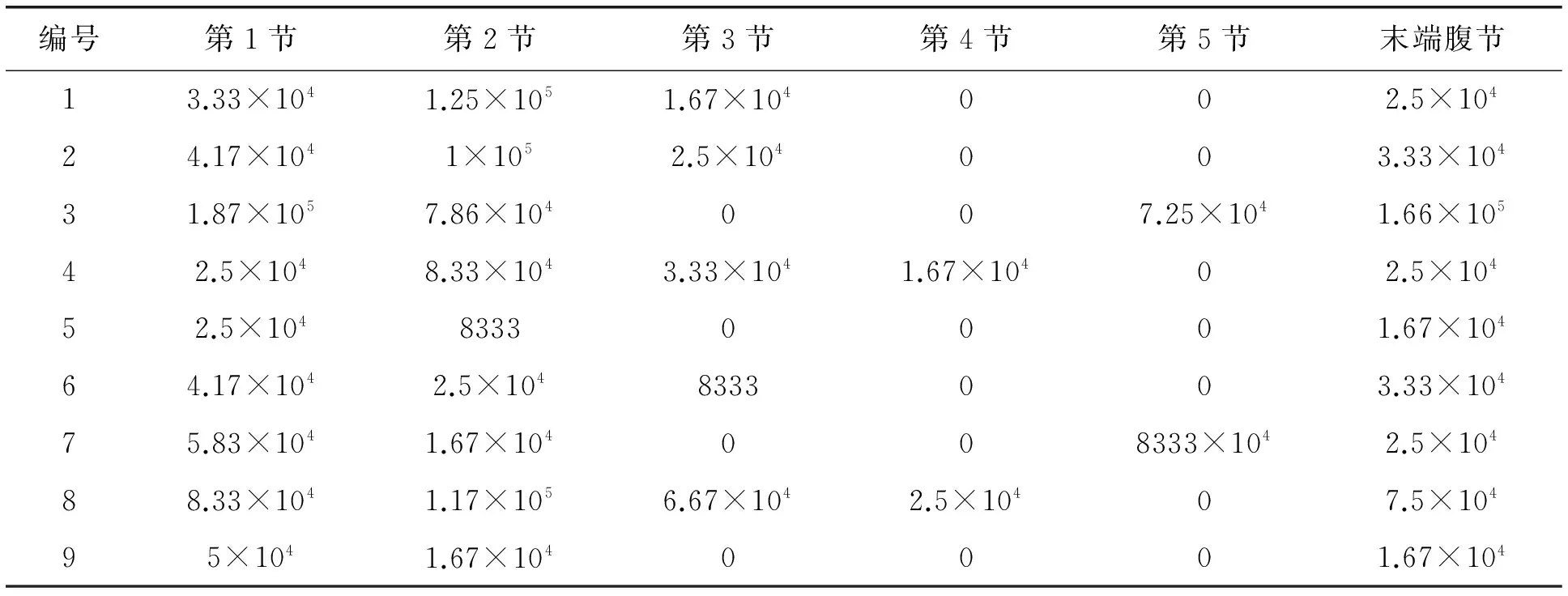
表1 轻微感染病蛾不同腹节微粒子数量分布
2.2中度感染病蛾
测定中度感染微粒子病母蛾不同腹节的微孢子数量分布如表2所示。结果显示,1、2、3、6、8号病蛾的第一腹节微粒子孢子最多;而4、5、7、9、10、11、12号病蛾病原密集的位置为第二腹节。
2.3 重度感染病蛾
测定重度感染微粒子虫母蛾不同腹节的微孢子数量分布如表3所示。结果显示,2、3、4、6、7、9号病蛾第一腹节的微孢子最多;1、5号和8号病蛾第二腹节的微孢子最多。
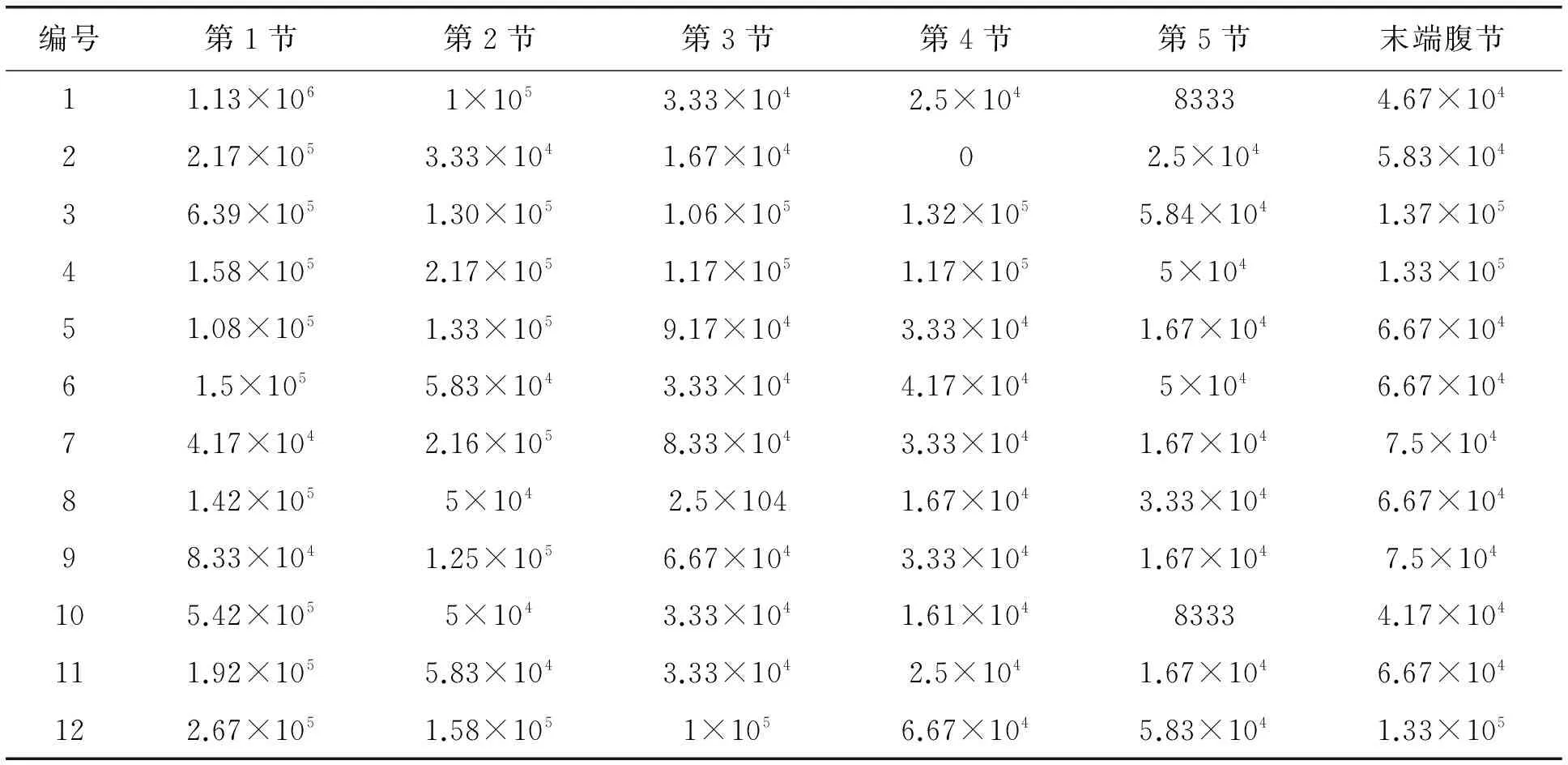
表2 中度感染病蛾不同腹节微粒子数量分布
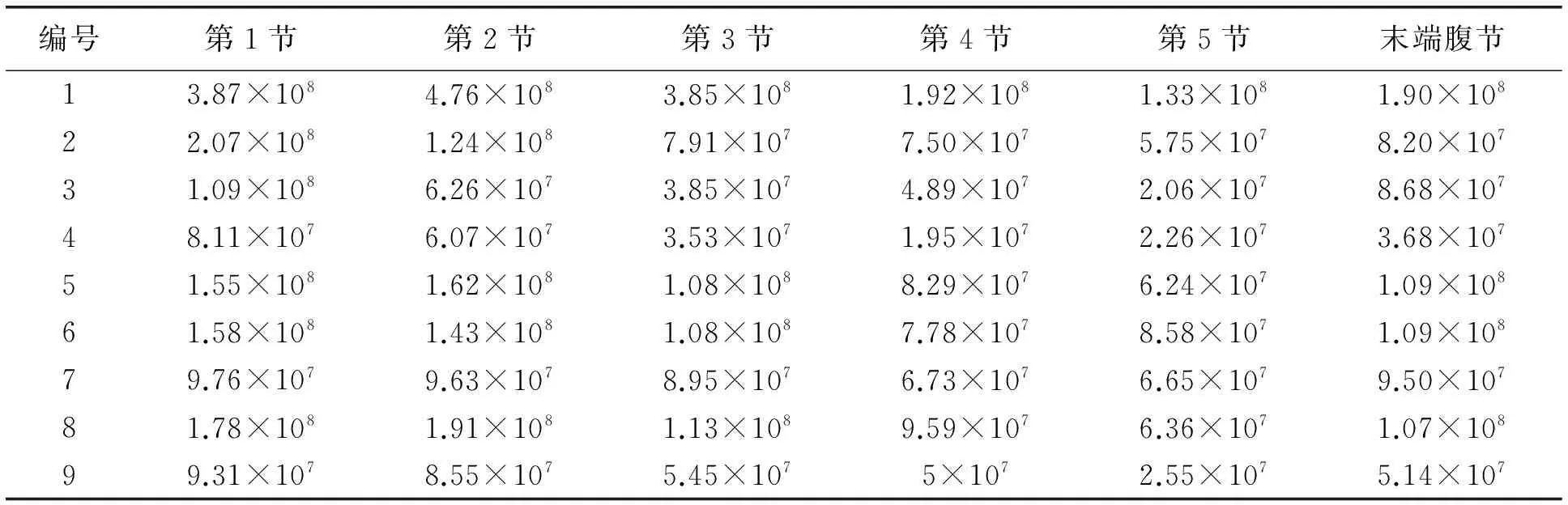
表3 重度感染病蛾不同腹节微粒子数量分布
3 结论与讨论
本文测定了柞蚕微粒子病母蛾不同腹节的微粒子孢子数量分布。结果表明,轻微感染母蛾、中度感染母蛾、重度感染母蛾均是第一或第二腹节的微孢子最多,说明其病原相对密集部位在第一第二腹节。在光学显微镜下,对于重度感染病蛾,各腹节均可见较多的微粒子孢子,因而点片的不同取样位置不会影响镜检结果。对于中度感染病蛾,在病原密集部位,每个视野或每2个视野可见1~10个微粒子,而其他部位微粒子孢子相对较少,如果取样位置不准确很容易造成漏检。历红达[8]指出同一头种蛾,若准确点取脂肪体,在显微镜下就比较容易发现微粒子孢子,如果平均每个视野里分布有10个以下的孢子,点取蛾体其他部位的样片,检出微粒子孢子的概率会降至5%以下。对于轻微感染母蛾,由于感染程度轻,微粒子孢子未扩散到蛾体部分中间腹节,而第一、第二腹节为母蛾中肠位置,是微粒子孢子最先感染增殖的位置[2],第五腹节及末端腹节是母蛾的生殖器位置,这可能是因为柞蚕微粒子病有垂直传播的特点,因而微粒子孢子也能扩散到母蛾的生殖器官。因此,点片取样时是否能采集病原密集部位对于是否能准确检出微粒子病蛾至关重要。
对于如何提高镜检法在柞蚕制种中的准确性,相关学者做了研究,提出了2次检查[5]、对检法[4],对提高检出率效果显著,本文研究了微病母蛾不同腹节的微孢子的数量分布,确定了其病原相对密集部位,为柞蚕制种过程中的微粒子检测提供了理论依据和指导。
虽然通过镜检方法的改进可以在一定程度提高镜检效果,但是这些都需要消耗大量的人力,降低了工作效率。近年来,关于微粒子病检测新方法也取得了一定成果,建立了PCR技术检测[9]、ELISA检测法[10],准确性高,但操作成本高、周期长;提出了胶体金免疫层析检测法[11],虽简便快捷,但灵敏度低,以致新方法尚未在柞蚕生产中推广和应用。因此,亟待研究建立一种简便、快捷、准确的柞蚕微孢子虫检查技术(如对于家蚕微粒子病检测中的PCR检验试剂盒[12]或快速检测试纸[13]),来弥补镜检法在生产应用中的不足,提高检测结果的准确性,从而杜绝柞蚕微粒子病的胚种传染。
[1] 李树英,秦利.柞蚕病理学[M].辽宁科学技术出版社,2015:135.
[2] 辽宁省蚕业科学研究所.中国柞蚕[M].辽宁科学技术出版,2003:64.
[3] 秦利.中国柞蚕学[M].北京:中国科学文化出版社,2003:347-352.
[4] 魏庆国,吕明涛.对检法在柞蚕微粒子病镜检中的应用实践[J].北方蚕业,2011,32(2):63-65.
[5] 季春广,王秉义,刘忠春.蛾期镜检柞蚕微粒子病应注意的几个问题[J].疾病防治,2010,4:18.[6] 姜义仁.柞蚕微孢子虫检测及感染柞蚕中肠转录组及蛋白质组学研究[D].沈阳农业大学,2012:23-24.
[7] 姜义仁,邓真华,王伯阳,等.柞蚕微孢子虫孢子分离纯化方法[J].应用昆虫学报,2011,48(2):452-456.
[8] 历红达,李喜升.论柞蚕微粒子病的显微镜补正检查[J].中国蚕业,2003,24(5):47.
[9] 邓真华,姜义仁,杨瑞生,等.应用PCR技术检测柞蚕微孢子虫[J].蚕业科学,2010,36(2):359-362.
[10] 姜义仁,王伯阳,孙影,等.间接竞争ELISA法对柞蚕微孢子虫的检测[J].应用昆虫学报,2013,50(5):1364-1370.
[11] 王伯阳,姜义仁,臧敏,等.作蚕微孢子虫胶体金免疫层析检测法[J].蚕业科学, 2012,38(1):97-101.
[12] 刘骏,钱科,沈中元. 家蚕微粒子病PCR 快速检测技术研究及诊断试剂盒的研制[J] .中国动物检疫, 2009,26(10):49-53.
[13] 芦琨.家蚕微粒子病免疫学快速检测试纸条的研制[D].西南大学,2009:38-41.
Study on Distribution of Nosema pernyi at Different Parts of Female Moth
JIA Shu,SONG Ce*,HE Yingzi ,LIU Xiaoliang,YU Tinghong,ZHAO Chong,ZUO Lingling
(Liaoning Provincial Sericultural Research Institute,118100, Fhengcheng, Liaoning, China)
Studying the distribution of Nosema pernyi at different parts of female moth is of significance for improving accuracy microscopy, ensuring tussah’s quality and production safety. This research tested the contents of Nosema pernyi in different abdominal sections of 30 female moths. According to statistics result, the density of the first and second abdominal section is the highest. The results show that pathogenic location was mainly in 1 ~ 2 abdomen section. For severely infected moth, high density of Nosema pernyi was observed at different abdominal segments, and lower density of it was found at other abdominal segments for mild and moderate infection female moth. It is concluded the sampling position could affect the results of microscopy in the process of seed production microscopy.
Nosemapernyi; female moth abdominal segment; distribution; detection
贾姝(1987—),女,硕士,研究实习员,从事柞蚕病害防治研究工作。
宋策(1966—),男,研究员。E-mail:songce2006@163.com.

