天然丝胶蛋白及其酶解产物抑制酪氨酸酶活性研究
叶崇军 李 冰 陈复生
(安徽省农业科学院蚕桑研究所,安徽合肥 230061)
天然丝胶蛋白及其酶解产物抑制酪氨酸酶活性研究
叶崇军 李 冰 陈复生*
(安徽省农业科学院蚕桑研究所,安徽合肥 230061)
丝胶蛋白是一种拥有多种特殊功能的蛋白质,在化妆品、保健食品及医用材料等领域都具有重要的应用价值。本研究从全天然丝胶茧中提取丝胶蛋白,采用多种蛋白酶进行酶解,选取最佳蛋白酶;测定丝胶蛋白及其酶解产物的溶解性,分析其对酪氨酸酶活性的抑制作用。结果表明:丝胶蛋白经木瓜蛋白酶酶解后产物的分子量集中分布在14~29 kDa,溶解性增强;丝胶蛋白及其酶解产物均能够抑制酪氨酸酶的活性,尤以分子量较小的酶解产物抑制能力较强;抑制能力与样品的质量分数呈明显的量效关系。
丝胶蛋白 木瓜蛋白酶 酶解产物 酪氨酸酶
丝胶蛋白是一种天然的高分子蛋白质,呈球状,约占丝蛋白总量的20%~30%[1-2]。已经证实丝胶中含有18种氨基酸,其中甘氨酸、丝氨酸和丙氮酸的含量都比较高,具有许多药理作用及保健功能,营养价值很高,目前已经广泛地应用于化妆品、保健品、生物医学材料等领域[3-4]。
酪氨酸酶(Tyrosinase)是广泛存在于人体、动物、植物及微生物中的含铜氧化还原酶[5],具有奇特的催化作用,是生物体内黑色素合成的关键酶,与皮肤的衰老及恶性黑色素瘤的发生有着紧密的关系[6]。酪氨酸酶的活性受到酪氨酸酶抑制剂的抑制,使生物体内不能正常地合成黑色素。因此,在医学和化妆品领域中常采用酪氨酸酶抑制剂来预防和治疗色素沉积、黑色素瘤等。此外,酪氨酸酶抑制剂还可用作果蔬的防腐及害虫的调控剂[7]。当前对酪氨酸酶抑制剂的研究已经引起相关研究学者的高度重视。丝胶蛋白具有抑制酪氨酸酶的活性是由日本学者Kato[8]首先发现。自此之后,尽管也有丝胶蛋白抑制酪氨酸酶活性的报道,但是绝大多数所研究的丝胶蛋白都是利用有机溶剂从工业废水中进行提取,很大程度上制约了丝胶蛋白在皮肤护理产品、食品添加剂等领域的应用[9]。安徽省农业科学院蚕桑研究所陈复生等[10]根据多年的家蚕遗传育种工作,选育得到全天然丝胶茧,其天然活性物质—丝胶蛋白不仅含量丰富,而且对皮肤的刺激性小、乳化性能优良、安全性高,因而在化妆品和保健食品等行业中具有广阔的发展前景。
本研究以育成的天然丝胶茧为材料,从中提取丝胶蛋白,采用多种蛋白酶进行酶解,从中选取最佳蛋白酶;通过测定丝胶蛋白及其酶解产物的溶解性,并以多巴为底物,分析其对酪氨酸酶活性的抑制作用,为发掘丝胶蛋白这一优质蛋白质的应用潜能提供理论基础和科学依据。
1 材料与方法
1.1 材料和主要试剂
天然丝胶茧品种:绿S,由本单位选育并饲养。饲养温度在25℃左右,常规桑叶育,化蛹后取茧壳作为实验材料。中性蛋白酶、木瓜蛋白酶、碱性蛋白酶(南宁庞博生物工程有限公司),十二烷基硫酸钠、三羟甲基氨基甲烷、低标准蛋白质分子量(Takara公司),蘑菇酪氨酸酶、L-多巴(美国Sigma公司),其他试剂均为分析纯。
1.2 丝胶蛋白粉的制备
温水洗涤蚕茧,60℃烘干后剪碎。准确称取5.00 g碎茧壳,加入到含250 mL去离子水的烧瓶中,于高温灭菌锅中125℃煮沸2.5 h。室温冷却后采用四层纱布过滤,将所获得的丝胶溶液进行真空抽滤,于60℃旋转蒸发至约100 mL。将丝胶蛋白浓缩液在-40℃下预冻2 h后于-33℃,压强1 Pa条件下进行冷冻真空干燥,所得丝胶粉末即为丝胶蛋白粉[11]。
1.3 蛋白酶对丝胶蛋白的酶解效果
参照文献[12]的方法选取中性蛋白酶、碱性蛋白酶和木瓜蛋白酶对提取的丝胶蛋白进行酶解。在pH 7.0、反应温度50℃、酶浓度为0.5%、底物浓度10%、反应时间 1 h的条件下进行酶解。反应结束后立即加热至95℃,保持5 min,进行灭酶活处理。待溶液冷却至室温,即可将获得的丝胶蛋白酶解产物采用聚丙烯酰氨凝胶电泳法(SDS-PAGE,10%分离胶,5%浓缩胶)测定其分子量大小。将所得的丝胶蛋白酶解产物浓缩、冷冻干燥,研磨成粉末状备用。
1.4 丝胶蛋白及其酶解产物的溶解性
准确称取1.00 g丝胶蛋白及酶解产物,配成质量百分比为10%的悬浮液,于95℃水浴锅中振荡保温2.5 h后,5000 r/min转速下离心30 min,然后将上清液置于平面皿中烘干(60℃),称取溶出物的质量,根据以下公式计算溶解率。
溶解率=m /m0×100
其中m为溶出物的干质量,m0为样品的干质量。每个样品平行测定3次。
1.5 酪氨酸酶活性的抑制率测定
在黑色素合成的过程中,酪氨酸在酪氨酸酶的作用下转化为多巴。多巴又被酪氨酸酶催化为多巴醌。多巴醌是体内黑色素合成的一个中间体,也是一种有色物质,可用分光光度计在475 nm处测定其含量[13]。
准确吸取丝胶蛋白或酶解产物溶液、磷酸缓冲液(pH 6.8)、L-多巴溶液(0.5 mg/mL)比色管中混合均匀,25℃下放置约10 min ,缓慢加入适量的酪氨酸酶液,迅速转移到石英比色皿中,于475 nm处测第10 min 的吸光度。pH 6.8的磷酸缓冲液为参比,总反应体系为5 mL。具体各组分含量见表1。
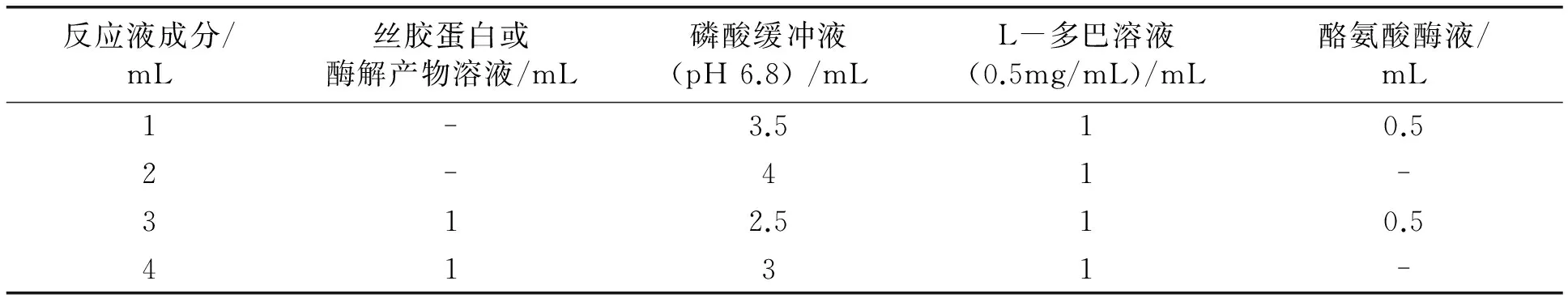
表1 反应液的组成
酪氨酸酶活性的抑制率(%) =[1- (OD3- OD4)/( OD1- OD2)]×100%
2 结果与分析
2.1 蛋白酶对丝胶蛋白的酶解效果
在蛋白酶(木瓜/中性/碱性蛋白酶)浓度为0.5%,pH 7.0,50℃,底物浓度10%,反应时间1 h的条件下,分析这3种蛋白酶对丝胶蛋白的酶解效果。由图1可以看出,丝胶蛋白的分子量在14~97.2 kDa均有分布;丝胶蛋白经木瓜蛋白酶降解后,其酶解产物的分子量集中分布
在14~29 kDa;而中性蛋白酶和碱性蛋白酶对丝胶蛋白的水解作用与对照组(无蛋白酶)相比几乎没有差别。显而易见,木瓜蛋白酶对丝胶蛋白的酶解功效优于其他两种蛋白酶。因此,选取丝胶蛋白的木瓜蛋白酶酶解产物进行下一步研究。
3—中性蛋白酶 4—碱性蛋白酶 M—蛋白标准
图1 蛋白酶对丝胶蛋白的酶解效果(SDS-PAGE图谱)
2.2 丝胶蛋白及酶解产物的溶解性
如表2所示,酶解产物的平均溶解率(68.83%)高于丝胶蛋白(52.77%)。猜想原因可能是丝胶蛋白的肽链被木瓜蛋白酶切断,蛋白质的高级结构受到损坏,从而使水解产物本身含有的亲水性基团暴露出来,与外界的水更易结合,最终使其溶解性增强[14]。
2.3 丝胶蛋白及其酶解产物抑制酪氨酸酶的活性
丝胶蛋白及其酶解产物都具有不同程度的抗酪氨酸酶活性的能力(图2)。在相同的浓度下,酶解产物对酪氨酸酶活性的抑制率要高于丝胶蛋白,可能是因为酶解产物的分子量较小。随着质量分数的增加,丝胶蛋白对酪氨酸酶活性的抑制率也随之提高,说明丝胶蛋白的浓度与酪氨酸酶活性的抑制作用成正相关关系。酶解产物对酪氨酸酶活性的抑制率也出现类似现象,呈剂量依赖性。

表2丝胶蛋白及酶解产物的溶解率
3 讨论
采用木瓜蛋白酶、中性蛋白酶和碱性白酶降解高分子量的丝胶,结果显示木瓜蛋白酶降解能力高于其他两种蛋白酶。SDS-PAGE结果显示使用木瓜蛋白酶在反应条件为反应温度 50℃、底物浓度10%、pH 7.0、酶浓度0.5%、反应时间为1 h,可以获得在14~29 kDa范围的酶解产物(图1)。这是因为木瓜蛋白酶隶属于巯基蛋白酶,首先分解精氨酸、赖氨酸的羧基端[15]。而丝胶蛋白含有较为丰富的精氨酸,经木瓜蛋白酶酶解后,释放出小分子的多肽和游离氨基酸[14]。这就说明了丝胶蛋白经木瓜蛋白酶降解后产物的分子量大幅减少。
丝胶蛋白中含有大量的亲水性氨基酸,其中绝大多数都能够被人体吸收,并且含有类黄酮等活性物质[16]。而黄酮类物质已经被证实具有抑制酪氨酸活性的作用[17]。这从理论上阐明了丝胶蛋白抑制酪氨酸酶活性的机制。本研究及前人的研究结果也进一步证明丝胶蛋白能够抑制酪氨酸酶活性[18]。
在本研究中,丝胶蛋白的酶解产物对酪氨酸酶同样具有抑制作用,且随着酶解产物浓度的增加,其对酪氨酸酶的抑制率也随之提高,呈现一定的剂量依赖性。这是因为丝胶蛋白经木瓜蛋白酶降解后产生了小分子量的丝胶多肽。这些多肽中又含有丰富的羟基、羧基等官能团,使其与微量元素如铜、铁络合的几率大大提高,最终抑制了酪氨酸酶的活性[7-8]。
丝胶及其水解产物可以根据其分子量大小应用到不同的领域中。10~70 kDa的丝胶多肽与胰岛素共轭结合后添加到糖尿病小鼠中,结果发现这种经过改良后的药物能够起到缓释作用[19];4~60 kDa的丝胶多肽能够头发护理产品中常用的添加剂—水溶性的壳聚糖衍生物以及三甲胺衍生物发生相互作用,更好地发挥产品的优良性能[12];平均分子量为30 kDa的丝胶多肽可以取代哺乳类动物、昆虫细胞培养基中的胎牛血清,从而大幅度地降低成本[20];低于20 kDa的丝胶多肽还可以应用到包括皮肤和头发护理产品的化妆品、保健品和药物中[21]。
综上所述,丝胶蛋白及小分子量的酶解产物都具有明显的抑制酪氨酸酶活性的作用,且同时具备保湿、抗氧化、紫外吸收等功能特性,在化妆品领域中具有优越的应用潜能,已引起相关研究者的密切关注。然而,如何充分利用优质的丝胶蛋白质资源,和将其应用到工业生产中还有待进一步研究。
[1] 陈 华, 朱良均, 闵思佳, 等. 蚕丝丝胶蛋白的利用研究[J]. 东华大学学报(自然科学版), 2002,28(3): 132-136.
[2] Wu JH, Zhang W, Xu SY. Preparation and characterization of sericin powder extracted from silk industry wastew ater[J]. Food Chem, 2007, 103: 1255-1262.
[3] Rupesh Dash, Mahitosh Mandal, Sudip K, et al. Silk sericin protein of tropical tasar silkworm inhibits UVB-induced apoptosis in human skin keratinocytes[J]. Mol Cell Biochem, 2008, 311:111-119.
[4] Jing Wang, Jiejing Shang, Fazheng Ren, et al. Study of the physical properties of whey protein: sericin protein-blended edible films[J]. Eur Food Res Technol, 2010, 231:109-116.
[5] 陈清西,宋康康.酪氨酸酶的研究进展[J].厦门大学学报(自然科学版),2006,45(5):731-737.
[6] Fenoll LG, Penalver MJ, Rodrigu EZ, et al. Tyrosinase kineics: D iscrim ination between two mode ls to explain the Oxidation mechanism of monophenol and dipheno l substrates[J]. Int J Biochem Cell Biol, 2004, 36: 235-246.
[7] 邹先伟,蒋志胜. 植物源酪氨酸酶抑制剂研究进展[J].中草药,2004,35:702-705.
[8] Kato N, Sato S, Yam anaka A, et al. Silk protein, sericin, inhibits lipid perox idation and tyrosinase activity[J]. Biosci Biotechnol Biochem, 1998, 62: 145-147.
[9] 靳春平,张海萍,杨明英,等. 丝胶蛋白及其酶解产物的保湿与抗氧化和抑制酪氨酸酶活性分析[J]. 蚕业科学,2013,39(6):1166-1171.
[10] 陈复生,魏兆军,陈远平.丝胶蛋白质利用与高纯度天然丝胶蚕品种选育[J].安徽农业科学,2007,35(32):10356-10357.
[11] 叶崇军,盛玉奇,魏兆军,等. 特用蚕品种茧丝胶蛋白质含量与氨基酸组分[J]. 食品科技,2010,35(8):146-149.
[12] Min-Hui Wu , Jing-Xia Yue , Yu-Qing Zhang. Ultrafiltration recovery of sericin from the alkaline waste of silk floss processing and controlled enzymatic hydrolysis[J]. Journal of Cleaner Production, 2014 ,76 :154-160.
[13] 刘锦梅,王艳丽,潘维.4种茶叶醇提物对酪氨酸酶的抑制作用[J].现代食品科技,2009,25(6):610-616.
[14] Simiso D, Mkhululi T K, Nelson T, et al. Characterization of amino acids in silk sericin protein from Gonometa rufobrunnae by MEKC with phenyl isothiocyanate derivatization[J]. Journal of Separation Science, 2006, 29(9):1245-1250.
[15] Ahmad H, Hossein B, Reyhaneh S,?et al. Immobilized papain on gold nanorods as heterogeneous biocatalysts[J]. Amino Acids, 2014, 46(7):1649-1657.
[16] Prommuaka C, De-eknamkulb W, Shotipruk A. Extraction of Flavonoids and Carotenoids from Thai Silk Waste and Antioxidant Activity of Extracts[J]. Separation and Purification Technology, 2008, 62: 444-448.
[17] Y B Ryua, T J Hab, M J Curtis-Longc, et al. Inhibitory effects on mushroom tyrosinase by flavones from the stem barks of Morus lhou (S.) Koidz[J]. Journal of Enzyme Inhibition and Medicinal Chemistry, 2008, 23(6):922-930.
[18] 吴金鸿, 王 璋, 许时婴.醇溶性丝胶肽的提纯及对酪氨酸酶抑制作用的研究[J].天然产物研究与开发,2008,20:233-238.
[19] Zhang Yu-Qing, Ma Yan,Xia Yun-Yue, et al. Silk sericin-insulin bioconjugates: synthesis, characterization and biological activity[J]. Journal of Controlled Release, 2006, 115(3):307-315.
[20] Terada Satoshi, Sasaki Masahiro, Yanagihara Kana, et al. Preparation of silk protein sericin as mitogenic factor for better mammalian cell culture[J]. Journal of Bioscience and Bioengineering,2005,100(6):667-671.
[21] Zhang, Yu-Qing. Applications of natural silk protein sericin in biomaterials[J]. Biotechnology Advances, 2002, 20(2): 91-100.
Inhibition of Natural Sericin Protein and its Enzymatic Hydrolysate on Tyrosinase Activity
YE Chongjun,LI Bing,CHEN Fusheng*
(The Sericultural Research Institute, Anhui Academy of Agricultural Sciences, 230061,Hefei ,China)
Sericin is a protein with variety of unique features, which has significant application value the fields of food, cosmetics and medical materials. In this study, sericin cocoons were used to extract sericin which was enzymatically hydrolyzed by various proteases to select the best protease. The solubility of sericin protein and its hydrolysate was determined to analyze its inhibitory effect on tyrosinase activity. The results showed that the molecular mass after dealing with papain hydrolysate was between 14 kDa and 29 kDa,with strong solubility. Sericin and its enzymatic hydrolysate have different degrees of inhibitory effect on tyrosinase activity, especially, the sericin peptide sample with lower molecular mass having greater inhibitory effect. In addition, inhibitory effect and mass fraction of samples displayed an obvious dose-effect relationship.
sericin protein;Papain;enzymatich ydrolysate;tyrosinase
国家蚕桑产业技术体系合肥综合实验站(CARS-22-SYZ09);安徽省农业科学院种子工程项目(15B0605)
叶崇军(1983—),女,硕士,助理研究员。
陈复生(1958—),男,博士,研究员。E-mail:chenfs58@163.com

