N-乙酰-L-色氨酸对新生鼠脑缺血缺氧纹状体损伤的保护作用
赵纳杰,王聚信,李晓双,高香红,于 海,刘清华,张 明,于树娜,蒋吉英△
(1.潍坊医学院药学院2013级2班,山东潍坊 261053;2.潍坊医学院人体解剖学教研室,山东潍坊 261053)
论著·基础研究
N-乙酰-L-色氨酸对新生鼠脑缺血缺氧纹状体损伤的保护作用
赵纳杰1,王聚信2,李晓双2,高香红2,于 海2,刘清华2,张 明2,于树娜2,蒋吉英2△
(1.潍坊医学院药学院2013级2班,山东潍坊 261053;2.潍坊医学院人体解剖学教研室,山东潍坊 261053)
目的 探讨N-乙酰-L-色氨酸(L-NAT)对新生鼠脑缺血缺氧纹状体损伤的保护作用。 方法 用出生第7天的SD大鼠制备新生鼠脑缺血缺氧模型,HE染色观察纹状体的形态学变化;免疫荧光染色观察Caspase3、Bcl-2和Bax的表达情况。结果 与Sham组相比,HIE组纹状体中神经细胞排列紊乱,且数量明显减少,Caspase-3、Bcl-2、Bax的表达升高;HIE +L-NAT组纹状体细胞的损伤程度减轻,Bax、Caspase-3表达下降,Bcl-2的表达进一步升高。结论 L-NAT可能通过调节Bcl-2家族蛋白的表达减轻纹状体细胞的损伤程度,从而保护新生鼠脑缺血缺氧损伤。
缺血缺氧损伤;L-乙酰-N-色氨酸;纹状体;细胞凋亡;大鼠
新生儿缺血缺氧性脑病(hypoxic-ischemicencephalopathy,HIE)是各种围生期因素引起的缺氧和血流量减少或停止导致的新生儿脑损伤,在我国的发病率为2‰~4‰,其中1‰~2‰出现脑瘫、癫痫、智力低下等程度不等的神经系统后遗症,其高发病率和高致残率使其成为目前神经科学研究的热点。纹状体是缺氧敏感区[1-3],以往的研究表明,NK1受体拮抗剂N-乙酰-L-色氨酸(L-NAT)对新生鼠脑缺血缺氧后的海马神经元有保护作用[4]。本实验探讨L-NAT对缺血缺氧损伤纹状体的保护作用,以期为L-NAT的临床应用提供实验依据。
1 材料与方法
1.1 实验动物的分组及动物模型的制备 将出生第7天的新生沙土鼠18只分成假手术组(Sham)、缺血缺氧损伤组(HIE)、缺血缺氧损伤加L-NAT组(HIE +L-NAT),每组6只。经乙醚吸入麻醉后,颈部常规消毒,颈正中切口,分离右侧颈总动脉,电凝结扎;置于37 ℃的缺氧容器中,通入92%氮气和8%氧气,流量2 L/min,持续3 h。HIE+L-NAT组分别在造模前和缺氧后30 min腹腔注射L-NAT 5 mg/kg;HIE组腹腔注射同等剂量的生理盐水;Sham组只分离右侧颈总动脉,不做结扎也不做缺氧处理。
1.2 取材与切片 各组分别于术后12 h处死动物,4%多聚甲醛灌注固定,断头取脑组织,置4%多聚甲醛固定24~48 h后,冠状取材,进行常规脱水,石蜡包埋,连续切片(厚5 μm)。
1.3 HE染色 各组切片经二甲苯脱蜡、梯度乙醇水化,常规HE染色,中性树胶封片,光镜下观察纹状体的形态学变化。
1.4 免疫荧光染色 各组切片常规脱蜡、水化;0.3%H2O2孵育15 min,以封闭内源性过氧化物酶的活性;多克隆抗体Caspase-3(1∶200,Cell Signaling)、Bcl-2(1∶200,Santa Cruz)、Bax(1∶50,Santa Cruz)4 ℃孵育过夜;FITC-conjugated Donkeny anti-Rabbit IgG(1∶200,Jackson Immunoresearch)37 ℃孵育30 min。以PBS代替一抗作阴性对照。荧光显微镜(激发光波长为490~495 nm)观察。
2 结 果
2.1 形态学变化 HE结果显示,Sham组纹状体神经细胞形态正常,数量多,分布均匀,神经细胞排列较紧密;HIE组细胞排列紊乱、疏松、形态不规则,神经元数量明显减少;L-NAT干预后细胞损伤程度明显减轻(图1)。
2.2 Bcl-2和Bax表达的改变 免疫荧光染色显示,Sham组纹状体中偶见Bcl-2和Bax表达;HIE组损伤侧纹状体内Bcl-2和Bax阳性细胞数明显增多;L-NAT干预后Bcl-2阳性细胞较HIE组增加,而Bax阳性细胞数量减少(图2、3)。
2.3 Cacpase-3表达的改变 免疫荧光显示,Sham组纹状体中Caspase-3阳性细胞数量很少;HIE组损伤侧壳核处Caspase-3阳性细胞数量明显增多;L-NAT干预后阳性细胞数量明显减少(图4)。
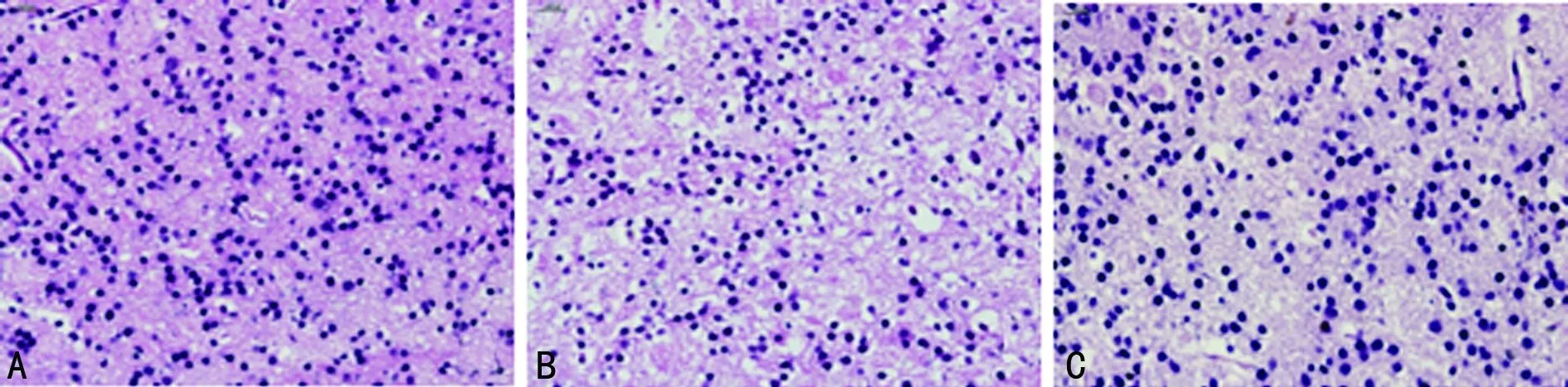
A:Sham组;B:HIE组;C:HIE+L-MAT组。
图1 纹状体细胞HE染色结果(×400)
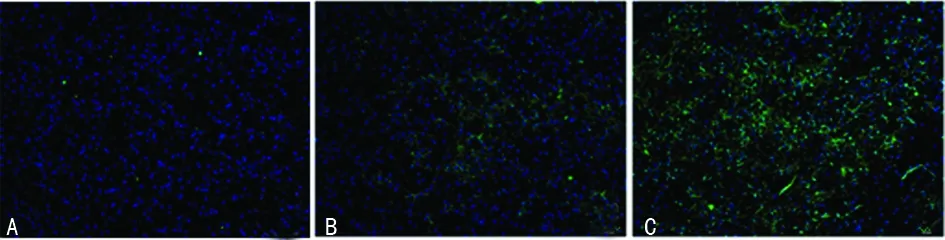
A:Sham组;B:HIE组;C:HIE+L-MAT组。
图2 各组Bcl-2的表达(×200)
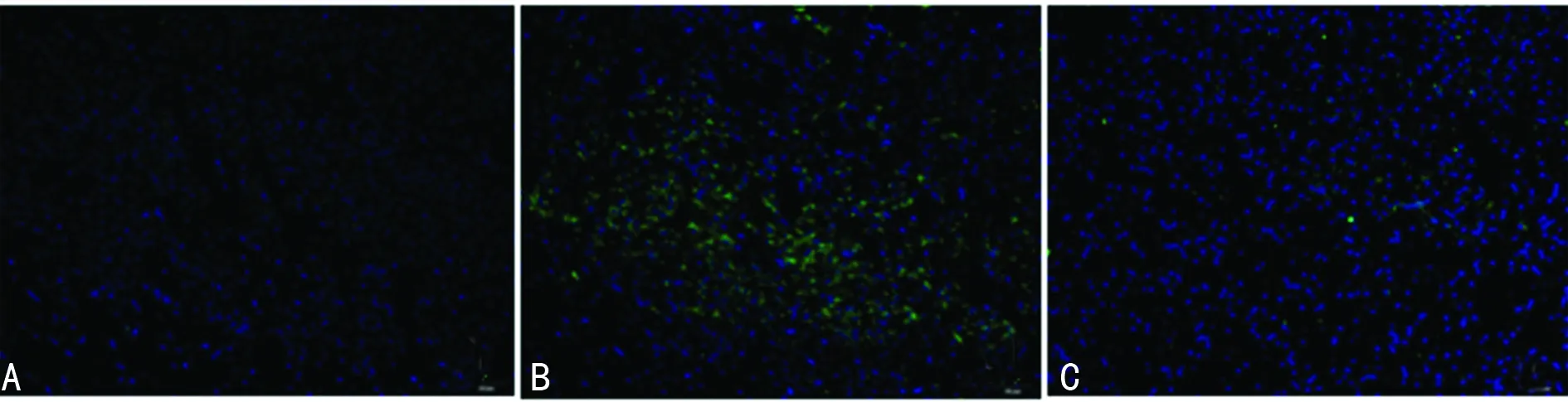
A:Sham组;B:HIE组;C:HIE+L-MAT组。
图3 各组Bax的表达(×200)
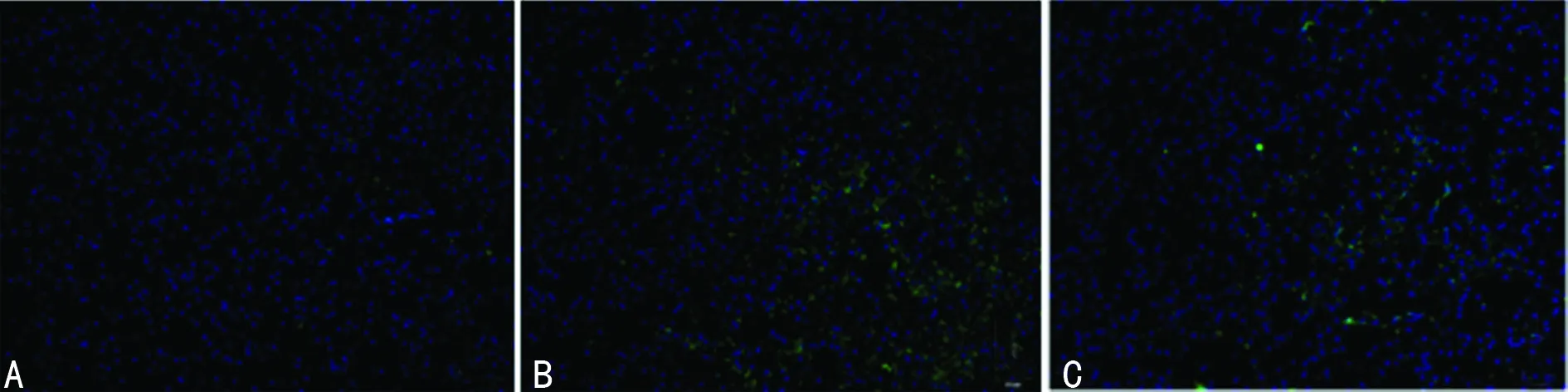
A:Sham组;B:HIE组;C:HIE+L-MAT组。
图4 各组Cacpase-3的表达(×200)
3 讨 论
HIE是由于窒息而导致脑部出现缺血缺氧损伤,可引起新生儿死亡或永久性神经功能缺陷及遗留并发症,如脑性瘫痪、智力低下、癫痫等,是新生儿的常见病、多发病。虽然目前国内外研究已取得很大进步,但至今无很好的治疗方法[5]。因此,探讨新的治疗方案非常有意义。
脑缺血缺氧损伤的发病机制尚未明确,研究表明,缺血缺氧损伤后神经细胞的死亡主要表现为缺血中心区的细胞坏死和缺血周边区的细胞凋亡。与坏死相比,细胞凋亡是一种主动的、可控的自杀方式。因此,寻求减轻细胞凋亡的方法,对于缺血缺氧损伤的治疗具有重要意义。细胞凋亡的诱导和调控过程十分复杂,在众多的凋亡调控基因中,Caspase-3、Bcl-2和Bax在神经细胞凋亡中的作用备受关注[6-7]。在细胞凋亡过程中,凋亡信号经过复杂的信号通路,最终是通过Caspases蛋白的激活而实现的。Caspases是导致凋亡细胞解体的蛋白系统,在细胞凋亡机制网络中居于中心地位。其中,Caspase-3是细胞凋亡起关键作用,是线粒体途径细胞凋亡、死亡受体途径细胞凋亡和内质网途径细胞凋亡的的效应分子,可启动细胞凋亡[8-9]。近年来的一系列研究也证实了Caspase-3在脑缺血缺氧损伤中的作用。有研究表明,脑缺血后缺血半暗区的活化型Caspase-3的表达增加,并且Caspase-3活性的变化的时序性与DNA片段化的改变一致[10],Caspase-3的抑制剂[11]或Caspase-3基因敲除[12]等均可减轻脑缺血缺氧引起的损伤。上述结果说明,Caspase-3参与了脑缺血缺氧损伤,可作为缺血缺氧损伤后细胞凋亡的标志物。本研究发现缺血缺氧侧纹状体神经细胞中活化型Caspase-3的表达明显增多,提示Caspase-3参与了新生鼠脑缺血缺氧损失的发生。
活化的Caspase-3是如何引起细胞凋亡?目前的研究发现,活化的Caspase-3可以裂解Bcl-2蛋白,使其失去抗凋亡活性,并且裂解的Bcl-2片段又可以进一步促进Caspase-3的活化,从而形成Caspase级联正反馈环路。Bax是Bcl-2蛋白家族的促凋亡蛋白,通过形成Bax-Bax同源二聚体和Bcl-2-Bax异源二聚体调节细胞凋亡的发生,因此,Bcl-2/Bax的比例是启动细胞凋亡的“分子开关”[13-15]。
SP是由11个氨基酸组成的多肽,属于速激肽家族。有研究表明,SP使心肌对缺血再灌注损伤的耐受力下降,干扰SP/NK-1系统的作用可减轻心肌的缺血再灌注损伤[16]。另有研究表明,SP/NK1在心、肝、胰腺、肺、小肠等器官的缺血再灌注损伤中的作用[17-21]。近年来,SP/NK1受体系统在神经系统疾病中的改变成为关注的热点,大量实验研究表明,抑制SP的释放或SP的拮抗剂可使脑水肿减轻,并改善神经功能评分[22-24],NK1受体的拮抗剂或基因敲除NK1受体均可缓解SP对神经细胞的损伤[25]。SP与NK-1受体结合诱导细胞死亡,在癫痫持续状态和局灶缺血引起的神经细胞死亡中起重要作用[26]。NK1受体拮抗剂在中枢神经系统中可缓解神经细胞的损伤,减轻脑水肿,减少细胞凋亡,保护海马神经元[4,27-29]。上述结果提示,NK1的拮抗剂L-NAT有可能对新生鼠脑缺血缺氧纹状体的损伤有保护作用。本实验发现,缺血缺氧损伤后,Caspase-3、Bcl-2、Bax表达明显增多;L-NAT可抑制Caspase-3活化,减少Bax的表达,并进一步提高Bcl-2的表达。提示L-NAT可通过调节Bcl-2家族蛋白的表达来减少纹状体神经元凋亡,减轻HIE损伤。
[1]Bokiniec R,Bekiesińska-Figatowska M,Rudzińska I,et al.Sonographic and MRI findings in neonates following selective cerebral hypothermia[J].Ginekol Pol,2014,85(12):933-938.
[2]Wang YJ,Mao J.Types of acute hypoxic-ischemic brain injury due to perinatal sentinel events in neonates[J].Chinese J Contemp Ped,2014,16(6):589-595.
[3]Ma Y,Feng Q,Ma J,et al.Melatonin ameliorates injury and specific responses of ischemic striatal neurons in rats[J].J Histochem Cytochem,2013,61(8):591-605.
[4]蒋吉英,姜桂兰,李磊,等.N-乙酰-L-色氨酸具有对新生鼠脑缺血/缺氧损伤的保护作用[J].解剖学报,2011,42(4):451-455.
[5]Tagin MA,Woolcott CG,Vincer MJ,et al.Hypothermia for neonatal hypoxic ischemic encephalopathy:an updated systematic review and meta-analysis[J].Arch Pediatr Adolesc Med,2012,166(6):558-566.
[6]Sun MY,Cui KJ,Yu MM,et al.Bax inhibiting peptide reduces apoptosis in neonatal rat hypoxic-ischemic brain damage[J].Int J Clin Exp Pathol,2015,8(11):14701-14708.
[7]刘新建,刘丽娜,温慧敏,等.缺氧缺血性脑损伤新生大鼠海马区脑红蛋白、凋亡相关蛋白Bcl-2、Bax的表达及其相关性[J].细胞与分子免疫学杂志,2010,26(10):1040-1042.
[8]Pandey P,Saleh A,Nakazawa A,et al.Negative regulation of cytochrome c-mediated oligomerization of apaf-1 and activation of procaspase-9 by heat shock protein 90[J].EMBO J,2000,19(16):4310-4322.
[9]Mccullough KD,Martindale JL,Klotz LO,et al.Gadd153 sensitizes cells to endoplasmic reticulum stress by down-regulating Bcl2 and perturbing the cellular redox state[J].Mol Cell Biol,2001,21(4):1249-1259.
[10]Han BH,Xu D,Choi J,et al.Selective,reversible caspase-3 inhibitor is neuroprotective and reveals distinct pathways of cell death after neonatal hypoxic-ischemic brain injury[J].J Biol Chem,2002,277(33):30128-30136.
[11]赵敏,李江华,霍晓东,等.高血压大鼠脑缺血再灌注后TGF-β1、Caspase-3的表达与细胞凋亡[J].中西医结合心脑血管病杂志,2010,8(2):205-206.
[12]Le DA,Wu Y,Huang Z,et al.Caspase activation and neuroprotection in caspase-3- deficient mice after in vivo cerebral ischemia and in vitro oxygen glucose deprivation[J].Proc Natl Acad Sci U S A,2002,99(23):15188-15193.
[13]王卫东,陈正堂.Bcl-2/Bax 比率与细胞“命运”[J].中国肿瘤生物治疗杂志,2007,14(4):393-396.
[14]Schoneich C,Dremina E,Galeva N,et al.Apoptosis in differentiating C2C12 muscle cells selectively targets Bcl-2-deficient myotubes[J].Apoptosis,2014,19(1):42-57.
[15]Qiu J,Zhou XY,Zhou XG,et al.Neuroprotective effects of microRNA-210 against oxygen-glucose deprivation through inhibition of apoptosis in PC12 cells[J].Mol Med Rep,2013,7(6):1955-1959.
[16]Kramer JH,Spurney C,Iantorno M,et al.Neurogenic inflammation and cardiac dysfunction due to hypomagnesemia[J].Am J Med Sci,2009,338(1):22-27.
[17]Nimmo AJ,Cernak I,Heath DL,et al.Neurogenic inflammation is associated with development of edema and functional deficits following traumatic brain injury in rats[J].Neuropeptides,2004,38(1):40-47.
[18]Grady EF,Yoshimi SK,Maa J,et al.Substance P mediates inflammatory oedema in acute pancreatitis via activation of the neurokinin-1 receptor in rats and mice[J].Br J Pharmacol,2000,130(3):505-512.
[19]Li PC,Lai IJ,Lin YC,et al.Substance P scavenger enhances antioxidant defenses and prevents prothrombotic effects on the rat lung after acute exposure to oil smoke[J].J Biomed Sci,2008,16(16):1-10.
[20]Stucchi AF,Shofer S,Leeman S,et al.NK-1 antagonist reduces colonic inflammation and oxidative stress in dextran sulfate-induced colitis in rats[J].Am J Physiol Gastrointest Liver Physiol,2000,279(6):1298-1306.
[21]Bang R,Biburger M,Neuhuber WL,et al.Neurokinin-1 receptor antagonists protect mice from CD95- and tumor necrosis factor-alpha-mediated apoptotic liver damage[J].J Pharmacol Exp Ther,2004,308(3):1174-1180.
[22]Vink R,Nimmo AJ.Novel therapies in development for the treatment of traumatic brain injury[J].Exp Opin Invesg Drug,2002,11(10):1375-1386.
[23]Donkin JJ,Turner RJ,Hassan I,et al.Substance P in traumatic brain injury[J].Prog Brain Res,2007,161(1):97-109.
[24]Vink R,van den Heuvel C.Substance P antagonists as a therapeutic approach to improving outcome following traumatic brain injury[J].Neurotherapeutics,2010,7(1):74-80.
[25]Ansar S,Svendgaard NA,Edvinsson L.Neurokinin-1 receptor antagonism in a rat model of subarachnoid hemorrhage:prevention of upregulation of contractile ETB and 5-HT1B receptors and cerebral blood flow reduction[J].J Neurosurg,2007,106(5):881-886.
[26]Castro-Obregón S,Rao RV,Del Rio G,et al.Alternative,nonapoptotic programmed cell death:mediation by arrestin 2,ERK2,and Nur77[J].J Biol Chem,2004,279(17):17543-17553.
[27]Donkin JJ,Nimmo AJ,Cernak I,et al.Substance P is associated with the development of brain edema and functional deficits after traumatic brain injury[J].J Cereb Blood Flow Metab,2009,29(8):1388-1398.
[28]Donkin JJ,Cernak I,Blumbergs PC,et al.A substance P antagonist reduces axonal injury and improves neurologic outcome when administered up to 12 hours after traumatic brain injury[J].J Neurotrauma,2011,28(2):217-224.
[29]Zhu J,Xu W,Wang J,et al.The neurokinin-1 receptor modulates the methamphetamine-induced striatal apoptosis and nitric oxide formation in mice[J].J Neurochem,2009,111(3):656-668.
Protective effect of N-acetyl-L-tryptophan on striatal injury of neonatal rat hypoxic ischemic encephalopathy*
ZhaoNajie1,WangJuxin2,LiXiaoshuang2,GaoXianghong2,YuHai2,LiuQinghua2,ZhangMing2,YuShuna2,JiangJiying2△
(1.Class2,Grade2013,DepartmentofPharmacy,WeifangMedicalCollege,Weifang,Shandong261053,China;2.TeachingandResearchingSectionofAnatomy,WeifangMedicalCollege,Weifang,Shandong261053,China)
Objective To investigate the protective effects of N-acetyl-L-tryptophan (L-NAT) on neonatal rat striatal injury hypoxic-ischemic encephalopathy(HIE).Methods The HIE rat model was established with SD neonatal rats on 7 d.The morphological change of striatum was evaluated by HE staining and the expression levels of Caspase3,Bcl-2 and Bax were observed by immunofluorescence staining.Results Compared with the sham group,the expression of Caspase-3,Bcl-2 and Bax in the HIE group was increased,while the neurons in striatum were arranged in disorder,moreover the number was significantly decreased;the injury degree of striatal neurons in the HIE+L-NAT group was alleviated,Caspase-3 and Bax expression was decreased and Bcl-2 expression was further increased.Conclusion L-NAT protects neonatal rat hypoxic-ischemic cerebral injury possibly by regulating Bcl-2 family protein expression to alleviate the injury degree of striatal neurons.
hypoxic-ischemic injury;N-acetyl-L-tryptophan;striatum;apoptosis;rats
10.3969/j.issn.1671-8348.2016.31.004
山东省自然科学基金资助项目(ZR2010HM006,ZR2014HL020,ZR2014HL021);山东省教育厅资助项目(J11LF14);山东省医药卫生科技发展计划资助项目(2014WS0464);潍坊医学院科技创新研究基金资助项目(K1301001);潍坊医学院大学生科技创新基金资助项目(KX20150091);潍坊医学院青年创新基金资助项目(K1302035)。
赵纳杰(1995-),本科,主要从事脑缺血缺氧损伤研究。△
,E-mail:jiangjiying2002@163.com。
R743.3
A
1671-8348(2016)31-4331-03
2016-02-24
2016-06-12)

