贝伐单抗与雷珠单抗治疗年龄相关性黄斑变性全身安全性的Meta分析
·文献计量学·
贝伐单抗与雷珠单抗治疗年龄相关性黄斑变性全身安全性的Meta分析
年龄相关性黄斑变性(age-relatedmaculardegeneration,AMD)又称老年性黄斑变性,是引起全球老年人视力丧失最主要的原因之一〔1〕。世界卫生组织的研究报告表明,全球约有3 000万AMD患者,每年约有50万人因此致盲。随着人口老龄化的加剧,其发病率逐年上升〔2〕。据临床与病理表现,AMD可分为两型,即萎缩型和渗出型,其中渗出型AMD由于脉络膜新生血管(choroidalneovascularization,CNV)的形成造成不可逆性的盲,严重影响患者的生存质量。大量的研究证据表明血管内皮生长因子(vascular endothelial growth factor,VEGF)是新生血管形成的关键调控因子〔3〕,抗VEGF单克隆抗体通过抑制VEGF阻止新生血管的形成并降低血管通透性,从而有效治疗AMD。其中贝伐单抗(Bevacizumab,商品名Avastin)和雷珠单抗(Ranibizumab,商品名Lucentis)两种药最具代表性。
贝伐单抗是抗VEGF的人源化全长单克隆抗体,可结合所有的VEGF异构体,与VEGF有两个结合位点。2004年美国FDA批准上市治疗结肠直肠肿瘤,其适应证并不包括AMD,然而,由于其价格相对低廉,被“标签外”广泛使用于AMD的治疗〔4〕。雷珠单抗是人源化的抗VEGF重组鼠单克隆抗体片断,由贝伐单抗的部分抗体片断衍生加工而成,仅有一个位点与VEGF结合,可结合所有的VEGF异构体及VEGF降解片段,美国FDA于2006年6月30日批准其用于治疗AMD的患者〔5〕。虽然贝伐单抗已有相当多的临床研究论证了其对AMD的疗效,但它迄今仍未被批准用于眼科治疗。理论上,贝伐单抗半衰期更长、Fc片段可以激活补体系统引发更严重的炎症反应,故其全身安全性受到了广泛的关注〔6〕。本研究希望通过Cochrane系统评价方法,系统分析贝伐单抗对比雷珠单抗治疗黄斑变性的全身安全性,以期为临床应用提供参考
1 资料与方法
1.1 检索策略
计算机检索Pubmed、EMbase、Cochrane Library、Web of Knowledge(WOK)、中国生物医学文献数据库(CBM)、中国知网(CNKI)、维普数据库(VIP)、万方数据库。英文检索词包括Ranibizumab、Lucentis、Bevacizumab、Avastin、Macular degeneration、AMD等,中文检索词包括雷尼单抗、雷珠单抗、贝伐单抗、阿瓦斯汀、黄斑变性、抗新生血管药物等。检索时间均为建库至2013年12月1日,语种不限。同时,手工检索纳入文献的参考文献。
1.2 文献纳入和排除标准
研究类型:纳入随机对照试验(RCT),无论是否采用盲法、有无失访。
研究对象:年龄相关性黄斑变性患者,渗出型,并排除患有高度近视多发性息肉等其他病因所造成的CNV;排除自身免疫性疾病高血压血液系统疾病等全身疾病;排除青光眼无晶体眼高度近视等眼部疾病。年龄、性别、病程、国籍和种族不限。
干预措施:玻璃体腔注射Bevacizumab与玻璃体腔注射Ranizumab。
结局指标:(1)总死亡率;(2)动脉栓塞事件发生率,包括中风、非致死性心肌梗死(Nonfatal MI)、血管源性死亡;(3)静脉血栓事件发生率。
排除标准:(1)只有摘要而缺乏全文;(2)重要资料不全,无法获取者;(3)重复发表;(4)两组基础疗法不一致;(5)综述、动物实验、个案报道、专家经验等类型文献。
1.3 文献质量评价
采用Cochrane系统评价员手册5.1版〔7〕偏倚风险评估工具进行评价,其具体内容包括:(1)随机分配方案的产生;(2)分配方案的隐藏;(3)对患者、医生或治疗师实施盲法;(4)对资料收集和分析人员实施盲法;(5)结果数据的完整性;(6)选择性的结果报告;(7)其他偏倚来源。针对上述条目采用“是”(低度偏倚风险)、“否”(高度偏倚风险)和“不清楚”(缺乏足够信息或偏倚情况不确定)的评价。
1.4 资料提取
阅读全文后由2名研究人员对资料进行提取并交叉核对,内容包括:作者、发表年、样本量/失访例数,研究设计方案,观察对象特征,试验及对照组的干预措施,结局测量指标、时间点及结果评价,不良事件的数量及类型。
1.5 统计分析
Meta分析采用Stata 11.2软件进行。采用相对危险度(RR)作为效应量,并计算95%CI。各研究的异质性检验采用χ2检验和I2检验,若P>0.10,I2<50%可认为各研究间具有同质性,选用固定效应模型进行Meta分析;若P<0.10,I2≥50%,认为存在统计学异质性,则分析异质性产生的原因,当异质性来源不能用临床异质性和方法学异质性解释时,采用随机效应模型进行Meta分析。采用逐次排除一项研究后重新分析的方法进行敏感性分析,通过评估漏斗图的对称性判断发表偏倚,并采用Begg检验和Egger检验进行验证。
2 结果
2.1 纳入研究的一般情况及基线特征
初检得到文献164篇,按照纳入与排除标准,有5篇〔8-12〕文献符合要求,其中4项研究〔8-11〕为多中心的RCT。全部为英文文献,故存在语种的偏倚性。纳入AMD患者2 382眼,其中贝伐单抗组1 170眼,雷尼单抗组1 212眼。2项研究在美国完成,其余在英国、法国和澳大利亚完成。2个研究随访2年,3个研究随访了1年。大部分研究中两组间在年龄、性别、视功能损害水平、黄斑厚度等基线情况比较结果显示无统计学差异。文献筛选流程见图1。纳入研究的一般情况及基线特征详见表1。
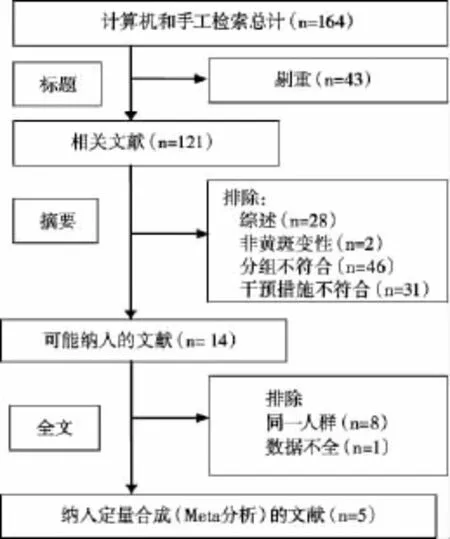
图1 文献筛选流程及结果
2.2 纳入研究的偏倚风险评价
纳入试验均质量较高。纳入的5项试验中,均采用计算机随机方法,提及分配隐藏。所有试验均描述基线资料,交代了基线可比性。5项研究均为双盲试验。在数据完整报道方面,4项研究均报道了完整的结果数据。所有研究均提及脱落,均报到不良反应。各个试验的偏倚分析见表2。
2.3 Meta分析结果
2.3.1 总死亡率的比较:纳入的5项试验均统计了各组治疗结束后总死亡率。Bevacizumab组和Ranizumab组总死亡率比较,异质性检验显示同质性好(χ2=0.89,P=0.926,I2=0.0%),采用固定效应模型进行合并,Meta分析显示两组总死亡率无统计学差异[RR=1.093,95%CI(0.759,1.573),Z=0.48,P= 0.633],见图2。
2.3.2 动脉血栓事件发生率的比较:有4项研究报道了动脉血栓事件发生率,各研究间无统计学异质性,合并效应量RR=1.011,合并效应量RR的95%可信区间为(0.673,1.520),表明相对于Ranizumab,玻璃体腔注射Bevacizumab并没有增加动脉血栓事件发生的风险。合并效应量的检验结果,Z=0.05,P= 0.957,表明2组比较,差异无统计学意义。我们将动脉血栓事件分为中风、非致死性心肌梗死和血管性死亡进行亚组分析,中风的3项研究异质性较小(χ2=0.61,P=0.736,I2=0.0%),采用固定效应模型合并显示无统计学差异[RR=0.830,95%CI(0.390,1.766)],以非致死性心肌梗死有4项研究,异质性较小(χ2= 0.47,P=0.925,I2=0.0%),合并结果显示无统计学意义[RR=0.969,95%CI(0.482,1.951)],对血管性死亡发生率的合并显示了类似的结果[RR=1.236,95%CI(0.627,2.436)],见图3。
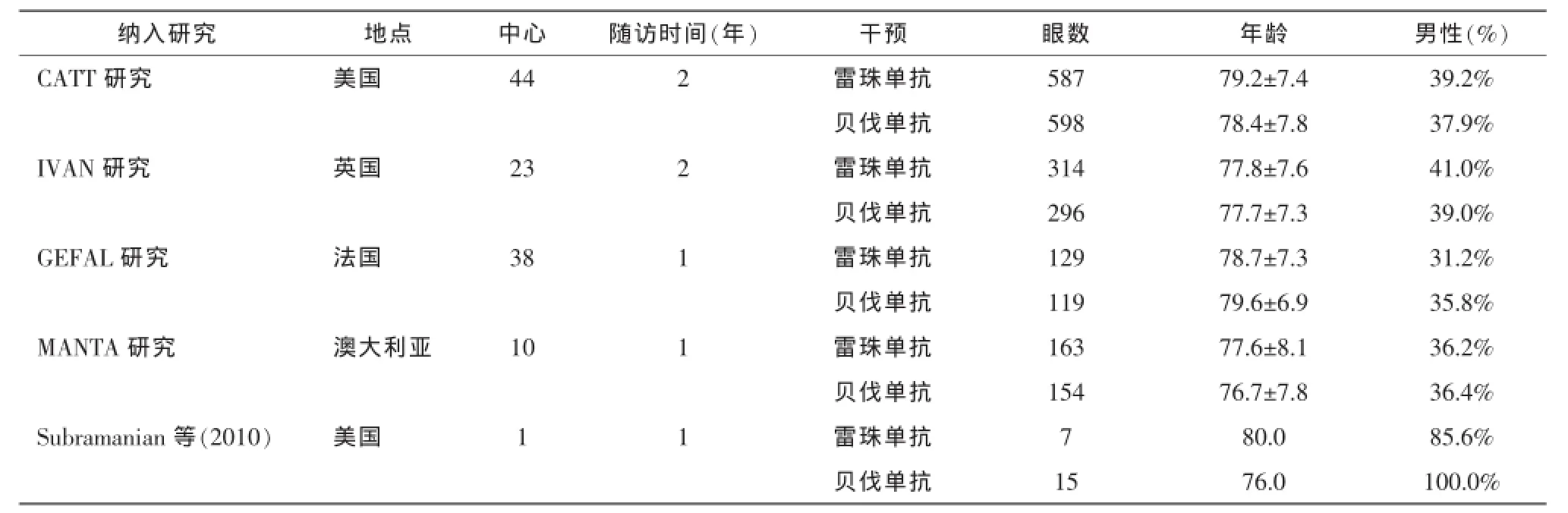
表1 纳入研究的一般情况及基线特征

表2 纳入研究的偏倚风险评价
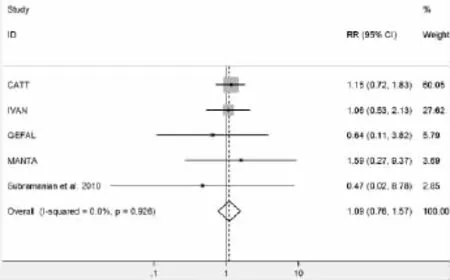
图2 Bevacizumab组与Ranizumab组总死亡率比较的Meta分析森林图
2.3.3 静脉血栓事件发生率的比较:有3项研究报道了静脉血栓事件发生率,异质性检验显示无明显异质性(χ2=0.79,P=0.674,I2=0.0%),采用固定效应模型进行合并。Meta分析显示两组静脉血栓事件发生率无统计学差异[RR=2.458,95%CI(0.986,6.131),Z=1.93,P=0.054],见图4,表明相对于Ranizumab,玻璃体腔注射Bevacizumab并没有增加发生静脉血栓事件的风险。
2.3.4 发表偏倚和敏感性分析:分析Bevacizumab与Ranizumab玻璃体腔注射治疗年龄相关性黄斑变性总死亡率的发表偏倚,漏斗图显示对称(图5),进一步行Begg检验和Egger检验,结果显示Begg's检验P=0.462,Egger's检验P=0.340,均大于0.05,提示发表偏倚的风险较小。采用考察每项研究对合并效应量的影响进行敏感性分析。表2显示删除某个研究后剩余其他研究的合并效应量:总死亡率合并RR波动在1.01(0.56,1.82)至1.11(0.77,1.60)之间,可见每一项研究对共效应量影响不大,并未能改变结局,说明结果稳定。
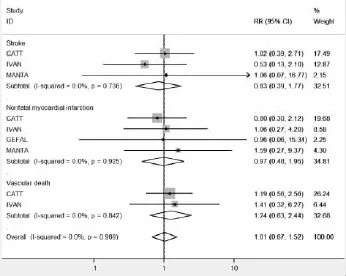
图3 贝伐单抗组与雷珠单抗组动脉血栓事件发生率比较的Meta分析森林图
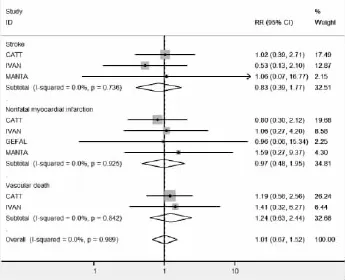
图4 Bevacizumab组与Ranizumab静脉血栓事件发生率比较的Meta分析森林图
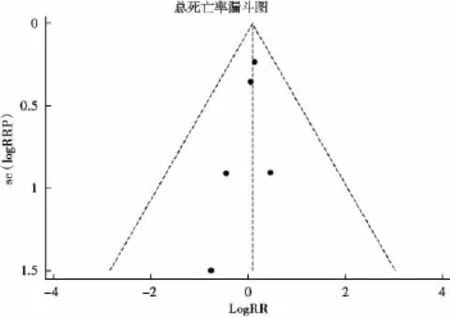
图5 总死亡率漏斗图
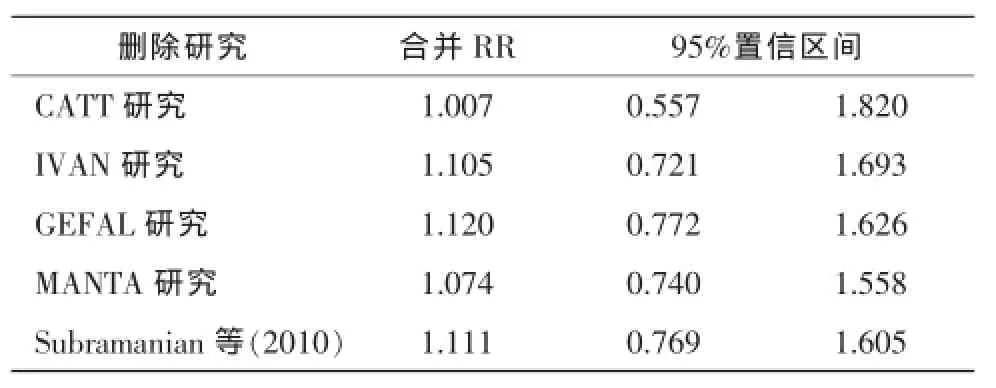
表2 单个研究删除后的合并总死亡率
3 讨论
随着全球人口老龄化的到来,AMD已经成为老年人群中一个重要的公共卫生问题〔2,13〕。近年来VEGF抑制剂药物的应用,给AMD的治疗开辟了新的途径。众多的临床资料已经证实了抗VEGF药物治疗AMD的有效性,但是长期、大量的应用抗VEGF药物也会带来一些并发症,因此抗VEGF治疗AMD带来的问题和潜在风险也越来越受到人们重视〔〕。
Ranibizumab是迄今经临床研究证实疗效可靠和安全的眼科VEGF抑制药〔5〕。由于分子量小,玻璃体腔注射后可能会更好地通过全层视网膜。药代动力学显示,Ranizumab在眼内各个部分的清除是同步的,半衰期3.2 d,它快速地分布到视网膜(6~24 h),在视网膜的浓度为玻璃体腔浓度的l/3。玻璃体腔注射之后,生物利用度达50%~60%,而血浆的浓度很低,反映出该药在到达血浆之后分布广泛、清除快速〔15〕。临床研究显示多数AMD患者在注射雷珠单抗1 h后血清药物浓度已低于0.3ng/ml,因此接受雷珠单抗玻璃体腔内注射治疗的患者血清药物浓度可以忽略〔16〕。与Ranibizumab不同,Bevasazumab分子量较大,动物研究显示贝伐单抗在玻璃体腔注射后不能通过视网膜内界膜。药代动力学研究显示其血浆半衰期为8.68 d,在全身血液中停留时间明显较Ranibizumab长〔17〕。此外,Fc片段可通过有Fc段受体的细胞介导免疫反应,抑制免疫系统〔18〕。因此,理论上Bevasazumab有更大的全身性风险。既往由于临床数据的缺乏,人们难以对此进行分析,近年来数个随机双盲对照研究的出现为我们提供了有效的数据。
本研究共纳入5篇随机临床试验,对其结果进行Meta分析,得出了较为客观的结论。Meta分析是将多个研究的结果汇总分析,评价合并效应量的定量系统评价方法,在临床循证决策方面有一定的借鉴意义。本研究结果提示,Bevacizumab组与Ranibizumab组相比,在总死亡率率、动脉血栓事件发生率、中风发生率、非致死性心肌梗死发生率、血管源性死亡发生率、静脉血栓事件发生率上均无统计学差异。说明Bevasazumab并没有比Ranibizumab增加了全身性并发症的风险,说明玻璃体腔注射这两种药物的全身风险是类似的。
但是,由于纳入研究和Meta分析本身的特性,本研究存在一定的局限性:(1)本研究共纳入5个RCT,其中2个研究随访2年,其余3个仅随访了1年,故纳入研究数量有限、随访时间不够长。另外,有些试验的样本数量偏小,容易产生测量偏移,因此,需要更大样本、更长随访时间的多中心RCT研究来支持本研究观点。(2)仅纳入了发表语言为英文的研究,同时只有摘要而无全文的文献未纳入研究,虽然发表偏倚分析显示无统计学差异,但仍存在发表偏倚的可能。(3)此次纳入的研究均为国外文献,由于包括雷珠单抗在内的抗VEGF类药物在国内应用尚未普及,无法获得大量的临床资料,本研究的结论是否适用于国人,还有待验证。总之,本研究进行的Bevacizumab和Ranibizumab治疗AMD全身安全性差异的Meta分析,为Bevacizumab和Ranibizumab的临床应用提供了一定的依据,但仍需大样本的随机临床试验进一步证实。
[1]Kawasaki R,Yasuda M,Song S J,et al.The prevalence of age-related macular degeneration in Asians:a systematic review and metaanalysis[J].Ophthalmology,2010,117(5):921-927.
[2]Schmier J K,Jones M L,Halpern M T.The burden of age-related maculardegeneration[J].Pharmacoeconomics,2006,24(4):319-334.
[3]Cheung C M,Wong T Y.Treatment of age-related macular degeneration[J].Lancet,2013,382(9900):1230-1232.
[4]Bellerive C,Cinq-Mars B,Lalonde G,et al.Bevacizumab and ranibizumab for neovascular age-related macular degeneration:a treatment approach based on individual patient needs[J].Can J Ophthalmol,2012,47(2):165-169.
[5]Frampton J E.Ranibizumab:a review of its use in the treatment of neovascularage-relatedmaculardegeneration[J].DrugsAging,2013,30(5):331-358.
[6]Campbell R J,Bell C M,Campbell E L,et al.Systemic effects of intravitreal vascular endothelial growth factor inhibitors[J].Curr Opin Ophthalmol,2013,24(3):197-204.
[7]Higgins JP,Green S.Cochrane Handbook for Systematic Reviews of Interventions.Version 5.1.0[updated March,2011].Available from:www.cochrane-handbook.org;2011.ed.The Cochrane Collaboration,2011,120(11):2300-2309.
[8]Krebs I,Schmetterer L,Boltz A,et al.A randomised double-masked trial comparing the visual outcome after treatment with ranibizumab or bevacizumab in patients with neovascular age-related macular degeneration[J].Br J Ophthalmol,2013,97(3):266-271.
[9]Kodjikian L,Souied E H,Mimoun G,et al.Ranibizumab versus Bevacizumab for Neovascular Age-related Macular Degeneration:Results from the GEFAL Noninferiority Randomized Trial[J].Ophthalmology,2013,120(11):2300-2309.
[10]Chakravarthy U,Harding S P,Rogers C A,et al.Alternative treatments to inhibit VEGF in age-related choroidal neovascularisation:2-year findings of the IVAN randomised controlled trial[J].Lancet, 2013,382(9900):1258-1267.
[11]Martin D F,Maguire M G,Fine S L,et al.Ranibizumab and bevacizumab for treatment of neovascular age-related macular degeneration:two-yearresults[J].Ophthalmology,2012,119(7):1388-1398.
[12]Subramanian M L,Abedi G,Ness S,et al.Bevacizumab vs ranibizumab for age-related macular degeneration:1-year outcomes of a prospective,double-maskedrandomisedclinicaltrial[J].Eye(Lond),2010,24(11):1708-1715.
[13]Brown M M,Brown G C,Sharma S,et al.The burden of age-related macular degeneration:a value-based analysis[J].Curr Opin Ophthalmol,2006,17(3):257-266.
[14]Tolentino M.Systemic and ocular safety of intravitreal anti-VEGF therapies for ocular neovascular disease[J].Surv Ophthalmol,2011,56(2):95-113.
[15]Patel R D,Momi R S,Hariprasad S M.Review of ranibizumab trials for neovascular age-related macular degeneration[J].Semin Ophthalmol,2011,26(6):372-379.
[16]Do D V.Implications of the comparisons of age-related macular degeneration treatments trials on clinical practice:what have we learned?[J].Ophthalmology,2013,120(5 Suppl):S8-S10.
[17]El-Mollayess G M,Noureddine B N,Bashshur Z F.Bevacizumab and neovascular age related macular degeneration:pathogenesis and treatment[J].Semin Ophthalmol,2011,26(3):69-76.
[18]Aujla J S.Replacing ranibizumab with bevacizumab on the Pharmaceutical Benefits Scheme:where does the current evidence leave us? [J].Clin Exp Optom,2012,95(5):538-540.
戴艳丽1 魏世辉2
目的评价贝伐单抗(Bevacizumab)与雷珠单抗(Ranibizumab)玻璃体腔内注射治疗年龄相关性黄斑变性的全身安全性。方法计算机检索Pubmed、EMbase、Cochrane Library、中国生物医学文献数据库(CBM)、中国知网(CNKI)、维普数据库(VIP)、万方数据库,查找有关Bevacizumab与Ranibizumab治疗年龄相关性黄斑变性的随机对照研究(RCT),同时追索纳入文献的参考文献。检索时限均为从建库至2013年12月1日。对纳入研究的质量进行严格评价和资料提取,对符合质量标准的RCT进行Meta分析。结果共纳入5个RCT,合计2382眼。各项研究中的全身安全性指标同质性较好,采用固定效应模型进行Meta分析。结果显示:Bevacizumab组与Ranibizumab组相比,在总死亡率率[RR=1.093,95%CI(0.759,1.573)]、动脉血栓事件发生率[RR=1.011,95%CI(0.673,1.520)]、中风发生率[RR=0.830,95%CI(0.390,1.766)],非致死性心肌梗死发生率[RR=0.969,95%CI(0.482,1.951)],血管源性死亡发生率[RR=1.236,95%CI(0.627,2.436)],静脉血栓事件发生率[RR=2.458,95%CI(0.986,6.131)]上均无统计学差异。结论Meta分析结果表明Bevacizumab与Ranizumab治疗年龄相关性黄斑变性具有相似的全身安全性,但尚需更多高质量的前瞻性研究结果进一步验证和支持。
年龄相关性黄斑变性;贝伐单抗;雷珠单抗;Meta分析
Systemic safety of intravitreal bevacizumab versus ranibizumab for age-related macular degeneration
DAI Yanli,WEI Shihui.Ophthalmology Department,General Hospital of People's Liberation Army,Beijing 100853, PR China
OBJECTIVETo evaluate the systemic safety of Bevacizumab and Ranibizumab in treatment of age-related macular degeneration.METHODSAll the randomized controlled trials(RCTs)comparing Bevacizumab and Ranibizumab in treatment of age-related macular degeneration were collected by searching Pubmed,EMbase, Cochrane Library,CBM,CNKI,VIP and Wangfang database from their establishment to December 2013.The bibliographies of these included studies were searched as well.The quality of RCTs meeting inclusion criteria was evaluated and the data were extracted;meta-analyses were performed with Stata 11.2 software.RESULTSFive RCTs involving 2382 eyes were included.Meta-analyses showed that the systemic safety of intravitreal bevacizumab was similar to the ranibizumab in terms of total mortality[RR=1.093,95%CI(0.759,1.573)],and morbidity of arteriothrombotic events[RR=1.011,95%CI(0.673,1.520)],stroke[RR=0.830,95%CI(0.390,1.766)],nonfatal myocardial infarction[RR=0.969,95%CI(0.482,1.951)],vascular death[RR=1.236,95%CI(0.627,2.436)],venous thrombotic events[RR=2.458,95%CI(0.986,6.131)].CONCLUSIONSThe present results show that both treatments are comparably safe.Because of the limited number of studies,the findings from our study must be confirmed in future research via well-designed cohort or intervention studies.
age-related macular degeneration;bevacizumab;ranibizumab;Meta analysis
R774.5
A
1002-4379(2016)02-0126-06
10.13444/j.cnki.zgzyykzz.2016.02.018
1沈阳军区政治部门诊部,沈阳110013
2解放军总医院眼科,北京100853
魏世辉,E-mail:weishihui706@yahoo.com

