羊肚菌生物转化玉米醇溶蛋白液体发酵工艺优化
文超婷 郑明珠 修 琳 盛 悦 刘景圣 蔡 丹
(吉林农业大学食品科学与工程学院 小麦和玉米深加工国家工程实验室,长春 130118)
羊肚菌生物转化玉米醇溶蛋白液体发酵工艺优化
文超婷 郑明珠 修 琳 盛 悦 刘景圣 蔡 丹
(吉林农业大学食品科学与工程学院 小麦和玉米深加工国家工程实验室,长春 130118)
要以玉米蛋白粉为主要原料,采用羊肚菌对其发酵培养,确定羊肚菌生物转化玉米醇溶蛋白的培养基配方和培养条件。结果表明:羊肚菌生物转化玉米醇溶蛋白液体发酵最适培养基配方为:葡萄糖添加量5.4%,玉米蛋白粉添加量8%,CaSO4添加量0.3%,KH2PO4添加量0.2%,此条件下,得出菌丝体生物量为1.62 g/100 mL,蛋白转化率为27.51%。在最适培养基配方的基础上,液体发酵培养条件为:接种量10%,培养温度26 ℃,初始pH 4,装液量100 mL /500 mL。在此优化条件下,试验验证得出菌丝体生物量为2.41 g/100 mL、蛋白转化率为36.69%。
玉米醇溶蛋白 羊肚菌 液体发酵 菌丝体生物量 蛋白转化率
玉米蛋白粉中主要的蛋白是玉米醇溶蛋白,占蛋白总量的50%~60%。根据mckinney[1]分类成α型和β型。Tatham[2]研究表明玉米醇溶蛋白分子形状呈椭圆、长棒球状,长轴与直径的比例为7∶1或28∶1。玉米醇溶蛋白的性质由其特殊氨基酸组成决定,特殊的氨基酸组成导致其具有良好的抗氧化性、成膜性、保水性,以及良好的热可塑性和稳定性。玉米醇溶蛋白中含有高比例的疏水性氨基酸,缺少赖氨酸、色氨酸等人体必需的氨基酸,其独特的氨基酸组成导致玉米蛋白的水溶性差,利用价值低[3-4]。使其不能直接用于人类消费,限制其在人类食品中的使用。国内外学者在寻找玉米醇溶蛋白改性方法方面作了大量工作,这些方法包括化学改性[5-7]、物理改性[8-12]、生物改性等,但是这些改性方法存在生物转化率低,易造成环境污染、生产成本高、改性效果不明显等弊端。
微生物发酵玉米醇溶蛋白,本质上是利用微生物发酵过程中分泌的复合酶对蛋白质发生不同程度的降解,大分子蛋白部分降解为小分子蛋白。真菌类菌种相较于其他菌种具有转化率高、环保安全、对原料营养成分破坏小、成本低、原料丰富、产酶活力高等优势,因此本研究选取羊肚菌作为优先菌种,羊肚菌在发酵过程中能够产生丰富的酶系,如胞外羧甲基纤维素酶、淀粉酶、漆酶、愈创木酚酶、蛋白酶等,能够更好地作用于玉米蛋白粉,降解玉米蛋白粉中的多糖、蛋白质及细胞壁成分等。我国羊肚菌资源丰富、营养、药用价值高[13-14],而且羊肚菌具有抗疲劳、免疫调节等功效使其在医药方面用途广泛[15-17],目前对于羊肚菌的研究主要以培养基配方、发酵条件对菌丝体生物量、菌丝体多糖和发酵液胞外多糖产量影响的研究居多。
本试验以玉米蛋白粉为主要原料,采用羊肚菌对其进行液体发酵培养,筛选出最适的培养基配方并探索最适培养条件,研究在发酵过程中,菌丝体生物量、蛋白转化率及醇溶蛋白一些性质的变化。为改善玉米醇溶蛋白功能特性,提高玉米蛋白粉的应用领域提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
羊肚菌菌种:吉林农业大学小麦和玉米深加工国家工程实验室。
1.1.2 菌种保存斜面培养基
固体麦芽汁培养基:吉林农业大学小麦和玉米深加工国家工程实验室提供。
1.1.3 试剂
玉米蛋白粉:吉林中粮生化能源销售有限公司;玉米粉、马铃薯:市售;可溶性淀粉:天津市光复精细化工研究所;麦芽糖、酵母浸粉、蛋白胨:北京奥博星生物技术有限责任公司。
1.2 仪器与设备
HZQ-F160全温振荡培养箱:哈尔滨市东联电子技术开发有限公司;LD5-2B 离心机:北京雷勃尔离心机有限公司;K1100全自动凯氏定氮仪:济南海能仪器股份有限公司。
1.3 方法
1.3.1 羊肚菌的活化:将4 ℃保藏的羊肚菌菌种转接至新鲜的PDA斜面培养基 ,置培养箱27 ℃培养至第12天时采用。
1.3.2 液体发酵种子培养基的制备:葡萄糖2%,酵母浸粉1%,KH2PO40.12%,MgSO4·7H2O 0.075%,FeSO4·7H2O 0.001%,pH值自然,121 ℃灭菌20 min,在无菌环境下,接入到装有30 mL液体种子培养基的100 mL三角瓶中,置于27 ℃恒温摇床振荡培养,160 r/min培养6 d得2级种子液备用。
1.3.3 培养基配方单因素筛选试验
分别以玉米蛋白粉添加量(2%、4%、6%、8%、10%),葡萄糖添加量(1.8%、3%、4.2%、5.4%、6.6%),KH2PO4添加量(0.05%、0.1%、0.2%、0.3%、0.4%),CaSO4添加量(0.05%、0.1%、0.2%、0.3%、0.4%)为单因素,考察各因素对蛋白转化率、菌丝体生物量的影响。
1.3.4 培养基配方筛选试验
通过单因素,选定玉米蛋白粉、葡萄糖、KH2PO4、CaSO4进行正交试验,选用L9(34) 正交表,见表1。500 ml三角瓶中装入100 ml液体培养基,初始pH为5,灭菌后接入10%二级种子液,置于旋转式摇床中,转速160 r/min,24 ℃恒温振荡培养6 d,过滤菌丝体离心(4 000 r/min,20min),测量菌丝体生物量,处理离心后的上清液,凯氏定氮测定蛋白质含量。每组 3 个平行,取其平均值。

表1 培养基配方正交试验因素和水平
1.3.5 液体发酵培养条件的优化试验
在单因素的基础上,葡萄糖添加量5.4%,玉米蛋白粉添加量8%,CaSO4添加量0.3%,KH2PO4添加量0.2%,对液体发酵培养条件进行优化。因此采用正交表L9(34)对影响的因素:初始pH、培养温度、装液量、接种量进行条件优化。因素水平表设计分别见表2。

表2 液体发酵培养条件正交试验因素和水平
1.4 菌丝体生物量的测定
培养6 d后,培养液经30目尼龙纱布过滤,菌丝体经蒸馏水冲洗数次后,放置在烘箱60 ℃干燥至恒重,称量菌丝体干重。
1.5 蛋白转化率的测定
使用凯氏定氮测定方法测定样品蛋白转化率。方法参照国标GB 5009.5—2010。蛋白转化率按照公式进行计算[18]。
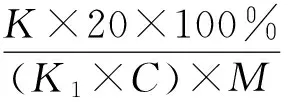
式中:20为酸溶蛋白上清液的总体积/mL;K为酸溶蛋白凯氏定氮数值/mgN/100 mL;K1为样品的凯氏定氮数值/mgN/100 mL;C为发酵培养基中样品的含量/%;M为发酵培养基的取样质量/g。
1.6 电泳试验
采用SDS-聚丙烯酰胺凝胶电泳方法进行电泳试验。
1.7 乳化性及乳化稳定性
样品经过均质用浓度为0.1%的SDS溶液稀释成0.1 L,立即用分光光度计在500 nm波长下测定其吸光值E[19]。
E1=t×B0/B0-B10
式中:E1为乳化稳定性/min;t为10 min;B0为均质后立刻稀释测得的吸光度值;B10为均质10 min后稀释测得的吸光度值。
E2=2×(2.303E)×稀释倍数/C·D·I
式中:E2为乳化性/m2/g;C为油相所占分数1/3;D为蛋白质浓度0.5%;I为比色皿的光径/(10 mm)。
1.8 起泡性及泡沫稳定性
起泡性及泡沫稳定性分别按公式计算。
起泡性(FA%)=VI(mL)×100/100(mL)
泡沫稳定性(FS%)=V2(mL)×100/100(mL)
式中:V1为均质后起泡体积;V2为均质后10 min稳定起泡体积。
2 结果与分析
2.1 培养基配方的单因素试验
2.1.1 最适氮源添加量的确定
由图1可以看出,玉米蛋白粉添加量为6%时,蛋白转化率、菌丝体生物量最高,蛋白转化率为22.64%,菌丝体生物量为0.67 g/100 mL,因此本试验选取玉米蛋白粉添加量4%、6%、8%为变量。

图1 最适氮源添加量的确定
2.1.2 最适碳源添加量的确定
由图2可以看出,在葡萄糖添加比例为4.2%时,蛋白转化率、菌丝体生物量达到最大值,分别为22.64%、0.67g/100 mL,因此本试验选取葡萄糖添加比例3%、4.2%、5.4%作为变量。
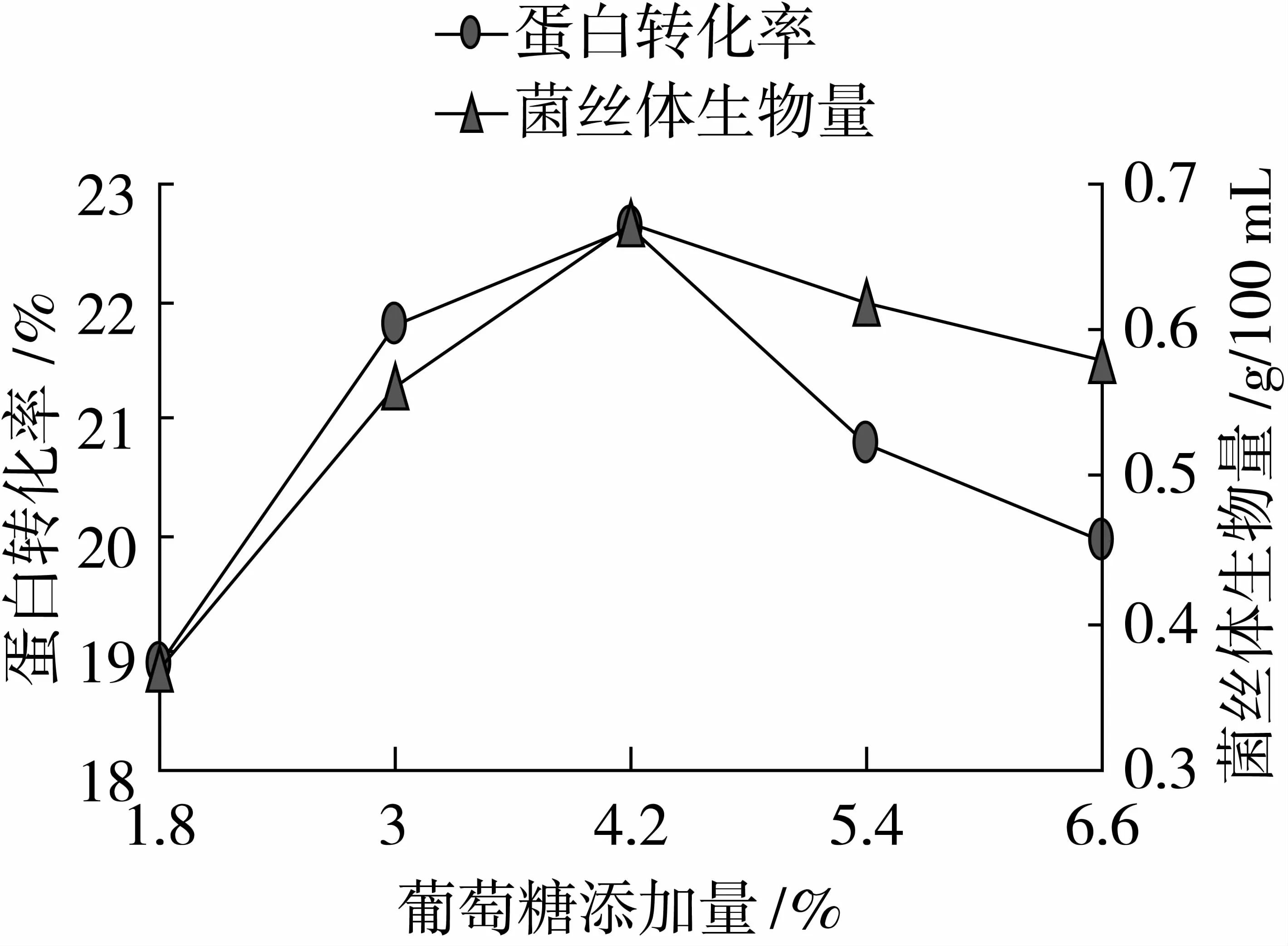
图2 最适碳源添加量的确定
2.1.3 最适生长因子添加量的确定
由图3可以看出, KH2PO4添加量为0.2%时,蛋白转化率、菌丝体生物量最高,蛋白转化率为23.12%,菌丝体生物量为0.82 g/100 mL,因此本试验选取KH2PO4添加量0.1%、0.2%、0.3%为变量。
由图4可以看出, CaSO4添加量为0.2%时,蛋白转化率、菌丝体生物量最高,蛋白转化率为22.91%,菌丝体生物量为0.78 g/100 mL,因此本试验选取CaSO4添加量0.1%、0.2%、0.3%为变量。
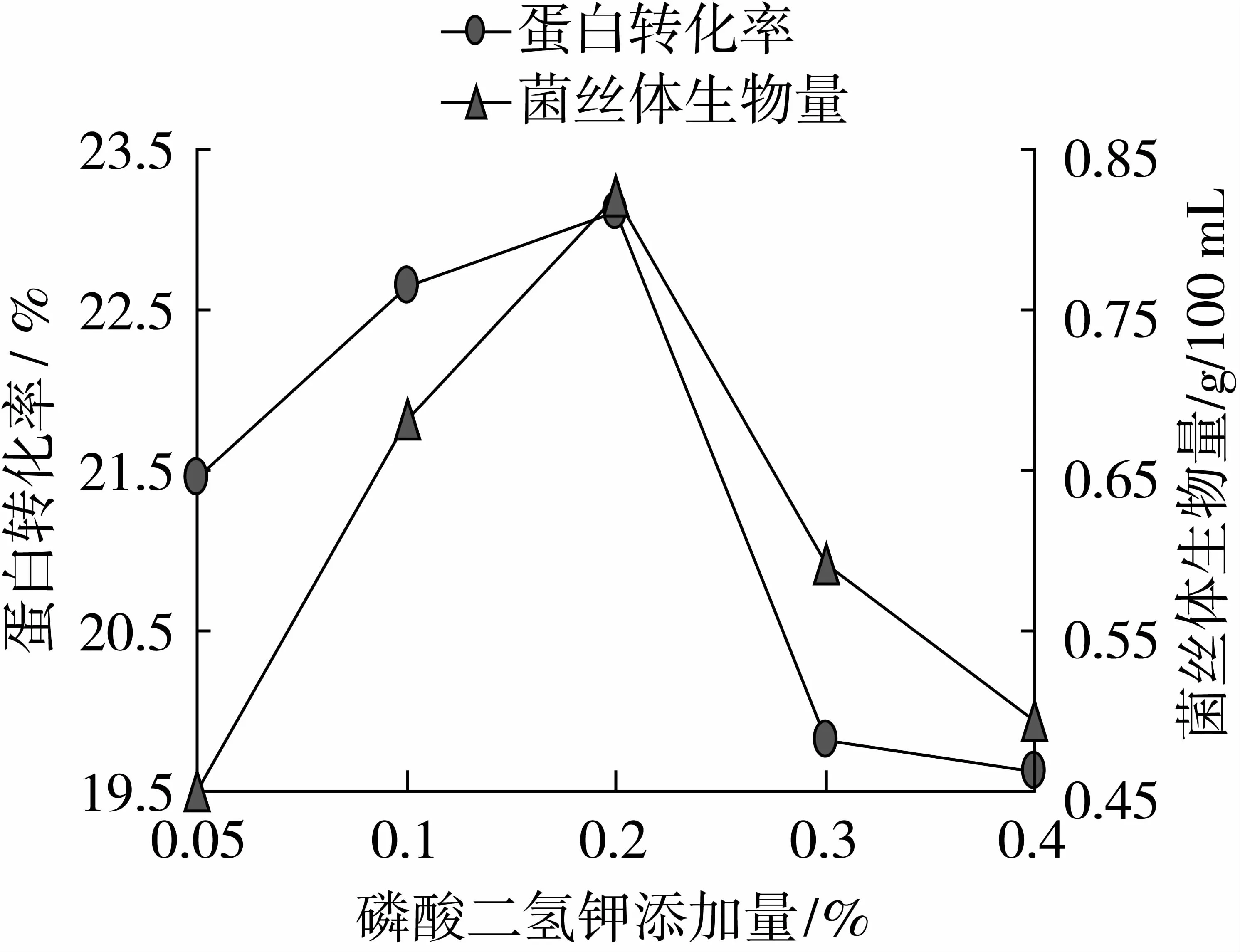
图3 最适碳酸二氢钾添加量的确定

图4 最适碳酸钙添加量的确定
2.2 培养基配方的正交优化试验
正交试验设计结果见表3。通过对正交试验结果进行极差分析,当以菌丝体生物量为指标时,影响菌丝体生物量的主次顺序依次为B >A >D >C,并确定了培养基配方为A2B2C3D1,即葡萄糖添加量4.2%,玉米蛋白粉添加量6%,CaSO4添加量0.3%,KH2PO4添加量0.1%。试验得出菌丝体生物量为1.45 g/100 mL。当以蛋白转化率为指标时,影响蛋白转化率的主次顺序依次为B>A>D>C,并确定了培养基配方为A3B3C3D2,即葡萄糖添加量5.4%,玉米蛋白粉添加量8%,CaSO4添加量0.3%,KH2PO4添加量0.2%。最优组合不在这9组试验中,通过验证试验得出蛋白转化率为27.51%。

表3 培养基配方正交试验结果
由于以菌丝体生物量为指标得出的极差分析和以蛋白转化率为指标得出的极差分析不一致,数据分析得知以蛋白转化率为指标得到的菌丝体生物量、蛋白转化率比以菌丝体生物量为指标得出的分别高0.17 g/100 mL、2.08%。故选取以蛋白转化率为指标确定的培养基配方A3B3C3D2,即葡萄糖添加量5.4%,玉米蛋白粉添加量8%,CaSO4添加量0.3%,KH2PO4添加量0.2%。
2.3 羊肚菌转化玉米醇溶蛋白液体发酵培养条件的单因素试验
2.3.1 培养基初始pH对蛋白转化率的影响
由图5可知,当pH 6时,蛋白转化率、菌丝体生物量的值达到最高,分别为25.69%、1.29 g/100 mL,因此选取pH为5、6、7。

图5 最适pH的确定
2.3.2 培养温度对蛋白转化率的影响
由图6可以看出,当培养温度24 ℃时,达到最高值,分别为26.54%、1.38 g/100 mL,因此选取22、24、26 ℃作为培养温度的变量。
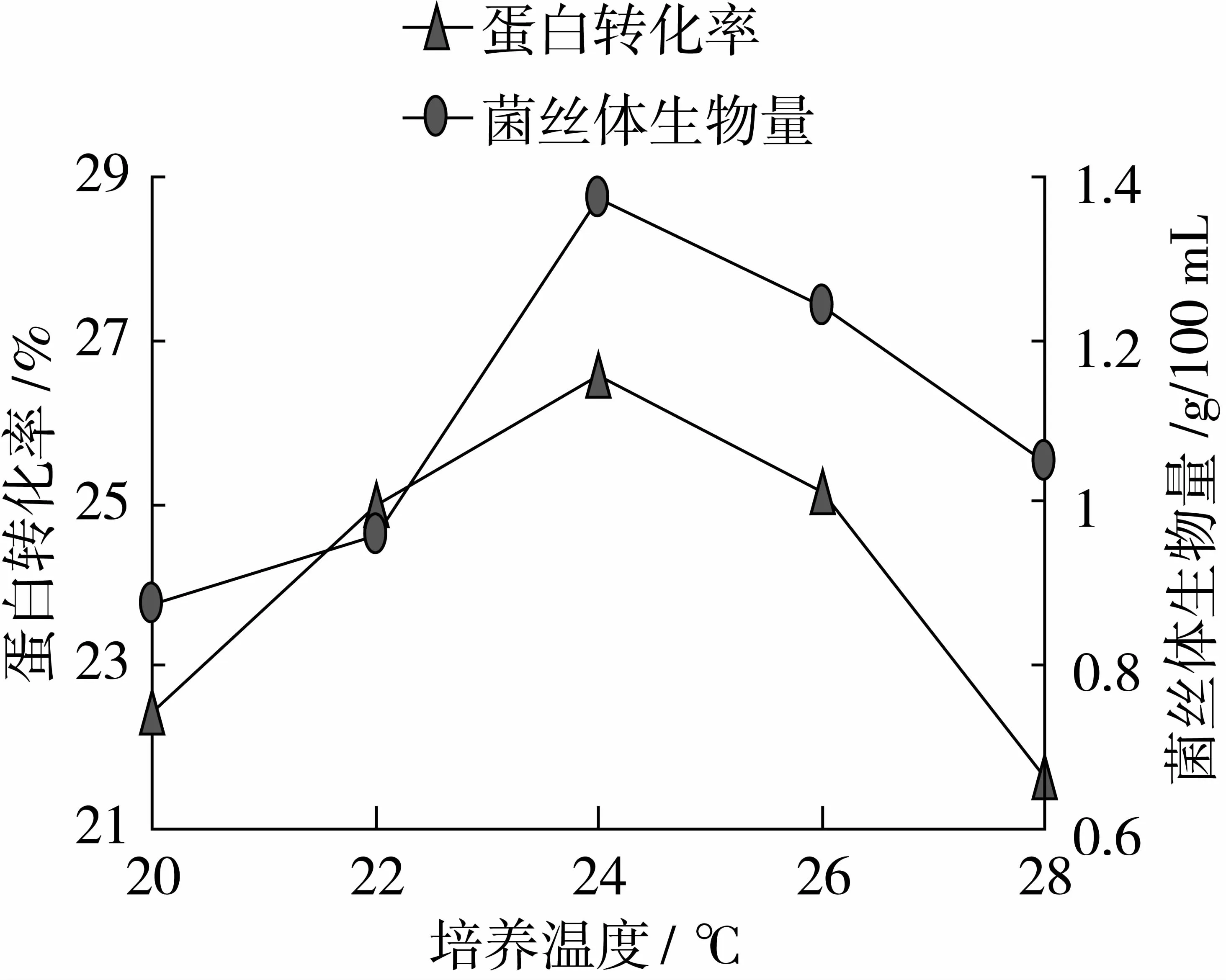
图6 最适培养温度的确定
2.3.3 装液量对蛋白转化率的影响
由图7可以看出,当装液量为100/500 mL时,蛋白转化率、菌丝体生物量达到最大值,分别为26.19%、1.32 g/100 mL。因此本试验选取80/500、100/500、120/500 mL作为装液量的变量。
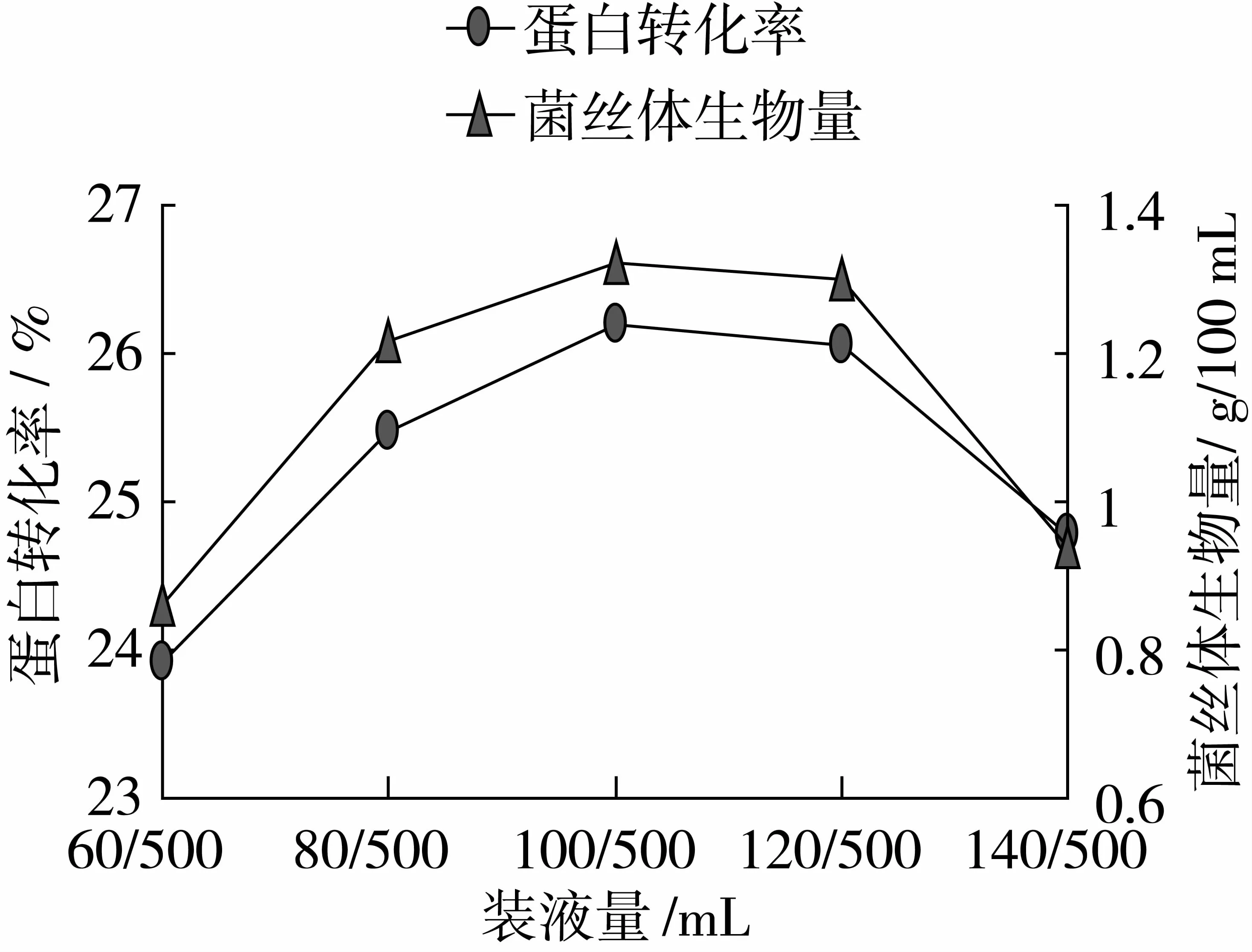
图7 最适装液量的确定
2.3.4 接种量对蛋白转化率的影响
由图8可以看出,当接种量为10%时,蛋白转化率、菌丝体生物量达到最大值,分别为26.21%、1.35 g/100 mL。因此本试验选取8%、10%、12%作为接种量的变量。

图8 最适接种量的确定
2.4 羊肚菌转化玉米醇溶蛋白液体发酵培养条件的正交优化试验
正交试验设计结果见表4。通过对正交试验结果表4进行极差分析,以菌丝体生物量、蛋白转化率为指标,影响菌丝体生物量的主次顺序均为B>A>D>C,并确定了培养基配方为A2B3C1D2,即接种量10%,培养温度26 ℃,初始pH 4,装液量100/500 mL。得出菌丝体生物量为2.37 g/100 mL、蛋白转化率为36.73%。在最适培养基配方的基础上,通过对液体发酵培养条件进行验证试验,做3组平行试验,在此条件下测得的菌丝体生物量为2.41 g/100 mL。
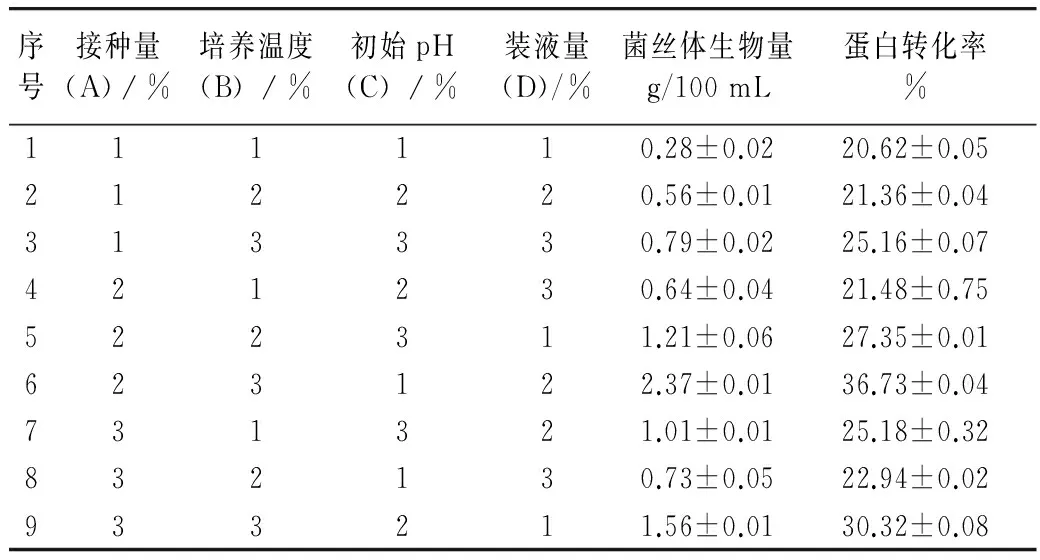
表4 液体发酵培养条件正交试验表
由于在发酵过程中有小部分的氮被羊肚菌利用,故在最适培养基配方、发酵条件的基础上,对获得的蛋白转化率进行验证试验,即:葡萄糖添加量5.4%,玉米蛋白粉添加量8%,CaSO4添加量0.3%,KH2PO4添加量0.2%,接种量10%,初始pH 4,每500 mL三角瓶装液量100 mL,于培养箱中26 ℃条件下恒温培养,发酵时间6 d,做3组平行试验,通过凯氏定氮法测得发酵前培养基中总氮量为9.43%、发酵液中总氮量为3.48%、发酵后总氮量为9.48%、羊肚菌代谢产生的含氮量为0.02%,可溶性氮含量为3.46%,得出蛋白转化率为36.69%。
2.5 电泳
由图 9 的电泳图可以看出,随着发酵时间的增加,玉米醇溶蛋白逐渐被羊肚菌利用,蛋白质逐渐被分解,深色条带逐渐变浅。蛋白质分子的表面电荷重新分布,导致维持蛋白质三级、四级结构的结合力变弱,分子间氢键、二硫键部分断裂,游离出更多的氨基和羧基,蛋白质分子通过极性基团吸附的水量增加,从而使玉米醇溶蛋白的理化性质得到改善。

注:条带1:发酵前;条带2:发酵3 d;条带3:发酵5 d;条带4:发酵7 d。
图9 不同发酵时间玉米醇溶蛋白的SDS-PAGE图谱
2.6 乳化性及乳化稳定性
由图10可以看出,乳化性、乳化稳定性随着发酵时间的增加,而逐渐增大,发酵时间在第5天时,乳化性达到最大值:29.13 m2/g,发酵时间在第6天,乳化稳定性达到最大值:41.21 min。随着发酵时间的继续增加,乳化性、乳化稳定性有下降的趋势。

图10 发酵时间对乳化能力的影响
2.7 起泡性及泡沫稳定性
由图11可以看出,起泡性、泡沫稳定性随着发酵时间的增加,而逐渐增大,发酵时间在第5天时,起泡性达到最大值212.5%,发酵时间在第6天时,泡沫稳定性达到最大值145.67%,随着发酵时间的继续增加,起泡性、起泡稳定性有下降的趋势。
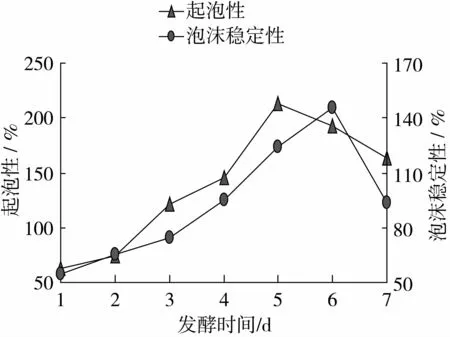
图11 发酵时间对起泡性和起泡稳定性的影响
3 结论
通过正交试验,确定了羊肚菌转化玉米醇溶蛋白液体发酵的工艺组合。
3.1 羊肚菌转化玉米醇溶蛋白液体发酵培养基配方为:葡萄糖添加量5.4%,玉米蛋白粉添加量8%,CaSO4添加量0.3%,KH2PO4添加量0.2%。
3.2 羊肚菌转化玉米醇溶蛋白液体发酵培养条件工艺是:接种量10%,培养温度26 ℃,初始pH 4,装液量100/500 mL。
3.3 在最适培养基配方、培养条件的基础上,通过验证试验得出菌丝体生物量、蛋白转化率分别为2.41 g/100 mL、36.69%。
[1]Lawliet L M.The encyclopedia of chemistry[M].New York: Reinhold Publishing Company, 1958: 319-320
[2]Shukla A T, Field J M, Morris V J. Solution conformational analysis of the alpha zein proteins of maize[J]. The Journal of Biological Chemistry, 1993, 26(8): 253-259
[3]赵新淮,冯志彪.蛋白质水解物水解度的测定[J].食品科学,1994(11):65-67
[4]刘萍,陈黎斌,杨严俊.酶解玉米蛋白制备降血压肽的研究[J].食品工业科技,2006,27(5):117-122
[5]Shukla R,Cheryan M.Zein: the industrial protein from corn[J].Industrial Crops and Products,2001,133
[6]袁怀波,刘国庆,陈宗道.磷酸化改性玉米蛋白质的性质[J]. 食品科学, 2007,28(10):50-52
[7]李红梅,侯立琪,马兴胜.玉米蛋白去酰胺改性的研究[J].粮食与饲料工业,2007(04):19-21
[8]Soliman E A, Furuta M. Influence of irradiation on mechanical and water barrier properties of corn protein based films[J]. Radiation Physics and Chemistry,2009, 78-7(8): 651-654
[9]Lee M, Lee S, Kyung Bin Song. Effect of irradiation on the physicochemical properties of soy protein isolate films[J]. Radiation Physics and Chemistry, 2005, 72 (1) : 35-40
[10]Lee S L,Song K B. Effect of irradiation on the physicochemical properties of gluten films[J]. Food Chemistry,2005, 92: 621-625
[11]Schurer F, Kieffer R, Wieser H, et al. Effect of hydrostatic pressure and temperature on the chemical and functional properties of wheat gluten II. Studies on theinfluence of additives[J]. Journal of Cereal Science, 2007,46(1): 39-48
[12]王标诗,李汴生,尹林清,等.超高静压对食品乳化体系的影响[J].食品科学,2008,29(9):74-77
[13]沙业雄. 羊肚菌研究进展[J]. 食用菌,1990:26-8
[14]章灵华.药用真菌中生物活性多糖的研究进展[J].中草药,1992,23(2): 95-99
[15]Duncan C J, Pugh N,Pasco D S,etal. Isolation of a galactomannan that enhances macrophage activation f romthe edible fungus Morchella esculenta [J].Journal of Agricultural and Food Chemistry,2002 ,50(20):5683-5685
[16]孙晓明,张卫明,吴素玲,等.羊肚菌抗疲劳作用研究[J].中国野生植物资源,2001,20 (1) :17-18 , 32
[17]孙晓明,张卫明,吴素玲,等.羊肚菌免疫调节作用研究[J].中国野生植物资源,2001,20 (2) :12-13 ,20
[18]NY/T 685-2003,饲料用玉米蛋白粉[S].凯氏定氮国标
[19] Zheng Xi qun,Li Li te,Liu Xiao Lan, et al.Produetion of hydrolysate with antioxid ativeactivity by enzymatic hydrolysis of extruded corn gluten [J]. Applied Microbiology and Biotechnology, 12006,73(4):763-770.
Optimization of Liquid Fermentation Technology for Zein Bioconverted by Morchella Esculenta
Wen Chaoting Zheng Mingzhu Xiu Lin Sheng Yue Liu Jingsheng Cai Dan
(Food Science and Engineering, Jilin Agricultural University National Engineering Laboratory of the Wheat-corn Deep Processing, Changchun 130118)
Taking zein as the main raw material, and making fermentation cultivation in morchella esculenta, to determine the culture medium formula and the optimum conditions of zein bioconverted by morchella esculenta. The results showed that the liquid fermentation culture medium formula was: glucose 5.4%, corn gluten meal 8%, CaSO40.3% and KH2PO40.2%, on this condition, the mycelium biomass was 1.62 g/100 mL, zein conversion rate was 27.51%. On the basis of the optimum medium formula, the conditions of liquid fermentation culture was: inoculum size 10%, culture temperature 26 ℃, the medium initial pH 4, and liquid volume 100 mL/500 mL. On this optimized condition, the experiment educes the mycelium biomass 2.41 g/100 mL and zein conversion rate 36.69%.
zein,morchellaesculenta, liquid fermentation, mycelium biomass,zein conversion rate
TS201.3
A
1003-0174(2016)02-0103-06
吉林省科技发展计划(20140204011NY),国家现代农业产业技术体系(CARS02-29)
2014-07-11
文超婷,女,1990年出生,硕士,食品生物化学工程与功能性食品
刘景圣,男,1964年出生,教授,博士,粮食深加工与功能性食品
蔡丹,女,1980年出生,副教授,乳品科学与发酵工程

