上尿路尿路上皮癌术前预后相关因素分析及初步风险分层模型构建
邢云超,熊耕砚,方 东,张 争,蔡 林,张 雷,何志嵩,李学松,周利群
(北京大学第一医院泌尿外科,北京大学泌尿外科研究所,国家泌尿、男性生殖系肿瘤研究中心,北京 100034)
·论著·
上尿路尿路上皮癌术前预后相关因素分析及初步风险分层模型构建
邢云超,熊耕砚,方 东,张 争,蔡 林,张 雷,何志嵩,李学松△,周利群△
(北京大学第一医院泌尿外科,北京大学泌尿外科研究所,国家泌尿、男性生殖系肿瘤研究中心,北京 100034)
目的:分析上尿路尿路上皮癌(upper tract urothelial carcinoma,UTUC)患者的术前预后因子,并构建适合中国患者的术前风险评估模型。方法:收集北京大学第一医院2003年至2013年的686例UTUC患者的临床和随访资料进行回顾性分析。结果:686例患者中,男性303例(44.2%),女性383例(55.8%),术后高分期(T3和T4)肿瘤203例(29.6%),高分级(G3)肿瘤300例(43.7%),淋巴结转移(N1)54例(7.9%),其中,肾盂肿瘤、肿瘤长径大于5 cm、肾小球滤过率(estimated glomerular filtration rate, eGFR)≥30 mL/min和男性与术后肿瘤高分期相关;输尿管肿瘤、肿瘤长径大于5 cm、没有吸烟史与术后肿瘤高分级相关;肾盂肿瘤、肿瘤长径大于5 cm和术前贫血与术后淋巴结转移相关。患者的平均随访时间65个月,其间有208例(30.3%)患者死于肿瘤,210例(30.6%)患者出现了膀胱复发,其中肿瘤长径大于5 cm(P=0.001)、伴随同侧肾积水(P=0.041)和术前贫血(P=0.001)是患者术后肿瘤特异性死亡的独立危险因子,输尿管肿瘤(P=0.04)、多发肿瘤(P=0.005)和术前血肌酐含量大于133 μmol/L(P=0.036)是患者术后膀胱复发的独立危险因素。结论:在UTUC患者常见的术前临床参数中,肿瘤长径大于5 cm、伴随同侧肾积水和术前贫血与术后肿瘤特异性生存呈独立相关,输尿管肿瘤、多发肿瘤和术前血肌酐大于133 μmol/L与术后膀胱复发呈独立相关。基于这些术前预后因素构建的中国患者术前风险分层系统,可以帮助临床医生在术前就对患者进行初步的风险评估,并指导后续的临床治疗。
尿道上皮;癌,移行细胞;肿瘤复发,局部;预后;危险因素
上尿路尿路上皮癌(upper tract urothelial carcinoma,UTUC)指发生于肾盂和输尿管的尿路上皮恶性肿瘤,其发病率约占全部尿路上皮癌的5%~10%,中国人群UTUC发病率略高于西方[1]。患侧肾输尿管全长+膀胱袖状切除(radical nephroureterectomy, RNU)被公认为是治疗UTUC手术的金标准,但由于UTUC本身的多中心性,即使在RNU术后,膀胱复发率也高达20%~40%,T2和T3期UTUC患者的5年肿瘤特异性生存率均小于50%,而T4期患者更是不足10%[2]。
在现有的医疗水平下,如果能对患者进行准确的预后风险评估,就可以帮助临床医生更加合理地选择治疗方案,避免过度治疗或是治疗不足,并改善患者预后。当前临床上使用的预后模型大多来自美国泌尿外科学会(American Urological Association,AUA)和欧洲泌尿外科学会(European Association of Urology,EAU)的指南[1],它们都是基于西方人群中UTUC患者的术后临床病理资料建立的,而事实上,相对于术后模型,术前风险评估更有利于指导临床治疗[3-4],而且中西方UTUC患者之间在发病机制、流行病学特点、肿瘤特征及预后影响因素等方面存在较多的差异,但是由于UTUC的发病率较低,国内在这一领域的研究不多,所以当前急需建立一个适合于中国UTUC患者的术前风险评估系统。
1 资料与方法
本次入组的研究对象均为2003年至2013年在北京大学第一医院确诊为UTUC并且接受了手术治疗的患者,排除术前有膀胱癌病史、临床资料不完整和失访的患者,最终有686例患者纳入本次研究。
手术方式包括开放式或者是腹腔镜辅助的肾、输尿管全长切除和输尿管部分切除(对侧肾功能不全或是孤立肾的患者),术后组织标本均送病理检查,肿瘤分期和分级分别以2002年国际抗癌联盟(Union for International Cancer Control,UICC)的恶性肿瘤TNM分期和1973年WHO的肿瘤分级为标准[5-6]。
本研究分析的术前临床参数共有12项,其中肿瘤位置(肾盂或输尿管)、肿瘤方位(左侧或右侧)、肿瘤体积(最大长径)、肿瘤是否多发、是否伴随同侧肾积水由术前影像检查结果来确定,吸烟史、饮酒史、性别和年龄由门诊问诊获得,术前肾功能根据肾小球滤过率(estimated glomerular filtration rate,eGFR)大小确定(以30 mL/min为界分为两组)[7],术前贫血、术前血肌酐含量(以133 μmol/L为界分成两组)由术前血常规检查确定。
从手术后即开始随访,前两年每3个月随访一次,之后每年随访一次,方法包括电话随访和门诊随访。把患者肿瘤特异性死亡和术后膀胱复发定义为终点事件,并分析与患者肿瘤特异性生存(cancer-specific survival, CSS)和膀胱无复发生存(bladder recurrence-free survival, BRFS)相关的预后因素。
单因素和多因素的二元Logistic回归模型用来分析与肿瘤3个恶性指标(高分期:T3和T4,高分级:G3,淋巴结转移:N1)相关的预测因子,单因素和多因素的Cox比例风险回归模型用来筛选和患者CSS以及BRFS相关的预后因素(首先由单因素分析来进行初步筛选,然后将单因素分析中有统计学意义的变量再进行多因素分析,最后确定独立预后因子),不同风险组间生存率的比较采用Kaplan-Meier法和Log-Rank检验。应用SPSS 20.0统计软件,双侧检验,P<0.05为差异有统计学意义。
2 结果
入组本次研究的686例UTUC患者中,男性303例(44.2%),女性383例(55.8%)。术后组织病理结果显示:高分期(T3和T4)肿瘤有203例(29.6%), 高分级(G3)肿瘤有300例(43.7%),淋巴结转移(N1)有54例(7.9%)。患者平均随访时间为65个月,在随访期间,有208例(30.3%)患者死于肿瘤,210例(30.6%)患者出现了膀胱复发。686例UTUC患者其他的临床参数见表1。
与肿瘤恶性程度相关的术前临床参数如表2所示,其中肿瘤位于肾盂(P=0.001)、最大长径大于5 cm(P=0.001)、eGFR ≥30 mL/min(P=0.002)、男性(P=0.008)与术后肿瘤高分期相关;肿瘤位于输尿管(P=0.003)、最大长径大于5 cm(P=0.022)、没有吸烟史(P=0.001)与术后肿瘤高分级相关;肿瘤位于肾盂(P=0.007)、最大长径大于5 cm(P=0.002)、术前贫血(P=0.013)与术后淋巴结转移相关。
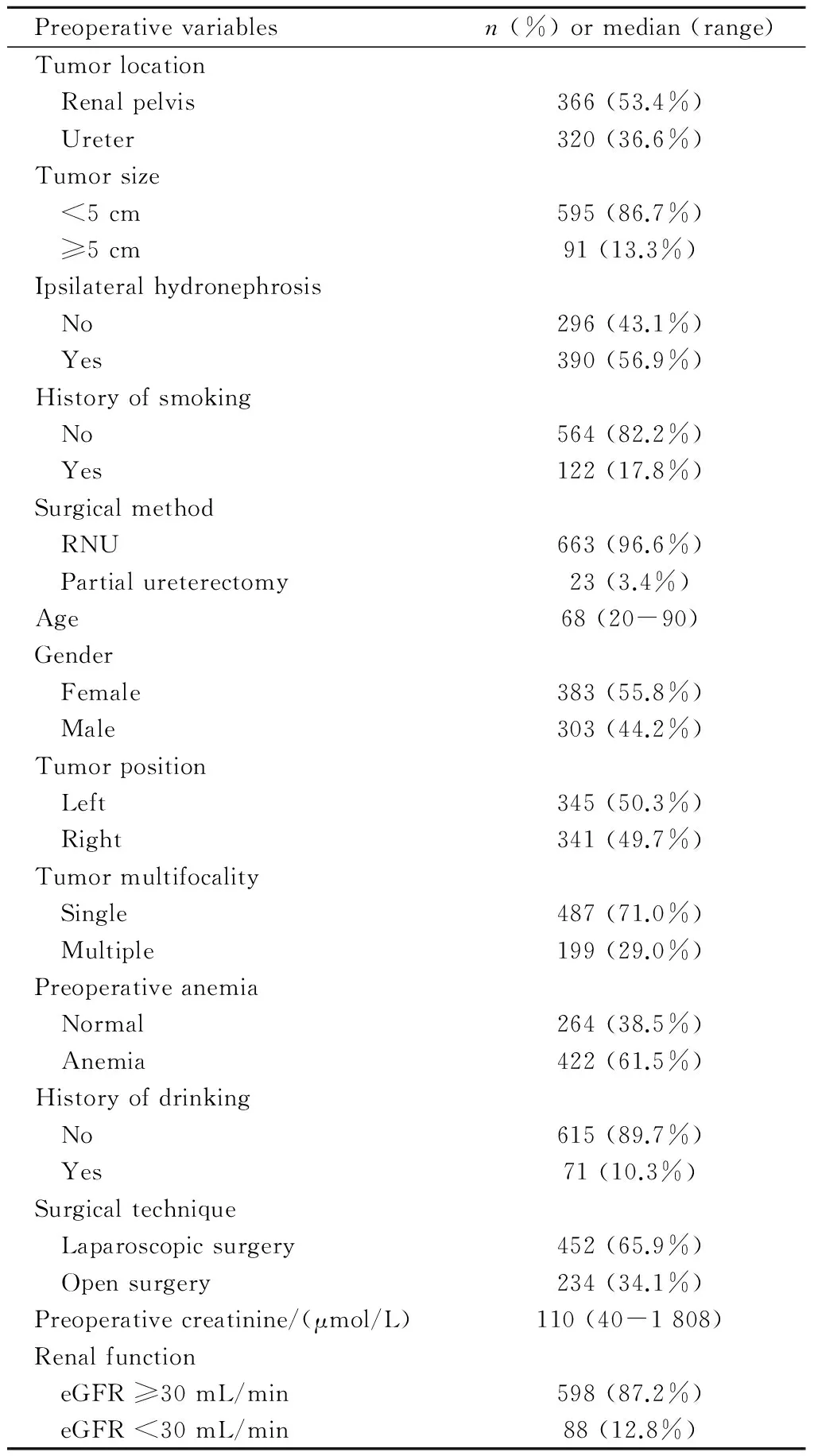
表1 686例UTUC患者的术前临床参数
UTUC, upper tract urothelial carcinoma; RNU, radical nephroureterectomy; eGFR, estimated glomerular filtration rate.
与患者CSS和BRFS相关的术前预后因子如表3所示,其中肿瘤最大长径大于5 cm(HR=2.48, 95%CI: 1.73~3.57,P=0.001)、伴随同侧肾积水(HR=1.36, 95%CI: 1.02~2.03,P=0.041)、术前贫血(HR=2.05, 95%CI: 1.46~2.89,P=0.001)是患者肿瘤特异性死亡的独立危险因子;输尿管肿瘤(HR=1.33, 95%CI: 1.01~1.75,P=0.04)、多发肿瘤(HR=1.51, 95%CI: 1.13~2.01,P=0.005)、术前血肌酐含量大于133 μmol/L(HR=1.4, 95%CI: 1.02~1.91,P=0.036)是患者术后膀胱复发的独立危险因素。
根据本研究得出的CSS与BRFS的独立危险因子,我们构建了基于中国UTUC患者的术前CSS和BRFS风险分层系统:将含有1个或少于1个独立危险因子的患者纳入低风险组,将含有2个独立危险因子的患者纳入中等风险组,将含有3个或是3个以上独立危险因子的患者纳入高风险组,不同风险组的详细信息见表4。图1A和B分别为不同CSS和BRFS风险组之间肿瘤特异性生存和膀胱无复发生存曲线,Log-rank检验结果分别为P<0.001 (CSS)和P=0.005 (BRFS)。
3 讨论
相对于临床上常用的基于国外患者术后的临床病理资料建立的预后模型,术前风险分层模型具有更好的时效性,能够使临床医生在手术之前,就能根据现有的检查结果和临床资料对患者疾病的危险程度有一个比较准确的评估,从而能更加合理地选择治疗方案。本研究收集我院近10年来收治的UTUC患者的临床病理和随访资料进行生存分析,筛选出能够作为独立预后因子的术前临床参数并且建立适合中国UTUC患者的术前风险分层系统。
A, the cancer-specific survival (CSS) risk group (P<0.001); B, the bladder recurrence-free survival (BRFS) risk group (P=0.005).
图1 不同风险组之间的生存曲线比较
Figure1 The survival curve of different risk group
本研究结果显示,肿瘤位于肾盂、肿瘤体积大、eGFR≥30 mL/min、男性预示着肿瘤的分期较晚;肿瘤位于输尿管、肿瘤体积较大、没有吸烟史预示着肿瘤分级较高;肿瘤位于肾盂、肿瘤体积较大、术前贫血的患者更易发生淋巴结转移。在预后方面,肿瘤体积较大、伴随同侧肾积水、术前贫血、男性患者的术后肿瘤特异性死亡率较高,而肿瘤位于输尿管、肿瘤多发、术前血肌酐高的患者术后易膀胱复发。
在平时的临床工作中,如果术前影像学检查发现上尿路的异常占位体积较大,一般都认为是肿瘤发现较晚,预后较差,而本研究此次的多因素分析结果也证实了这个一般结论。肿瘤伴随的同侧肾积水,一般是由于肿瘤的生长堵塞输尿管所致,积水进展迅速,除了手术以外难以解除,这就使其比其他原因引起的肾积水更容易损伤肾功能,并限制了临床上常用的基于铂化合物的化疗药物的使用,从而降低患者的预后[8]。国外研究曾经报道过术前贫血易导致UTUC的不良预后,包括肿瘤特异性死亡和膀胱复发[9],本研究发现术前贫血与淋巴结转移相关,而与膀胱复发无关。以往的研究发现,肿瘤相关的贫血可能早在肿瘤被诊断之前就已经持续了很长时间,它表明了肿瘤的恶性程度较高,对全身状态(包括造血功能)的影响较大,所以预后也更差。性别与UTUC预后的关系在中西方患者之间差别较大,基于西方UTUC患者的研究报道,男性发病率高,但女性的预后差[10],而基于中国患者的研究报道,女性发病率高,男性预后差[11-12];本研究也证实了这一点,男性患者具有更高的肿瘤分期,术后特异性死亡率也高于女性,这说明中西方UTUC患者之间在流行病学特点和预后影响因素等方面的差异性是确实存在的,需要我们重新审视国外的研究结果在中国患者中的适用性,并督促我们开展基于中国UTUC患者的研究。
相对于肾盂肿瘤,输尿管的肿瘤更靠近膀胱,所以由各种原因(如肿瘤细胞的自然脱落,输尿管镜检查和手术中的误操作导致的癌细胞脱落)产生的脱落肿瘤细胞也容易在膀胱发生种植性的转移。多发肿瘤和膀胱复发的相关性早已经被多数研究证实[13-14]。术前血肌酐水平大于133 μmol/L只能部分说明肾功能的损伤,然而其为何能预测术后膀胱复发,目前还没有一个合理的解释,后续的研究可以着眼于此。
本研究尚有很多不足之处,首先,回顾性研究本身的局限性使偏倚无法避免,但是鉴于UTUC发病率较低,大样本的前瞻性研究很难实现;另外,本研究所选择的患者在时间上跨度达10年以上,技术的不断发展使研究无法完全统一不同患者之间的诊疗方式,这可能会对结果造成影响;最后,UTUC患者术前的临床参数有很多,本研究借鉴国内外相关文献并结合现有的资料共选取了12项和预后可能相关的临床参数进行分析,但总会存在本次没有分析且和患者预后相关的其他参数,这只能有待于之后的进一步研究。
综上所述,本研究系统地分析了中国UTUC患者的常见术前临床参数的预后作用,根据分析结果构建的CSS和BRFS术前风险分层系统能够较好地区分不同风险组的患者,这样可以使临床医生对患者疾病的危险程度有一个初步的了解,并指导后续的治疗,包括是否给予新辅助化疗、手术方式的选择、术后化疗方案、术后监测和随访策略等。
[1]Roupret M, Babjuk M, Comperat E, et al. European guidelines on upper tract urothelial carcinomas: 2013 update [J]. Eur Urol, 2013, 63(6): 1059-1071.
[2]周利群, 李学松, 熊耕砚. 中国人群上尿路尿路上皮癌新进展[J]. 北京大学学报: 医学版, 2014, 46(4): 504-506.
[3]Fujita K, Uemura M, Yamamoto Y, et al. Preoperative risk stratification for cancer-specific survival of patients with upper urinary tract urothelial carcinoma treated by nephroureterectomy [J]. Int J Clin Oncol, 2015, 20(1): 156-163.
[4]Morizane S, Yumioka T, Yamaguchi N, et al. Risk stratification model, including preoperative serum C-reactive protein and estimated glomerular filtration rate levels, in patients with upper urinary tract urothelial carcinoma undergoing radical nephroureterectomy [J]. Int Urol Nephrol, 2015, 47(8): 1335-1341.
[5]Greene FL, Sobin LH. A worldwide approach to the TNM staging system: collaborative efforts of the AJCC and UICC [J]. J Surg Oncol, 2009, 99(5): 269-272.
[6]Epstein JI, Amin MB, Reuter VR, et al. The World Health Organization/International Society of Urological Pathology consensus classification of urothelial (transitional cell) neoplasms of the urinary bladder. Bladder Consensus Conference Committee [J]. Am J Surg Pathol, 1998, 22(12): 1435-1448.
[7]Ma YC, Zuo L, Chen JH, et al. Modified glomerular filtration rate estimating equation for Chinese patients with chronic kidney disease [J]. J Am Soc Nephrol, 2006, 17(10): 2937-2944.
[8]Kaag MG, O′Malley RL, O′Malley P, et al. Changes in renal function following nephroureterectomy may affect the use of perio-perative chemotherapy [J]. Eur Urol, 2010, 58(4): 581-587.
[9]Rink M, Sharifi N, Fritsche HM, et al. Impact of preoperative anemia on oncologic outcomes of upper tract urothelial carcinoma treated with radical nephroureterectomy [J]. J Urol, 2014, 191(2): 316-322.
[10]Lughezzani G, Sun M, Perrotte P, et al. Gender-related diffe-rences in patients with stage I to III upper tract urothelial carcinoma: results from the Surveillance, Epidemiology, and End Results database [J]. Urology, 2010, 75(2): 321-327.
[11]Xiong G, Liu J, Tang Q, et al. Prognostic and predictive value of epigenetic biomarkers and clinical factors in upper tract urothelial carcinoma [J]. Epigenomics, 2015, 7(5): 1-12.
[12] 虞巍, 赵亚元, 沈棋, 等. 上尿路尿路上皮癌病理特点的性别差异(附597例分析)[J]. 北京大学学报: 医学版, 2011, 43(4): 522-524.
[13] Narukawa T, Hara T, Arai E, et al. Tumour multifocality and grade predict intravesical recurrence after nephroureterectomy in patients with upper urinary tract urothelial carcinoma without a history of bladder cancer [J]. Jpn J Clin Oncol, 2015, 45(5): 488-493.
[14]Yafi FA, Novara G, Shariat SF, et al. Impact of tumour locationversusmultifocality in patients with upper tract urothelial carcinoma treated with nephroureterectomy and bladder cuff excision: a homogeneous series without perioperative chemotherapy [J]. BJU Int, 2012, 110(2 Pt 2): E7-E13.
(2015-10-15收稿)
(本文编辑:任英慧)
Preoperative prognostic factors and preoperative risk stratification of upper tract urothelial carcinoma
XING Yun-chao, XIONG Geng-yan, FANG Dong, ZHANG Zheng, CAI Lin, ZHANG Lei, HE Zhi-song, LI Xue-song△, ZHOU Li-qun△
(Department of Urology, Peking University First Hospital; Institute of Urology, Peking University; National Urological Cancer Center, Beijing 100034, China)
Objective: To identify the preoperative prognostic factors of upper tract urothelial carcinoma (UTUC) and construct preoperative risk stratification system. Methods: A retrospective study including 686 patients who were diagnosed with UTUC and received radical nephroureterectomy or partial ureterectomy in Peking University First Hospital during 2003 and 2013. Results: Of the 686 UTUC patients, 303 (44.2%) were male and 383 (55.8%) female. The postoperative pathological examination showed that 203 (29.6%) had high tumor stages (T3, T4), 300 (43.7%) had high tumor grades (G3) and 54 (7.9%) had lymph nodes metastasis (N1). After multivariate analysis, renal pelvic tumor, large tumor, estimated glomerular filtration rate (eGFR) ≥30 mL/min, and male were associated with high tumor stage. Ureteral tumor, large tumor, and non-smoking history were associated with high tumor grade. Renal pelvis tumor, large tumor, and preoperative anemia were associated with positive N status. During the follow-up, 208 (30.3%) died for cancer and 210 (30.6%) developed intravesical recurrence. Multivariate analysis showed: large tumor (P=0.001), concomitant ipsilateral hydronephrosis (P=0.041), and preoperative anemia (P=0.001) were independently associated cancer-specific mortality after surgery, while ureteral tumor (P=0.04), multiple tumor (P=0.005), and high preoperative creatinine (P=0.036) were independent risk factors for intravesical recurrence. Conclusion: Of the preoperative clinical parameters of UTUC patients, the large tumor, concomitant ipsilateral hydronephrosis, and preoperative anemia were independently associated with cancer-specific mortality after surgery. Ureteral tumor, multiple tumor, and high preoperative creatinine were independently associated with intravesical recurrence after surgery.
Urothelium; Carcinoma, transitional cell; Neoplasm recurrence, local; Prognosis; Risk factors
国家自然科学基金(81372746)、北京市自然科学基金(7152416)、首都临床特色应用研究与临床推广基金(Z151100004015173)和北京大学医学部与台湾大学医学合作研究项目基金(BMU20120318)资助 Supported by the National Natural Science Foundation of China (81372746), the Beijing Natural Science Foundation (7152416), the Capital Foundation for Clinical Characteristics and Application Research (Z151100004015173), and the Medical Cooperative Research Project Fund of Peking University Health Science Center and Taiwan University (BMU20120318)
时间:2016-1-6 10:19:55
http://www.cnki.net/kcms/detail/11.4691.R.20160106.1019.008.html
R737.1
A
1671-167X(2016)06-1032-06
10.3969/j.issn.1671-167X.2016.06.019
△ Corresponding author’s e-mail, pineneedle@sina.com, zhoulqmail@sina.com

