纤维素酶法提取百里香黄酮的工艺优化研究
王娣,柯春林,曹珂珂,谢海伟,李妍
(蚌埠学院 生物与食品工程系,安徽 蚌埠 233030)
纤维素酶法提取百里香黄酮的工艺优化研究
王娣,柯春林,曹珂珂,谢海伟,李妍
(蚌埠学院 生物与食品工程系,安徽 蚌埠 233030)
利用纤维素酶对百里香中黄酮进行了提取工艺研究。考察了酶解温度、酶量、pH和酶解时间对黄酮得率的影响。百里香黄酮最佳提取工艺:酶解温度45 ℃,酶量0.2%,pH 5.0,酶解时间1.5 h,黄酮得率可达1.528%。抗氧化实验表明百里香黄酮具有较强的抗氧化活性,黄酮提取物浓度为1.0 mg/mL时,对DPPH自由基的清除率达73.84%,对羟基自由基的清除率为51.73%。
纤维素酶;黄酮;正交试验;抗氧化
百里香(Thyme),别称麝香草,为唇形科百里香属植物,原产地中海沿岸,为西方珍贵的香辛调味料,在我国多分布在内蒙古、甘肃、陕西、青海、宁夏等地[1]。其所含精油因成分独特,在医药、日用化工及精细化工等领域广泛应用[2-4]。百里香茎叶中富含百里香酚、黄酮等活性成分,近年来又成为食品工业中保鲜剂、抗氧化剂、稳定剂等的理想替代品[5-8]。
纤维素酶是一组能够降解纤维素酶的总称,可破坏细胞壁的致密结构,消除胞内黄酮等大分子溶出的屏障,加速有效成分的溶出[9]。近年来,使用纤维素酶进行植物有效成分的提取取得了不少新的成果[10-13]。本课题拟采用单因素和正交试验法优化提取条件,考察酶解温度、酶量、pH、酶解时间等因素对百里香黄酮提取的影响,并对黄酮提取物的抗氧化活性进行初探,以期为百里香黄酮的进一步开发与应用提供有价值的参考依据。
1 材料和方法
1.1 材料与仪器
百里香 安徽亳州医药公司,粉碎,过60目筛。纤维素酶 上海润捷化学试剂有限公司;芦丁标准品(分析纯) 上海生化试剂厂;DPPH(分析纯) Sigma 公司。
DZKW-4电子恒温水浴锅 北京中兴伟业仪器有限公司;UV1102紫外-可见分光光度计 上海天普紫外可见分光光度计有限公司;DY881-8恒温干燥箱 合肥爱拓实验器材公司;JA2003A电子天平 北京赛多利斯仪器系统有限公司;HH-1(HH-5)恒温水浴锅 江苏省金坛市恒丰仪器制造有限公司;RE-52旋转蒸发器 上海亚荣生化仪器厂。
1.2 方法
准确称取2.00 g百里香粉,加入纤维素酶和10 mL的HAc-NaAc缓冲液混合,在不同纤维素酶浓度、酶解温度和pH条件下酶解后,95 ℃维持10 min,使酶灭活;接着加入等体积无水乙醇浸提24 h后过滤,滤渣再加入50%乙醇20 mL浸提24 h过滤,合并滤液备用。
1.2.1 黄酮含量的测定
1.2.1.1 芦丁标准工作曲线的绘制
准确称取干燥至恒重的芦丁标准品0.020 g,用30%乙醇溶解,定容于100 mL容量瓶中,得质量浓度为0.20 mg/mL的芦丁标准液。准确吸取芦丁标准溶液0,1.0,2.0,3.0,4.0,5.0 mL于10 mL容量瓶中,加入5%的NaNO2溶液0.3 mL还原6 min,加入10%的Al(NO3)3溶液0.3 mL络合6 min,加入质量分数为4%(即1 mol/L)的NaOH溶液4 mL,最后用30%乙醇定容,摇匀,显色15 min,在波长510 nm处测定吸光度。以吸光度A为纵坐标,芦丁浓度C为横坐标,得到芦丁标准曲线。
1.2.1.2 提取物中黄酮含量的确定
准确吸取样液1 mL,置于10 mL容量瓶中,加入5%的NaNO2溶液0.3 mL还原6 min,加入10%的Al(NO3)3溶液0.3 mL络合6 min,加入质量分数为4%(即1 mol/L)的NaOH溶液4 mL,最后用30%乙醇定容,摇匀,显色15 min,在波长510 nm处测定吸光度。从标准曲线方程中计算出黄酮含量,进而计算出黄酮得率。
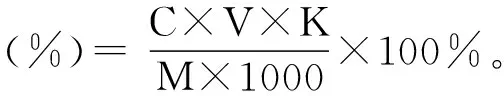
式中:C为测得的样品溶液的黄酮浓度(mg/mL);K为样品溶液的稀释倍数;V为测定液总量(mL);M为样品的质量(g)。
1.2.2 单因素和正交试验
1.2.2.1 酶解温度对百里香黄酮得率的影响
准确称取2.00 g百里香粉,加入0.2%的纤维素酶和10 mL的HAc-NaAc缓冲液(pH 4.6),不同温度(35,40,45,50,55 ℃)下水解1.5 h,95 ℃维持10 min,使酶灭活;加入等体积无水乙醇浸提24 h过滤,滤渣再加入50%乙醇20 mL浸提24 h过滤,合并滤液备用。考察不同酶解温度对百里香黄酮得率的影响。
1.2.2.2 酶量对百里香黄酮得率的影响
准确称取2.00 g百里香粉,按不同质量比(0.1%,0.2%,0.3%,0.4%,0.5%)添加纤维素酶和10 mL的HAc-NaAc缓冲液(pH 4.6),45 ℃下水解1.5 h,以下操作同上。考察不同酶量对百里香黄酮得率的影响。
1.2.2.3 pH对百里香黄酮得率的影响
准确称取2.00 g百里香粉,加入0.2%的纤维素酶和10 mL的HAc-NaAc缓冲液(pH分别为4.2,4.6,5.0,5.4,5.8),45 ℃水解1.5 h,以下操作同上。考察不同pH对百里香黄酮得率的影响。
1.2.2.4 酶解时间对百里香黄酮得率的影响
准确称取2.00 g百里香粉,加入0.2%的纤维素酶和10 mL的HAc-NaAc缓冲液(pH 4.6),45 ℃下水解不同时间(0.5,1.0,1.5,2.0,2.5 h),以下操作同上。考察不同酶解时间对百里香黄酮得率的影响。
1.2.2.5 正交试验设计
正交试验因素水平表见表1。
表1 正交试验因素水平表L9(34)
Table 1 Factors and levels of orthogonal experiment

水平A酶解温度(℃)B酶量(%)CpHD酶解时间(h)1400.14.21.02450.24.61.53500.35.02.0
1.2.3 百里香提取物抗氧化活性研究[14,15]
1.2.3.1 百里香提取物对DPPH自由基的清除能力
将百里香提取液减压浓缩,真空冷冻干燥,得到黄褐色粉状提取物,用无水乙醇溶解。将待测的百里香提取物溶液稀释成系列溶液,添加6.5×10-5mol/L DPPH·乙醇溶液,避光反应10 min,在517 nm波长下测定吸光值。
清除率(%)=[1-(A2-A1)/A0]×100。
式中:A0为2.5 mL 6.5×10-5mol/L DPPH·乙醇溶液+0.5 mL无水乙醇的吸光值;A1为2.5 mL无水乙醇+0.5 mL样品溶液的吸光值;A2为2.5 mL 6.5×10-5mol/L DPPH·乙醇溶液+0.5 mL样品溶液的吸光值。
1.2.3.2 羟自由基实验
羟基自由基是一种强氧化剂,对羟基自由基的清除率是反映提取物抗氧化作用的一项重要指标。反应体系中加入邻二氮菲,邻二氮菲-Fe2+被羟自由基氧化为邻二氮菲-Fe3+后,红色褪去,在536 nm处的吸收大幅度下降。将百里香粉状提取物用无水乙醇溶解,稀释成系列溶液。按表2加样,37 ℃保温60 min,于波长536 nm处测吸光度(A)值(3次平均),计算羟自由基清除率。

表2 实验加样表及相应的吸光值Table 2 Sampling table of experiments and the corresponding absorbance
2 实验结果与分析
2.1 芦丁标准工作曲线
以吸光度为横坐标,芦丁浓度(μg/mL)为纵坐标,绘制标准曲线,见图1。得回归方程y=0.0115x+0.0063,R2= 0.9997,具有良好的线性关系。
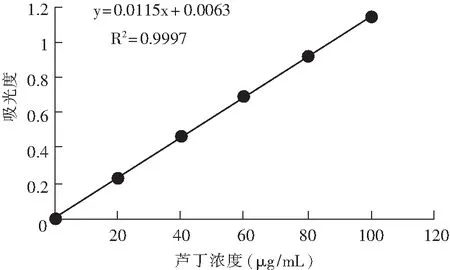
图1 芦丁标准曲线Fig.1 The standard curve of rutin
2.2 单因素试验结果
2.2.1 酶解温度对百里香黄酮得率的影响

图2 酶解温度对黄酮得率的影响Fig.2 Effect of enzymolysis temperature on the yield of flavonoids
由图2可知,开始随着温度的升高,黄酮的得率也不断地增大;当温度达到45 ℃时,黄酮得率达到最大1.453%;再随着温度的升高,黄酮得率则出现了下降趋势。因此,选定40,45,50 ℃为温度对总黄酮得率较敏感的3个水平。
2.2.2 酶量对百里香黄酮得率的影响
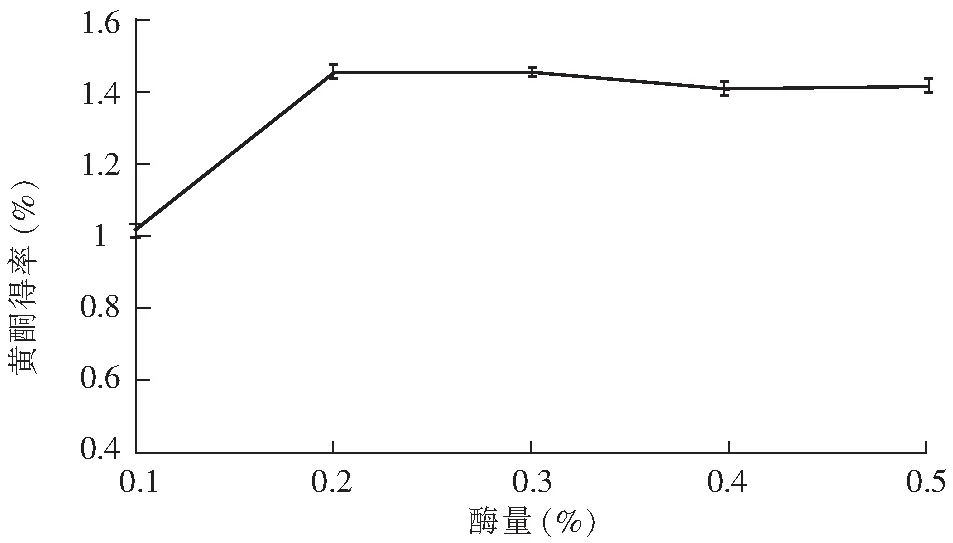
图3 酶量对黄酮得率的影响Fig.3 Effect of enzyme amount on the yield of flavonoids
由图3可知,黄酮得率先随着酶加量的增加而增大,当酶量添加到0.2%时,得率达到最大值并趋于稳定;再增加酶用量,增幅效果不明显。因此,选定0.1%,0.2%,0.3%为酶量对总黄酮得率较敏感的3个水平。
2.2.3 pH对百里香黄酮得率的影响
图4 pH值对黄酮得率的影响Fig.4 Effect of pH value on the yield of flavonoids
由图4可知,随着pH值的升高,黄酮得率逐渐增大,当pH为4.6时,得率最高;再增大pH值,黄酮得率则呈现下降的趋势。因此,选定4.2,4.6,5.0为pH对总黄酮得率较敏感的3个水平。
2.2.4 酶解时间对百里香黄酮得率的影响
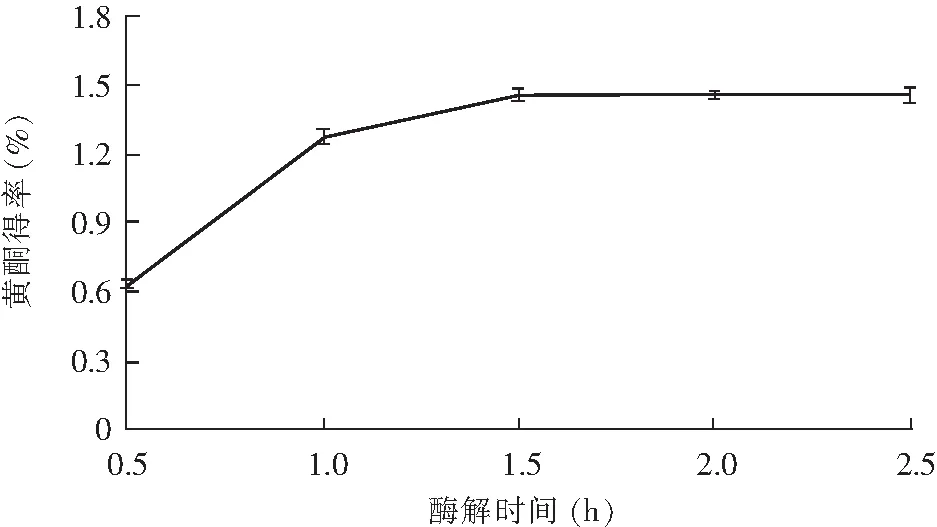
图5 酶解时间对黄酮得率的影响Fig.5 Effect of enzymolysis time on the yield of flavonoids
由图5可知,随着酶解反应时间的延长,黄酮得率逐渐增大,当达到1.5 h时,黄酮得率达到最大,这说明此时酶和底物已经充分反应;当时间继续增加时,黄酮得率增幅很小,趋于稳定。因此,选定1.0,1.5,2.0 h为提取时间对总黄酮得率较敏感的3个水平。
2.3 正交试验结果与分析
表3 正交设计与试验结果
Table 3 The orthogonal array design matrix and experimental results
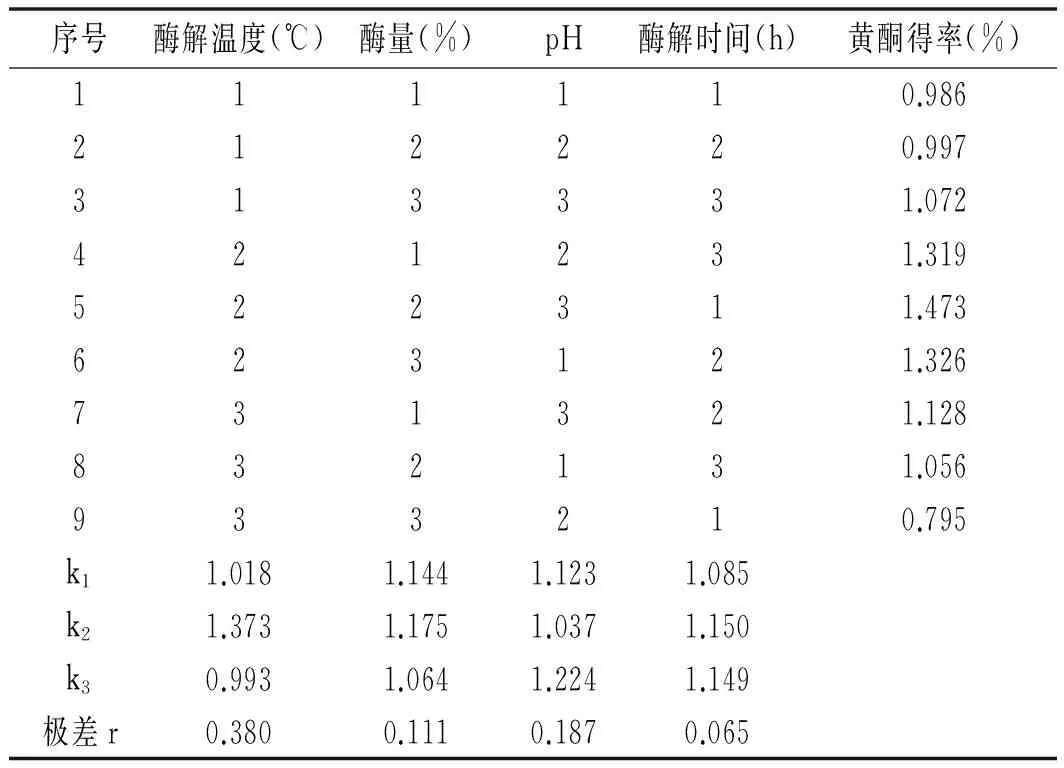
序号酶解温度(℃)酶量(%)pH酶解时间(h)黄酮得率(%)111110.986212220.997313331.072421231.319522311.473623121.326731321.128832131.056933210.795k11.0181.1441.1231.085k21.3731.1751.0371.150k30.9931.0641.2241.149极差r0.3800.1110.1870.065
表4 正交试验结果方差分析
Table 4 Variance analysis of orthogonal experimental results

因素偏差平方和自由度方差F比显著性酶解温度0.27020.13533.750*酶量0.02020.0102.500pH0.05320.0276.625酶解时间0.00820.0041.000误差0.012
注:F0.05(2,2)=19。
由表3和表4可知,纤维素酶法提取百里香黄酮的影响因素依次为酶解温度>pH值>酶量>酶解时间。由表4可知,酶解温度对黄酮提取的影响显著,而pH、酶量和酶解时间对黄酮得率的影响较小。确定了最佳提取条件为A2B2C3D2,即:在酶解温度45 ℃,酶量0.2%,pH 5.0,酶解时间1.5 h的条件下,黄酮得率可达1.528%(3次平均)。
2.4 百里香提取物抗氧化实验
2.4.1 对DPPH自由基的清除能力
百里香黄酮提取物对DPPH自由基的清除能力实验结果见图6,表明百里香黄酮提取物具有较强的抗氧化活性。随着百里香黄酮提取物浓度的不断增加,对DPPH自由基清除能力逐步增大。当提取物浓度为1.0 mg/mL时,对DPPH自由基的清除率可达73.84%。

图6 百里香黄酮提取物清除DPPH自由基的量效关系Fig.6 The DPPH·scavenging effect of thyme flavonoids
2.4.2 对羟基自由基的清除能力
百里香黄酮提取物对羟基自由基的清除能力实验结果见图7,表明百里香黄酮提取物对羟基自由基有明显的清除作用。随着百里香黄酮提取物浓度的增加,对羟基自由基的清除作用也逐渐增强。当提取物浓度为1.0 mg/mL时,对羟基自由基的清除率为51.73%。
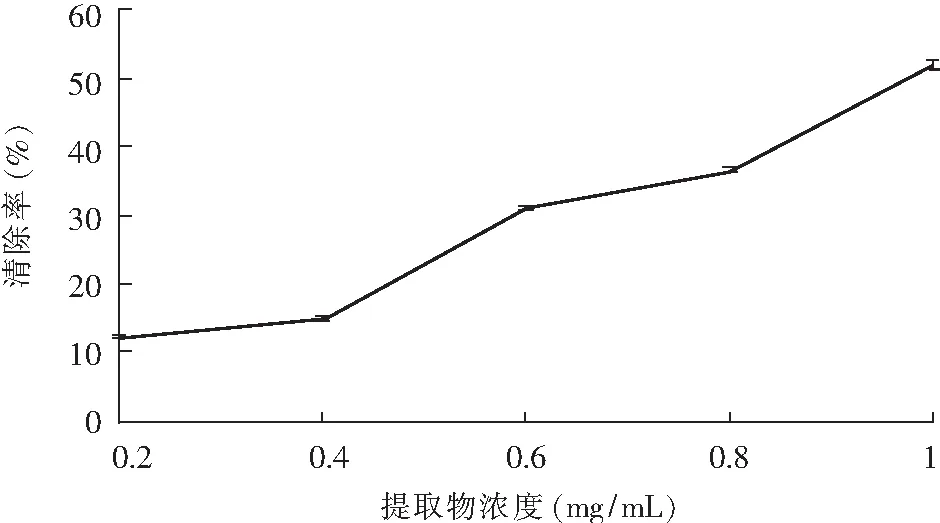
图7 百里香黄酮提取物清除羟自由基的量效关系Fig.7 The ·OH scavenging effect of thyme flavonoids
3 结论
采用纤维素酶法可有效提取百里香黄酮。酶解温度对百里香黄酮提取的影响最显著,百里香黄酮的最优提取条件为:酶解温度45 ℃,酶量0.2%,pH 5.0,酶解时间1.5 h,黄酮得率可达1.528%。抗氧化实验表明百里香黄酮具有较强的抗氧化活性。对DPPH自由基的清除能力很强,当黄酮提取物浓度为1.0 mg/mL时,对DPPH自由基的清除率达73.84%。随着百里香黄酮浓度的增加,对羟基自由基的清除作用也逐渐增强。当黄酮提取物浓度为1.0 mg/mL时,对羟基自由基的清除率为51.73%。本实验为初步抗氧化探究,旨在为百里香资源在我国的开发利用和发展提供一定基础数据。
[1]中国科学院植物研究所.中国高等植物图鉴(第三册)[M].北京:科学出版社,2002:681.
[2]Bensmira M, Jiang B, Nsabimana C, et al. Effect of lavender and thyme incorporation in sunflower seed oil on its resistance to frying temperatures[J].Food Research International, 2007, 40(3): 341-346.
[3]Solmakos N, Govaris A, Koidis P, et al. The antimicrobial effect of thyme essential oil, nisin, and their combination againstListeriamonocytogenesin minced beef during refrigerated storage[J].Food Microbiology, 2008, 25(1): 120-127.
[4]Iraj Rasooli, Mehdi Razzaghi Abyaneh. Inhibitory effects of thyme oils on growth and aflatoxin production byAspergillusparasiticus[J].Food Control,2004,15:479-483.
[5]Seung J L, Katumi U, Shibamoto T, et al. Identification of volatile components in basil(Ocimumbasilicuml)and thyme leaves(ThymusvulgarisL.)and their antioxidant properties[J].Food Chemistry, 2005 (91): 131-137.
[6]Chu C L, Liu W T, Zhou T. Fumigation of sweet cherries with thymol and acid to reduce post harvest brown rot and blue mold rot[J].Fruits, 2001 (56): 123-130.
[7]Solimana K M, Badeaab R I. Effect of oil extracted from some medicinal plants on different mycotoxigenic fungi[J].Food and Chemical Toxicology, 2002 (40): 1669-1675.
[8]Liu W T, Chu C L, Zhou T. Thymol and acetic acid vapors reduce post harvest brown rot of apricot and plums[J].Hort Science, 2001 (37): 151-156.
[9]刘智峰.酶法-超声波辅助提取香椿叶中总黄酮及抗氧化活性研究[J].食品工业科技,2015(20):314-319.
[10]陈佳, 徐怀德, 米林峰,等.洋葱皮总黄酮纤维素酶法提取及抗氧化研究[J].食品科学, 2011, 32(4): 37-41.
[11]方芳, 许凯扬, 朱强,等.超声波辅助水酶法萃取葫芦籽油的研究[J].中国粮油学报, 2012, 27(10): 62-66.
[12]施英英, 薛培俭, 夏黎明.酶法提取葛根渣中异黄酮的研究[J].林产化学与工业, 2006, 26(1): 62-64.
[13]王岩岩, 李文娟.纤维素酶提取陈皮黄酮的工艺条件[J].食品与生物技术学报, 2008, 27(2): 71-74.
[14]Paryathy K S, Negi P S, Srinivas P. Antioxidant, antimutagenic and antibacterial activities of curcumin-[betta]-diglucoside[J].Food Chemistry,2009,115:265-270.
[15]Liu H, Qiu N, Ding H, et al. Polyphenols contents and antioxidant capacity of 68 Chinese herbals suitable for medical or food uses[J].Food Research International, 2008, 41:363-365.
Study on Extraction Technology of Flavonoids from Thyme by Cellulase
WANG Di, KE Chun-lin, CAO Ke-ke, XIE Hai-wei, LI Yan
(Department of Biology and Food Engineering, Bengbu College, Bengbu 233030, China)
The extraction technology of flavonoids from thyme by cellulase is studied. The effects of enzymolysis temperature, enzyme amount, pH and enzymolysis time on the yield of flavonoids are investigated. The orthogonal experimental results show that the optimum extraction technology conditions of flavonoids from thyme by cellulase are as follows: enzymolysis temperature of 45 ℃, enzyme amount of 0.2%, pH of 5.0 and enzymolysis time of 1.5 h, the yield of flavonoids is 1.528%. The antioxidant experiments indicate that when the concentration of flavonoid extracts is 1.0 mg/mL, the clearance rate of DPPH·reaches 73.84%, and the clearance rate of OH·reaches51.73%.
cellulase; flavonoid; orthogonal experiment; antioxidant
2016-06-20
安徽省教育厅重点科研项目(KJ2015A204)
王娣(1976-),女,副教授,硕士,研究方向:食品生物技术。
TS201.1
A
10.3969/j.issn.1000-9973.2016.12.009
1000-9973(2016)12-0038-05

