河蚬多肽的理化特性及抗氧化性质
杨玉娈,陈丽丽,杜雨芊,赵利*,袁美兰,白春清
(1.江西科技师范大学 生命科学学院,国家淡水鱼加工技术研发分中心,南昌 330013;2.南昌市食品化妆品监督所,南昌 330038)
河蚬多肽的理化特性及抗氧化性质
杨玉娈1,陈丽丽1,杜雨芊2,赵利1*,袁美兰1,白春清1
(1.江西科技师范大学 生命科学学院,国家淡水鱼加工技术研发分中心,南昌 330013;2.南昌市食品化妆品监督所,南昌 330038)
文章研究了河蚬多肽的理化性质和抗氧化性质。结果表明:河蚬多肽具有很好的起泡性、溶解性和热稳定性以及良好的吸油性;相对分子质量集中在70~2000 Da范围内(占95%以上),其中数均相对分子质量为72的肽含量最多,占36.38%;必需氨基酸含量较高,占42.69%;呈味氨基酸含量为34.88%,具有很好的呈味效果;有很强的清除DPPH自由基活性,IC50=2.55 mg/mL,铁离子还原力FRAP值为95.52 μmol/mg,而对羟自由基和超氧阴离子的清除活性较弱。
河蚬;多肽;理化性质;抗氧化性质
生物活性肽是具有特殊生理活性的肽类,这方面的研究近几年已成为食品科学界关注的热点,主要涉及到改善和提高矿物质的运输和吸收、抗菌、提高免疫力、抗氧化、抗高血压和降血脂等功能[1]。国内外有研究报道了关于贝类蛋白及其水解物的研究[2],相继从河蚌[3]、文蛤[4]、紫贻贝[5]、牡蛎[6]、美洲帘蛤[7]和马氏珠母贝[8]等水产贝类制备出有特殊生理功能的生物活性肽。然而,目前使用的大多抗氧化剂由化学合成,对人体的肝、脾、肺有不利影响,可诱发恶性肿瘤等[9]。许多蛋白水解物都被发现具有抗氧化活性,被认为是安全性较高的抗氧化剂来源。
本文主要研究了河蚬多肽的理化特性和抗氧化性质,主要测定了其起泡性和泡沫稳定性、溶解性、热稳定性、吸油能力等理化特性,以及河蚬多肽的相对分子量分布、氨基酸含量及构成比例;并通过测定河蚬多肽对DPPH自由基、羟自由基、超氧阴离子自由基的清除率以及对铁离子的还原力,探讨了河蚬多肽的抗氧化活性。
1 材料与设备
1.1 材料与试剂
新鲜河蚬,壳长1.5~2.5 cm,捕捞于鄱阳湖水域。
Alcalase碱性蛋白酶(200000 U/mL) Novozymes公司;福林酚试剂 北京索莱宝生物科技有限公司;牛血清蛋白 上海蓝季科技发展有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)、三吡啶吖嗪 Sigma公司;邻菲罗啉 国药集团化学试剂有限公司;其它试剂均为分析纯。
1.2 仪器与设备
JJ-2高速组织捣碎机 上海标本模型厂;TDL-5A离心机 上海菲恰尔分析仪器有限公司;精密pH计 Mettler Toledo;HZ-8812S多用途水浴恒温振荡器 Hualida Laboratory Equipment Company;T25高速分散机:IKA Works Guangzhou;BSA224S-CW型电子分析天平 北京赛多利斯仪器系统有限公司;UV-1100型紫外可见分光光度计 上海美谱达仪器有限公司;SNB-1数字式粘度计 上海精密科学仪器有限公司天平仪器厂;DA201-C大孔吸附树脂 江苏苏青水处理工程集团有限公司;层析柱系统(DBS系列电脑自动部分收集器、DHL-B电脑定时恒流泵、HD-3紫外检测仪) 上海沪西分析仪器有限公司;层析柱(2.5 cm×60 cm) 上海华美实验仪器厂。
2 方法
2.1 河蚬多肽的制备
鲜活河蚬漂烫剥壳取肉,经绞肉机绞碎、胶体磨匀浆,用Alcalase碱性蛋白酶在50 ℃,加酶量为2%,pH为8.5,底物蛋白浓度为2%的条件下酶解3 h,5000 r/min离心20 min取上清液冷冻干燥即为粗多肽粉,粗多肽经DA201-C大孔吸附树脂吸附乙醇,解吸得到分离纯化,过柱条件为:层析柱(2.5 cm×60 cm),上样浓度为30 mg/mL,上样流速为1 BV/h,用紫外检测器检测流出液的A220 nm,以A220 nm=0.05为穿透点,达到穿透点停止上样,用蒸馏水洗涤层析柱至洗脱液的电导率与去离子水相当,水清洗结束后用75%浓度的乙醇以0.5 BV/h的流速进行洗脱,收集洗脱液经旋蒸浓缩、冷冻干燥即为纯化河蚬多肽。
2.2 河蚬多肽中基础成分的测定
水分:GB 5009.3-2010《食品中水分的测定》;蛋白质含量:GB 5009.5-2010《食品中蛋白质的测定》;灰分:GB 5009.4-2010《食品中灰分的测定》。
2.3 河蚬多肽理化性质的测定
2.3.1 河蚬多肽的起泡性及泡沫稳定性[10-13]
将大豆分离蛋白、乳清蛋白、河蚬多肽配制成1%(W/V)的悬浊液,取10 mL于50 mL离心管中,分别加入1 mol/L盐酸溶液或1 mol/L氢氧化钠溶液调节水解液pH分别为2,4,6,8,10,用分散机在13500 r/min下分散1 min,分别测定分散操作停止时泡沫体积和液体体积之和V0,以及分散操作停止0,5,10,15,20 min时的泡沫体积Vx。起泡性(foaming characteristics,FC)和泡沫稳定性(foam stability,FS)计算公式如下:
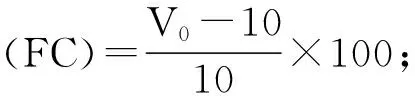
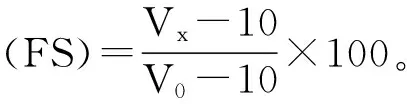
2.3.2 河蚬多肽的溶解性
采用Folin-Phenol法测定不同pH 值下河蚬多肽的溶解性。
牛血清蛋白标准曲线的绘制:分别吸取250 μg/mL的牛血清蛋白标准溶液100,200,400,600,800,1000 μL 于10 mL比色管中,用水补至1 mL,所得浓度依次为25,50,100,125,200,250 μg/mL,依次加入Folin-Phenol试剂甲液5 mL,Folin-Phenol试剂乙液0.5 mL,立即混匀,于25 ℃水浴30 min,取出后于500 nm处测定吸光度,制备标准曲线。
溶解性:采用福林酚法,测定不同pH 值下河蚬多肽的溶解性。根据蛋白质在等电点处溶解性最低的原理,通过测蛋白质的溶解性来测定样品的等电点。参照文献[14]稍作改动,用氮溶解指数(nitrogen solubility index,NSI)来评价河蚬多肽的溶解性。取9支只50 mL离心管,各取0.5 g河蚬多肽溶解于25 mL水中,用1 mol/L的HCl和NaOH调pH(2~10),振荡30 min后经5000 r/min离心20 min,取上清液测可溶性氮指数。用Folin-Phenol法测上清液中和样品中的总蛋白含量,氮溶解指数计算公式如下:

2.3.3 河蚬多肽的热稳定性
热稳定性:将浓度为1.0%的河蚬蛋白分别在不同的pH值(2~10)和不同温度(70~90 ℃)下加热30 min后,经5000 r/min离心20 min,用Folin-Phenol法测定上清液中蛋白质含量,河蚬多肽的热稳定性以上清液中蛋白质含量占总蛋白的百分数来表示。
2.3.4 河蚬多肽的吸油能力[15]
吸油能力(OAC):称取 M g河蚬多肽与食用大豆油以1∶12比例混合,加入已称重的离心管M1中,加盖摇匀1 min后室温放置30 min,5000 r/min下离心20 min,用吸管吸去上层液层,再将离心管倒置在滤纸上25 min后称重M2。以大豆分离蛋白和乳清蛋白作为对比。
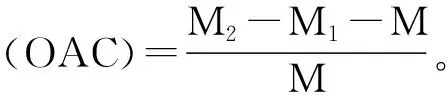
2.4 河蚬多肽相对分子量分布的测定
采用HPLC检测河蚬多肽的相对分子质量分布,色谱条件:色谱柱:TSKgel 2000 SWXL(300 nm×7.8 mm);流动相体积比:乙醇+水+氯乙酸=450+550+1;检测波长:220 nm;流量:0.5 mL/min;柱温:30 ℃。以细胞色素C(MW 12500)、杆菌酶(MW 1450)、乙氨酸-乙氨酸-酪氨酸-精氨酸(MW 451)和乙氨酸-乙氨酸-乙氨酸(MW 189) 为相对分子质量标准品,做相对分子量标准曲线。
2.5 河蚬多肽的氨基酸组成分分析
河蚬多肽的氨基酸组成:采用氨基酸自动分析仪法;准确称取河蚬多肽0.5 g置入水解管中,加入15 mL浓度为6 mol/L的HCl,真空封口后放在110 ℃的恒温干燥箱内水解24 h,待冷却后,定容至25 mL,吸取滤液100 μL 在 40 ℃的真空干燥器中进行干燥,最后用0.2 mol/L HCl定容至1 mL。采用氨基酸分析仪测定河蚬多肽除色氨酸以外的氨基酸含量。
2.6 河蚬多肽的抗氧化性质
2.6.1 河蚬多肽对DPPH自由基的清除率[16]
DPPH自由基是一种较稳定的自由基,它已被广泛应用于抗氧化剂清除自由基活性的评价中[17,18]。DPPH溶解在乙醇中呈深紫色,在可见光区517 nm处有最大吸收峰,将河蚬多肽配制成1,2,3,4,5 mg/mL的溶液,取 2 mL多肽溶液于试管中再加入2 mL的DPPH溶液(0.1 mmol/L,0.004%,W/W),轻轻振荡,使充分混匀,在避光环境下反应30 min,用分光光度计于517 nm下测定吸光度值。
式中:以水代替河蚬多肽溶液、无水乙醇代替DPPH溶液做空白试验;A1为样品实验的吸光值;A0为对照实验的吸光值(以水代替河蚬多肽溶液);A2为样品干扰实验的吸光值(以无水乙醇代替DPPH溶液)。
2.6.2 羟基自由基清除活性的测定[19,20]
羟基自由基清除活性的测定用邻二氮菲-Fe2+氧化法检测。H2O2与二价铁离子发生Fenton反应生成·OH,·OH把体系中邻二氮菲-Fe2+氧化成邻二氮菲-Fe3+,在536 nm处的最大吸收峰减弱,当体系中存在抗氧化剂时,可使此氧化反应受抑制,从而通过紫外-可见分光光度计测定加入抗氧化剂前后吸光度变化,计算自由基清除率。在10 mL试管中依次加入邻二氮菲(5 mmol/L)1.0 mL,PBS缓冲液(0.2 mol/L,pH 7.4)2.0 mL,河蚬多肽溶液(6,8,10,12,14,16,18,20 mg/mL),H2O2(0.1%,V/V)1.0 mL,37 ℃水浴1 h。用紫外-可见分光光度计在536 nm处测定加入抗氧化剂前后吸光度变化,计算自由基清除率。羟基自由基清除活性的计算如下:
式中:A1为样品的吸光度值;A0为空白对照,用双蒸水代替样品;A2为干扰试验,用双蒸水代替除样品以外的物质。
2.6.3 铁离子还原力(FRAP)的测定[21,22]
FRAP溶液的配制:将醋酸盐缓冲液(0.3 mol/L,pH 3.7)、氯化铁溶液(0.02 mol/L)和三吡啶吖嗪(TPTZ)溶液(0.01 mol/L,用0.04 mol/L的盐酸溶液配制),以10∶1∶1的体积比混匀。
FeSO4标准曲线的绘制:取0,0.05,0.10,0.15,0.20,0.25,0.30 mL FeSO4溶液 (1.0 mol/L)于7支试管中,分别加水至1.0 mL,再分别加入5.0 mL FRAP试剂,摇匀,37 ℃水浴10 min,用分光光度计在593 nm处测吸光值。以FeSO4的μmoL数为横坐标,吸光值为纵坐标,绘制FeSO4标准曲线。
样品的测定:取1 mL样品于试管中,加入5 mL FRAP试剂,摇匀于37 ℃下水浴10 min,用分光光度计测593 nm处的吸光值。以蒸馏水代替河蚬多肽溶液做空白试验;以蒸馏水代替氯化铁溶液做干扰实验吸光值记作A2;样品的吸光值为A1;样品抗氧化能力(FRAP值)是以每毫克样品达到相同吸光度(A1-A2)所需FeSO4的μmol数表示。
2.6.4 超氧阴离子自由基清除活性的测定[23,24]
表1 超氧阴离子自由基清除活性测定加样表
Table 1 The scavenging capacity of super oxideygen anion free radical

Tris-HCl蒸馏水10mmol/LHCl邻苯三酚总体积空白试验4.54.20.39对照试验4.54.20.39样品4.54.20.39
采用邻苯三酚自氧化法测定超氧阴离子清除活性。配制不同浓度的河蚬多肽溶液,按表1加入样品和试剂,迅速摇匀后倒入比色皿中,用分光光度计在420 nm处测定1次吸光值,每隔30 s测定1次5 min后停止,计算邻苯三酚的自氧化速率,根据邻苯三酚的自氧化速率计算抑制率,用下式计算清除超氧阴离子活性(scavenging activity, SA):
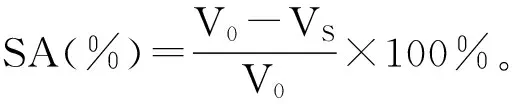
式中:V0为对照管吸光度值随时间的变化率;VS为样品管吸光度值随时间的变化率;pH为8.2 Tri-HCl缓冲液(0.1 mol/L)用2 mmol/L EDTA配制;邻苯三酚(60 mmol/L)用10 mmol/L HCl配制。
2.7 数据处理
采用SPSS 13.0软件对数据进行统计分析,各试验平行3次。
3 结果与讨论
3.1 河蚬多肽的基础成分
河蚬多肽的化学成分见表2。

表2 河蚬多肽的化学成分Table 2 The chemical composition of Corbicula fluminea polypeptide g/100 g
3.2 河蚬多肽理化性质
3.2.1 河蚬多肽的起泡性及泡沫稳定性
起泡性是蛋白质和多肽的重要功能性质之一,相对分子质量高的肽或者部分水解蛋白具有较好的成膜粘附性[25]。蛋白质起泡方法的测定是在有大量气体存在时搅打蛋白溶液,搅打能产生较为激烈的机械应力和剪切作用,使蛋白质分散液在气水界面处的表面张力降低,其重叠的分子部分展开,气体被卷入液体并滞留从而形成泡沫并分散均匀[26]。影响起泡能力的因素主要有蛋白质分子结构、浓度、温度、pH 值、离子强度、搅打时间和强度,以及蛋白质-蛋白质复合物在水-空气界面的相互作用等[27]。
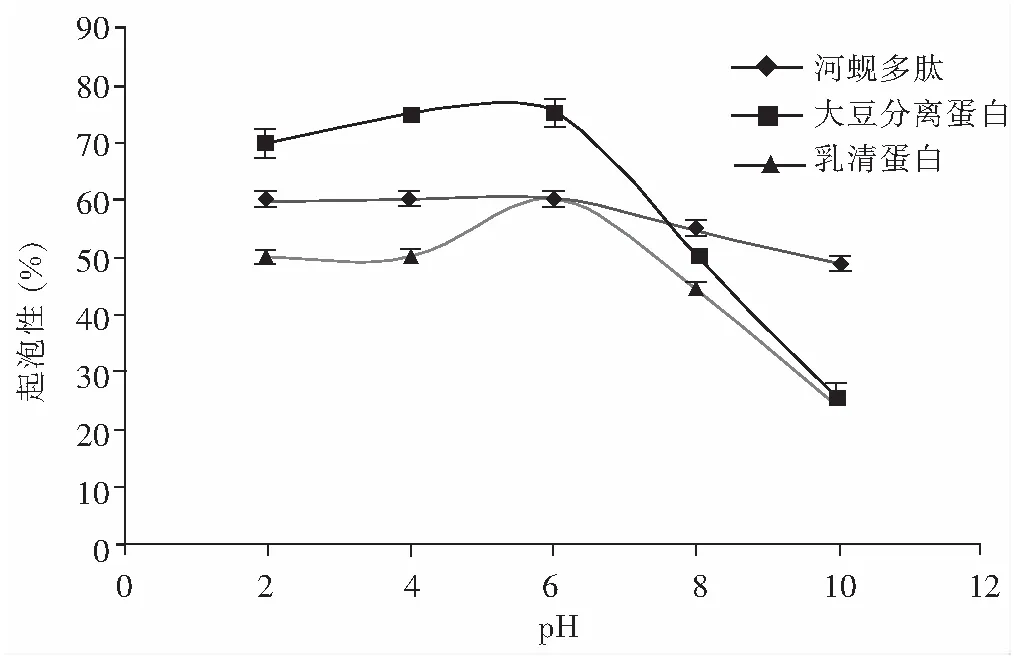
图1 河蚬多肽的起泡性Fig.1 The foaming capacity of Corbicula fluminea polypeptide
由图1可知,河蚬多肽、大豆分离蛋白、乳清蛋白的起泡性是随pH值的增大呈下降趋势。影响泡沫稳定性的因素主要有蛋白膜压力、连续相之间的粘弹性和界面张力[28]。水在重力条件下具有流动性、泡沫之间气体扩散会导致气体不均衡,这是泡沫不稳定的主要因素[29,30]。3种蛋白的起泡稳定性见图2,随着放置时间延长,泡沫迅速减少,到一定程度后趋于稳定。
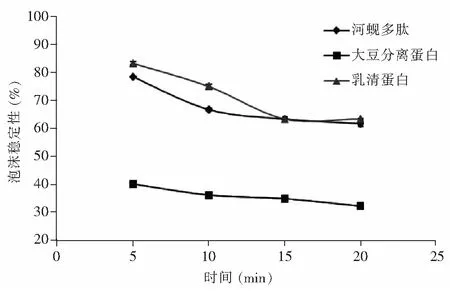
图2 河蚬多肽的泡沫稳定性Fig.2 The foaming stability of Corbicula fluminea polypeptide
3.2.2 河蚬多肽的溶解性
不同pH 值下河蚬多肽的溶解性见图3。
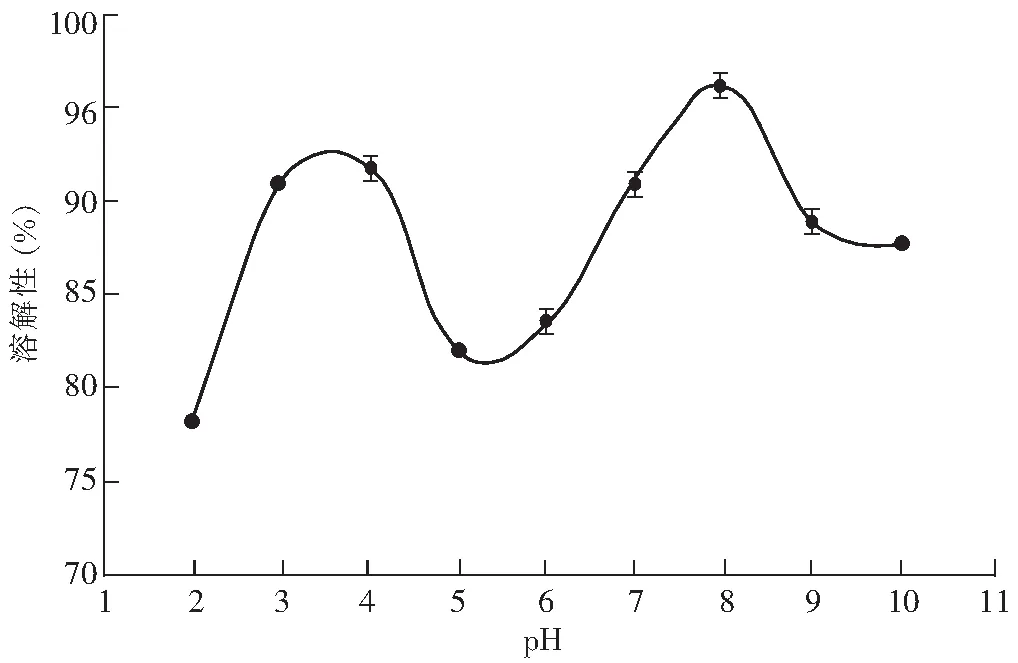
图3 河蚬多肽在不同 pH 下的溶解性Fig.3 The solubility of Corbicula fluminea polypeptide in different pH values
根据蛋白质在等电点处溶解性最低的原理,通过测蛋白质的溶解性来测定样品的等电点。由图3可知,在 pH 2.0~10.0 范围内,河蚬多肽在pH值为5~6之间,溶解性呈现出 U 形,达到最低点。在pH值<3和>8时,河蚬多肽的溶解性都有所下降,是因为蛋白质在等电点处呈电中性,分子之间缺少静电排斥力,疏水相互作用导致河蚬蛋白大部分聚集和沉淀,表现为溶解性降低。
3.2.3 河蚬多肽的热稳定性
由于蛋白质具有不耐热的特性,在一定程度上限制了它们的应用,蛋白质水解为多肽后其分子量变小,溶解度增大,热稳定性也相应增大。河蚬多肽在不同pH值、不同温度下加热一定时间的稳定性情况见图4。
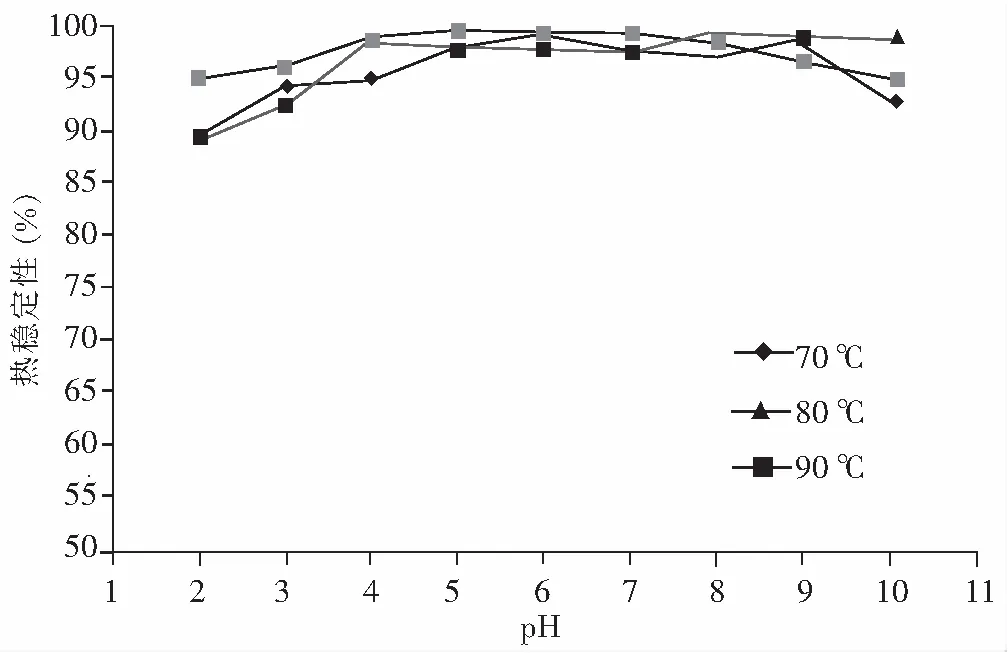
图4 河蚬多肽在不同 pH 下的热稳定性Fig.4 The thermostability of Corbicula fluminea polypeptide in different pH values
由图4可知,在较宽的pH值范围内,随着加热温度的升高,河蚬多肽均具有良好的溶解性,在较低的pH值条件下,溶解度略微下降,但在中性及碱性条件下其溶解性基本上可以得到保持,即便有很少的、细小的聚集物产生,但这些聚集物仍然能够保持可溶状态。
3.2.4 河蚬多肽的吸油能力

表3 河蚬多肽的吸油能力Table 3 OAC of Corbicula fluminea polypeptide g/g
由表3可知,河蚬多肽具有较好的吸油能力,其吸油能力远大于大豆分离蛋白和乳清蛋白。多肽具有的良好吸油性使它能广泛用于高油食品中,使产品组织细腻、口感好,同时又能提高经济价值。
3.2.5 河蚬多肽相对分子质量
在TSKgel 2000 SWXL(300 nm×7.8 mm)色谱柱上,以乙醇/水/氯乙酸(450∶550∶1)为流动相, 以细胞色素C(MW 12500 U)、抑肽酶(MW 6500 U)、杆菌酶(MW 1450 U) 、乙氨酸-乙氨酸-酪氨酸-精氨酸(MW 451 U)和乙氨酸-乙氨酸-乙氨酸(MW 189 U)为相对分子质量标准品。回归方程为log MW=6.98e+000-2.42e-001 T^1,相关系数r=0.997589。表明相对分子质量对数与各标样的洗脱时间呈很好的线性关系,可以准确地测定河蚬多肽的相对分子质量分布范围。
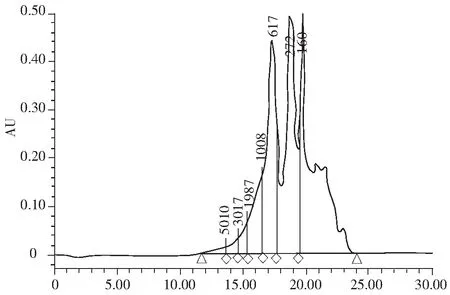
图5 河蚬多肽的相对分子质量分布图谱Fig.5 Molecular weight distribution of Corbiculafluminea polypeptide
注:色谱柱为TSKgel 2000 SWXL 300 nm×7.8 mm;流动相体积比为乙醇+水+氯乙酸=450+550+1;检测波长为220 nm;流量为0.5 mL/min;柱温为30 ℃。
表4 河蚬多肽的分子量分布
Table 4 Molecular weight distribution ofCorbiculaflumineapolypeptide
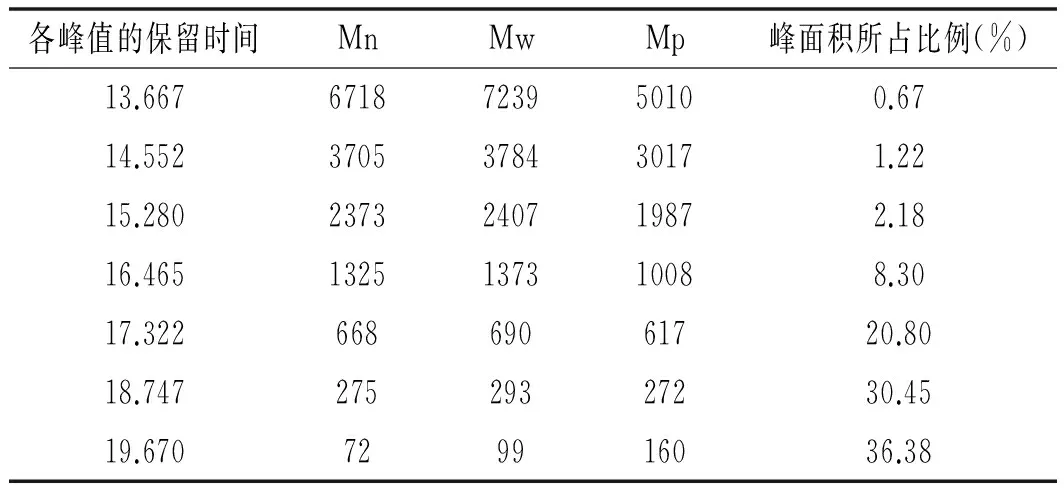
各峰值的保留时间MnMwMp峰面积所占比例(%)13.6676718723950100.6714.5523705378430171.2215.2802373240719872.1816.4651325137310088.3017.32266869061720.8018.74727529327230.4519.670729916036.38
由图5和表4可知,河蚬多肽有多种不同相对分子质量的组分,河蚬多肽的数均相对分子质量Mn为72的肽含量最多,约占36.38%。
3.3 河蚬多肽的营养评价
平共处河蚬多肽的氨基酸组成见表5。
表5 河蚬多肽的氨基酸组成
Table 5 Amino acid composition ofCorbiculaflumineapolypeptide
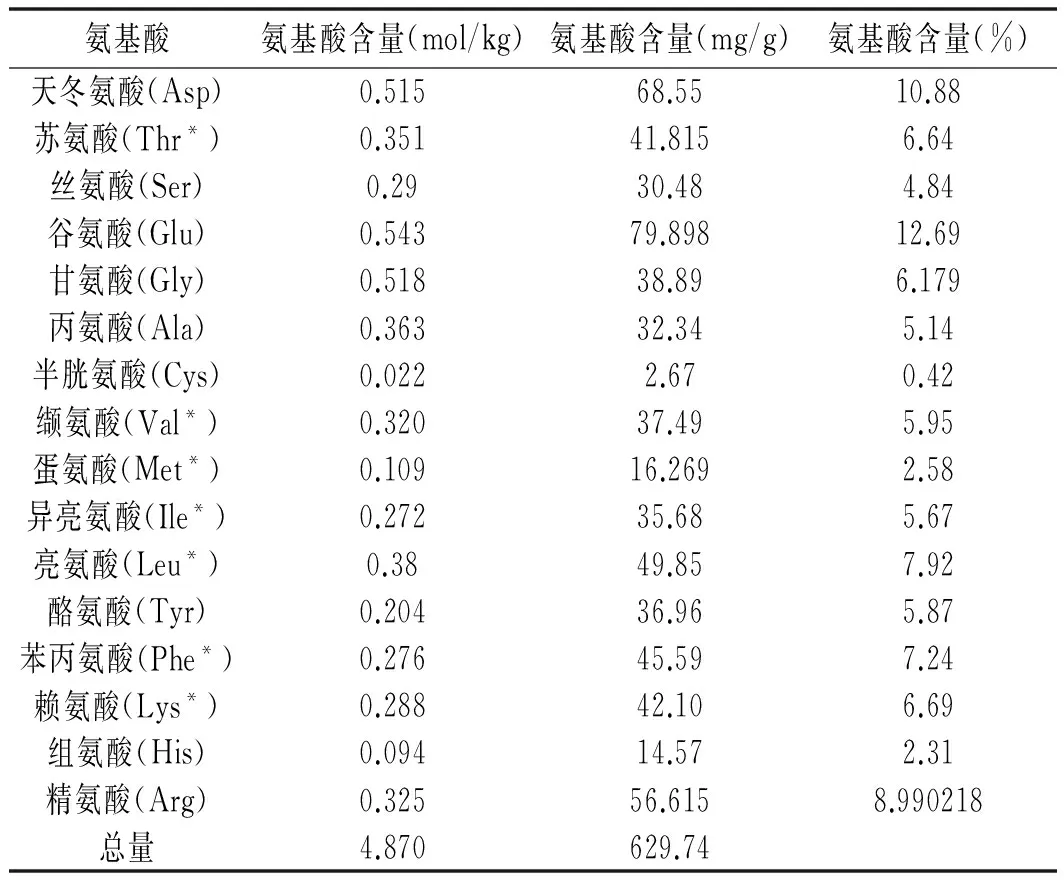
氨基酸氨基酸含量(mol/kg)氨基酸含量(mg/g)氨基酸含量(%)天冬氨酸(Asp)0.51568.5510.88苏氨酸(Thr*)0.35141.8156.64丝氨酸(Ser)0.2930.484.84谷氨酸(Glu)0.54379.89812.69甘氨酸(Gly)0.51838.896.179丙氨酸(Ala)0.36332.345.14半胱氨酸(Cys)0.0222.670.42缬氨酸(Val*)0.32037.495.95蛋氨酸(Met*)0.10916.2692.58异亮氨酸(Ile*)0.27235.685.67亮氨酸(Leu*)0.3849.857.92酪氨酸(Tyr)0.20436.965.87苯丙氨酸(Phe*)0.27645.597.24赖氨酸(Lys*)0.28842.106.69组氨酸(His)0.09414.572.31精氨酸(Arg)0.32556.6158.990218总量4.870629.74
注:“*”为必需氨基酸。
由表5可知,河蚬多肽中必需氨基酸含量较高,占总氨基酸含量的42.69%(除色氨酸以外)。河蚬多肽中谷氨酸含量最多,占总氨基酸含量的12.69%,河蚬多肽体系中的呈味氨基酸(天冬氨酸(Asp)、谷氨酸(Glu)、甘氨酸(Gly)、丙氨酸(Ala)含量较高,占总氨基酸含量的34.88%,这说明河蚬多肽具有很好的鲜味,适合用于开发风味调料、调味品等。此外,河蚬多肽还含有促进婴儿生长发育的组氨酸和精氨酸,含量分别占氨基酸总量的2.31%和8.99%。
3.4 河蚬多肽的抗氧化性质
3.4.1 不同浓度河蚬多肽对DPPH·的清除率
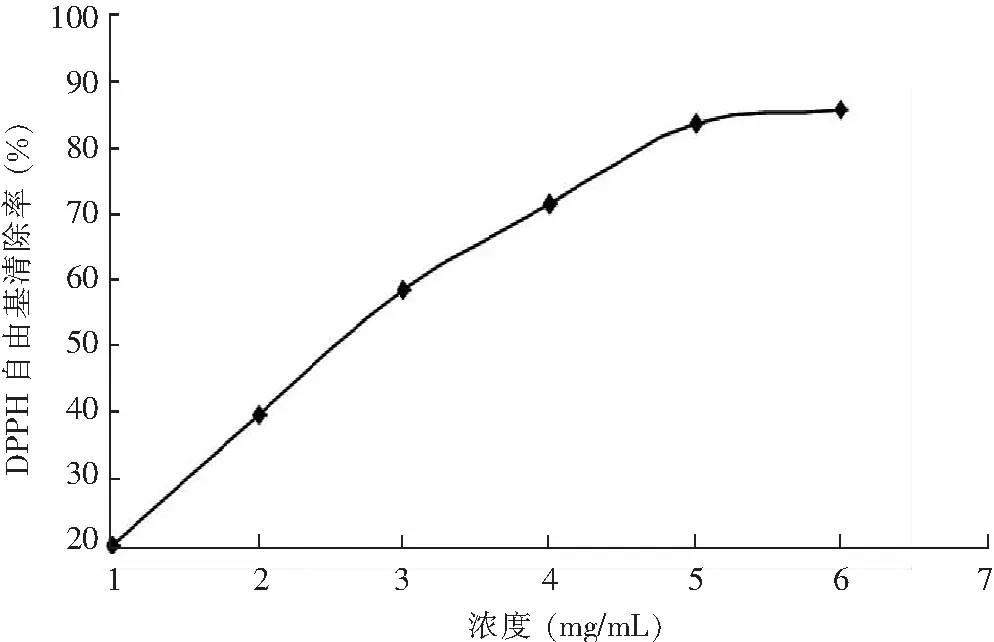
图6 不同浓度河蚬多肽对DPPH自由基的清除作用Fig.6 DPPH free radical scavenging effect of Corbicula fluminea polypeptide
由图6可知,河蚬多肽对DPPH·的清除率,随着多肽浓度由1~4 mg/mL增加呈上升趋势;当多肽浓度达到5 mg/mL后,浓度的增加对DPPH·的清除率影响缓慢。河蚬多肽对DPPH·清除率的IC50=2.55 mg/mL。IC50表示待测物质对测试自由基的半数清除浓度,IC50值越小,则表明待测抗氧化剂的自由基清除能力越大,其抗氧化活性也越强。游丽君[31]研究了泥鳅多肽清除 DPPH·的 IC50值为2.64 mg/mL。多肽清除DPPH·的机理是肽自由基作为供氢体给自由基形成稳定的自由基中间体,从而终止了自由基的链式反应[32]。清除自由基能力的大小与蛋白水解后多肽中氨基酸的组成有关,含有较多疏水性氨基酸的蛋白水解物或多肽具有更强的清除自由基能力[33]。
3.4.2 不同浓度河蚬多肽对羟自由基的清除率
·OH是进攻性最强的化学物质之一,·OH的反应十分短暂,有非常高的速度常数[34]。·OH可降解 DNA、细胞膜和多糖类化合物,威胁生物体健康[35]。抗氧化剂清除·OH的机理是有效抑制经 Fenton 反应后·OH 的产生[36]。由于 Fenton 反应产生·OH 需要 Fe2+的参与,因此具有螯合金属能力的物质可以延缓·OH的产生。
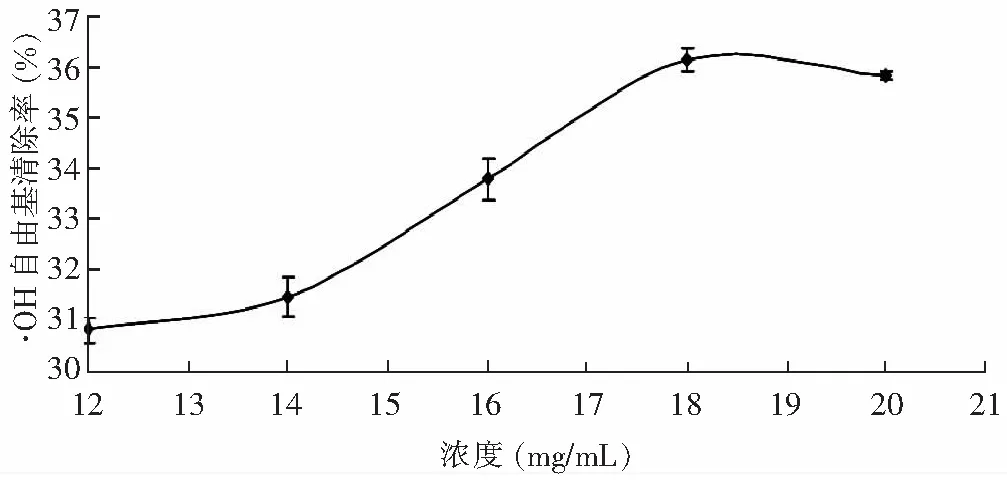
图7 不同浓度河蚬多肽对·OH的清除作用Fig.7 Scavenging effect of Corbicula fluminea polypeptide on·OH
由图7可知,河蚬多肽对·OH的清除能力随浓度的增大而增大,当浓度达到18 mg/mL时,清除率达到最大值,为36.12%,之后再增大浓度,对·OH的清除率无显著影响。
3.4.3 河蚬多肽对铁离子的还原力
不同浓度的河蚬多肽对铁离子的还原力见图8,吸光值越高,河蚬多肽对铁离子的还原力就越强。
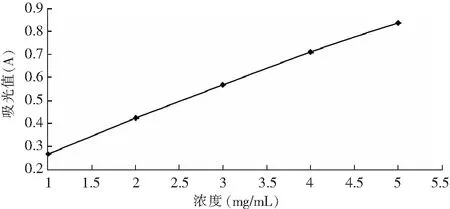
图8 不同浓度河蚬多肽的还原力Fig.8 Reducing activity of Corbicula Fluminea polypeptide
由图8可知,随着河蚬多肽浓度的增大,对铁离子的还原力也逐渐增大,有明显的线性关系,相关系数为0.9988。河蚬多肽的铁离子还原力FRAP值为95.52 μmol/mg。
3.4.4 河蚬多肽对超氧阴离子的清除率
不同浓度河蚬多肽对超氧阴离子的清除率见图9。
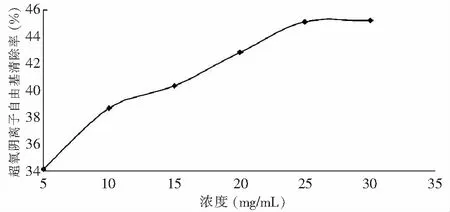
图9 不同浓度河蚬多肽对O2-·的清除作用Fig.9 Scavenging effect of Corbicula fluminea polypeptide on superoxide anion radical
河蚬多肽对超氧阴离子的清除率与浓度在一定范围内呈正相关,在5~25 mg/mL范围内对超氧阴离子的清除率随浓度的增大不断增大,在多肽浓度为25 mg/mL时的清除率最高为45.13%,之后多肽浓度继续增大,清除率增加缓慢。
4 结论
河蚬多肽具有较好的起泡性、溶解性和热稳定性;河蚬多肽具有良好的吸油性。
河蚬多肽的相对分子质量集中在70~2000 Da范围内(占95%以上),其中数均相对分子质量为72的肽含量最多,占36.38%;河蚬多肽中必需氨基酸含量较高,占42.69%,呈味氨基酸含量为34.88%;此外,河蚬多肽还含有促进婴儿生长发育的组氨酸和精氨酸。
河蚬多肽具有较强的清除DPPH自由基活性,IC50=2.55 mg/mL;河蚬多肽具有较强的铁离子还原力,河蚬多肽的铁离子还原力FRAP值为95.52 μmol/mg;河蚬多肽对羟基自由基和超氧阴离子的清除活性较弱。
[1]梁拥军,孙向军,杨璞,等.罗非鱼鱼皮胶原蛋白多肽的制备及其理化性质研究[J].安徽农业科学,2009,37(4):1588-1590.
[2]Bautista Teruel M N, Fermin A C, Koshio S S. Diet development and evaluation for juvenilefor juvenile abalone, haliotis asinine: animal plant protein sources[J].Aquaculture,2003,219:645-653.
[3]王素雅,刘长鹏,吴珊,等.酶法制备河蚌功能性产品[J].食品科学,2007,28(9):298-302.
[4]白仁奥,马英,何传波,等.文蛤蛋白酶解条件的优化及酶解产物体外抗氧化活性的分析[J].中国农学通报,2013,29(11):44-49.
[5]吕振磊,刘朝龙,王雨生,等.响应面法优化紫贻贝蛋白酶解工艺条件[J].食品科学,2012,33(10):61-66.
[6]林海生,曹文红,章超桦,等.牡蛎蛋白酶解物的制备及其抗氧化活性研究[J].食品工业科技,2013,34(16):163-168.
[7]穆姣姣,赵前程,李建伟,等.风味酶辅助下蛤蛋白酶解物自由基清除能力研究[J].食品科技,2011,36(9):50-54.
[8]蒲利民,吴晓萍,王涛,等.蛋白酶水解马氏珠母贝肉对镉解离效果的研究[J].食品与机械,2013,29(1):66-71.
[9]刘晶晶,顾云,黄婷,等.洪泽湖野生河蚬抗氧化肽酶解工艺及清除自由基能力的研究[J].食品工业科技,2013,34(7):165-168.
[10]金文刚.虾夷扇贝生殖腺水解物及其衍生物的功能特性研究[D].杨凌:西北农林科技大学,2013.
[11]孙协军,李秀霞,蔡路昀,等.鲅鱼蛋白水解产物功能性质分析[J].食品工业科技,2015,36(6):179-184,189.
[12]姜云庆.鸡蛋清蛋白酶水解物的制备及其功能性质的研究[D].哈尔滨:东北农业大学,2001.
[13]Hammershoj M, Qvist K B. Importance of hen age and egg storage time for egg albumen foaming[J].Leben smittel Wissenschaft Technologie,2001,34:118-120.
[14]毛晓英,华欲飞.不同提取工艺制备的核桃蛋白的组成与结构特征[J].江苏大学学报(自然科学版),2011,32(6):631-635.
[15]聂丽洁.杂豆粉及杂豆蛋白的功能性质研究[D].杨凌:西北农林科技大学,2013.
[16]Hu F, Lu R,Huang B, et al. Free radiceal scavenging activity of extracts prepared from fresh leaves of selected Chinese medicinal plants[J].Fitoterapia, 2004,75(1):24-23.
[17]Ursp M L, Clarkson P M. Oxidative stress exercise and antioxidant supplementation[J].Toxicology,2003,189:41-45.
[18]Akinmoladun A C, Ibukun E O,Dan-ologe I A.phytochemical constituents and antioxidant properties of extracts from the leaves of Chromolaena odorata[J].Sci Res Essays,2007,2(6):191-194.
[19]Yuan Y V, Bone D E, Carrington M F.Antioxidant activity of dulse (Palmariapalmata) extract evaluated in vitro[J].Food Chemistry,2005,91(3):485-494.
[20]Li Xiaolan, Zhou Aiguo, Han Yong. Anti-oxidation and anti-microorganism activities of purification polysaccharide fromLygodiumjaponicumin viltro[J].Carbohydrate Polymers,2006,66(l):34-42.
[21]Wei Qin, Ma Xihan,Zhao Xihan, et al. Antioxidant activities and chemical profiles of pyroligneous acids from walnut shell[J].Journal of Analytical and Applied Pyrolysis,2010,88(2):149-154.
[22]田蔚.米渣霉菌发酵产物分离鉴定及抗氧化活性研究[D].长沙:湖南农业大学,2012.
[23]高亚妮,田呈瑞,康宇新,等.超声波提取花椒皮总黄酮工艺及其抗氧化性研究[J].食品科学,2012,33(18):77-82.
[24]Benzie I F F, Strain J J. The ferric reducing ability of plasma (FRAP) as a measure of “antioxidant power”: the FRAP assay[J].Analytical Bioehemistry,1996,239(l):70-76.
[25]Kong X, Zhou H, Qian H.Enzymatic preparation and functional properties of wheat gluten hydrolysates[J].Food Chemistry,2007,101(2):615-620.
[26]张敏,周梅,王长远.米糠4种蛋白质的提取与功能性质[J].食品科学,2013,34(1):18-21.
[27]Adebowale K O, Lawal O S.Comparative study of the functional properties of bambarra groundnut(Voandzeiasubterranean), jack bean (Canavaliaensiformis) and mucuna bean (Mucunapruriens) flours[J].Food Research International, 2004(37):355-360.
[28]王晓飞,闵伟红,朱运明,等.长白山核桃球蛋白的提取、分离纯化及其功能性质研究[J].现代食品科技,2015,40(4):234-241.
[29]朱艳华.玉米多肽的制备、理化性质及生物活性的研究[D].武汉:华中农业大学,2007.
[30]Moro A, Báez G D, Ballerini G A, et al. Emulsifying and foaming properties of β-lactoglobulin modified by heat treatment[J].Food Research International,2013,51(1):1-7.
[31]游丽君.泥鳅蛋白抗氧化肽的分离纯化及抗疲劳、抗癌功效研究[D].广州:华南理工大学,2010.
[32]Khantaphant S, Benjakul S. Comparative study on the proteases from fish pyloric caeca and the use for production of gelatin hydrolysate with antioxidative activity[J].Comp Biochem Physiol,2008,151 B:410-419.
[33]Rajapakse N, Mendis E, Byun H G, et al. Kim SK purification and in vitro antioxidative effects of giant squid muscle peptides on free radical-mediated oxidative systemssystems[J].J Nutr Biochem,2005,16:562-569.
[34]李琳.鳙鱼蛋白控制酶解及酶解物抗氧化研究[D].广州:华南理工大学,2006.
[35]张淼.夏枯草提取物抗氧化活性研究[D].杨凌:西北农林科技大学,2012.
[36]Roginsky V, Lissi E A.Review of methods to determine chain breaking antioxidant activity in food[J].Food Chem,2005,92:235-254.
Physicochemical Property and Antioxidant Activity of Corbiculafluminea Polypeptide
YANG Yu-luan1, CHEN Li-li1, DU Yu-qian2, ZHAO Li1*, YUAN Mei-lan1, BAI Chun-qing1
(1.College of Life Science, Jiangxi Science and Technology Normal University, National R & D Branch Centre for Freshwater Fish Processing Technology, Nanchang 330013, China; 2.Nanchang Food and Cosmetics Supervision Institute, Nanchang 330038, China)
The functional properties and antioxidant activity ofCorbiculaflumineapolypeptide are studied. TheCorbiculaflumineapolypeptide has good foaming ability,protein solubility, thermostability and oil absorption.The relative molecule weight ofCorbiculaflumineapolypeptide is in the range of 70~2000 Da, the peptides with the number-average molecular weight about 72 are the most, accounting for 36.38%. The content of essential amino acids and flavor amino acids is high, accounting for 42.69%, 34.88% respectively. The activity of scavenging DPPH (IC50=2.55 mg/mL) and iron reduction capability (FRAP=95.52 μmol/mg) is stronger than superoxide anion free radical and hydroxyl radical.
Corbiculafluminea; polypeptide; physicochemical property; antioxidant activity
2016-06-14 *通讯作者
南昌市农业科技支撑计划项目(洪财企[2012]80号);江西省现代农业产业技术体系建设专项资金资助项目
杨玉娈(1989-),女,硕士,研究方向:食品化学;
赵利(1967-),女,教授,博士,研究方向:食品化学。
TS254.1
A
10.3969/j.issn.1000-9973.2016.12.013
1000-9973(2016)12-0059-08

