内蒙古西部赤霞珠葡萄自然发酵酵母菌群的动态变化
王凤梅++马利兵


摘要:在无菌条件下,对内蒙古西部地区赤霞珠葡萄汁进行自然发酵,分别在发酵初、中、后期分离酵母菌株,采用WL营养琼脂对其进行形态学分类,采用基于酵母5.8S rRNA-ITS区域的RFLP(restriction fragment length polymorphism)分析对分类酵母菌株进行分子生物学鉴定,统计不同发酵时期发酵液中酵母菌株的种类及数量。结果表明,分离到的327株酵母菌分属于5个属的5个酵母菌种,分别是酿酒酵母(Saccharomyces cerevisiae)、东方伊萨酵母(Issatchenkia orientalis)、克鲁维毕赤氏酵母(Pichia kluyveri)、浅黄隐球酵母(Cryptococcus flavescens)及葡萄汁有孢汉逊酵母(Hanseniaspora uvarum);自然发酵初期,葡萄汁有孢汉逊酵母、克鲁维毕赤氏酵母的数量占据优势,分别占分离总菌株数的64.22%、17.43%;随着发酵进行,非酿酒酵母(non-Saccharomyces)菌株的数量有所减少,酿酒酵母的数量逐渐增加,至发酵后期,发酵液中仅能检测到酿酒酵母的存在。这表明内蒙古西部地区野生酵母菌种较为丰富,WL营养琼脂形态学分类法结合酵母5.8S rRNA-ITS区域的RFLP分析能够快速分类、鉴定野生酵母菌种,实时监测发酵液中酵母菌群的动态变化趋势。
关键词:葡萄酒;酵母;赤霞珠;WL营养琼脂;动态变化
中图分类号: S182;TS262.61文献标志码: A文章编号:1002-1302(2016)10-0340-04
收稿日期:2015-08-03
基金项目:国家自然科学基金(编号:31160245)。
作者简介:王凤梅(1975—),女,河北定县人,硕士,副教授,主要从事发酵微生物研究。E-mail:maywfm@126.com。
通信作者:马利兵,博士,教授,主要从事细胞工程及基因工程研究。E-mail:mlb-xn2004@163.com。葡萄表面、葡萄园土壤、葡萄酒厂乃至酿酒设备上存在着大量与葡萄酒发酵有关的天然酵母菌种[1]。在这些酵母菌种中,酵母属(Saccharomyces)在发酵过程中起主要作用,发酵力较强,产酒精多,产生的有益副产物多;而非酵母属(non-Saccharomyces)在葡萄汁中数量较多,能启动发酵,但其发酵力相对较弱[2]。在传统的葡萄及葡萄酒产区,一些天然酵母菌种在每年生长、繁殖过程中逐渐适应了当地的气候及土壤条件,并与当地葡萄品种形成良好的共生关系,再经自然选择作用形成适应于不同类型葡萄酒的酵母菌系[3]。对天然酵母种群的研究报道表明,绝大多数情况下,葡萄品种、地理位置及气候条件等会影响天然酵母的菌群及其数量[4]。
内蒙古西部地区属中温带半干旱大陆性气候,干旱少雨,日照充足,昼夜温差大,有效积温高,是我国优质的酿酒葡萄产区。本研究采用WL营养琼脂形态学分类法,结合酵母 5.8S rRNA-ITS区域的RFLP(restriction fragment length polymorphism)分析,对内蒙古西部地区赤霞珠葡萄中的酵母菌种进行分类、鉴定,确定该地区天然酵母菌群的种类,探究自然发酵过程中天然酵母菌群的动态变化趋势,为该地区葡萄酒发酵工艺控制及后续优良酿酒酵母筛选提供理论及技术依据。
1材料与方法
1.1菌种分离
1.1.1培养基YPD培养基(yeast extract peptone dextrose medium)[5]:酵母浸粉1%、蛋白胨2%、葡萄糖2%,固体培养基中需添加2%琼脂、0.01%氯霉素。WL琼脂培养基(wallerstein laboratory nutrient agar)配方[6]:酵母浸粉0.4%、胰蛋白胨0.5%、葡萄糖5%、琼脂2%、磷酸二氢钾0.055%、氯化钾0.042 5%、氯化钙0.012 5%、硫酸镁0.012 5%、氯化铁0.000 25%、硫酸锰0.000 25%、溴钾酚绿0.002 2%,pH值为5.5。
1.1.2自然发酵过程中酵母的分离赤霞珠来源于内蒙古西部阿拉善盟酿酒葡萄产区,选取成熟的赤霞珠果粒,无菌条件下破碎,转入1 L的无菌玻璃容器内,室温下进行自然发酵;分别在自然发酵前期(瓶底部有少量气泡产生,发酵启动)、中期(大量气泡上升,发酵旺盛)及后期(无明显气泡上升,发酵消退期)取发酵液,经梯度稀释,涂布于YPD平板上,28 ℃培养3 d;结合菌落颜色及形态挑取菌落,对挑取的单个菌落以划线方式在YPD平板上进一步分离、纯化。
1.2分离菌种的形态学分类
将各时期分离的酵母菌株划线接种于WL培养基上,28 ℃ 培养5 d,观察记录菌落的颜色、形态,并对其进行分类,统计不同发酵时期不同酵母菌株的数量。
1.3酵母菌种的分子生物学鉴定
对经形态学鉴定的酵母菌种,参照Esteve-Zarzoso等的方法[7-8],进一步进行5.8S rRNA-ITS区域RFLP分析。采用天根生化科技(北京)有限公司生产的酵母基因组提取试剂盒,按试剂盒说明书提取酵母菌的基因组DNA,-20 ℃冻存、备用;采用由生工生物工程(上海)股份有限公司合成的引物ITS1:5′-TCCGTAGGTGAACCTGCGG-3′和ITS4:5′-TCCTCCGCTTATTGATATGC-3′对不同酵母菌株的 5.8S rRNA-ITS区域进行PCR扩增。PCR反应体系为:模板DNA 1 μL,10 μmol/L上、下游引物各1 μL,10×PCR buffer 5 μL、2.5 U/μL Taq DNA聚合酶1 μL,dNTP混合液1 μL,超纯水40 μL。反应条件为:95 ℃预变性5 min;95 ℃变性 1 min,55 ℃ 退火2 min,72 ℃延伸2 min,共35个循环;72 ℃延伸10 min。PCR扩增产物分别采用由宝生物(大连)有限公司生产的限制性核酸内切酶HinfⅠ、HaeⅢ及HhaⅠ于37 ℃条件下酶切16 h,酶切反应体系为:PCR扩增产物10 μL,10×buffer 2 μL,限制性核酸内切酶2 μL,超纯水6 μL。酶切产物经1%琼脂糖凝胶电泳、溴化乙锭染色,在凝胶成像分析仪下观察并摄影。
2结果与分析
2.1WL培养基上酵母菌株的聚类分析
从赤霞珠自然发酵的葡萄汁中共分离、纯化出327株酵母菌,将所有菌株划线接种于WL培养基上继续进行培养,观察酵母菌株在WL培养基上的菌落颜色及形态。根据不同酵母菌种在WL培养基上呈现的不同菌落颜色及形态(图1、表1),将分离纯化的327株酵母菌分为5类。
2.2酵母5.8S rRNA-ITS区域的RFLP分析
分别提取5种类型酵母菌的基因组DNA,以ITS1/ITS4为引物对其5.8S rRNA-ITS区域进行PCR扩增,扩增产物分别用Hif、HaeⅢ及HhaⅠ进行酶切,经凝胶电泳检测,共有5种不同的酶切类型,见图2、表2。通过与Esteve-Zarzoso等研究结果[7-10]进行比对分析,确定Ⅰ至Ⅴ类型酵母菌种分别为酿酒酵母(Saccharomyces cerevisiae)、东方伊萨酵母(Issatchenkia orientalis)、克鲁维毕赤酵母(Pichia kluyveri)、浅黄隐球酵母(Cryptococcus flavescens)和葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)。
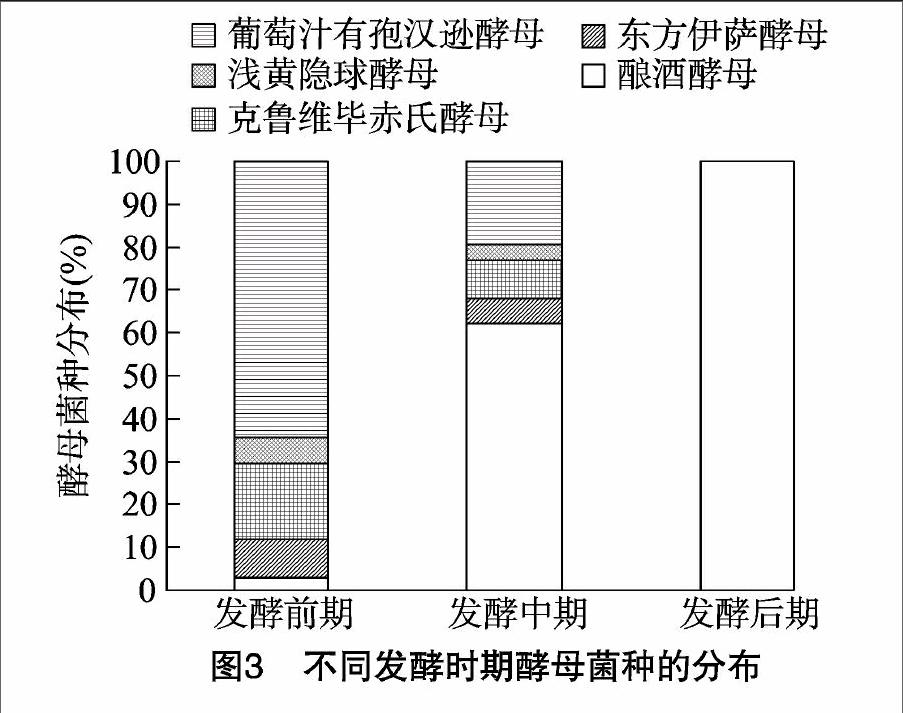
2.3不同发酵时期酵母菌的种群分布
由图3可见,不同发酵时期的发酵液中,不同酵母菌种的分布存在很大差异;发酵前期,分离到的菌株为酿酒酵母、东方伊萨酵母、克鲁维毕赤氏酵母、浅黄隐球酵母和葡萄汁有孢汉逊酵母,分别占分离总菌株的2.75%、9.17%、17.43%、6.42%、64.22%,葡萄汁有孢汉逊酵母是这一时期的优势酵母菌,其次是克鲁维毕赤酵母,酿酒酵母、东方伊萨酵母及浅黄隐球酵母检出量相对较少;发酵中期,发酵液中葡萄汁有孢汉逊酵母的数量锐减,其他非酿酒酵母的数量也有所减少,而酿酒酵母随发酵的进行逐渐占据优势地位;发酵后期,发酵液中仅能检测到酿酒酵母的存在。
3结论与讨论
酵母菌普遍存在于葡萄果实、叶片、根系以及葡萄园土壤颗粒中,葡萄果实表面是各种酵母菌的天然栖息地,其上分布的酵母菌数量尤为可观。葡萄汁在发酵过程中,酵母菌群种类及其数量处于动态变化中,不同酵母菌群有规律地此消彼长,发酵力强的酿酒酵母比例会逐渐上升,发酵力弱的酵母比例会迅速下降。近些年,有关葡萄发酵过程中酵母菌群的动态变化国内外已做了大量研究与报道,结果表明,在葡萄浆果表面占主导地位的酵母主要为葡萄汁有孢汉逊酵母属、假丝酵母属(Candida)及毕赤酵母属(Pichia)等,这些非酿酒酵母在发酵初期占据优势;随着发酵的进行,非酿酒酵母的数量会逐渐减少,直至消失,而耐酒精能力更强的酵母属酵母会逐渐增多,直至占据主导地位;发酵结束,发酵液中存活的几乎全部是酵母属酵母[11-14]。本试验得到同样一致的结论,这说明不同葡萄产区的天然酵母虽然存在种属差异,然而,葡萄汁在发酵过程中,天然酵母种群的变化趋势是相同的。
本试验中使用的WL培养基是一种非选择性培养基,该培养基最初由Wallerstein实验室设计,用于检测饮料中的微生物菌群。国内外研究表明,使用WL培养基能够实现基于菌落的颜色及形态对酵母菌进行分类,该培养基对自然发酵过程中葡萄汁中分离到的酵母菌种具有良好的鉴别能力[6,13,15]。Pallmann等采用WL营养培养基对发酵过程中发酵液的酵母菌种进行分类,采用26S rDNA测序技术对分类结果进行验证,结果表明,WL营养琼脂培养基可用于监测发酵液中酵母菌群的动态变化趋势[16]。杨莹等也采用WL营养培养基对葡萄酒相关酵母菌种进行分类,采用酵母5.8S-ITS区及26S rDNA D1/D2区扩增与测序技术对分类结果进行验证,结果表明,WL营养琼脂与分子生物学的鉴定结果相一致[13]。因此,WL营养琼脂能对葡萄酒相关酵母进行分类,此法经济简单、易行。
亲缘关系相近的菌种,其5.8S rRNA序列很相似,但其两侧的间隔序列(ITS)由于相对较快的进化速率,而具有长度和序列上的高度变异性,可以提供丰富的变异位点和信息位点。因此,采用酵母菌种5.8S rRNA-ITS区的RFLP分析,可作为鉴别酵母菌种的依据[6]。Esteve-Zarzoso等首次建立了132种酵母的RFLP分析图谱数据库,并确定5.8S rRNA-ITS扩增片段的RFLP分析在种的水平上鉴定酵母的有效性[6]。此后,该数据库得到不断的补充和完善[7-9],Echeverrigaray等使用该方法鉴定出巴西葡萄酒中的非酵母属败坏酵母[17],U'beda等也采用5.8S rRNA-ITS区RFLP分析及26S rDNA D1/D2区扩增与测序技术研究西班牙La Mancha地区葡萄酒厂的非酵母属的多样性[18]。
早期的研究一般认为,葡萄汁有孢汉逊酵母的发酵力低,能生成较多的醋酸及乙酸乙酯,对葡萄酒的整个酿造过程具有负面影响[19]。然而,近期研究表明,有孢汉逊酵母属中的部分菌株能生成大量的酯类、甘油及β-葡萄糖苷酶,对葡萄酒的化学成分和最终感观有着积极影响[20]。Longo等认为,随着发酵力低的克勒克酵母属、有孢汉逊酵母属及其他一些属酵母如毕赤酵母属、假丝酵母属等的发酵启动,耐酒精能力强的酿酒酵母会逐步占据优势,主导发酵的完成[21]。本试验在无菌环境下对内蒙古西部地区采集到的赤霞珠进行自然发酵,通过分析不同发酵时期酵母菌群的动态变化过程,一方面证明发酵液中存在大量的野生酿酒酵母,发酵初期,发酵液中能分离到少量的克鲁维毕赤酵母、酿酒酵母、东方伊萨酵母及浅黄隐球酵母,葡萄汁有孢汉逊酵母在发酵早期为优势菌株,另一方面,结果表明,在发酵中期,非酿酒酵母的数量锐减,酿酒酵母的数量逐渐占据优势,分析其原因在于:随着发酵的进行,发酵液中的酒精浓度逐渐升高,非酿酒酵母由于较低的酒精耐受力而使生长受到抑制,甚至死亡,而酿酒酵母的酒精耐受力较强,仍可大量增殖,此消彼长,最终导致发酵中期的发酵液中酵母菌群的数量发生根本性改变,且这一过程持续进行,直至发酵末期,发酵液中仅能分离到酿酒酵母。
参考文献:
[1]Boulton R B,Singleton V L,Bisson L F.葡萄酒酿造学:原理及应用[M]. 赵光鳌,译.北京:中国轻工业出版社,2001:103-173.
[2]赫尔姆特·汉斯. 葡萄酒微生物学[M]. 宋尔康,译.北京:轻工业出版社,1989:16-26.
[3]Guillamón J M,Sabaté J,Barrio E,et al. Rapid identification of wine yeast species based on RFLP analysis of the ribosomal internal transcribed spacer (ITS) region[J]. Archives of Microbiology,1998,169(5):387-392.
[4]Granchi L,Ganucci D,Messini A,et al. Oenological properties of Hanseniaspora osmophila and Kloeckera corticis from wines produced by spontaneous fermentations of normal and dried grapes[J]. FEMS Yeast Research,2002,2(3):403-407.
[5]巴尼特 J A,佩恩 R W,亚罗 D,等. 酵母菌的特征及鉴定手册[M]. 青岛:青岛海洋大学出版社,1984.
[6]Cavazza A,Grando M S,Zini C. Rilevazione della flora microbica di mosti e vini[J]. Vignevini,1992,9:17-20.
[7]Esteve-Zarzoso B,Belloch C,Uruburu F,et al. Identification of yeasts by RFLP analysis of the 5.8S rRNA gene and the two ribosomal internal transcribed spacers[J]. Int J Syst Bacteriol,1999,49:329-337.
[8]Fernádez-Espinar M T,Esteve-Zarzoso B,Querol A,et al. RFLP analysis of the ribosomal internal transcribed spacers and the 5.8S rRNA gene region of the genus Saccharomyces:a fast method for species identification and the differentiation of flor yeasts[J]. Antonie Van Leeuwenhoek,2000,78(1):87-97.
[9]de Llanos Frutos R,Fernández-Espinar M T,Querol A. Identification of species of the genus Candida by analysis of the 5.8S rRNA gene and the two ribosomal internal transcribed spacers[J]. Antonie Van Leeuwenhoek,2004,85(3):175-185.
[10]Villa-Carvajal M,Querol A,Belloch C. Identification of species in the genus Pichia by restriction of the internal transcribed spacers (ITS1 and ITS2) and the 5.8S ribosomal DNA gene[J]. Antonie Van Leeuwenhoek,2006,90(2):171-181.
[11]van Keulen H,Lindmark D G,Zeman K E,et al. Yeasts present during spontaneous fermentation of lake erie chardonnay,pinot gris and riesling[J]. Antonie Van Leeuwenhoek,2003,83(2):149-154.
[12]Sˇuranská B,Vránová D,Omelková J,et al. Monitoring of yeast population isolated during spontaneous fermentation of Moravian wine[J]. Chemical Papers,2012,66(9):861-868.
[13]杨莹,徐艳文,薛军侠,等. WL营养琼脂对葡萄酒相关酵母的鉴定效果验证[J]. 微生物学杂志,2007,27(5):75-78.
[14]宋育阳,裴颖芳,王国平,等. 黑比诺葡萄接种发酵过程酵母菌的变化监控[J]. 中国食品学报,2010,10(2):125-130.
[15]薛军侠,徐艳文,杨莹,等. WL培养基在酿酒酵母筛选中的应用[J]. 中国酿造,2007(9):36-39.
[16]Pallmann C L,Brown J A,Olineka T L,et al. Use of WL medium to profile native flora fermentations[J]. American Journal of Enology Viticulture,2001,52(3):198-203.
[17]Echeverrigaray S,Randon M,da Silva Keoma,et al. Identification and characterization of non-Saccharomyces spoilage yeasts isolated from Brazilian wines[J]. World Journal of Microbiology & Biotechnology,2013,29(6):1019-1027.
[18]U'beda J,Maldonado Gil M,Chiva R,et al. Biodiversity of non-saccharomyces yeasts in distilleries of the La Mancha region (Spain)[J]. FEMS Yeast Research,2014,14(4):663-673.
[19]Esteve-Zarzoso B,Manzanares P,Ramón D,et al. The role of non-Saccharomyces yeasts in industrial winemaking[J]. International Microbiology,1998,1(2):143-148.
[20]Romano P,Fiore C,Paraggio M,et al. Function of yeast species and strains in wine flavour[J]. International Journal of Food Microbiology,2003,86(1/2):169-180.
[21]Longo E,Cansado J,Agrelo D,et al. Effect of climatic conditions on yeast diversity in grape musts from northwest Spain[J]. American Journal of Enology and Viticulture,1991,42(2):141-144.

