CT引导下Hook-wire定位对早期肺癌术后复发率的影响
陈若 毛文君 郑明峰 陈静瑜 何毅军 叶书高 刘峰 陆荣国
CT引导下Hook-wire定位对早期肺癌术后复发率的影响
陈若 毛文君 郑明峰 陈静瑜 何毅军 叶书高 刘峰 陆荣国
目的 探讨胸腔镜术前CT引导下Hook-wire不同定位方式,对Ⅰ期肺癌切除术后复发率的影响。方法 2010年1月至2013年12 月,我院共收治了147例肺部孤立性小结节(solitary pulmonary nodule,SPN)或磨玻璃样病变(ground-glass opacity ,GGO)。经过删选后共有125例患者纳入研究,其中SPN 81例,GGO 44例,所有患者胸腔镜手术前均行Hook-wire定位,68例患者接受Hook-wire穿刺针穿过病灶,57例贴近病灶定位于周围正常肺组织中。根据手术结果,评价Hook-wire不同定位方式定位的效果,对早期肺癌术后复发的影响,使用Logistic回归分析早期肺癌经Hook-wire定位切除术后复发的危险因素。结果 125例患者术前平均定位时间为(20±8)min,3例出现导丝脱落(2.4%),无症状并发症78例。所有患者均行胸腔镜下手术治疗,12例由于胸腔粘连中转开胸,术后病理:原发性肺癌76例,良性病变44例,5例为转移性肿瘤。原发性肺癌患者中,Hook-wire定位穿过病灶40例,贴近病灶定位36例,术后9例复发,前者复发率明显高于后者(20%vs2.8%,P=0.031)。单因素和多因素Logistic回归分析显示,亚肺叶切除、病理为腺癌、Hook-wire穿过病灶定位、术前穿刺出血是术后复发的独立危险因素,术后辅助化疗为保护性因素。结论 胸腔镜术前早期肺癌经CT引导下Hook-wire定位,穿过病灶定位的术后复发率高于贴近病灶定位,对于直径≤2.0 cm的早期肺癌,选择亚肺叶切除术需谨慎。
CT引导;Hook-wire定位;早期肺癌;复发率;胸腔镜手术
近年来,随着CT技术在肺癌筛查中的广泛应用,尤其是低剂量CT用于肺癌的筛查,越来越多的肺部孤立性小结节(solitary pulmonary nodule,SPN)和磨玻璃样病变(ground-glass opacity,GGO)被发现[1-2]。根据此类病灶的影像学表现,判别其良恶性存在一定的困难,电视胸腔镜手术(VATS)由于手术时间短、创伤小,在SPN和GGO的治疗中应用广泛,但VATS术者术中难以用手指直接触摸肺组织,器械探查存在局限性,因此术前CT引导下Hook-wire定位在肺部SPN或GGO胸腔镜手术中应用广泛,而且术前Hook-wire定位具有良好的安全性和有效性。但常规的Hook-wire定位针穿过肿块定位,可使脱落的肿瘤细胞沿针道或血行转移,是肺癌术后复发的高危因素之一。本研究探讨Hook-wire穿刺针穿过病灶或贴近病灶定位对早期肺癌术后复发的影响,并评价其临床价值。
资料与方法
一、临床资料
回顾性分析我院自2010年1月至2013年12月,收治的147例肺部孤立性SPN(95例)或GGO患者(52例)临床资料,其中男性91例,女性56例,年龄31-78岁,平均58.3岁,SPN和GGO(见图A)所示,本研究经本院伦理委员会批准同意,所有患者均签署知情同意书。本研究患者纳入标准:① 肺部孤立性SPN或GGO,② 病灶最大径5-20 mm,③ 病灶距离脏层胸膜为5-35mm,④ 胸膜无粘连;所有符合者方可纳入研究。患者排除标准:① 病灶和胸膜粘连明显,累及脏层胸膜,② 病灶最大径>20 mm,③ 病灶距脏层胸膜<5mm,④ 肺门或纵隔见明显肿大淋巴结,⑤ 既往有恶性肿瘤病史,⑥ 患者无法耐受手术;符合以上任一条者即剔除研究。所有患者接受CT引导下Hook-wire定位穿刺后VTAS手术切除病灶。
患者纳入研究前均由1名影像科医师和1名胸外科医师共同阅片(均具有15年以上阅片经验),当意见无法统一时由一名胸外科主任医师(具有25年以上临床经验)共同探讨,决定是否纳入。所有肺部病灶定位由1名影像科医师(具有10年以上肺穿刺经验)和1名胸外科医师共同完成。

图A 左:肺部GGO;右:肺部SPN
二、定位方法及胸腔镜手术
共有125例患者符合纳入标准,进行进一步研究。所有患者在VATS术前2小时送至CT室,行胸部CT扫描(双源64排螺旋CT,德国simenz公司,层厚3mm),选择合适体位,确定最佳进针的深度和路线,应尽量避开肋骨及肺裂的层面。常规消毒、铺巾,以2%的利多卡因局麻后置入Hook-wire套管穿刺针,根据研究要求调整角度,穿刺针穿过病灶或贴近病灶约5-10mm穿入正常肺组织中,重复CT扫描(层厚3mm),若穿刺针成功到达目标位置,再将金属钩推进或固定钢丝,同时后退套管针2.0cm,金属钩会自动弹开,这时轻拉钢丝会有阻力感,重复行CT扫描(层厚3mm),显示定位针位置正确,再次CT扫描确定金属钩锚定膨胀良好,将套管针拔出,顶端超过病灶约5 mm,同时观察是否有气胸、血胸等并发症发生,定位过程(图B)所示。(图C)显示定位针穿过病灶和贴近病灶定位。体外钢丝以无菌纱布覆盖固定,轮椅送患者入手术室行VATS手术。
患者全麻后取侧卧位,患侧朝上,VATS采用两孔或三孔法,根据病灶位置选择最适当部位做一约2.0cm切口,距脏层胸膜3 cm剪断钢丝,用抓钳提起定位钢丝,根据病灶深度及部位,使用腔镜下肺直线切割缝合器楔形切除病灶或行肺段切除术,取出标本(图D和图E),送快速冰冻切片检查,根据病理结果决定下一步手术方案。若病灶为良性病变,则结束手术,若为转移性病灶,将病灶楔形切除后结束手术,随后请相关科室医师会诊共同商讨进一步治疗方案。如病变为原发性肺癌,若患者情况能耐受肺叶切除术,则继续行肺叶切除术加系统性淋巴结清扫,若患者肺功能差,无法耐受肺叶切除,则在先前肺楔形切除或肺段切除的基础上行系统性淋巴结清扫(亚肺叶切除术)。所有患者出院后在我院随访,检查包括血液学和影像学指标,如肿瘤指标、头、胸部CT、腹部彩超、骨扫描等,随访至2015年12月。

图B Hook-wire 肺部病灶穿刺定位

图C 左:定位针穿过病灶;右:定位针贴近病灶

图D 左:术中所见,导丝定位在肺部病灶中;右:定位钢丝

图E 左:确定手术切除范围;右:切除的病灶及切口大小
三、统计学方法
结 果
一、 结节定位及并发症情况
125例患者术前平均定位时间为(20±8)min,其中定位针穿过病灶68例,贴近病灶定位于正常肺组织中57例,病灶直径平均为(15±5)mm,距离脏层胸膜平均为(20±14)mm。125例患者中,原发病SPN 81例,GGO 44例,均为肺部孤立性病灶,其中右上肺13例(10.4%),右中肺25例(20.0%),右下肺42例(33.6%),左上肺18例(14.4%),左下肺27例(21.6%)。125例定位穿刺中,3例出现导丝脱落(2.4%),无症状并发症78例(62.4%),其中气胸47例(45例气胸范围<20%,2例为30%),少量出血20例,少量气胸并出血11例。患者并发症多较轻微,随后送入手术室行VATS手术治疗。
二、 胸腔镜手术及术后病理情况
125例患者中肺癌76例,7例患者由于胸腔粘连、暴露困难改为胸腔镜辅助下手术治疗,术后病理包括腺癌48例,鳞癌21例,腺鳞癌4例,肺泡细胞癌3例。76例原发性肺癌患者中,40例术前肺部病灶定位方式为Hook-wire穿刺针穿过病灶,定义为(组一),36例为贴近病灶定位(约5-10mm),定义为(组二)。组一 26例患者手术方式为肺叶切除加系统性淋巴结清扫,14例患者由于肺功能欠佳或高龄接受亚肺叶切除术,随后行系统性淋巴结清扫,组二中肺叶切除术21例,亚肺叶切除术15例,两组手术方式无明显统计学差异(P=0.550)。两组患者详细临床资料比较见表1,具有可比性。组一40例患者中,ⅠA期32例,ⅠB期5例,ⅡA期2例,ⅡB期1例。组二患者,ⅠA期26例,ⅠB期7例,ⅡA期1例,ⅡB期2例。(见表1)。

表1 Hook-wire不同定位方式肺癌患者临床资料
三、Hook-wire不同定位方式对肺癌术后复发的影响
76例肺癌患者术后均在我院随访,组一14例接受术后辅助化疗,8例接受酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKIS)药物治疗,组二 术后辅助化疗10例,接受TKIS药物治疗5例。随访至2015年12月,两组患者共有9例患者复发,复发率为11.8%,死亡6例(7.9%),其中组一复发率为20%(8/40),显著高于组二2.8 % (1/36),P=0.031,组一患者肺癌死亡率显著高于组二患者(6/40,15% VS 0/36,0 %,P=0.026)。
四、早期肺癌经Hook-wire定位切除术后,复发的单因素和多因素Logistic回归分析
根据肺癌患者术后病理分期,剔除6例Ⅱ期患者,提取70例IA、IB期患者的临床资料进行分析。患者临床资料因素如年龄、性别、吸烟状况、病灶大小、病灶类型、病灶形态、病灶距胸膜深度、是否合并慢性阻塞性肺疾病、术前穿刺出血、手术方式、术后病理类型、Hook-wire定位方式、术后化疗等,先纳入单因素Logistic回归模型分析,结果显示患者高龄、性别为男性、吸烟、合并慢性阻塞性肺疾病,术前穿刺出血、行亚肺叶切除术、病理类型为腺癌、Hook-wire定位穿刺经过病灶是早期肺癌术后复发的危险因素,术后辅助化疗为保护性因素,(见表2)。
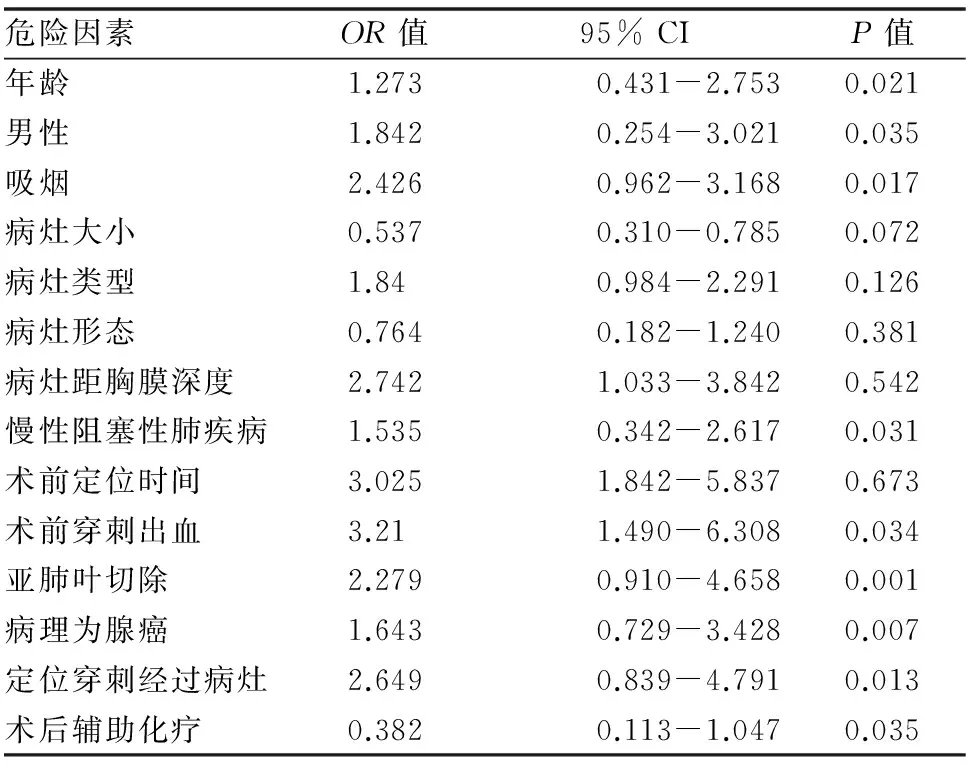
表2 早期肺癌经Hook-wire定位切除术后, 复发的单因素Logistic回归分析
单因素Logistic回归分析有统计学意义的9个变量纳入多因素Logistic回归模型分析,结果显示亚肺叶切除、病理为腺癌、Hook-wire定位穿刺经过病灶、术前穿刺出血是早期肺癌术后复发的独立危险因素,术后辅助化疗为保护性因素(见表3)。

表3 早期肺癌经Hook-wire定位切除术后, 复发的多因素Logistic回归分析
讨 论
随着CT技术的快速发展,体检发现的肺部小病灶(直径≤20mm)逐年增多[3-4],但通过影像学检查往往不能判断病灶良恶性,定期随访期间许多患者心理压力巨大,因此胸腔镜下手术切除是主要的治疗手段。由于病灶位于胸膜下,直径较小,仅单纯手指触诊或器械探查不能满足胸腔镜手术对病灶的定位要求。术前肺部病灶定位是手术的关键,目前肺部小病灶定位方式主要是在CT或彩超引导下,通过细针穿刺注射染料(亚甲蓝等)、对比剂或放射性核素,也可在病灶内放置带钩钢丝(Hook-wire)[5-7]。术中超声定位需要肺组织处于萎陷状态,且超声分辨率比较低,不同操作者之间定位时可能存在较大偏差,因此彩超在肺部小病切除术前定位中应用较少。CT引导下通过细针穿刺注射对比剂等存在多种风险,目前逐渐被带钩钢丝取代。Mark等[8]于1992年首次提出了Hook-wire定位,随后被认为是最传统的肺部SPN或GGO定位技术,临床上取得了较好的效果,很大程度提高了定位的准确性,使手术时间缩短,特别是对于亚厘米级病灶优势更明显[9-10]。本研究共125例患者接受了Hook-wire术前定位,仅3例出现导丝脱落,可能与患者由CT室搬运至手术室有关,因此对于此类手术,在杂交手术间定位后直接手术,既可缩短手术时间,又可减少长途搬运导致钢丝脱落、气胸、出血等并发症的发生。本组有78例(62.4%)患者Hook-wire定位后出现并发症,但大多无症状,我们定位后即刻行VATS下手术治疗,对手术产生的影响很小,因此Hook-wire术前定位具有较好的安全性。
目前少有文献报道不同定位方式对早期肺癌术后复发率的影响,虽然有中心采取Hook-wire定位针穿过病灶和贴近病灶定位,但没有分析两种定位方式对肺癌术后复发的影响。本研究中,我们首次分析,Hook-wire定位针穿过病灶与定位针贴近病灶相比,前者肺癌术后的复发率和死亡率明显高于后者(P<0.05),单因素和多因素Logistic回归分析也显示Hook-wire定位穿刺经过病灶是肺癌术后复发的危险因素,结果也显示术前穿刺出血、病理为腺癌也是独立危险因素。我们认为,Hook-wire穿刺针经过病灶时,由于恶性肿瘤细胞间的黏合性较差,受到机械刺激后可能出现脱落,出现针道转移,病灶行亚肺叶切除,存在肿瘤细胞残留的可能性;术前定位时出现穿刺出血,病人出现痰血,即使行肺叶切除术,也不能排除肿瘤细胞血行转移的可能,因此贴近病灶穿刺能避免直接接触肿瘤细胞,减少了肺癌直接或血行转移的可能性。在以后的临床工作中,我们尽量选择贴近病灶穿刺定位肿块,避免肿瘤的直接播散和转移,从而降低早期肺癌术后复发的风险。肺癌术后腺癌的复发率明显高于鳞癌等其他非小细胞肺癌,本研究Logistic回归分析也证实了腺癌是肺癌复发的独立危险因素。
早期肺癌行肺叶还是亚肺叶切除,一直存在争议。1995年Ginsberg等的一项多中心研究[11],通过比较肺癌患者接受肺叶切除或亚肺叶切除的预后,结果发现亚肺叶切除的患者肺癌复发率明显高于肺叶切除的患者,肿瘤特异性病死率增加50%,病死率增加30%,此后肺叶切除术被确定为早期肺癌的标准术式。但许多高龄、心肺功能差的早期肺癌患者无法耐受肺叶切除,仅能行亚肺叶切除以保存更多的肺功能,但随着临床研究的深入,越来越多的研究证明此类患者接受亚肺叶切除术安全有效,与标准的肺叶切除术相比,远期复发率、生存率没有显著性差异。Dell’Amore等对319例年龄大于75周岁的肺癌患者术后资料进行研究,经过合理的术前准备、综合考虑手术安全因素后,早期老年肺癌患者行亚肺叶切除术可达到良好的效果[12]。
尽管根据第七版国际肺癌诊疗指南,Ⅰ期肺癌患者手术方式,建议采用解剖性肺叶切除术+系统性淋巴结的清扫或采样,对于无法耐受肺叶切除的患者,采用亚肺叶切除术。但对于肺功能良好,能耐受肺叶切除术的早期肺癌患者,是否一定需要行亚肺叶切除术?Okada等[13]于在2005年回顾分析了1272例非小细胞肺癌完全切除后的临床结果,结论指出对于直径≤2.0cm的无淋巴结转移的早期非小细胞肺癌应行亚肺叶切除术,但对于病灶直径在2.0-3.0cm的患者最佳手术方式尚待进一步的研究。随后2006年Okada等[14]报道了一项直径≤2 cm的I A期非小细胞肺癌手术治疗的前瞻性多中心非随机研究,指出亚肺叶组与肺叶组5年生存率分别为89.6%和89.1%,5年无病生存率为85.9%和83.4%,结果无统计学差异,肺叶切除术在术后复发和预后方面并不占优,但亚肺叶切除在肺功能保护上更具优势。也有专家提出不同意见,2011年Kates等通过研究指出亚肺叶切除的选定标准应为肿瘤直径≤1.0 cm的病灶[15],Landreneau等的一项前瞻性非随机多中心研究指出,肺癌肺叶切除术较亚肺叶切除术局部复发率低,5年生存率更好,结果有统计学意义[16]。本研究中单因素和多因素Logistic回归分析均显示亚肺叶切除是早期肺癌术后复发的危险因素,我们认为对于能耐受肺叶切除的患者,不管术前采取何种病灶定位方式,应尽可能采用肺叶切除+系统性淋巴结清扫术,此类患者肺癌复发的具体机制有待进一步研究。我们通过Logistic回归分析发现术后辅助化疗可减少肺癌术后复发风险(OR=0.52,P≤0.05),因此对于一些肿瘤复发的高危患者,术后进行辅助化疗能减少肺癌的复发率。目前多个评估早期肺癌行肺叶切除或亚肺叶切除的大样本多中心前瞻性随机对照临床研究正在进行中,最终结果对临床工作具有重要的指导意义。
综上所述,早期肺癌胸腔镜手术前病灶经CT引导下Hook-wire定位准确、并发症轻微,能满足定位需要。早期肺癌经Hook-wire穿过病灶定位,肺癌复发率高于贴近病灶定位,对于直径≤2.0 cm的早期肺癌(SPN或GGO),肺叶切除+系统性淋巴结清扫是标准术式,选择亚肺叶切除术需谨慎。
[1] Gould MK.Lung-cancer screening with low-dose computed tomography[J].N Engl J Med, 2014,371(19):1813-1820.
[2] Weinstock T, Kidambi P, Channick CL,et al.Implementation of Lung Cancer Screening Programs with Low-Dose Computed Tomography in Clinical Practice[J].Ann Am Thorac Soc,2016,13(3):425-427.
[3] Black WC,Gareen IF,Soneji SS,et al.Cost-effectiveness of CT screening in the National Lung Screening Trial[J]. N Engl J Med,2014,371(19):1793-1802.
[4] Tanner NT, Silvestri GA. Screening for Lung Cancer Using Low-Dose Computed Tomography. Are We Headed for DANTE′s Paradise or Inferno[J].Am J Respir Crit Care Med,2015,191(10):1100-1101.
[5] 黄浩哲,李文涛,何新红,等. CT引导下hook-wire定位在肺小结节胸腔镜切除术中的应用价值[J].肿瘤影像学, 2013,22(4):309-313.
[6] Hanauer M, Perentes JY, Krueger T, et al. Pre-operative localization of solitary pulmonary nodules with computed tomography-guided?hook wire: report of 181 patients[J].J Cardiothorac Surg,2016,11(1):1-7.
[7] Xu X, Yao Y, Shen Y, et al. Clinical Analysis of Percutaneous Computed Tomography-Guided Hook Wire Localization of 168 Small Pulmonary Nodules[J].Ann Thorac Surg, 2015,100(5):1861-1867.
[8] Mack MJ, Gordon MJ, Postma TW, et al. Percutaneous localization of pulmonary nodules for thoracoscopic lung resection[J]. Ann Thorac Surg,1992,53(6):1123-1124.
[9] Nakashima S, Watanabe A, Obama T, et al. Need for preoperative computed tomography-guided localization in video-assisted thoracoscopic surgery pulmonary resections of metastatic pulmonary nodules[J].Ann Thorac Surg,2010,89(1):212-218.
[10] Chen YR, Yeow KM, Lee JY, et al. CT-guided hook wire localization of subpleural lung lesions for video-assisted thoracoscopic surgery (VATS)[J]. J Formos Med Assoc, 2007,106(11):911-918.
[11] Ginsberg RJ, Rubinstein LV. Randomized trial of lobectomy versus limited resection for T1 N0 non-small cell lung cancer. Lung Cancer Study Group[J].Ann Thorac Surg, 1995,60(3):615-622; discussion 622-623.
[12] Dell′Amore A, Monteverde M, Martucci N, et al. Early and long-term results of pulmonary resection for non-small-cell lung cancer in patients over 75 years of age: a multi-institutional study[J].Interact Cardiovasc Thorac Surg, 2013,16(3):250-256.
[13] Okada M, Nishio W, Sakamoto T, et al. Effect of tumor size on prognosis in patients with non-small cell lung cancer: the role of segmentectomy as a type of lesser resection[J]. J Thorac Cardiovasc Surg, 2005,129(1):87-93.
[14] Okada M, Koike T, Higashiyama M, et al. Radical sublobar resection for small-sized non-small cell lung cancer: a multicenter study[J]. J Thorac Cardiovasc Surg, 2006 ,132(4):769-775.
[15] Kates M, Swanson S, Wisnivesky JP. Survival following lobectomy and limited resection for the treatment of stage I non-small cell lung cancer<=1 cm in size: a review of SEER data[J]. Chest, 2011,139(3):491-496.
[16] Landreneau RJ, Sugarbaker DJ, Mack MJ, et al. Wedge resection versus lobectomy for stage I (T1 N0 M0) non-small-cell lung cancer[J]. J Thorac Cardiovasc Surg, 1997 ,113(4):691-698.
Effect of CT-guided localization with a Hook-wire system on postoperative recurrence for early lung cancer
CHENRuo,MAOWen-jun,ZHENGMing-feng,CHENJing-yu,HEYi-jun,YEShu-gao,LIUFeng,LURong-guo
WuxiPeople'sHospital,Wuxi,Jiangsu214023,China
Objective To evaluate the effectiveness of different CT-guided localization with a Hook-wire system prior to video-assisted thoracoscopic surgery (VATS) on postoperative recurrence forⅠstage lung cancer. Methods From January 2010 to December 2013, 147 patients with solitary pulmonary nodule (SPN) or ground glass opacity (GGO) was admitted to our hospital. A total of 125 patients was enrolled into the study after clear screen. CT-guided localization with a Hook-wire system was used before VATS in all patients, including 68 patients with Hook-wire needle through the lesions and 57 patients with needle close to the lesions located in the surrounding normal lung tissue. On the basis of surgery results, the effect of different CT-guided localization with Hook-wire system was estimated, the effect on postoperative recurrence was also evaluated, and the risk factors of lung cancer recurrence after localization with a Hook-wire system was illustrated by Logistic regression analysis. Results The mean preoperative localization time of 125 patients was(20±8)min, and localization failure was found in 3 cases due to guide wire slipping. There were 78 cases of complication without symptoms. All patients underwent VATS for their disease, excluding 12 patients because of thoracic cavity adhesion and they received thoracotomy. After pathological examinations, there were 76 lung cancer, 44 benign lesions, and 5 metastatic tumors. Among the 76 patients with lung cancer, 40 patients with Hook-wire needle through the lesions and 36 patients with needle close to the lesions.Nine patients suffered cancer recurrence, and the rate was higher for patients in the former group than in the latter group (20%vs2.8%,P=0.031). Univariate and multivariate logistic regression analysis showed sub-lobar resection, adenocarcinoma, Hook-wire needle through the lesions, and bleeding during localization were independent risk factors for lung cancer recurrence. However, adjuvant chemotherapy was protective factor. Conclusion CT guided localization for early lung cancer with Hook-wire system is prior to VATS. The postoperative cancer recurrent rate is higher in patients with needle through the lesions than close to the lesions. For patients of early lung cancer with diameter≤2.0 cm, sub-lobar resection should be conducted with great cautions.
CT-guided; Hook-wire localization; early lung cancer; recurrent rate; video-assisted thoracoscopic surgery
10.3969/j.issn.1009-6663.2017.02.005
214023 江苏 无锡,南京医科大学附属无锡市人民医院胸外科、江苏省人体器官移植重点实验室
毛文君, E-mail:maowenjun1@126.com
2016-06-23]

