二十二碳六烯酸虾青素酯的合成及质谱分析
杨 鲁,李学敏,周庆新,李兆杰,徐 杰,薛长湖*
二十二碳六烯酸虾青素酯的合成及质谱分析
杨 鲁,李学敏,周庆新,李兆杰,徐 杰,薛长湖*
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
以二十二碳六烯酸(docosahexaenoic acid,DHA)与虾青素作为反应底物合成DHA虾青素酯,探索出最佳反应条件为:虾青素250 mg、DHA 282 mg、无水丙酮5 mL、4-二甲氨基吡啶(DMAP)100 mg、1-乙基-3(3-二甲基丙胺)碳二亚胺(EDCI)100 mg,充氮、避光、磁力搅拌,25 ℃反应3 h。液相色谱-质谱联用鉴定结果表明:产物中存在游离虾青素、DHA虾青素单酯、DHA虾青素双酯。经高效液相色谱法测定,采用峰面积归一法进行积分计算出各组分含量,结果表明,最佳反应条件下,产物中DHA虾青素酯峰面积可达95.67%,其中主要为DHA虾青素双酯(77.46%)、部分DHA虾青素单酯(18.21%)和少量游离虾青素(3.24%)。用硅胶层析柱进行梯度洗脱,增加溶剂极性(石油醚-丙酮体积比100∶0~92∶8)依次洗脱出DHA虾青素双酯、DHA虾青素单酯,纯度分别为(98.2±0.5)%和(94.0±0.6)%。
虾青素;DHA虾青素酯;合成;分离鉴定;质谱
虾青素(3,3’-二羟基-β,β’胡萝卜素-4,4’-二酮基)是类胡萝卜素的一种,天然虾青素主要来源于雨生红球藻、红发夫酵母、虾、蟹等甲壳类动物[1],但动物不能合成虾青素,只能通过食物链从植物或藻类中获得。虾青素有多种结构形式,现已发现,天然虾青素中9、13和15位为Z式结构,因此虾青素可能的几何异构体有全-E、(9Z)、(13Z)、(15Z)、(9Z、13Z)、(9Z、15Z)、(13Z、15Z)和(9Z、13Z、15Z)等[2]。虾青素可以淬灭单线态氧、清除自由基[3-4]、防止或终止单线态氧和自由基引起的链式反应[5]。因此,它具有抗癌[6-7]、抗炎、抗衰老、抗疲劳活性、预防心血管疾病[8-10]、保护视神经、提高免疫力、有效降低糖尿病发病率[11-12]等功能。虾青素因具有抗氧化性、增强机体免疫力等特性,已被用于保健食品[13-14]。在自然界中虾青素以游离态、单酯或双酯混合形式存在,且以酯的形式为主。
二十二碳六烯酸(docosahexaenoic acid,DHA)是ω-3多不饱和脂肪酸,对人类健康具有重要的意义,有益于胎儿大脑及视力的发育[15],对成年人而言,DHA是参与维持大脑和神经系统正常运作的重要营养物[16-18]。DHA的缺乏会引起多种疾病,如阿尔茨海默氏病、精神分裂症、诵读困难、注意力缺陷或多动症[19-20]。
近年来研究表明,虾青素酯的吸收利用率较游离虾青素更高,尤其是带有中长脂肪酸链的虾青素酯,而单、双酯的吸收利用率又有明显区别[21-22]。所以本实验将虾青素与DHA两者结合起来,预期两者能起到较好的协同作用,从而高效地发挥它们在人体健康方面的有益作用。已有文献报道过辛酸虾青素酯、棕榈酸虾青素酯、DHA虾青素酯等单一脂肪酸虾青素酯的化学合成[21,23],但这些文献中都只是合成这些单一脂肪酸虾青素酯作为原料,并没有对其合成方法进行优化,也没有对这些单一脂肪酸虾青素酯的结构特点做详细分析。本研究不仅优化了化学合成DHA虾青素酯的方法,还利用高效液相色谱-串联质谱(high performance liquid chromatographytandem mass spectrometry,HPLC-MS/MS)联用法具体分析了DHA虾青素酯的化学结构及其裂解规律,为今后设计出高生物利用度虾青素酯功能产品提供理论依据。
1 材料与方法
1.1 材料与试剂
全反式虾青素(all-trans-astaxanthin)标准品 德国Dr. Ehrenstorfer公司;合成虾青素(纯度10%) 浙江巴仕曼生物科技有限公司;DHA(纯度80%) 中国海洋大学食品科学与人类健康实验室制备;4-二甲氨基吡啶(4-dimethylaminopyridine,DMAP)、1-乙基-3(3-二甲基丙胺)碳二亚胺(1-(3-dimethylaminopropyl)-3-ethylcarbodiimide,EDCI) 上海Medpep有限公司;甲醇(色谱纯) 德国Merck公司;色谱纯甲基叔丁基醚美国Muskegon公司;其余试剂均为国产分析纯。
1.2 仪器与设备
DF-101S集热式恒温加热磁力搅拌器 上海羌强仪器设备有限公司;Heidolph Laborota 4000型旋转蒸发仪 德国Heidolph公司;6410B Triple Quard LC/MS(配有大气压化学电离(atmospheric-pressure chemical ionization,APCI)源)、1100型HPLC仪(配有二极管阵列检测器) 美国Agilent公司;UV-2550紫外分光光度计 日本岛津公司;YMC-Carotenoid-C30色谱柱(4.6 mm×250 mm,5 μm) 日本YMC株式会社。
1.3 方法
1.3.1 虾青素原料预处理
称取600 g合成虾青素(含量10%)置于5 L的烧杯里,加入3 L二氯甲烷,机械搅拌1 h,布氏漏斗抽滤,收集滤液,减压旋蒸至干,滤渣倒回烧杯中重复以上操作3 次,整个过程避光操作。最终得到64.45 g黑紫色粉末,经HPLC检测纯度为84.22%,得率为90.47%。
1.3.2 DHA虾青素酯的合成及反应条件优化
1.3.2.1 反应体系的影响
各取250 mg虾青素(0.419 mmol)、282 mg DHA(0.858 mmol)分别加入5 个棕色小瓶中,再分别加入5 mL无水丙酮、无水乙酸乙酯、无水二氯甲烷、无水乙醇、无水正己烷,混合均匀后各加入100 mg EDCI(0.514 mmol)、100 mg DMAP(0.835 mmol),25 ℃、充氮、磁力搅拌。反应3 h后将反应混合物转移到烧杯中,加入50 mL丙酮,再用100 mL 1 mol/L盐酸溶液、100 mL饱和碳酸氢钠溶液、100 mL饱和氯化钠溶液依次清洗。回收有机相,减压旋蒸至无丙酮后,于-20 ℃避光保存,待用。
1.3.2.2 反应温度的影响
各取250 mg虾青素(0.419 mmol)、282 mg DHA(0.858 mmol)、5 mL无水丙酮分别加入4 个棕色小瓶中,混合均匀后各加入100 mg EDCI(0.514 mmol)、100 mg DMAP(0.835 mmol),充氮、磁力搅拌,分别于15、25、35、45 ℃条件下反应3 h。反应结束后将混合物转移到烧杯中,加入50 mL丙酮,再用100 mL盐酸溶液(1 mol/L)、100 mL饱和碳酸氢钠溶液、100 mL饱和氯化钠溶液依次清洗。回收有机相,减压旋蒸至无丙酮后于-20 ℃避光保存,待用。
1.3.2.3 EDCI用量的影响
各取250 mg虾青素(0.419 mmol)、282 mg DHA(0.858 mmol)、5 mL无水丙酮分别加入3个棕色小瓶中,混合均匀后各加100 mg DMAP(0.835 mmol),再分别加入EDCI 50 mg(0.257 mmol)、100 mg(0.514 mmol)、200 mg(1.028 mmol),25 ℃、充氮、磁力搅拌。反应3 h后将反应混合物转移到烧杯中,加入50 mL丙酮,再用100 mL盐酸溶液(1 mol/L)、100 mL饱和碳酸氢钠溶液、100 mL饱和氯化钠溶液依次清洗。回收有机相,减压旋蒸至无丙酮后,于-20 ℃避光保存,待用。
1.3.2.4 DMAP用量的影响
各取250 mg虾青素(0.419 mmol)、282 mg DHA(0.858 mmol)、5 mL无水丙酮分别加入3个棕色小瓶中,混合均匀后各加100 mg EDCI(0.514 mmol),再分别加入DMAP 50 mg(0.417 mmol)、100 mg(0.835 mmol)、200 mg(1.67 mmol),25 ℃、充氮、磁力搅拌。反应3 h后将反应混合物转移到烧杯中,加入50 mL丙酮,再用100 mL盐酸溶液(1 mol/L)、100 mL饱和碳酸氢钠溶液、100 mL饱和氯化钠溶液依次清洗。回收有机相,减压旋蒸至无丙酮后于-20 ℃避光保存,待用。
1.3.2.5 反应时间的影响
各取250 mg虾青素(0.419 mmol)、282 mg DHA(0.858 mmol)、5 mL无水二氯甲烷分别加入5个棕色小瓶中,混合均匀后各加入100 mg EDCI和100 mg DMAP,25 ℃、充氮、磁力搅拌,分别于反应1、2、3、4、5 h时终止反应,随即将混合物转移到烧杯中,加入50 mL二氯甲烷,再用100 mL盐酸溶液(1 mol/L)、100 mL饱和碳酸氢钠溶液、100 mL饱和氯化钠溶液依次清洗。回收有机相,减压旋蒸至干后于-20 ℃避光保存,待用。
1.3.3 虾青素单酯/双酯的纯化
将柱层层析硅胶置于110 ℃烘箱活化2 h,待用。称100 g硅胶与石油醚搅拌后湿法装柱,用3倍柱体积的石油醚压实硅胶柱。分别取2 g反应产物,用5 mL石油醚溶解上样。先用石油醚冲洗出未反应的游离脂肪酸,再用石油醚/丙酮(96∶4,V/V)溶液冲洗出DHA虾青素双酯,最后用石油醚/丙酮(92∶8,V/V)溶液冲洗出DHA虾青素单酯。洗脱后分别收集单酯部分和双酯部分,减压旋蒸至干,DHA虾青素单/双酯样品置于-20 ℃避光保存,待用。
1.3.4 虾青素单酯/双酯的纯度测定
准确称取适量虾青素标准品,用丙酮配成1 mg/mL的储备液(超声波促溶,冰浴避光条件下操作),存放于棕色瓶中,-20 ℃条件下保存,使用前用丙酮稀释成0.05、0.1、0.5、1、2、5、10、20 μg/mL质量浓度的工作液用于色谱分析。样品中虾青素单/双酯的纯度按如下公式计算得到:
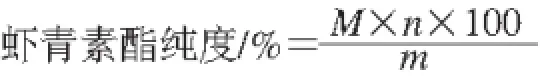
式中:M为虾青素单酯或虾青素双酯的摩尔质量/(g/mol);n为总虾青素类化合物的物质的量/mol,以虾青素为标样,经峰面积计算得到;m为样品质量/g。
1.3.5 薄层色谱(thin layer chromatography,TLC)检测
正己烷-丙酮(4∶1,V/V)配制展开剂,取15 mL加入层析缸中,密封平衡60 min;用3 mm的毛细管点样,点样线距硅胶板下边缘1.5 cm,重复多次,点样过程用氮气及时吹干溶剂,以减小“点样环形色谱效应”和虾青素化合物的降解,待溶剂前沿距硅胶板上边缘1 cm时,取出硅胶板,室温条件下自然显色。
1.3.6 紫外检测
取适量虾青素标准品及纯化后的DHA虾青素双酯,用丙酮配制成适宜浓度,UV-2550紫外分光光度计进行全光谱扫描。
1.3.7 HPLC-MS/MS检测
H P L C条件:Y M C-C a r o t e n o i d-C30色谱柱(4.6 mm×250 mm,5 μm);流动相A:甲醇,B:甲基叔丁基醚;线性梯度洗脱:0~15 min,B维持在10%;15~21 min,B由10%升至30%;21~38 min,B维持在30%;38~46 min,B由30%升至48%;46~51 min,B维持在48%;51~54 min,B由48%升至100%;54~57 min,B由100%下降至10%;57~60 min,B维持在10%。流速1.0 mL/min;检测波长476 nm;进样量5 μL。
MS条件:APCI源,正离子模式,一级MS的质量扫描范围为m/z 300~1 400。雾化气压力60 psi;干燥气(N2)流速5 L/min,干燥气温度350 ℃,离子源温度450 ℃。毛细管压力3.7 kV,电晕电流4 μA。二级MS采用母离子扫描和子离子扫描模式,碎裂电压为60 V,碰撞能量为25 eV,质量扫描范围为m/z 100~1 500。
数据处理:通过参考文献中的裂解规律,确定DHA虾青素酯的特征离子,从而实现对其定性分析;同时对目标组分用峰面积归一法进行积分计算,从而得出反应生成的DHA虾青素酯含量。
2 结果与分析
2.1 TLC分析和光谱扫描结果
图1A中合成产物条带的比移值与雨生红球藻虾青素藻油中游离虾青素及虾青素单双酯的位置一致,初步认定成功合成了虾青素酯,图1B结果表明,游离虾青素和DHA虾青素双酯在丙酮中的最大吸收波长分别为475 nm和476 nm,由于游离态虾青素和虾青素酯的最大吸收波长非常相似,可以利用游离虾青素作为标样,准确定量DHA虾青素酯的含量。
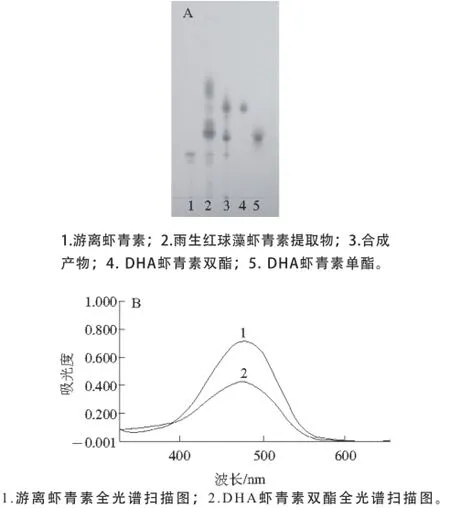
图1 产物TLC(A)和全光谱扫描(B)图Fig. 1 Thin layer chromatograms and absorption spectra of the products
DHA和虾青素的反应产物经硅胶柱正己烷/丙酮体系分离纯化的结果如图1A中条带4、5所示,分别为DHA虾青素双酯、DHA虾青素单酯。DHA虾青素单酯纯度为(94.0±0.6)%,DHA虾青素双酯纯度为(98.2±0.5)%。
2.2 反应条件优化结果
2.2.1 反应体系的影响
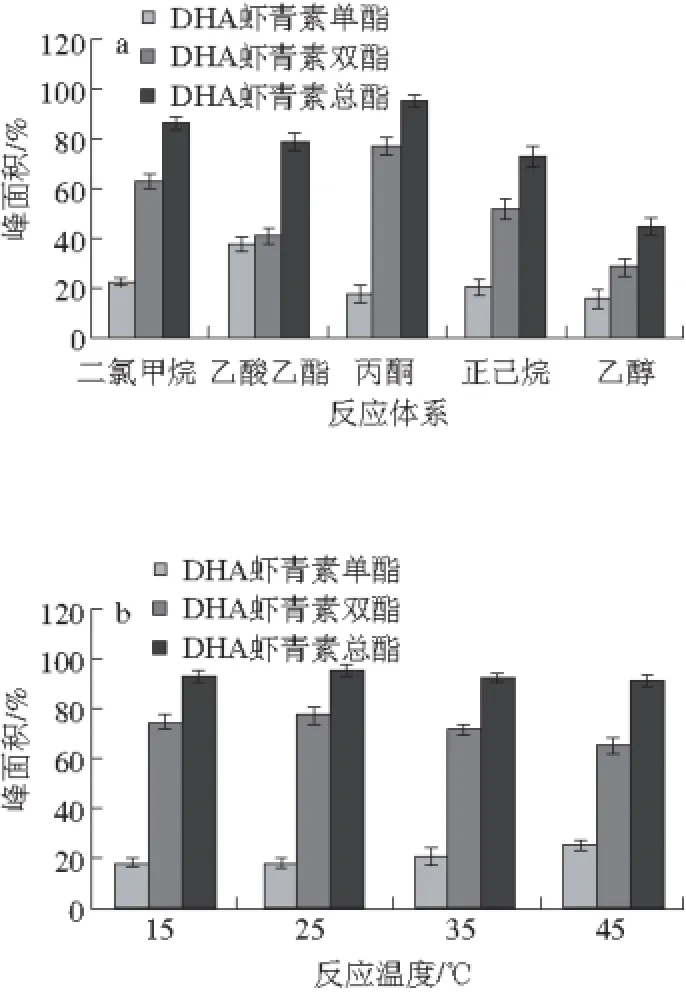
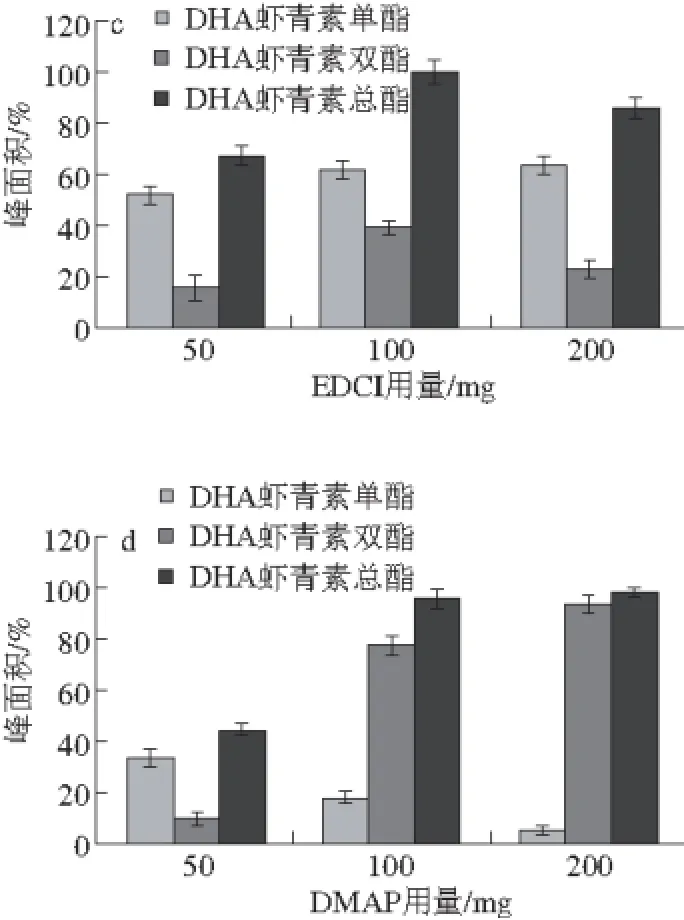
图2 反应体系(a)、反应温度(b)、EDCI用量(c)、DMAP用量(d)对合成DHA虾青素酯的影响Fig. 2 Effects of reaction temperature, time, EDCI dosage and DMAP dosage on the synthesis of DHA astaxanthin esters
如图2a所示,以乙醇为反应体系时,DHA虾青素总酯峰面积只有44.69%,明显低于丙酮、乙酸乙酯、正己烷、二氯甲烷体系中DHA虾青素总酯的产量,这主要是由于虾青素、DHA虾青素酯在乙醇中的溶解性远不如其他几种体系。以丙酮为反应体系时,DHA虾青素总酯峰面积最高,可达到95.67%,所以丙酮为最适反应体系。在这几种体系中DHA虾青素双酯的含量都大于单酯,该方法更适合于生产DHA虾青素双酯。
2.2.2 反应温度的影响
如图2b所示,不同反应温度条件下,产物中DHA虾青素单酯峰面积都在20%左右,而DHA虾青素双酯都在74%左右。因此反应温度对DHA虾青素酯产量无明显影响,DHA虾青素酯主要以双酯存在,反应温度对产生的单、双酯比例无明显影响,反应温度为25 ℃时DHA虾青素总酯产量略高一些,而且温度越高虾青素在有机溶剂中的异构化程度越高[23],故将25 ℃定为最适反应温度。
2.2.3 EDCI用量的影响
如图2c所示,控制DMAP用量都为100 mg,当DMAP、EDCI各加入100 mg时,DHA虾青素总酯含量高达95.67%。EDCI用量继续提高到200 mg时,DHA虾青素总酯含量略有下降,DHA虾青素单酯含量略有上升,双酯含量下降明显,只有25.74%。结果表明:EDCI用量对合成DHA虾青素酯的反应有显著影响,DHA虾青素总酯生成量随EDCI用量的增加呈现先增后减的趋势。所以,EDCI用量为100 mg最为合适。
2.2.4 DMAP用量的影响
DMAP是一种超强亲核的酰化作用催化剂,它的极性和水溶解能力使得它在引发反应和净化产品方面有相当大的优势,在该反应中被假定为酰化过程的催化剂。在DMAP存在的情况下加入EDCI作为偶联剂,尤其适用于催化ω-3多不饱和脂肪酸的酰化反应。DMAP用量对合成DHA虾青素酯反应的影响如图2d所示,控制EDCI用量都为100 mg,当DMAP、EDCI各加入100 mg时,DHA虾青素酯含量高达95.67%。DMAP用量继续提高到200 mg时,DHA虾青素总酯含量略有上升,DHA虾青素双酯含量明显上升,双酯含量达到92.81%。结果表明,DMAP用量对合成DHA虾青素酯的反应有显著影响,DHA虾青素总酯生成量随DMAP用量的增加而增加,并且总酯中双酯比例随之增加。为了尽量控制催化剂的用量,所以选定DMAP用量为100 mg最为合适。
2.2.5 反应时间的影响
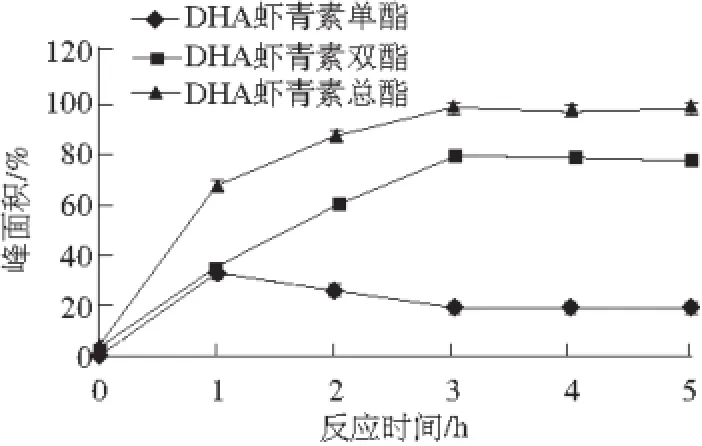
图3 反应时间对合成DHA虾青素酯的影响Fig. 3 Effect of reaction time on the synthesis of DHA astaxanthin esters
如图3所示,反应3 h DHA虾青素总酯峰面积达到最高值95.67%。继续反应,单、双酯转化率均趋于稳定。DHA虾青素单酯的含量比例先增加后降低,最后趋于稳定,DHA虾青素双酯不断增加,这符合虾青素两端的羟基随着时间延长逐渐与DHA发生酯化的趋势。故最适反应时间为3 h。
2.3 HPLC-MS/MS分析产物成分

图4 反应产物的HPLC分离图谱Fig. 4 HPLC-DAD chromatograms of the products
图4 为本实验反应产物的HPLC分离图谱,可以看出,色谱吸收峰主要分为3部分,结合MS分析可知,游离虾青素的保留时间为8~10 min,DHA虾青素单酯的保留时间为28~33 min,DHA虾青素双酯的保留时间在46~52 min。通过DAD全光谱扫描显示,色谱峰均在波长476 nm左右有最大吸光度。
通过HPLC-MS/MS对反应产物进行鉴定分析,结合前人研究成果及MS裂解规律[24],得到本实验反应产物鉴定结果如表1所示。结果表明,峰1为游离虾青素,峰2、3为DHA虾青素单酯,峰4、5、6为DHA虾青素双酯。由于全反式虾青素在高温、光照、有机溶剂环境中会产生顺式异构体,异构体中主要是9-顺式虾青素和13-顺式虾青素[25-26],且峰2含量明显高于峰3,所以峰2应该是全反式虾青素DHA单酯,峰3可能为9-顺式虾青素虾青素DHA单酯或13-顺式虾青素DHA单酯,同理,由于峰4在峰4、5、6中含量最高,峰4应该是全反式虾青素DHA双酯,而峰5和峰6分别对应着9-顺式虾青素DHA双酯和13-顺式虾青素DHA双酯中的一种。

表1 反应产物中各组分MS分析结果Table1 Mass spectral data of the products

图5 DHA虾青素单酯的二级MS图(a)及裂解规律(b)Fig. 5 MS-MS spectra of the DHA astaxanthin monoester, along with its principal fragmentation pattern
由图5可知,m/z 907.7为DHA虾青素单酯质子化的准分子离子峰;m/z 579.4为[M+H-C22:6]+,是DHA虾青素单酯的分子离子峰失去一个C22:6脂肪酸链所产生的碎片离子峰;m/z 561.5为[M+H-C22:6-H2O]+,是DHA虾青素单酯的分子离子峰失去一个C22:6脂肪酸链又失去一分子水所产生的碎片离子峰;m/z 147.0、m/z 172.7、m/z 201.3都是虾青素两端六元环区裂解、重排后形成的特征碎片离子[27]。

图6 DHA虾青素双酯的二级MS图(a)及裂解规律(b)Fig. 6 MS-MS spectra of the DHA astaxanthin diester, along with its principal fragmentation pattern
由图6可知,m/z 1 217.9为DHA虾青素双酯质子化的准分子离子峰;m/z 889.6为[M+H-C22:6]+,是DHA虾青素双酯的分子离子峰失去一个C22:6脂肪酸链所产生的碎片离子峰,m/z 561.5是DHA虾青素双酯分子同时失去两个C22:6脂肪酸链所产生的碎片离子峰,m/z 147.0、m/z 172.7、m/z 201.3都是虾青素两端六元环区裂解、重排后形成的特征碎片离子。通过MS分析可知,虾青素酯的裂解规律是以失去脂肪酸为主要特征。
3 结 论
以DHA与虾青素作为反应底物合成DHA虾青素酯,通过单因素试验优化出最佳反应条件为:虾青素250 mg、DHA 282 mg、无水丙酮5 mL、DMAP 100 mg、EDCI 100 mg,充氮、避光、磁力搅拌,25 ℃反应3 h。合成产物经过硅胶柱纯化后,用C30色谱柱进行梯度洗脱,甲醇和甲基叔丁基醚为流动相,采用HPLCMS/MS法对纯化后样品进行分析,根据二级MS结果分析鉴定出产物主要成分为游离虾青素、DHA虾青素单酯、DHA虾青素双酯。以虾青素为标准品做出标准曲线,采用峰面积归一法进行积分计算出各组分含量,结果表明,最佳反应条件下,产物中DHA虾青素总酯峰面积可达95.67%;其中主要为DHA虾青素双酯(77.46%),部分DHA虾青素单酯(18.21%)和少量游离虾青素(3.24%)。纯化后DHA虾青素单酯纯度为(94.0±0.6)%,DHA虾青素双酯纯度为(98.2±0.5)%。DHA虾青素酯的合成方法是合成不同分子结构虾青素酯的可靠依据,为后续研究不同分子结构虾青素酯的稳定性、生物利用度、生物活性等奠定基础,并为相关功能产品的开发提供原料。
[1] SILA A, NASRI M, BOUGATEF A. Isolation and characterisation of carotenoproteins from deep-water pink shrimp processing waste[J]. International Journal of Biological Macromolecules, 2012, 51(5): 953-959. DOI:10.1016/j.ijbiomac.2012.07.011.
[2] ZHAO L, ZHAO G, CHEN F, et al. Different effects of microwave and ultrasound on the stability of (all-E)-astaxanthin[J]. Journal of Agricultural and Food Chemistry, 2006, 54(21): 8346-8351. DOI:10.1021/jf061876d.
[3] FASSETT R G, COOMBES J S. Astaxanthin in cardiovascular health and disease[J]. Molecules, 2012, 17(2): 2030-2048. DOI:10.3390/ molecules17022030.
[4] HAN D X, LI Y T, HU Q. Astaxanthin in microalgae: pathways, functions and biotechnological implications[J]. Algae, 2013, 28(2): 131-147. DOI:10.4490/algae.2013.28.2.131.
[5] KIDD P. Astaxanthin, cell membrane nutrient with diverse clinical benef ts and anti-aging potential[J]. Alternative Medicine Review: A Journal of Clinical Therapeutic, 2011, 16(4): 355-364.
[6] YASUI Y, HOSOKAWA M, MIKAMI N, et al. Dietary astaxanthin inhibits colitis and colitis-associated colon carcinogenesis in mice via modulation of the inflammatory cytokines[J]. Chemico-Biological Interactions, 2011, 193: 79-87. DOI:10.1016/j.cbi.2011.05.006.
[7] RAO A R, SINDHUJA H N, DHARMESH S M, et al. Effective inhibition of skin cancer, tyrosinase, and antioxidative properties by astaxanthin and astaxanthin esters from the green alga Haematococcus pluvialis[J]. Journal of Agricultural and Food Chemistry, 2013, 61(16): 3842-3851. DOI:10.1021/jf304609j.
[8] TRIPATHI D N, JENA G B. Astaxanthin intervention ameliorates cyclophosphamide-induced oxidative stress, DNA damage and early hepatocarcinogenesis in rat: role of Nrf2, p53, p38 and phase-Ⅱ enzymes[J]. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 2010, 696(1): 69-80. DOI:10.1016/ j.mrgentox.2009.12.014.
[9] MONROY-RUIZ J, SEVILLA M Á, CARRON R, et al. Astaxanthinenriched-diet reduces blood pressure and improves cardiovascular parameters in spontaneously hypertensive rats[J]. Pharmacological Research, 2011, 63(1): 44-50. DOI:10.1016/j.phrs.2010.09.003.
[10] KHAN S K, MALINSKI T, MASON R P, et al. Novel astaxanthin prodrug (CDX-085) attenuates thrombosis in a mouse model[J]. Thrombosis Research, 2010, 126(4): 299-305. DOI:10.1016/ j.thromres.2010.07.003.
[11] MARIN D P, BOLIN A P, MACEDO S, et al. ROS production in neutrophils from alloxan-induced diabetic rats treated in vivo with astaxanthin[J]. International Immunopharmacology, 2011, 11(1): 103-109. DOI:10.1016/j.intimp.2010.10.013.
[12] ISHIKI M, NISHIDA Y, ISHIBASHI H, et al. Impact of divergent effects of astaxanthin on insulin signaling in l6 cells[J]. Endocrinology, 2013, 154(8): 2600-2612. DOI:10.1210/en.2012-2198.
[13] MIKI W. Biological functions and activities of animal carotenoids[J]. Pure and Applied Chemistry, 1991, 63(1): 141-146. DOI:10.1351/ pac199163010141.
[14] GUERIN M, HUNTLEY M E, OLAIZOLA M. Haematococcus astaxanthin: applications for human health and nutrition[J]. Trends in Biotechnology, 2003, 21(5): 210-216. DOI:10.1016/S0167-7799(03)00078-7.
[15] SWANSON D, BLOCK R, MOUSA S A. Omega-3 fatty acids EPA and DHA: health benefits throughout life[J]. Advances in Nutrition, 2012, 3(1): 1-7. DOI:10.3945/an.111.000893.
[16] DOMENICHIELLO A F, CHEN C T, TREPANIER M O, et al. Whole body synthesis rates of DHA from α-linolenic acid are greater than brain DHA accretion and uptake rates in adult rats[J]. Journal of Lipid Research, 2014, 55(1): 62-74. DOI:10.1194/jlr.M042275.
[17] KURATKO C N, BARRETT E C, NELSON E B, et al. The relationship of docosahexaenoic acid (DHA) with learning and behavior in healthy children: a review[J]. Nutrients, 2013, 5(7): 2777-2810. DOI:10.3390/nu5072777.
[18] PICQ M, BEMOUD-HUBAC N, LAGARDE M. Synthesis and biological interest of structured docosahexaenoic acid-containing triacylglycerols and phospholipids[J]. Current Organic Chemistry, 2013, 17(8): 841-847. DOI:10.1002/chin.201333233.
[19] CUNNANE S C, CHOUINARD-WATKINS R, CASTELLANO C A, et al. Docosahexaenoic acid homeostasis, brain aging and Alzheimer’s disease: Can we reconcile the evidence?[J]. Prostaglandins, Leukotrienes and Essential Fatty Acids (PLEFA), 2013, 88(1): 61-70. DOI:10.1016/j.plefa.2012.04.006.
[20] WU F J, XUE Y, LIU X F, et al. The protective effect of eicosapentaenoic acid-enriched phospholipids from sea cucumber Cucumaria frondosa on oxidative stress in PC12 cells and SAMP8 mice[J]. Neurochemistry International, 2014, 64: 9-17. DOI:10.1016/j.neuint.2013.10.015.
[21] FUKAMI H, NAMIKAWA K, SUGIURA-TOMIMORI N, et al. Chemical synthesis of astaxanthin n-octanoic acid monoester and diester and evaluation of their oral absorbability[J]. Journal of Oleo Science, 2006, 55(12): 653-656. DOI:10.5650/jos.55.653.
[22] KOBAYASHI M, SAKAMOTO Y. Singlet oxygen quenching ability of astaxanthin esters from the green alga Haematococcus pluvialis[J]. Biotechnology Letters, 1999, 21(4): 265-269. DOI:10.1023/ A:1005445927433.
[23] HALLDORSSON A, HARALDSSON G G. Fatty acid selectivity of microbial lipase and lipolytic enzymes from salmonid f sh intestines toward astaxanthin diesters[J]. Journal of the American Oil Chemists’Society, 2004, 81(4): 347-353. DOI:10.1007/s11746-004-0905-8.
[24] 苗凤萍. 雨生红球藻(Haematococcus pluvialis)虾青素酯和脂肪酸的鉴定及差异表达基因的分析[D]. 北京: 中国科学院研究生院(武汉植物园), 2007: 28-32.
[25] YUAN J P, CHEN F. Isomerization of trans-astaxanthin to cis-isomers in organic solvents[J]. Journal of Agricultural and Food Chemistry, 1999, 47(9): 3656-3660. DOI:10.1021/jf981319u.
[26] 金兴江, 吴月婵, 仇丹, 等. 虾青素几何异构体的分离、鉴定及抗氧化性能研究[J]. 食品科技, 2010, 35(12): 224-227.
[27] van BREEMEN R B, SCHMITZ H H, SCHWARTZ S J. Fast atom bombardment tandem mass spectrometry of carotenoids[J]. Journal of Agricultural and Food Chemistry, 1995, 43(2): 384-389. DOI:10.1021/ jf00050a024.
Synthesis and Mass Spectrometry Analysis of Docosahexaenoic Acid Astaxanthin Ester
YANG Lu, LI Xuemin, ZHOU Qingxin, LI Zhaojie, XU Jie, XUE Changhu*
(College of Food Science and Engineering, Ocean University of China, Qingdao 266003, China)
In this study, docosahexaenoic acid (DHA) and astaxanthin were applied as reaction substrates to synthesize DHA astaxanthin ester The optimal reaction conditions were determined as follows: 250 mg of astaxanthin 282 mg of DHA, 5 mL of anhydrous acetone, 100 mg of 4-dimethylaminopyridine (DMAP) and, 100 mg of 1-ethyl-3-(3-dimethylaminopropyl) carbodiimide (EDCI), were reacted in a nitrogen atmosphere under dark conditions with magnetic stirring at 25 ℃ for 3 h. As identified by liquid chromatography-mass spectrometry (LC-MS), the synthesized products were composed of free astaxanthin, DHA astaxanthin monoester and DHA astaxanthin diester. Each of these components was analyzed by HPLC-DAD and quantif ed by peak area normalization method. The results showed that under optimum conditions, DHA astaxanthin esters accounted for 95.67% of the total products, mainly DHA astaxanthin diester (77.46%), DHA astaxanthin monoester (18.21%) and small amounts of free astaxanthin (3.24%). DHA astaxanthin diesters and DHA astaxanthin monoesters were separated by silica gel column chromatography with increasing solvent polarity from 100:0 to 92:8 (petroleum ether:acetone, V/V). Finally, the purity of the purif ed DHA astaxanthin diesters and DHA astaxanthin monoesters were (98.2 ± 0.5)% and (94.0 ± 0.6)%, respectively.
astaxanthin; DHA astaxanthin ester; synthesis; isolation and identif cation; mass spectroscopy
10.7506/spkx1002-6630-201702035
TS254.1
A
1002-6630(2017)02-0220-07
杨鲁, 李学敏, 周庆新, 等. 二十二碳六烯酸虾青素酯的合成及质谱分析[J]. 食品科学, 2017, 38(2): 220-226. DOI:10.7506/spkx1002-6630-201702035. http://www.spkx.net.cn
YANG Lu, LI Xuemin, ZHOU Qingxin, et al. Synthesis and mass spectrometry analysis of docosahexaenoic acid astaxanthin ester[J]. Food Science, 2017, 38(2): 220-226. (in Chinese with English abstract)
10.7506/spkx1002-6630-201702035. http://www.spkx.net.cn
2016-06-26
国家自然科学基金面上项目(31571864);“泰山学者攀登计划”建设工程专项
杨鲁(1992—),男,硕士研究生,研究方向为水产品化学。E-mail:yanglusp@163.com
*通信作者:薛长湖(1964—),男,教授,博士,研究方向为水产化学、水产品加工技术、海洋食品功效成分研究与海洋活性物质。E-mail:xuech@ouc.edu.cn

