大黄酚对局灶性脑缺血再灌注小鼠缺血半暗带区环氧化酶2和基质金属蛋白酶-9表达的影响
房亚兰 黄语悠 赵咏梅 李锦程 段云霞 赵海苹 高 利 罗玉敏
(首都医科大学宣武医院 北京市老年病医疗研究中心 神经变性病教育部重点实验室 脑血管病转化医学北京市重点实验室,北京 100053)
· 脑血管病、认知障碍的基础及临床研究 ·
大黄酚对局灶性脑缺血再灌注小鼠缺血半暗带区环氧化酶2和基质金属蛋白酶-9表达的影响
房亚兰 黄语悠 赵咏梅*李锦程 段云霞 赵海苹 高 利 罗玉敏
(首都医科大学宣武医院 北京市老年病医疗研究中心 神经变性病教育部重点实验室 脑血管病转化医学北京市重点实验室,北京 100053)
目的 探究大黄酚(Chrysophanol, CHR)对大脑中动脉梗死(middle cerebral artery occlusion, MCAO)模型小鼠再灌注后脑内环氧化酶2(cyclooxygenase-2, COX2)和基质金属蛋白酶-9(matrix metalloproteinase-9, MMP-9)表达的影响,探讨CHR保护脑缺血再灌注损伤的抗炎机制。方法采用数字表法随机将18只健康雄性C57BL小鼠分为3组:假手术(Sham)组、MCAO组、CHR组(小鼠造模当天按0.1 mg/kg腹腔注射CHR,此后每天1次,连续给药14 d),每组6只。使用线栓法制作小鼠右侧大脑中动脉缺血45 min再灌注模型。术中监测小鼠肛温,使其维持在正常范围。于再灌注后14 d处死小鼠,迅速取脑,用免疫荧光染色检测小鼠脑组织冰冻切片缺血半暗带区COX2和MMP-9的表达,并用免疫荧光双标法对COX2和MMP-9在缺血脑组织的表达进行细胞定位。结果1)Sham组小鼠偶见COX2或MMP-9染色阳性细胞。与Sham组相比,MCAO组小鼠脑缺血半暗带区COX2和MMP-9的表达明显增高(P<0.05)。2)与MCAO组相比,给予CHR治疗后,缺血再灌注小鼠脑缺血半暗带区COX2和MMP-9的表达均明显减少(P<0.05)。3)缺血再灌注小鼠脑缺血半暗带区,COX2或MMP-9免疫荧光染色分别与神经元标志物NeuN免疫荧光染色共定位。结论CHR可能通过抑制COX2和MMP-9的蛋白表达,减轻炎性反应,从而对脑缺血再灌注损伤发挥长期的神经保护作用。
脑缺血;大黄酚;炎性反应;大脑中动脉梗死;环氧化酶2;基质金属蛋白酶-9
缺血性脑卒中是由于脑血管狭窄或闭塞导致脑组织供血障碍引起的神经系统损害。它是造成成人永久性残疾的主要原因,也是世界范围内导致死亡的直接原因之一[1]。脑缺血/再灌注损伤机制非常复杂,有众多的细胞因子参与其中,最终启动凋亡信号通路,导致神经元凋亡或死亡。其中,炎性反应在缺血性脑损伤过程中扮演着重要的角色[2-3]。因而,抑制脑缺血/再灌注过程中的炎性反应是一个颇具吸引力的治疗策略[4]。
在中国,应用大黄治疗脑损伤的历史悠久,大黄酚(Chrysophanol, CHR)是大黄蒽醌类中一种纯化的活性成分[5],一些研究[6-7]表明,CHR对脑缺血再灌注损伤具有神经保护作用。但目前关于CHR在神经保护作用方面的相关机制的基础研究还十分有限。
环氧化酶2(cyclooxygenase-2, COX2)是花生四烯酸合成炎性介质前列腺素的限速酶,生理状态下,COX2几乎不表达[8]。研究[9]表明,局灶性脑缺血大鼠缺血30 min时,COX2在缺血半暗带区及扣带回的表达显著增加,抑制COX2的表达能减轻脑缺血损伤[10]。基质金属蛋白酶-9(matrix metalloproteinase-9, MMP-9)是基质金属蛋白酶(matrix metalloproteinase, MMPs)家族成员之一,能特异性地降解胶原蛋白、弹性蛋白等细胞外基质,在缺血性脑梗死病人的血清中,MMP-9显著增加[11]。研究[12]显示,敲除MMP-9基因的脑缺血再灌注小鼠能显著减小脑梗死体积,降低脑缺血损伤,表明MMP-9与脑缺血损伤过程密切相关。因此,本研究采用大脑中动脉梗死(middle cerebral artery occlusion, MCAO)再灌注模型小鼠,观察CHR对模型小鼠脑缺血再灌注后14 d COX2和MMP-9表达的影响,从而进一步探讨CHR长期拮抗脑缺血再灌注损伤的抗炎机制。
1 材料与方法
1.1 主要仪器设备
小动物手术显微镜(Carl Zeiss公司,德国)、麻醉机(Harvard Apparatus公司,美国)、反馈式温度调节仪(CMA 150,Carnegie Medicin公司,瑞典)、双极电凝器(德威公司,DEVEL,ACC100)、荧光显微镜(Nikon公司,日本)。
1.2 试剂
恩氟烷(河北一品制药有限公司);CHR(中国食品药品检定研究院);Tween 80(Sigma公司,美国);COX2抗体(CST公司,美国);MMP-9抗体(Abcam公司,美国);NeuN抗体(Millipore公司,美国)等。
1.3 实验动物及分组
2月龄健康雄性C57BL小鼠,实验动物许可证号:SCXK(京) 2012-0001(北京维通利华实验动物公司),体质量(23.5±1) g,于SPF级动物实验室饲养。将18只小鼠按照数字表法随机分为3组:假手术(Sham)组、MCAO组、CHR组。CHR溶于含有1%(体积分数) Tween 80和1%(体积分数) DMSO的0.9%(质量分数)的氯化钠注射液中,CHR组小鼠造模当天按0.1 mg/kg腹腔注射CHR,此后每天1次,连续给药14 d,Sham组和MCAO组小鼠腹腔注射同等体积的含1%(体积分数) Tween 80和1%(体积分数) DMSO的0.9%(质量分数)的氯化钠注射液。
1.4 动物模型制作
MCAO模型按照改良ZeaLonga法制备。将恩氟烷混合于70%(体积分数)N2O和30%(体积分数)O2中,首先用5%(体积分数)恩氟烷诱导麻醉,然后用面罩吸入2%(体积分数)恩氟烷维持麻醉。于小鼠颈部沿正中线切口,分离右侧的颈总动脉、颈外动脉和颈内动脉,将头端直径为0.38 mm的尼龙线栓自颈外动脉残端插进颈内动脉,到达距颈外动脉和颈内动脉分叉约1 cm处。使用反馈性控温毯监测术中小鼠肛温,将其维持在(37.0±0.5)℃。缺血45 min后,将线栓小心地拔出进行再灌注。术后小鼠饲养于SPF级动物实验室14 d,自由进食饮水。
1.5 免疫荧光双标
各组小鼠于造模后14 d,用水合氯醛腹腔注射麻醉后,快速断头取脑,于4%(质量分数)多聚甲醛后固定48 h,30%(质量分数)蔗糖脱水24 h,行连续冰冻切片(厚度为20 μm)。将脑组织冰冻切片经PBS洗后,用含有0.2%(体积分数)TritonX-100的PBS孵育约10 min,PBS洗后,用5 %(体积分数)的山羊血清在室温下封闭30 min,滴加一抗(COX2兔多克隆抗体 1∶100,MMP-9兔多克隆抗体 1∶500,NeuN鼠多克隆抗体 1∶300),4 ℃孵育过夜。次日将切片取出,PBS洗后,滴加山羊抗兔和山羊抗鼠荧光二抗(1∶300),在室温下避光孵育1 h。PBS洗后,最终用含DAPI(4’,6-diamidino-2-phenylindole)的封片剂封片。在荧光显微镜下观察脑皮质半暗带区[9]。阴性对照组用PBS代替一抗。在相同放大倍数下,使用相同参数,每张脑组织冰冻切片随机选取4个视野照相,用NIS Element软件统计COX2和MMP-9的阳性细胞数目。
1.6 统计学方法
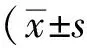
2 结果
2.1 CHR抑制MCAO小鼠脑缺血半暗带区COX2的表达
免疫荧光染色结果可见,Sham组小鼠脑组织偶见COX2绿色荧光染色;在MCAO小鼠缺血侧额顶叶皮质和纹状体有大量的COX2阳性细胞,MCAO组小鼠缺血半暗带区COX2染色阳性细胞显著增加;与MCAO组相比,CHR组小鼠缺血半暗带区COX2染色阳性细胞数目显著减少(图1 A),差异具有统计学意义(P<0.05,图1 B)。
2.2 CHR抑制MCAO小鼠脑缺血半暗带区MMP-9的表达
免疫荧光染色结果显示,Sham组小鼠脑组织可见少量MMP-9绿色荧光染色,散在分布于大脑皮质和海马组织。MCAO组小鼠脑缺血半暗带区MMP-9染色阳性细胞明显增多。与MCAO组相比,CHR组小鼠脑缺血半暗带区MMP-9的表达明显减少(图2 A),差异具有统计学意义(P<0.05,图2 B)。
2.3 MCAO小鼠脑缺血半暗带区域COX2、MMP-9与NeuN共定位
免疫荧光双标结果可见,在MCAO小鼠脑缺血半暗带区域COX2阳性细胞及MMP-9阳性细胞,均呈绿色荧光。NeuN染色阳性细胞呈红色荧光。所有细胞的胞核为蓝色荧光。合并图像后,发现绿色与红色荧光相重合,表明COX2和MMP-9与神经元共定位,该结果提示,脑缺血再灌注后神经元内COX2及MMP-9的表达增加(图1、2)。

图1 Sham组、MCAO组及CHR组小鼠再灌注14 d脑缺血半暗带区COX2/NeuN免疫荧光双标结果
A:representative double immunofluorescence staining for COX2 (green) and neuron-specific NeuN (red) on 14th day after reperfusion. Bar=20μm. B: comparison of the numbers of COX2-positive immunoreactive cells in Sham, MCAO and CHR group mice.*P<0.05vssham group,#P<0.05vsMCAO group,n=5; MCAO: middle cerebral artery occlusion; DAPI: 4’,6-diamidino-2-phenylindole; CHR:Chrysophanol.
A:representative double immunofluorescence staining for MMP-9 (green) and neuron-specific NeuN (red) on 14th day after reperfusion. Bar=20μm. B: comparison of the numbers of MMP-9-positive immunoreactive cells in Sham, MCAO and CHR group mice.*P<0.05vsSham group,#P<0.05vsMCAO group,n=5; MCAO: middle cerebral artery occlusion; DAPI: 4’,6-diamidino-2-phenylindole;CHR:Chrysophanol;MMP-9:matrix metalloproteinase-9.
3 讨论
炎性反应可增加缺血性卒中的严重程度,在脑缺血再灌注损伤过程中发挥了重要作用[2]。核因子-κΒ(nuclear factor-kappa Β, NF-κΒ)是一个参与调节多种炎性细胞因子表达的核转录因子,在许多炎性疾病中发挥举足轻重的作用。据报道[13],NF-κB的活化与缺血再灌注损伤过程中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)及白介素-1β(interleukin-1β,IL-1β)浓度的显著升高有关。本课题组最新的研究[14]表明,再灌注后14 d,CHR仍能显著抑制MCAO小鼠脑缺血半暗带区内NF-κΒ的活化和TNF-α、IL-1β的表达,提示CHR通过抑制NF-κΒ的活化,下调TNF-α、IL-1β的表达,进而发挥长期的神经保护作用。然而有关CHR神经保护作用的相关机制目前尚不十分清楚,本研究通过免疫荧光染色方法检测脑缺血半暗带区COX2和MMP-9的表达情况,进一步探讨CHR拮抗脑缺血再灌注损伤的抗炎机制。
NF-κΒ信号通路和COX2广泛参与脑缺血再灌注中的炎性反应[15-18]。NF-κΒ p65从细胞质转位到细胞核引起NF-κΒ的活化,进而促进应答基因的转录。COX2是NF-κΒ的一个下游靶基因,活化的NF-κΒ可以促使COX2基因转录,已有研究[9-10,15]表明,脑缺血可引起COX2的产生,介导有害的炎性反应,参与脑缺血损伤。为了阐明CHR减轻脑缺血损伤炎性反应的机制,本研究采用免疫荧光染色方法观察CHR对MCAO小鼠脑缺血半暗带区COX2表达的影响。结果显示,MCAO小鼠再灌注14 d时脑缺血半暗带区COX2的表达仍比Sham组显著增加,高表达的COX2可促使促炎介质和氧自由基的增多,也能直接损伤神经细胞,导致细胞死亡[16,19],因此,本研究中MCAO小鼠再灌注14 d时 COX2表达增加,可加重脑缺血损伤。给予MCAO小鼠CHR治疗14 d后,脑缺血半暗带区COX2的表达明显减少,说明CHR对COX2的产生有抑制作用。本课题组最近的研究[14]结果显示,CHR能显著改善MCAO小鼠再灌注后14 d的神经功能评分,明显减少因脑缺血导致的脑组织损失,并且抑制NF-κΒ的活化。结合本研究结果,提示CHR可能通过抑制NF-κΒ活化,减少COX2的表达,进而减轻炎性损伤,发挥长期的神经保护作用。
已有研究[12]表明,急性脑梗死病人血清中MMP-9的浓度与脑梗死体积呈正相关,且COX2和MMP-9的表达呈正相关[20]。为了进一步阐明CHR拮抗脑缺血损伤的机制,本研究采用免疫荧光染色法观察CHR对MCAO小鼠脑缺血半暗带区MMP-9表达水平的影响。结果表明,MCAO小鼠再灌注14 d时脑缺血半暗带区MMP-9的表达仍比Sham组显著增多,提示此时MMP-9仍参与脑缺血损伤。本课题组最近的研究[14]表明,CHR能抑制MCAO小鼠脑组织内NF-κΒ的活化,而活化的NF-κΒ可诱导MMP-9转录[21],因此,在本研究中,CHR可能通过抑制NF-κΒ的活化,进而抑制了MMP-9的表达。有关癌症的研究[20]显示,COX2可能通过促进前列腺素合成,间接促进MMP-9表达,也可能直接促进MMP-9产生。因此,本研究中,给予CHR治疗的MCAO小鼠,其MMP-9的表达显著减少,可能是CHR通过降低COX2的表达实现的。
COX2参与远隔缺血预适应对大鼠脑缺血再灌注损伤的保护作用[10],敲除MMP-9基因的MCAO小鼠再灌注后脑梗死体积明显降低[12],抑制脑缺血再灌注大鼠脑内COX2和MMP-9的表达,能有效改善其神经细胞凋亡[22-23]。为了阐明MCAO小鼠脑缺血半暗带区COX2、MMP-9是否在神经元中的表达增加,本研究采用免疫荧光双标染色法将COX2和MMP-9分别与神经元标志物NeuN进行共染色。结果显示,MCAO小鼠脑缺血半暗带区COX2和MMP-9分别与神经元共定位,提示COX2和MMP-9很可能参与脑缺血再灌注损伤过程中神经元的凋亡。
本研究以上的结果提示,给予MCAO小鼠CHR治疗能降低COX2的表达,进而抑制MMP-9的表达,减轻炎性反应,从而对脑缺血再灌注损伤起到长期的神经保护作用。本研究进一步为深入探讨CHR发挥神经保护作用的抗炎机制提供了相关的科学依据。
[1] Heron M. Deaths: leading causes for 2010 [J]. Natl Vital Stat Rep, 2013, 62(6): 1-96.
[2] Herz J, Hagen S I, Bergmuller E, et al.Exacerbation of ischemic brain injury in hypercholesterolemic mice is associated with pronounced changes in peripheral and cerebral immune responses [J]. Neurobiol Dis, 2014, 62: 456-468.
[3] Cheng C Y, Lee Y C. Anti-inflammatory effects of traditional Chinese medicines against ischemic injury in in vivo models of cerebral ischemia [J]. Evid Based Complement Alternat Med, 2016, 2016: 5739434.
[4] Qin W Y, Luo Y, Chen L, et al. Electroacupuncture could regulate the NF-κB signaling pathway to ameliorate the inflammatory injury in focal cerebral ischemia/reperfusion model rats [J]. Evid Based Complement Alternat Med, 2013, 2013: 924541.
[5] 房亚兰, 罗玉敏, 赵咏梅. 大黄对缺血性脑血管病的保护作用及机制研究 [J].首都医科大学学报, 2015, 36(5): 718-722.
[6] Zhang N, Zhang X, Liu X, et al. Chrysophanol inhibits NALP3 inflammasome activation and ameliorates cerebral ischemia/reperfusion in mice [J]. Mediators Inflamm, 2014, 2014: 370530.
[7] 李超, 张丹参, 赵晓倩, 等. 三种大黄酚制剂改善脑缺血/再灌注小鼠记忆功能的实验筛选研究 [J]. 中国药理学通报, 2010, 26(12): 1607-1612.
[8] 龙洁, 张在强, 路敦跃. 钙离子拮抗剂对大鼠局灶性脑缺血环氧化酶-2的影响 [J]. 首都医科大学学报, 2000, 21(3): 214-216.
[9] Yokota C, Kaji T, Kuge Y, et al.Temporal and topographic profiles of cyclooxygenase-2 expression during 24 h of focal brain ischemia in rats [J]. Neurosci Lett, 2004, 357(3): 219-222.
[10]尹洁, 闫峰, 李森, 等. 环氧化酶2参与远隔缺血预适应对大鼠脑缺血再灌注损伤的保护作用 [J]. 中国神经免疫学和神经病学杂志, 2014, 21(3): 166-169.
[11]Lucivero V, Prontera M, Mezzapesa D M, et al. Different roles of matrix metalloproteinases-2 and -9 after human ischemic stroke [J]. Neurol Sci, 2007, 28(4): 165-170.
[12]Suofu Y, Clark J F, Broderick J P, et al. Matrix metalloproteinase-2 or -9 deletions protect against hemorrhagic transformation during early stage of cerebral ischemia and reperfusion [J]. Neuroscience, 2012, 212: 180-189.
[13]Chen S, Zhu J, Chen G, et al. 1,25-Dihydroxyvitamin D3 preserves intestinal epithelial barrier function from TNF-ainduced injury via suppression of NF-kB p65 mediated MLCK-P-MLC signaling pathway [J]. Biochem Biophys Res Commun, 2015, 460(3): 873-878.
[14]Zhao Y, Fang Y, Li J, et al. Neuroprotective effects of Chrysophanol against inflammation in middle cerebral artery occlusion mice [J]. Neurosci Lett, 2016, 630: 16-22.
[15]Kang B K, Kim M K, Kim S Y, et al. Anti-neuroinflammatory effects of Uncaria sinensis in LPS-stimulated BV2 microglia cells and focal cerebral ischemic mice [J]. Am J Chin Med, 2015, 43(6): 1099-1115.
[16]张艳桥, 张一娜, 陈仁武, 等. 细胞周期蛋白D1在环加氧酶-2诱导的大鼠神经细胞死亡中的作用 [J]. 中风与神经疾病杂志, 2005, 22(4): 335-337.
[17]李春明, 舒适,钱小路,等. 自噬与脑缺血-再灌注损伤的研究进展[J]. 中国脑血管病杂志,2015,12(6) :330-333.
[18]胡瑞, 张晓云,晏雪,等. 脑出血后炎性反应机制的研究进展[J]. 中国脑血管病杂志,2015,12(7) :370-374.
[19]Yu L, Yang B, Wang J, et al. Time course change of COX2-PGI2/TXA2 following global cerebral ischemia reperfusion injury in rat hippocampus [J]. Behav Brain Funct, 2014, 10: 42.
[20]孙春雷, 王祥军,周士福,等. 乳腺浸润性导管癌中COX-2、MMP-9的表达及临床意义[J]. 现代肿瘤医学, 2010, 18(3): 480-482.
[21]Adya R, Tan B K, Chen J, et al. Nuclear factor-κB induction by visfatin in human vascular endothelial cells:its role in MMP-2/9 production and activation [J]. Diabetes Care, 2008, 31(4): 758-760.
[22]Nakayama M, Uchimura K, Zhu R L, et al. Cyclooxygenase-2 inhibition prevents delayed death of CA1 hippocampal neurons following global ischemia [J]. Proc Natl Acad Sci U S A, 1998, 95(18): 10954-10959.
[23]Gu Z, Cui J, Brown S, et al. A highly specific inhibitor of matrix metalloproteinase-9 rescues laminin from proteolysis and neurons from apoptosis in transient focal cerebral ischemia [J]. J Neurosci, 2005, 25(27): 6401-6408.
编辑 陈瑞芳
Effects of chrysophanol on the expressions of cyclooxygenase-2 and matrix metalloproteinase-9 in the penumbra of mice following focal cerebral ischemia/reperfusion
Fang Yalan, Huang Yuyou, Zhao Yongmei*, Li Jincheng, Duan Yunxia, Zhao Haiping, Gao Li, Luo Yumin
(XuanwuHospital,CapitalMedicalUniversity,BeijingGeriatricMedicalResearchCenter,KeyLaboratoryofNeurodegenerativeDiseasesofMinistryofEducation,BeijingKeyLaboratoryofTranslationalMedicineforCerebrovascularDiseases,Beijing100053,China)
Objective To explore the effects of Chrysophanol (CHR) on the expression levels of cyclooxygenase-2 (COX2) and matrix metalloproteinase-9 (MMP-9) in mice with middle cerebral artery occlusion (MCAO)/reperfusion injury and to investigate the potential anti-inflammatory mechanism of CHR. Methods Eighteen male C57BL mice were divided into 3 groups randomly: Sham group (n=6), MCAO group (n=6), and CHR group [mice received 0.1 mg/kg CHR (i.p.) for 14 days after ischemia/reperfusion]. MCAO was induced by using the suture method. The mice underwent 45 min of right MCAO, and then reperfusion by withdrawing filament. Rectal temperature was monitored and kept in normal range during the operation. The mice were sacrificed and the brains were harvested on 14 d after reperfusion. The expressions of COX2 and MMP-9 were detected by immunofluorescent staining. And the cellular location of COX2 and MMP-9 were detected by double immunofluorescence labeled antibody technique. Results 1) In Sham group, little COX2 positive cells and MMP-9 positive cells were observed. Compared with Sham group, the number of COX2 positive cells and MMP-9 positive cells increased significantly in the penumbra of MCAO group (P<0.05). 2) Compared with MCAO group, the number of COX2 positive cells and MMP-9 positive cells decreased significantly in the penumbra of MCAO+CHR group on day 14 after reperfusion (P<0.05). 3) COX2-positive immunoreactive cells were colocalized with the general neuronal marker, NeuN, in the penumbra of ischemia/reperfusion mice. And MMP-9-positive immunoreactive cells were colocalized with NeuN. Conclusion CHR has long-term neuroprotective effect against ischemia/reperfusion injury which might be attributed to its anti-inflammatory actions by decreasing the expression of COX2 and MMP-9.
cerebral ischemia; Chrysophanol; inflammatory middle cerebral artery occlusion; cyclooxygenase-2; matrix metalloproteinase-9
国家临床重点专科(中医,财社122号),北京市自然科学基金(7122036)。This study was supported by National Key Clinical Specialty (Traditional Chinese Medicine, No.122),Natural Science Foundation of Beijing (7122036).
时间:2017-01-17 23∶22
http://www.cnki.net/kcms/detail/11.3662.R.20170117.2322.010.html
10.3969/j.issn.1006-7795.2017.01.010]
R 743.3
2016-11-28)
*Corresponding author, E-mail:yongmeizhao@hotmail.com

