基质湿度对黄芪幼苗防御应答及根际微生物的影响
信小娟,孙海峰,李玉成,丛建华
(大兴安岭林业集团公司农业林业科学研究院,黑龙江加格达奇165000)
基质湿度对黄芪幼苗防御应答及根际微生物的影响
信小娟,孙海峰,李玉成,丛建华
(大兴安岭林业集团公司农业林业科学研究院,黑龙江加格达奇165000)
通过考察基质湿度对黄芪幼苗防御应答及根际微生物的影响,了解土壤水分在黄芪药材品质形成中的可能作用。采用渗灌控水方式控制盆栽黄芪基质水分,分光光度法测定黄芪幼苗根、茎、叶绿叶挥发物(green leaf volatiles, GLVs)合成途径关键酶——脂肪氧合酶(lipoxygenase, LOX)和苯丙烷类类物质合成关键酶——苯丙氨酸解氨酶(phenylalanin ammonia-lyase, PAL)活性和总黄酮含量,梯度稀释法测定根际细菌和真菌数量,SPSS软件进行数据分析。结果表明,高水分含量(81.6%)导致黄芪幼苗根际微生物数量显著下降,叶PAL和根LOX活性显著升高,但根中的总黄酮含量明显低于低湿度组的。相比较而言,低湿度组黄芪根际真菌和细菌数量无明显变化,且叶LOX活性较高。基质水分含量是影响黄芪黄酮合成与积累的重要因素,高基质湿度不利于黄芪黄酮类物质的合成与积累且很可能与根中高LOX活性有关,低基质湿度下较为稳定的根际微生物群落很可能是黄芪幼苗中黄酮类物质的合成与积累的有益因素。
黄芪;基质湿度;绿叶挥发物;异黄酮;根际微生物
黄芪[Astragalusmembranaceus(Fisch.) Bunge]为常见补益类中药,在抗肿瘤、抗疲劳、增强免疫等方面有着广泛的临床应用。黄芪的品质源于其内在含有的皂苷类、黄酮类、多糖类等有效成分以及相互之间的综合作用[1-4],而上述有效成分的积累与黄芪药材的生长环境有着密切的联系。
近年来针对环境因素对于黄芪品质的影响以及对黄芪有效成分调控机制的研究已有不少研究报道[5-9],其中涉及黄酮类成分较多,但土壤水分对黄芪品质形成及其根际微生物的影响,尚未见文献报道。由于黄芪药材中C6挥发物与其品质相关,所以在研究药材品质形成中,除考虑活性物质的合成和积累外,还应考虑该类挥发物的作用[4,10]。
本研究即通过控制盆栽黄芪基质湿度,模拟黄芪生境中不同的土壤水分,研究土壤水分对黄芪幼苗绿叶挥发物合成途径关键酶—脂肪氧合酶(lipoxygenase, LOX)和苯丙烷合成途径关键酶—苯丙氨酸解氨酶(phenylalanin ammonia-lyase, PAL)活性、总黄酮含量和根际微生物的影响,以了解土壤水分在黄芪药材品质形成中的可能作用和机制。
1 材料与方法
1.1 实验材料
黄芪种子采集于山西浑源黄芪GAP基地,基源为蒙古黄芪(Astragalusmembranaceusvar.mongholicus)。暗培养箱中25℃萌发种子,萌发后移栽于不同基质湿度的营养钵中,光照培养8周,明暗周期为14h/10h,对应温度为20℃/16℃。每组3个平行,每个平行5株植物。2周喷施液体肥料1次,间隔周喷以相同体积的自来水。整个实验过程中严格控制喷施量,以保证基质水分恒定。
盆栽培养结束时,收集黄芪幼苗根、茎、叶和根际与非根际基质,植物材料液氮速冻后-80℃保存备用,根际土样4℃保存,1周内完成后续实验。
1.2 基质水分测定
参照《中华人民共和国药典》(2010版)方法测定。1.3 根际微生物计数
采用梯度稀释法,取适量稀释液接种于LB和马丁氏琼脂平板中,前者于37℃培养48h,后者于28℃培养72h,进行计数。每组样品测定3个样本,记录CFU数量。
1.4 LOX与PAL活性测定
参照谢道生等、赵则海等方法制备粗酶提取液,并进行酶活性测定[10-11]。
1.5 黄芪总黄酮的含量测定
参照文献[11]进行。
1.6 数据处理与分析
每组数据均为3个平行的平均值±标准偏差,SPSS 16.0软件进行差异显著性分析。
2 实验结果
2.1 基质湿度对黄芪幼苗根际微生物菌落的影响
以黄芪幼苗生长前基质为对照,对实验结束后基质水分含量和根际微生物数量进行了计数,结果见表1。实验分为高湿度组和低湿度组,其中低湿度组水分含量与对照间无显著差异,而高湿度组明显高于二者。细菌和真菌数量与水分含量变化特征一致,低湿度组根际细菌、真菌数量与对照间无显著差异,高湿度组根际细菌和真菌数量明显减少。简言之,高基质湿度是影响黄芪根际微生物菌群数量的重要环境因子之一。

表1 基质湿度对黄芪幼苗根际微生物数量的影响
注:不同的字母表示组间存在显著性差异,P<0.05;表2~4同。
2.2 基质湿度对黄芪幼苗LOX的影响
黄芪幼苗根、茎、叶LOX活性测定结果见表2。从该表可以看出,基质湿度对黄芪幼苗LOX活性的影响主要体现在叶片和根,对茎影响较小,高湿度与低湿度组茎LOX无显著差异。在叶片中,高基质湿度导致LOX活性显著降低。而在根中,基质高水分含量引起根LOX活性的显著升高。该结果表明,黄芪幼苗地上和地下部分对土壤水分的响应存在明显差异。相同湿度组黄芪幼苗不同部位LOX活性的t-检验结果表明,高湿度组幼苗不同部位LOX活性无显著差异,而低湿度组茎叶间存在显著差异。换言之,土壤水分含量低时,黄芪茎叶C6挥发物合成响应存在差异,叶片C6挥发物合成途径关键酶LOX活性显著增加。
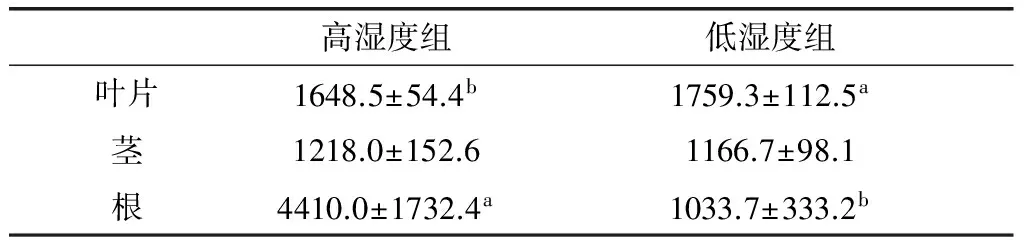
表2 基质湿度对黄芪幼苗
2.3 基质湿度对黄芪幼苗PAL活性的影响
已有研究表明,苯丙氨酸解氨酶(PAL)是黄芪黄酮类物质合成的关键酶,在该类物质合成与积累中起着关键作用[12]。黄芪幼苗不同部位PAL测定结果见表4。从该表可以看出,PAL在黄芪幼苗根和茎中较为稳定,2组数据间无显著差异。但是,PAL活性在叶片组织中明显不同,基质高湿度导致叶片PAL活性显著升高,即由基质湿度引起的黄芪幼苗苯丙烷代谢途径主要响应部位为叶片,明显有别于GLVs合成途径的主要响应部位。具体而言,高湿度基质有助于黄芪叶片PAL活性升高。不同部位间PAL活性t-检验结果表明,高湿度组茎叶PAL活性无显著差异,但二者与根存在显著差异。低湿度组中,根、茎、叶三者间PAL活性均存在显著差异,特别是叶与茎、根之间差异极显著,茎叶组织中活性远高于根。换言之,无论基质湿度高低,黄芪幼苗中的主要响应部位均为地上茎叶,特别是叶片,响应最高。

表3 基质湿度对黄芪幼苗不同部位
2.4 基质湿度对黄芪幼苗总黄酮积累的影响
从表4可见,基质湿度对黄芪幼苗茎叶总黄酮含量影响较小,高、低湿度组间茎叶含量均无显著差异。但是,基质湿度显著影响着根中总黄酮含量,低基质湿度组总黄酮含量显著高于低湿度组,即低基质湿度有利于黄酮类物质在根中的积累。相同湿度组内不同部位t-检验结果表明,高湿度组黄芪幼苗叶与茎、叶与根之间存在显著差异,与PAL活性分析结果正好相反。
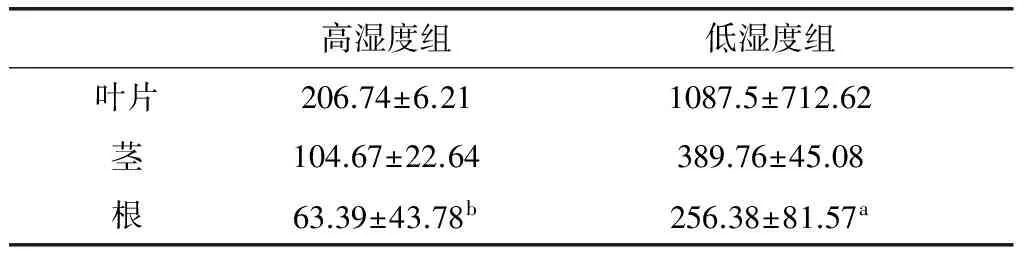
表4 基质湿度对黄芪幼苗
综上所述,基质湿度影响着黄芪防御应答。较低的基质湿度对黄芪黄酮合成的关键酶PAL活性和总黄酮积累影响更大,且响应部位主要为根。
3 讨论
赵则海等通过比较攀援型和矮生型四棱豆苯丙氨酸解氨酶活性和黄酮含量发现,PAL活性均为种子最高,嫩豆荚最低;总黄酮含量均为叶最高,储藏器官块根最低[13]。黄檗(PhellodendronamurenseRupr.)是我国名贵中药关黄柏的药源植物,黄檗生物碱是其主要药效成分。李霞等发现,轻度干旱有利于黄檗根茎外皮中生物碱的合成与积累,水涝处理则导致幼苗生物碱的含量显著降低[14]。在抗旱性不同的甘蔗中,10%聚乙二醇胁迫2h~14h,幼苗叶片中PAL活性均呈现先降低后升高的变化规律,但类黄酮含量在抗旱性强的品种中降低,而在抗旱性弱的品种中先降低后升高[15]。本研究中,无论是低湿度条件下生长的黄芪幼苗、还是高湿度条件下的黄芪幼苗,叶片中总黄酮含量均较高,但低基质湿度促进了药用部位根中黄酮类物质的积累。但PAL活性变化与总黄酮积累并不一致,在高湿度组幼苗叶片中活性最高。
在本研究中,高基质湿度导致黄芪幼苗根际可培养微生物数量减少,即引起根际菌群的明显改变,同时伴随着根LOX活性的显著增加。同时,低湿度组菌群可培养微生物数量与对照间无显著差异,并伴随着总黄酮积累的增加。该结果是不是意味着土壤水分在维系黄芪根际微生物平衡中发挥着重要作用,稳定的根际微生态在药材品质形成中发挥着重要作用。为了解释该问题,我们有必要从环境因子影响根际微生物与植物互作的角度,从多个层次研究药用植物黄芪中黄酮类物质积累机制。
[1]Sinclair, S. Chinese herbs: a clinical review of Astragalus, Ligusticum, and Schizandrae[J]. Altern Med Rev ,1998, 3, 338-344.
[2]Ma, X. Q.; Shi, Q.; Duan, J. A.; Dong, T. T.; Tsim, K. W. Chemical analysis of Radix Astragali (Huangqi) in China: a comparison with its adulterants and seasonal variations[J]. J Agric Food Chem ,2002, 50, 4861-4866.
[3]Wagner, H.; Bauer, R.; Xiao, P. G..; Chen, J. M.; Michler, G. Radix Astragali (Huang Qi)[J]. Chinese Drug Monographs and analysis, 1997, 1, 1-17.
[4]Sun Hai-feng, Xie Dao-sheng, Wu Bin, Qin Xue-mei, et al. The Study on the Relevance Between Beany Flavor and Main Bioactive Components in Radix Astragali[J]. J Agric Food Chem ,2010,58,5568-5573.
[5]胡明勋,陈安家,郭宝林,等. 影响山西恒山野生蒙古黄芪的环境因素研究[J]. 中草药, 2012, 43: 984-989.
[6]曹建军. 中药黄芪种质资源及环境因素对品质的影响[D]. 咸阳:西北农林科技大学,2006.
[7]白效令,魏玲,苏森旺.北岳恒山黄芪的品质优势研究[J].中草药,1994,25:317-319.
[8]王渭玲,王振,徐福利. 氮、磷、钾对膜荚黄芪生长发育及有效成分的影响[J]. 中国中药杂志,2008, 33: 1802-1806.
[9]张庆芝,吴晓俊,刘涤,等. 影响黄芪有效成分含量的因子的研究[J]. 中草药,2002, 33(4): 314-315.
[10]谢道生, 武滨, 孙海峰, 等. 浑源黄芪药材豆腥味与品质关联性探讨—脂肪氧合酶提取及影响酶活因素的研究[J]. 世界科学技术-中医药现代化,2009,11(3):375-381.
[11]赵则海,邱卓荣,陈雄伟,等. 攀援型和矮生型四棱豆苯丙氨酸解氨酶活性和黄酮含量的研究[J]. 生态环境学报,2011, 20(11): 1670-1674.
[12]Liu R, Xu S, Li J, Hu Y, Lin Z. Expression profile of a PAL gene from Astragali membranceus var. Mongholicus and its crucial role in flux into flavonoid biosynthesis[J]. Plant Cell Rep, 2006, 25: 705-710.
[13]赵则海, 邱卓荣, 陈雄伟, 等.攀援型和矮生型四棱豆苯丙氨酸解氨酶活性和黄酮含量的研究[J]. 生态环境学报,2011,20(11):1670-1674.
[14]李霞,王洋,阎秀峰.水分胁迫对黄檗幼苗三种生物碱含量的影响[J].生态学报,2007,27(1): 58-64.
[15]周桂,李杨瑞,杨丽涛,等.干旱胁迫下甘蔗叶类黄酮及相关酶活性的变化[J]. 干旱地区农业研究, 2009, 27(6): 185-203.
Effects of Matrix Moisture on Defense Response and Rhizosphere Microbial Communities ofAstragalusmembranaceusvar.mongholicusSeedlings
Xin Xiaojuan,Sun Haifeng,Li Yucheng,Cong Jianhua
(Forest Group Company of Agroforestry Sciences Academy of Daxing anling,Jiagedaqi,Heilongjiang 165000)
To find out potential role of soil water on quality formation of Astragali Radix by exploring effects of matrix moisture on defense response and rhizosphere microbial communities ofAstragalusmembranaceusvar.monghoseedlings. The matrix moisture was controlled by the method of root-sphere osmotic irrigation, isoflavone content and activities of lipoxygenase (LOX) and phenylalanin ammonia-lyase (PAL) involved in the biosynthese of green leaf volatiles (GLVs) and isoflavones respectively, were determined by spectrophotometry; colony forming units (CFU) of rhizosphere bacteria and fungi were counted by gradient dilution method, resulting data was analyzed by SPSS software. Results: Higher matrix moisture (81.6%) not only resulted in significant decrease in both rhizosphere bacterial and fungal CFUs and significant increase in leaf PAL and root LOX activities but lead to lower isoflavone content in roots. Comparatively, lower matrix moisture resulted in higher leaf LOX activities and relatively steady rhizosphere microbial communities and their CFUs were at the same level to the ones before planting. Matrix moisture affected the biosynthesis and accumulation of isoflavone compounds, and higher moisture adverse to the process, which might be caused by higher root LOX activity. Steady rhizosphere microbial communities in lower moisture level might benefit to the biosynthesis and accumulation of isoflavones.
Astragalusmembranaceusvar.mongholicusSeedlings; Matrix moisture; Green leaf volatiles; Isoflavone; Rhizosphere microbiota
2016-10-28
信小娟(1967-),女,高级工程师,从事中草药种植研究,E-mail:Xinxiaojuan323@163.com; *通讯作者:孙海峰,副教授,从事中药质量评价与品质形成研究, E-mail:haifeng@sxu.edu.cn。
S567.23
A
DOI.:10.13268/j.cnki.fbsic.2017.01.003

