应用合成生物学策略改良光合蓝细菌
孙韬,陈磊,张卫文
天津大学化工学院合成微生物学实验室,天津 300072
应用合成生物学策略改良光合蓝细菌
孙韬,陈磊,张卫文
天津大学化工学院合成微生物学实验室,天津 300072

陈磊,天津大学化工学院副教授,硕士生导师。主要从事微生物合成生物学以及光合蓝细菌领域的研究。主要成果包括:首次发现蓝细菌对乙醇和丁醇耐受性的专一性调控蛋白,工作得到《ASBMB Today》配发专文评述;鉴定并解析了蓝细菌应对环境胁迫的调控蛋白及相关机制等。至今发表SCI论文60余篇,累计影响因子大于200。受邀担任国际杂志《Frontiers in Microbiology》审稿编辑。2011年起,担任《Microbial Cell Factories》、《Frontiers in Microbiology》、《ACS Synthetic Biology》等多个国际学术刊物的经常评审人。作为项目负责人主持国家自然科学基金面上项目2项、天津市自然科学基金1项,作为子课题负责人主持国家“973计划”项目3项,累计主持科研经费400多万元。2013年入选天津市“用三年时间引进千名以上高层次人才”计划,2016年入选天津大学“北洋青年学者”计划。E-mail:lchen@tju.edu.cn
蓝细菌是一类能够直接利用光能和CO2作为唯一能源和碳源进行生长的光合微生物。近年来,光合蓝细菌以其独特的优势作为“自养型细胞工厂”合成了多种燃料及化学品。以光合蓝细菌中的几种模式生物为例,总结近年来以蓝细菌为工程菌株合成生物燃料及化学品的研究进展,对目前蓝细菌菌株存在的固有问题进行分析,并提出应用合成生物学进行菌种改良的方案。
合成生物学;蓝细菌;生物燃料;化学品;菌种改良
油气资源的减少及对化石燃料和石油化学产品的长期依赖引起的环境污染等问题,促使人们寻找绿色清洁的燃料、化学品及可持续的生产方式。近些年,随着合成生物学的兴起及快速发展,利用微生物作为细胞工厂进行生物燃料及化学品的合成取得了令人瞩目的进展。尽管如此,现有研究所利用的微生物如运动假单胞菌、大肠杆菌及酿酒酵母等在生产过程中仍需要利用一些高成本物质如葡萄糖和肥料等,大幅增加了生产成本从而使得工业生产受到限制。
蓝细菌(cyanobacteria)作为一类能进行放氧光合作用的原核生物,在地球上已存在了20余亿年,亦称为蓝藻(blue algae)或蓝绿藻(blue-green algae),能利用太阳能和CO2作为唯一的能源和碳源进行生长。蓝细菌比其他微生物具备一系列更优良的特质:①遗传背景简单,便于基因改造;②生长营养需求低,不需要粮食作物作为原料供应,培养不占用耕地;③能够固定CO2,有望减缓全球变暖进程;④生长速度相对较快,培养周期短,生长密度高;⑤具有复杂的光合系统,其光能利用效率是陆生植物的数倍。
基于蓝细菌的这些优势,利用其作为生产高附加值化学产品和生物燃料的新型“自养型人工细胞工厂”引起了科研人员广泛关注。近年来,借助于合成生物学手段在蓝细菌中构建内源及外源通路用于生物燃料和化学品的生产取得了突破性进展(图1)。以蓝细菌中的模式生物如集胞藻PCC 6803(Synechocysits sp. PCC 6803)、聚球藻PCC 7942(Synechococcus elongatus sp. PCC 7942)及聚球藻PCC 7002(Synechococcus sp. PCC 7002)为例,对目前以蓝细菌为工程菌进行生物燃料和化学品合成的工作进行总结,并针对现在蓝细菌菌株存在的固有问题进行分析,提出应用合成生物学进行菌种改良的方案。
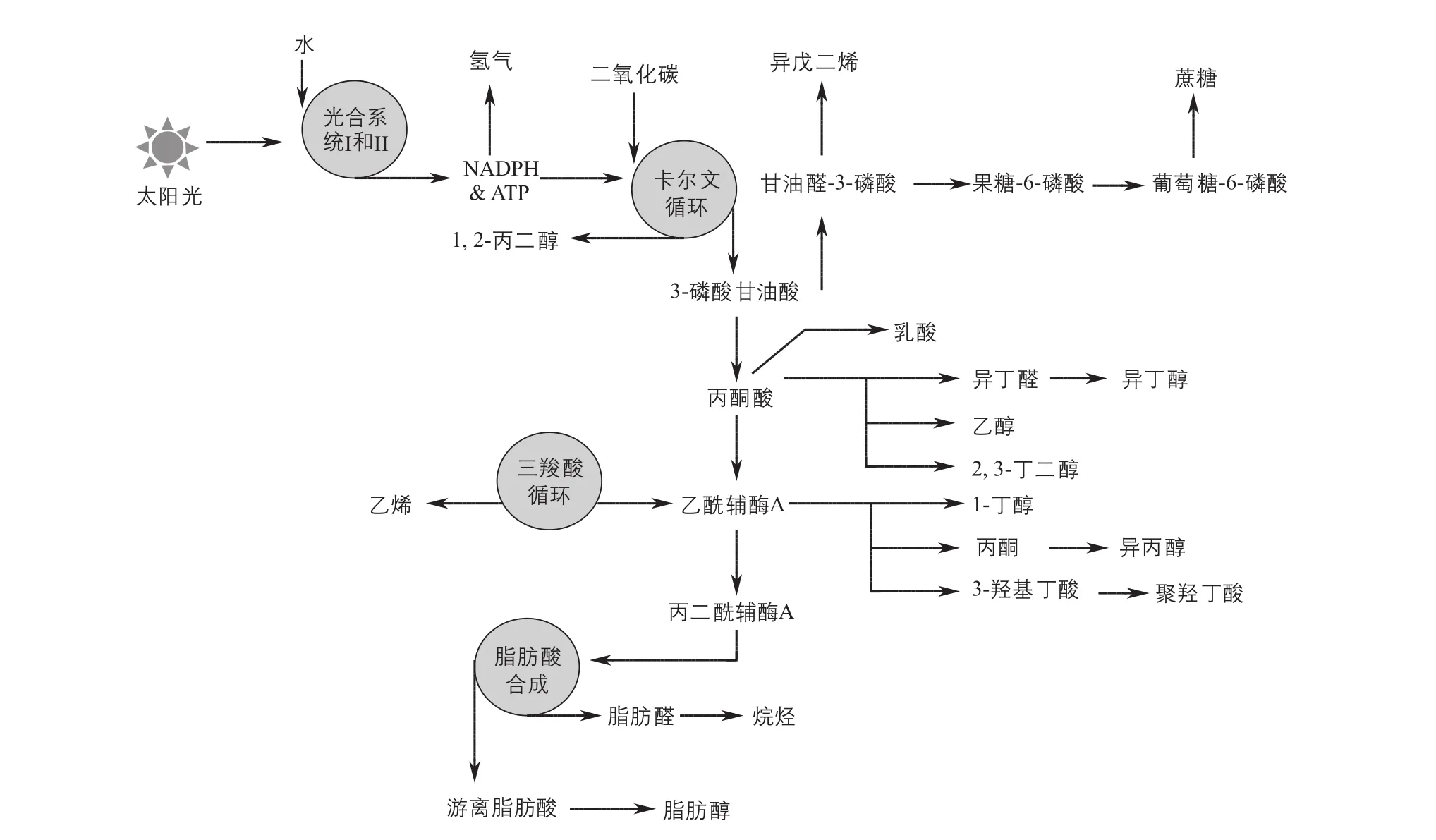
图1 蓝细菌合成多种生物燃料及化学品代谢通路
1 应用光合蓝细菌合成生物燃料
1.1 乙醇
生物乙醇可以单独或与汽油混配制成乙醇汽油作为汽车燃料,是一种重要的清洁能源。早在1999年,Deng和Coleman[1]通过在聚球藻PCC 7942中导入外源丙酮酸脱羧酶(PDC)和乙醇脱氢酶(ADH)成功构建出乙醇的合成通路,虽然产量只有230mg/L,却是利用蓝细菌合成生物燃料的开端。2009年Dexter等[2]将这一产量提升至460mg/L。而在2012年,Gao等[3]通过替换乙醇脱氢酶等一系列措施在集胞藻PCC 6803中实现了5.5g/L的乙醇产出。
1.2 正丁醇
相比于乙醇,正丁醇具有更优良的特性,即更高的热值、更易存、低挥发性等等,因此更适宜作为生物燃料。James Liao课题组[4-5]对蓝细菌中正丁醇的合成做出了重要贡献,通过在聚球藻PCC 7942中引入六种外源基因,实现宿主细胞正丁醇的产出。通过优化丁醇生产需要的还原力及前体供应,正丁醇产量可达到404mg/L。
1.3 烷烃
含有4~23个碳原子的烷烃拥有更高的能量密度、疏水特性及更好的设备兼容性。目前已有一些在聚球藻PCC 7942及集胞藻PCC 6803中合成烷烃的报道。2013年, Kaiser等[6]在聚球藻PCC 7942中实现了2.3mg/L烷烃的产出,而中国科学院青岛生物能源研究所吕雪峰研究组[7]在集胞藻PCC 6803中将烷烃产量提升至26mg/L。
2 应用光合蓝细菌合成化学品
2.1 乙烯
乙烯是一种重要的工业原材料,是合成纤维、橡胶、塑料、乙醇的基本化工原料,也可用于制造氯乙烯、苯乙烯、环氧乙烷等;美国70%的乙烯来自于石脑油。早在1997年,Sakai等[8]在聚球藻PCC 7942中导入外源乙烯形成酶(EFE)实现了乙烯在蓝细菌中的首次合成。经过科研人员多年努力,目前以集胞藻PCC 6803为宿主菌,乙烯产率可达(718±19)μL/(L·h·OD)[9]。
2.2 乳酸
乳酸是一种手性化合物,有D型和L型两种,在食品、化妆品等行业都有广泛应用。另外,由不同比例D-乳酸和L-乳酸聚合而成的聚合物可用于替代传统的聚乙烯塑料。目前,D-乳酸最高产量由Varman等[10]在集胞藻PCC 6803中实现,产量达2.17g/L;而L-乳酸的最高产量由van der Woude等[11]同样在集胞藻PCC 6803中实现,产量为1.8g/L。
2.3 聚羟基烷酸酯单体
聚羟基烷酸酯是由单体如3-羟基丙酸(3-HP)、3-羟基丁酸(3-HB)和3-羟基戊酸(3-HV)聚合而成的长链物质,在可生物降解的包装材料、组织工程材料、缓释材料、电学材料以及医疗材料方面有广阔的应用前景。天津大学张卫文研究组[12-13]先后在集胞藻PCC 6803中实现了3-HB及3-HP的合成,产量分别达到533.4mg/L及837.2mg/L。
3 应用合成生物学进行菌种改良
3.1 光合效率优化
光合作用是蓝细菌将光能转化为化学能的过程,光合效率极大限制蓝细菌的产率。因此,筛选光合效率高的蓝细菌也显得尤为重要。在蓝细菌中,与光合作用相关的主要有光合系统I、光合系统Ⅱ和藻胆体三个亚基复合物(图2)。一方面,蓝细菌吸收的为可见光400~700nm部分,不能利用红外或紫外光。因而,拓宽蓝细菌的吸收光谱是一种有效的改良方案。将外源可吸收额外光谱的叶绿素基因如叶绿素d、叶绿素f(可吸收范围700~750nm)等的基因导入蓝细菌中很可能获得光合能力更强的新菌种;甚至可将两个光合系统中的一个亚基复合物替换。另一方面,自然界中的蓝细菌在进化过程中形成了过量的捕光天线,如图2中别藻蓝蛋白(AP)、藻青蛋白(PC)及藻红蛋白(PE),而这部分天线蛋白捕获过多的光子会引起光损伤而影响光合效率。因而,对蓝细菌菌株另一改造可集中在最小化捕光天线蛋白。总之,对光合作用的修饰对于蓝细菌改良依然重要。
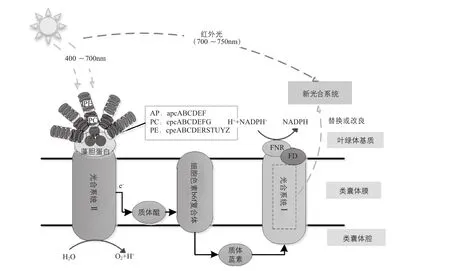
图2 蓝细菌的光合系统及其优化策略[14]
3.2 固碳效率增强
蓝细菌有一个很有效的CO2浓缩机制(CCM),以无机碳(CO2、HCO3-等)为碳源,进行无机碳源的摄取、富集。CO2的富集由HCO3-和CO2传递系统和1,5-二磷酸核酮糖羧化酶加氧酶(Rubisco)及羧酸酐酶组成的羧化酶系统实现(图3)。因此,改良蓝细菌菌种固碳能力最直接的策略就是通过识别并且过表达特定的无机碳转运蛋白和Rubisco或者用更高效的酶替代。目前在蓝细菌中已经发现了5种无机碳摄取机制,3种涉及HCO3-的固定(BicA、SbtA和BCT1),2种涉及CO2的固定(NDH-I3和NDH-I4)。但是目前还未成功通过修饰无机碳转运蛋白来强化无机碳的摄取。已有研究表明,通过过表达HCO3-转运蛋白Sll0834,可有效提高集胞藻PCC 6803菌株的固碳能力[15];此外,也有将异源Rubisco导入聚球藻PCC 7942中增强异丁醛产量的报道[16]。可见固碳能力的增强对于蓝细菌菌株的改良十分重要,未来还需要进行更多的探索。
3.3 碳流重新排布
在蓝细菌的多条代谢途径中,碳通量(carbon f ux)分布是极不平衡的,只有5%和10%的碳通量进入了萜类和脂肪酸的合成,这也极大限制了蓝细菌对外源产品的生物合成。因此需要构建更优良的蓝细菌菌株来适应外源产品的生产。目前主要有两种策略来优化以丙酮酸或乙酰辅酶A为底物的化合物合成过程中的碳通量。①强化关键前体物质的合成途径来获取更多的碳。天津大学张卫文等[13]通过在集胞藻PCC 6803中过表达了内源的乙酰辅酶A合成相关基因增加了乙酰辅酶A的供给,将3-HP的最高产量增加了4.5倍。②敲除内源消耗碳通量较多的竞争途径。蓝细菌中存在着如糖原合成途径、PHB合成途径及乙酸合成途径等,这些途径消耗了大量的碳通量却限制了外源产品的积累,因而部分或全部敲除该途径将会获得更优良的工程菌株。据报道,在集胞藻中删除编码PHB途径的基因slr1829和slr1830可提高3-HB产量2.1倍。这些研究表明在蓝细菌底盘中优化碳通量是一个有效方式,在后续菌种改良过程值得进一步尝试。
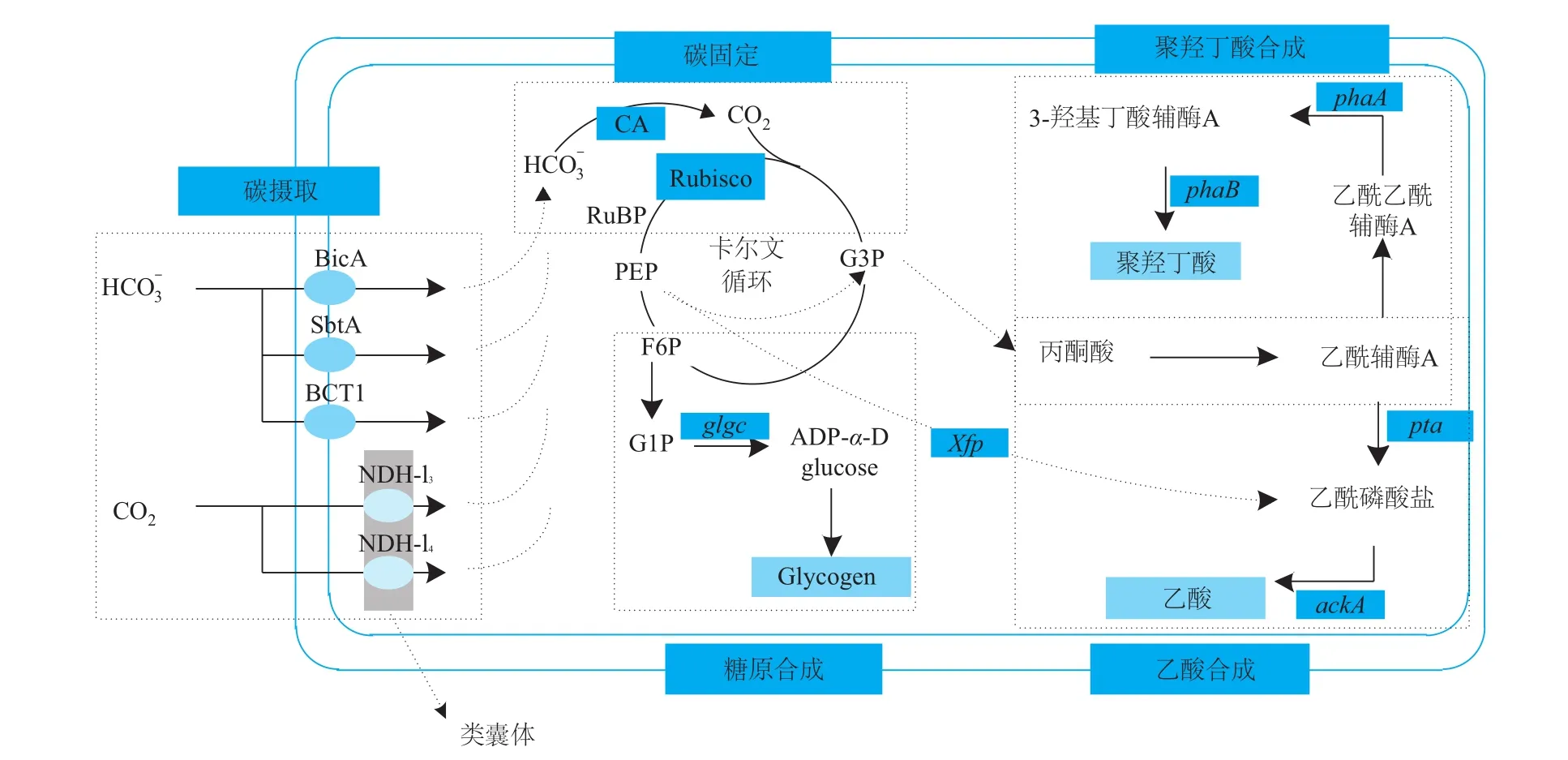
图3 蓝细菌固碳能力及碳通量优化策略[14]
3.4 底盘耐受性改善
很多产品尤其是一些生物燃料,即使在低浓度下对蓝细菌也有毒害作用,降低了宿主细胞的生长速率,限制了生产潜力和未来工业生产的可能性,因此筛选耐受性更好的菌株很关键。要提高菌种的耐受性,首先要了解菌株对产品的响应机制。对此,借助转录组学、定量蛋白组学及代谢组学等方法,天津大学张卫文等对此进行了深入研究,发现了集胞藻PCC 6803中诸多与乙醇、丁醇及己烷等生物燃料产品胁迫响应相关的调控蛋白(表1)。未来,可通过过表达这些调控蛋白培育耐受性更好的蓝细菌菌株。此外,蓝细菌的大规模培养一般在海水中进行以节省淡水资源,因此,盐分、温度、pH变化的耐受性也需要考虑在内。为了筛选更好的蓝细菌,未来的工作可主要集中于以下几个方面。①选择合适的蓝细菌菌种。例如,聚球藻PCC 7002更合适短链醇生产,而集胞藻PCC 6803则适合游离脂肪酸的生产。此外,目前蓝细菌中的合成生物学研究主要集中于易于基因编辑的模式生物,未来可探索更优良的蓝细菌菌种。②适应性定向进化。尽管适应性进化研究需要大量时间和精力,却一直被认为是强化优势而获得全局基因修饰的一种策略。经过在集胞藻PCC 6803培养过程不断添加并提高正丁醇的浓度,天津大学张卫文等[23]将集胞藻PCC 6803对正丁醇的耐受性提高了150%,获得了更优良的菌种。③过表达外排泵和转运蛋白。外排泵能够直接将最终产物从胞内排到胞外使产品在胞内保持一个很低的浓度,将产品的毒性降到最低。有研究发现,集胞藻PCC 6803中缺少ABC转运蛋白Slr0982后,对乙醇耐受性降低,表明Slr0982可能负责乙醇的转运[24]。未来的相关工作可集中于向蓝细菌中引入转运蛋白以提高蓝细菌的耐受性获得更好的工程菌株。
4 总结与展望
光合蓝细菌凭借其可直接利用CO2和太阳能作为碳源和能源进行生物质合成的优势日益受到研究者的关注,越来越多的生物燃料及化学品合成途径在蓝细菌中得以实现,其前景不言而喻。然而,目前以蓝细菌作为工程菌进行生物燃料及化学品合成仍存在不少产量低、耐受能力差等固有的问题,这些问题限制了未来的工业化应用。相信通过科研人员的不懈努力,定能将这一“自养型细胞工厂”合理利用并为人类服务。
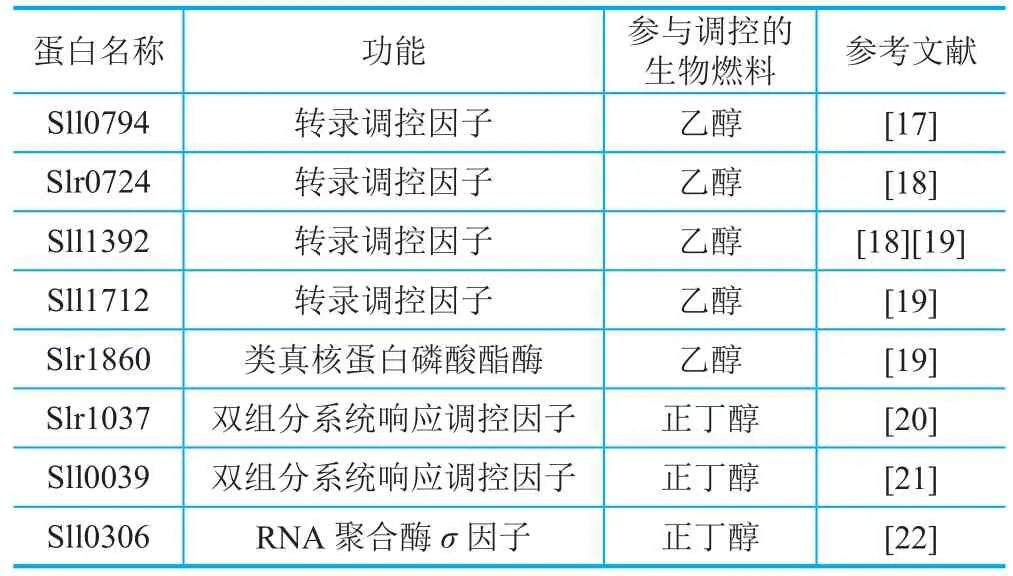
表1 集胞藻PCC 6803中与生物燃料耐受性调控有关的调控蛋白
[1] DENG M D,COLEMAN J R. Ethanol synthesis by genetic engineering in cyanobacteria[J]. Appl Environ Microbiol,1999,65:523-528.
[2] DEXTER J,FU P. Metabolic engineering of cyanobacteria for ethanol production[J]. Energy Environ Sci,2009,2(8):857-864.
[3] GAO Z,ZHAO H,LI Z,et al. Photosynthetic production of ethanol from carbon dioxide in genetically engineered cyanobacteria[J]. Energy Environ Sci,2012,5:9857-9865.
[4] LAN E I,LIAO J C. ATP drives direct photosynthetic production of 1-butanol in cyanobacteria[J]. Proc Natl Acad Sci U S A,2012,109:6018-6023.
[5] LAN E I,RO S Y,LIAO J C. Oxygen-tolerant coenzyme A-acylating aldehyde dehydrogenase facilitates eff cient photosynthetic n-butanol biosynthesis in cyanobacteria[J]. Energy Environ Sci,2013,6(9):2672-2681.
[6] KAISER B K,CARLETON M,HICKMAN J W,et al. Fatty aldehydes in cyanobacteria are a metabolically f exible precursor for a diversity of biofuel products[J]. PLoS One,2013,8(3):e58307.
[7] WANG W,LIU X,LU X. Engineering cyanobacteria to improve photosynthetic production of alka(e)nes[J]. Biotechnol Biofuels,2013,6(1):1-9.
[8] SAKAI M,OGAWA T,MATSUOKA M,et al. Photosynthetic conversion of carbon dioxide to ethylene by the recombinant cyanobacterium,Synechococcus sp. PCC 7942,which harbors a gene for the ethylene-forming enzyme of Pseudomonas syringae[J]. J Ferment Bioeng,1997,84(5):434-443.
[9] XIONG W,MORGAN J A,UNGERER J,et al. The plasticity of cyanobacterial metabolism supports direct CO2conversion toethylene[J]. Nature Plants,2016,100(8):3401-3413.
[10] VARMAN A M,YU Y,YOU L,et al. Photoautotrophic production of D-lactic acid in an engineered cyanobacterium[J]. Microb Cell Fact,2013,12(1):1-8.
[11] VAN DER WOUDE A D,ANGERMAYR S A,PUTHAN V V,et al. Carbon sink removal:Increased photosynthetic production of lactic acid by Synechocystis sp. PCC6803 in a glycogen storage mutant[J]. J Biotechnol,2014,184:100-102.
[12] WANG B,PUGH S,NIELSEN D R,et al. Engineering cyanobacteria for photosynthetic production of 3-hydroxybutyrate directly from CO2[J]. Metab Eng,2013,16:68-77.
[13] WANG Y,SUN T,GAO X,et al. Biosynthesis of platform chemical 3-hydroxypropionic acid (3-HP) directly from CO2in cyanobacterium Synechocystis sp. PCC 6803[J]. Metab Eng,2015,34:60-70.
[14] GAO X,SUN T,PEI G,et al. Cyanobacterial chassis engineering for enhancing production of biofuels and chemicals[J]. Appl Microbiol Biotechnol,2016,100(8):3401-3413.
[15] KAMENNAYA N A,AHN S,PARK H,et al. Installing extra bicarbonate transporters in the cyanobacterium Synechocystis sp. PCC6803 enhances biomass production[J]. Metab Eng,2015,29:76-85.
[16] ATSUMI S,HIGASHIDE W,LIAO J C. Direct photosynthetic recycling of carbon dioxide to isobutyraldehyde[J]. Nat Biotechnol,2009,27:1177-1180.
[17] SONG Z,CHEN L,WANG J,et al. A transcriptional regulator Sll0794 regulates tolerance to biofuel ethanol in photosynthetic Synechocystis sp. PCC 6803[J]. Molecular & Cellular Proteomics, 2014,13(12):3519-3532.
[18] WANG J,CHEN L,HUANG S,et al. RNA-seq based identification and mutant validation of gene targets related to ethanol resistance in cyanobacterial Synechocystis sp. PCC 6803[J]. Biotechnol Biofuels,2012,5(1):1-18.
[19] ZHU Y,PEI G,NIU X,et al. Metabolomic analysis reveals functional overlapping of three signal transduction proteins in regulating ethanol tolerance in cyanobacterium Synechocystis sp. PCC 6803[J]. Mol Biosyst,2015,11(3):770-782.
[20] CHEN L,WU L,WANG J,et al. Butanol tolerance regulated by a two-component response regulator Slr1037 in photosynthetic Synechocystis sp. PCC 6803[J]. Biotechnol Biofuels,2014,7:89.
[21] NIU X,ZHU Y,PEI G,et al. Elucidating butanol tolerance mediated by a response regulator Sll0039 in Synechocystis sp. PCC 6803 using a metabolomic approach[J]. Appl Microbiol Biotechnol,2015,99(4):1845-1857.
[22] KACZMAEZYK D,ANFELT J,SARNEGRIM A,et al. Overexpression of sigma factor SigB improves temperature and butanol tolerance of Synechocystis sp. PCC6803[J]. J Biotechnol,2014,182-183:54-60.
[23] WANG Y,SHI M,NIU X,et al. Metabolomic basis of laboratory evolution of butanol tolerance in photosynthetic Synechocystis sp. PCC 6803[J]. Microb Cell Fact,2014,13:151.
[24] ZHANG Y N,NIU X F,SHI M L,et al. Identif cation of a transporter Slr0982 involved in ethanol tolerance in cyanobacterium Synechocystis sp. PCC 6803[J]. Frontiers in Microbiology,2015,6:487.
Engineering of photosynthetic cyanobacteria strains using synthetic biology: a review
SUN Tao,CHEN Lei,ZHANG Weiwen
Laboratory of Synthetic Microbiology, School of Chemical Engineering and Technology, Tianjin University, Tianjin 300072, China
Cyanobacteria have emerged as an important chassis for producing biofuels and chemicals due to their capability to directly utilize sunlight and CO2as the sole energy and carbon sources. Recent progresses in developing and applying various synthetic biology tools have led to the successful constructions of novel pathways of several dozen green fuels and chemicals utilizing cyanobacterial chassis. In recent years, numerous researches have been conducted to enhance the production of green fuels and chemicals through cyanobacterial chassis engineering including photosynthesis, CO2uptake and f xation, products exporting, tolerance and cellular regulation. In this article, we critically reviewed recent progresses and universal strategies in cyanobacterial chassis engineering to make it more robust and effective for bio-chemicals production.
synthetic biology; cyanobacteria; biofuels; bio-chemicals; strain engineering
10.3969/j.issn.1674-0319.2017.01.009
孙韬,博士研究生。研究方向:光合蓝细菌中小RNA的功能鉴定及异源代谢通路的构建等。E-mail:tsun@tju.edu.cn

