艾司洛尔对福尔马林炎性大鼠脊髓背角pERK表达的影响
陈烨 邹聪华 郑晓春
【摘要】 目的:探讨鞘内注射艾司洛尔对福尔马林炎性大鼠脊髓背角pERK蛋白表达的影响。方法:36只SD大鼠鞘内置管后,采用随机数字表法分为生理盐水组(N组)、艾司洛尔注射液400 μg/kg组(S1组)、艾司洛尔注射液800 μg/kg组(S2组),各12只。鞘内置管5 d后,各组注射以上药物,然后在大鼠后肢皮下注射福尔马林50 μL,以Vonfrey及Hargreaves法测定机械缩足反射阈值(MWT)和热刺激缩足反射潜伏期(TWL),观察大鼠的疼痛行为学变化。观察1.5 h后,采用免疫组织化学方法检测脊髓背角pERK蛋白表达。结果:与N组相比,S1、S2组的Ⅱ相阶段的疼痛行为均有减少,且S1、S2组L4~5节段脊髓表达的pERK蛋白表达均比N组少(P<0.01)。结论:鞘内注射艾司洛尔可减少福尔马林大鼠脊髓背角pERK蛋白表达。
【关键词】 疼痛; 脊髓; 艾司洛尔; pERK
肾上腺素受体分布于大部分交感神经节后纤维所支配的效应器细胞膜上,其受体分为3种类型,即β1受体、β2受体和β3受体。β1受体主要分布于心肌,可激动引起心率和心肌收缩力增加,其代表为艾司洛尔,近几年广泛应用于临床。文献[1-4]研究发现该阻滞药可减少麻醉维持药物的用量,而静脉注射艾司洛尔可减少丙泊芬的注射痛[5]。但β1受体阻滞药艾司洛尔是否具有调节疼痛的作用仍未阐明。细胞外信号调节激酶(ERK)信号转导通路是促分裂素原活化蛋白激酶(MAPK)信号转导通路中最具代表性的通路,ERK信号通路的调节是治疗糖尿病神经病理性痛的新靶点[6]。转录因子环磷酸腺苷反应元件结合蛋白(CREB)是ERK信号通路最重要的下游信号蛋白,p-ERK可从胞浆转位到核内通过磷酸化CREB发挥其对靶基因表达的调节作用[7]。本研究拟通过鞘内注射艾司洛尔,观察大鼠脊髓背角COX-2 mRNA表达的变化,来探索艾司洛尔是否具有疼痛调节作用,现报告如下。
1 材料与方法
1.1 试剂与仪器 Microspianl导管(美国ALZA公司),艾司洛尔注射液(江苏奥赛康医药公司,批号20150213),5%福尔马林(NS 3.2 mL+37%福尔马林0.5 mL),Real time PCR仪(TAKARA公司,日本),MMLV逆转录试剂盒,PCR试剂盒(Invitrogen Life公司,美国),兔抗鼠pERK一抗(4370S,Cell Signaling,USA),羊抗兔生物素化二抗(BA1003,武汉博士德生物工程有限公司),DAB显色试剂盒(AR1022,武汉博士德生物工程有限公司)。
1.2 动物选择及鞘内置管 SD雄性大鼠,由福建医科大学实验动物中心提供,体重260~290 g。用10%水合氯醛350 mg/kg腹腔注射,参照文献[8]的方法,鞘内置管。置管隔天行注射2%利多卡因实验,未出现双下肢无力的大鼠剔除。
1.3 实验分组 将置管成功的大鼠随机分为三组,各12只。生理盐水组(N组),艾司洛尔注射液400 μg/kg组(S1组),艾司洛尔注射液800 μg/kg组(S2组)。置管5 d后,大鼠注射各组药物后在同侧足掌皮下注射5%福尔马林50 μL。
1.4 行为学观察 以文献[9]的Vonfrey细丝法和文献[10]的Hargreaves法测定机械缩足反射阈值(MWT)和热刺激缩足反射潜伏期(TWL),观察大鼠术后1.5 h的疼痛行为学变化。Von法是用Von Frey丝刺激大鼠注射处旁,逐渐加压至大鼠出现抬腿、添足行为,记录压力值。Hargareaves法是热痛刺激仪照射大鼠足底,至出现回避。每只大鼠测定5次,每次间隔3 min,取平均值。
1.5 免疫组化方法 注射甲醛1.5 h后,各大鼠均在注射福尔马林后1.5 h断头处死,剪开脊柱肌肉及椎板,暴露脊髓和L5神经节,截取L4~5段脊髓,置于甲醛固定液中固定后石蜡包埋切片,切片经抗原修复、封闭非特异抗原、一抗兔抗Fos血清(1∶50)、二抗羊抗兔IgG血清及DAB呈色处理后,苏木素复染,透明、封片。采用LEICA Qwin图像处理与分析系统对免疫组织化学染色的切片进行图像分析,每张图像选用积分光密度(integrated optical density,IOD)来表示pERK阳性反应产物的量。
1.6 统计学处理 采用SPSS 16.0统计软件进行分析,计量资料以均数±标准差(x±s)表示,Levene法检测各组样本方差齐性。方差齐时,各组pERK相对蛋白浓度采用Friedman ANOVA方差分析,pERK的IOD值的组间采用One-way ANOVA方差分析,差异有统计学意义时用LSD法比较;方差不齐时,采用多因素方差分析,pERK的IOD值的组间比较采用Kruskal-Walllis秩和检验。P<0.05为差异有统计学意义。
2 结果
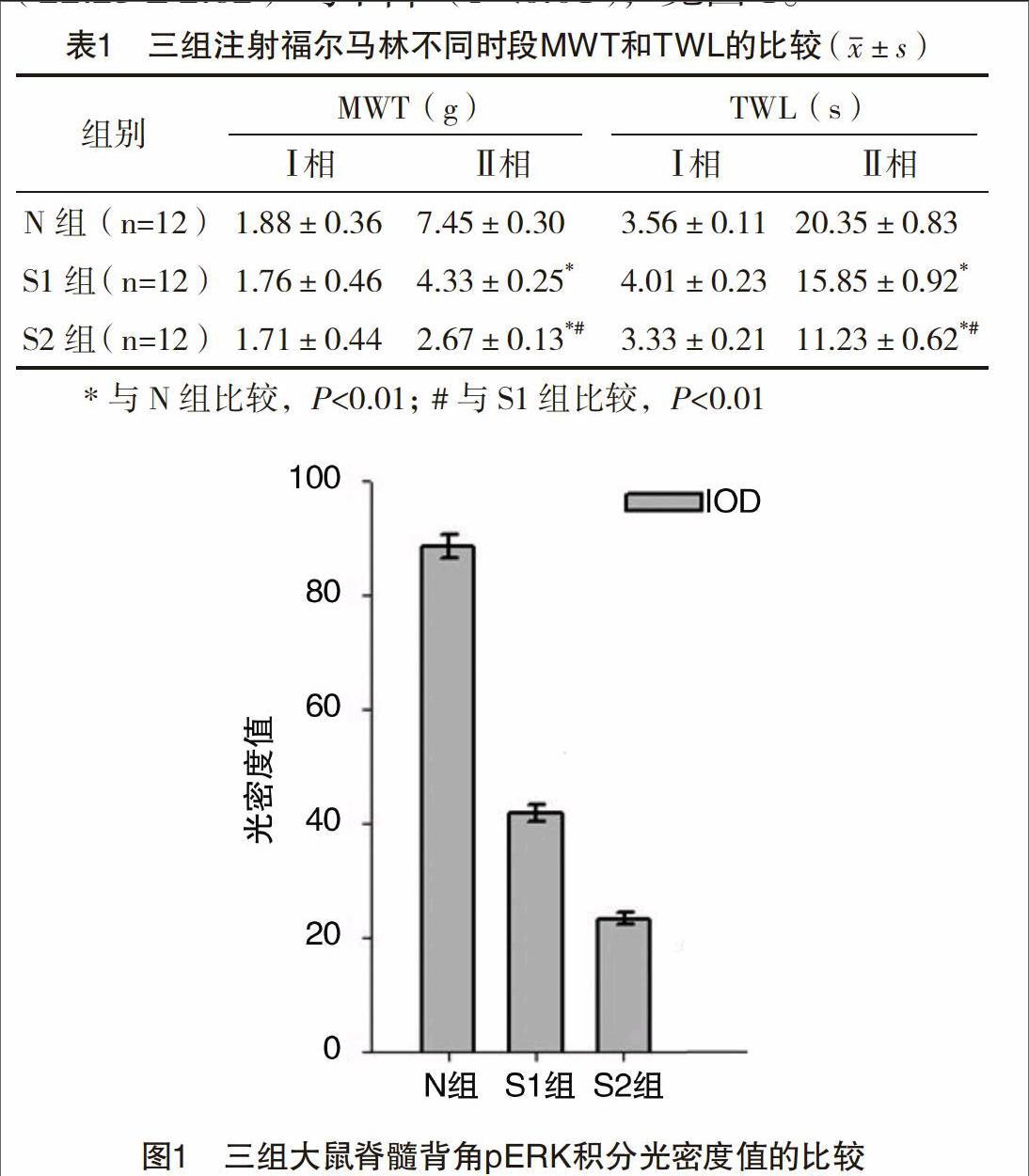
N组、S1组、S2组注射甲醛后出现疼痛反应,表现为注射足只能稍受力或不能受力,抬起甚至舔咬注射足。可观察到完整的双相疼痛反应,即注射后即刻出现3~5 min的急性疼痛时相(第一时相),中间5~10 min的静息期,随后出现可持续40~60 min的继发性疼痛时相(第二时相),静息期注射足可正常行走,无明显疼痛反应。注射福尔马林后各组大鼠均出现疼痛行为,与N组相比,S1、S2组MWT均减低,TWL缩短,差异均有统计学意義(P<0.01),见表1。与Ⅱ相N组IOD值(88.35±4.83)比较,S1、S2组大鼠脊髓背角pERK蛋白表达均变少,IOD值为(41.85±3.92)、(22.23±2.62)均下降(P<0.01),见图1。
3 讨论
急慢炎性疼痛实验中,福尔马林实验是具有代表性的模型[11],它广泛应用于疼痛相关机制及止痛药的评价。有研究表明,大鼠后足注射福尔马林后即可出现2个疼痛机制不同的反应时相:Ⅰ相(5~10 min)是福尔马林直接刺激外周伤害感受器所致;Ⅱ相(15~50 min)是主要是由于中枢神经系统神经元兴奋性增加而导致中枢敏化有关[12-13]。本研究中N组大鼠足底注射福尔马林后,大鼠出现明显的两相疼痛反应,表明大鼠出现了炎性疼痛及痛觉过敏,Ⅱ相生理盐水组的时间显著高于艾司洛尔组,提示艾司洛尔能抑制炎性反应所导致的第二期的疼痛中枢敏感化,这可能与艾司洛尔抑制交感神经有关。endprint
丝裂原活化蛋白激酶(mitogen activated protein kinases,MAPK)是细胞内信号转导的重要系统,它被激活后可维持疼痛敏化状态[14-15],其中细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)是MAPK的重要成员,激活后的ERK可通过磷酸化神经元膜离子通道或受体,改变神经元的兴奋性。例如,伤害性刺激通过ERK信号通路激活NR1受体,诱导中枢敏化。ERK信号通路还参与缓激肽诱导脊髓第2板层神经元NMDA受体和AMPA受体电流增强,诱发痛觉过敏[16-17]。本研究中福尔马林致炎后的大鼠脊髓背角均可见高表达的pERK,说明存在伤害性刺激的持续性传入。
本研究表明,艾司洛尔呈剂量依赖地减少福尔马林炎性大鼠Ⅱ相的疼痛行为,并且抑制了脊髓背角pERK蛋白表达。Mizobuchi等[18]发现兰地洛尔可减少福尔马林炎性大鼠脊髓c-fos mRNA表达,也表明了β1受体阻滞剂具有减少炎性疼痛的作用。文献[19-20]研究发现,β1受体阻滞剂阻滞感觉神经中的河豚毒素相关的Na+离子通道,β-受体阻滞剂能激活游离细胞膜上的G-蛋白,产生突触后或突触前抑制,减少神经介質的释放,提示β-受体阻滞剂对疼痛有中枢抑制作用,虽然艾司洛尔脂溶性低、在血液中被快速代谢,但并不排除其具有中枢作用的可能性。本研究采用置管给药,理论上存在局部吸入血引起全身效应,但艾司洛尔是超短效药,不可能持续存在几个小时的镇痛作用,所以推断艾司洛尔在脊髓水平参与了疼痛的调节。虽然鞘内单独应用艾司洛尔的镇痛效应不足以完全逆转痛行为,但其独特的抗损伤效应和累积的镇痛效应,可能使其成为新的鞘内镇痛的辅助用药。由于国内外对艾司洛尔调节疼痛研究少,其机制仍需进一步研究并阐明。
参考文献
[1]李彩虹.气管表面麻醉与静注艾司洛尔对全麻诱导插管时血流动力学的影响[J].临床麻醉学杂志,2009,25(4):1072-1073.
[2] Lee M H,Chung M H,Han C S,et al.Comparison of effects of intraoperative esmolol and ketamine infusion on acute postoperative pain after remifentanil-based anesthesia in patients undergoing laparoscopic cholecystectomy[J].Korean J Anesthesiol,2014,66(3):222-224.
[3]腾士勇,陶国荣,于布为.艾司洛尔、拉贝洛尔和尼卡地平对气管插管期间心血管反应、脑电双频指数和熵指数的影响[J].临床麻醉学杂志,2008,9(3):756-758.
[4] Akgün S E,Titiz L,Akpek E,et al.Pretreatment with a very low dose of intravenous esmolol reduces propofol injection pain[J].Agri,2013,25(1):13-18.
[5] Dhir R,Singh M R,Kaul T K.Effect of intravenous esmolol on analgesic requirements in laparoscopic cholecystectomy[J].Anaesthesiol Clin Pharmacol,2015,31(3):37-39.
[6] Ma W,Quirion R.The ERK/MAPK pathway, as a target for the treatment of neuropathic pain[J].Expert Opinion on Therapeutic Targets,2005,9(4):699-713.
[7] Song X S,Cao L,Xu Y B,et al.Activation of ERK/CREB pathway in spinal cord contributes to chronic constrictive injury-induced neuropathic pain in rats[J].Acta Pharmacol Sin,2005,26(7):789-798.
[8] Yaksh T L,Rudy T A.Chronic catheterization of the spinal subarachnoid space[J].Physiol Behav,1976,17(1):1031-1036.
[9] Chaplan S R,Bach F W,Pogrel J W,et al.Quantitative assessment of tactile allodynia in the rat paw[J].Neurosci Methods,1994,53(1):55-63.
[10] Hargreaves K,Dubner R,Brown F,et al.A new and sensitive method for measuring thermal nociception in cutaneous hyperalgesia[J].Pain,1998,32(1):77-88.
[11] Onifer S M,Reed W R,Sozio R S.Antinociceptive Effects of Spinal Manipulative Therapy on Nociceptive Behavior of Adult Rats during the Formalin Test[J].Evid Based Complement Alternat Med,2015,3(4):52-54.endprint
[12] Diniz D A,Petrocchi,J A,Navarro L C.Serotonin induces peripheral mechanical antihyperalgesic effects in mice[J].Eur J Pharmacol,2015,15(2):767-769.
[13] Hagihira S,Taenaka N,Yoshiya I.Inhalation anesthetics suppress the expression of c-fos protein evoked by noxious somatic stimulation in the deeper layer of the spinal cord in the rat[J].Brain Research,1997,751(1):124-130.
[14]曹紅,张玉秋.ERK/MAPK信号通路与痛觉信息加工[J].中国疼痛医学杂志,2011,6(2):370-373.
[15] Zhang X,Zhang H,Shao H.ERK MAP kinase activation in spinal cord regulates phosphorylation of Cdk5 at serine 159 and contributes to peripheral inflammation induced pain/hypersensitivity[J].Plos One,2014,31,9(1):87-89.
[16] Hu H J.ERK integrates PKA and PKC signaling in superficial dorsal horn neurons.Ⅱ.Modulation of neuronal excitability[J].Journal of Neurophysiology,2003,90(3):1680-1688.
[17] Zhuang Z Y,Gerner P,Woolf C J,et al.ERK is sequentially activated in neurons, microglia, and astrocytes by spinal nerve ligation and contributes to mechanical allodynia in this neuropathic pain model[J].Pain,2005,114(6):149-159.
[18] Mizobuchi S,Matsuoka Y,Obata N.Antinociceptive Effects of Intrathecal Landiolol Injection in a Rat Formalin Pain Model[J].Acta Med Okayama,2012,66(3):285-289.
[19] Gencer A,Gunduz O,Ulugol A.Involvement of Descending Serotonergic and Noradrenergic Systems and their Spinal Receptor Subtypes in the Antinociceptive Effect of Dipyrone[J].Drug Res (Stuttg),2015,65(12):645-649.
[20] Hageluken A,Naurnberg B,Harhammer R,et al.Lipophilic beta-adrenoceptor antagonists are effective direct activators of G-proteins[J].Biochem Pharmacol,1994,47(10):1789-1795.
(收稿日期:2016-08-04) (本文编辑:张爽)endprint

