GRP78基因沉默对人卵巢癌SKOV3细胞增殖与凋亡的影响及机制
李平,潘银凤,王艳伟,焦燕
(1山东能源新汶矿业集团莱芜中心医院,山东莱芜271103;2长春中医药大学)
GRP78基因沉默对人卵巢癌SKOV3细胞增殖与凋亡的影响及机制
李平1,潘银凤2,王艳伟1,焦燕1
(1山东能源新汶矿业集团莱芜中心医院,山东莱芜271103;2长春中医药大学)
目的 探讨葡萄糖调节蛋白78(GRP78)基因沉默对人卵巢癌SKOV3细胞增殖与凋亡的影响及机制。方法 设计、合成针对GRP78基因的短发夹RNA干扰序列,构建GRP78载体质粒,将其转染入293T细胞,包装产生慢病毒(GRP78 shRNA)。将培养好的SKOV3细胞随机分为对照组、空白载体组、实验组,将空白质粒、GRP78 shRNA分别转染至空白载体组、实验组。用MTT法检测各组细胞生长抑制率,用流式细胞术检测细胞凋亡率,用Western blotting法检测细胞内GRP78、半胱氨酸天冬氨酸蛋白水解酶3(Caspase-3)及增强子结合蛋白同源蛋白(CHOP)蛋白表达。结果 转染24、48、72 h,与对照组、空白载体组比较,实验组细胞生长抑制率升高(P均<0.05);且实验组各时间点细胞生长抑制率比较差异有统计学意义(P均<0.05)。转染72 h,与对照组、空白载体组比较,实验组细胞凋亡率升高(P均<0.05)。转染72 h,与对照组、空白载体组比较,实验组GRP78蛋白相对表达量降低,CHOP、Caspase-3蛋白相对表达量升高(P均<0.05)。结论 沉默SKOV3细胞内GRP78基因后,激活内质网应激凋亡信号通路,从而抑制细胞增殖、促进其凋亡。
卵巢肿瘤;SKOV3细胞;葡萄糖调节蛋白78;细胞增殖;细胞凋亡;内质网应激
卵巢癌是妇科常见的恶性疾病,其发病率占妇科癌症的20%。中、晚期卵巢癌患者5年生存率不足20%[1]。卵巢癌以手术治疗及化疗为主,但效果并不理想。葡萄糖调节蛋白78(GRP78)是内质网上重要的分子伴侣蛋白,与肿瘤细胞生长、转移及死亡抵抗有密切关系[2]。内质网应激(ERS)是近年来新发现的凋亡机制,现阶段研究认为ERS发生的主要原因是内质网折叠蛋白功能异常,导致错误蛋白在内质网内堆积[3],短时间的ERS是细胞自我修复的一种方法,但长期的ERS即可引起细胞凋亡。已有研究表明,沉默GRP78可直接影响卵巢癌细胞的侵袭力和迁移力,但具体机制尚不完全清楚[4]。2016年1~6月,本研究采用慢病毒转染技术沉默卵巢癌SKOV3细胞GRP78的表达,探讨GRP78基因沉默对人卵巢癌SKOV3细胞增殖与凋亡的影响及机制,为卵巢癌的靶向治疗提供理论依据。
1 材料与方法
1.1 材料 shRNA慢病毒(沈阳万类生物科技有限公司);人卵巢癌SKOV3细胞(美国ATCC公司),293T细胞(上海纪宁生物公司);GRP78、增强子结合蛋白同源蛋白(CHOP)及半胱氨酸天冬氨酸蛋白水解酶3(Caspase-3)抗体(Boster公司),GAPDH内参抗体(中国Wanleibio公司);Annexin V细胞凋亡试剂盒(美国SIGMA公司),RPMI1640(美国GIBCO公司),光学显微镜(日本Olympus公司),WD-9405B型水平摇床(中国六一公司),LSR-Ⅱ流式细胞仪(美国BD公司)。
1.2 慢病毒载体构建 用Ambion公司软件,针对人GRP78基因mRNA(NM 005347.3)设计shRNA序列,构建质粒,转染293T细胞。根据其对GRP78的抑制效率,确定有效RNAi模版序列:正义3′-GGAGCGCAUUGAUACUAGATT-5′、反义3′-UCUAGUAUCAAUGCGCUCCTT-5′。慢病毒骨架质粒pLVTHM经BamHⅠ和EcoRⅠ双酶切消化后与双链DNA进行反应,对其克隆进行菌种培养扩增,抽提质粒DNA。将对数生长期的293T细胞接种于25 mL细胞培养皿,细胞生长至70%时,将重组的慢病毒骨架质粒与包装辅助质粒用磷酸钙共转染至病毒包装细胞293T,培养12 h后弃去含有转染混和物的培养液,加入新鲜的细胞培养液继续培养。收集转染72 h的293T细胞上清液,于4 ℃、4 000 r/min离心10 min去除细胞碎片,经0.45 μm滤器过滤后置于25 000 r/min超速离心10 min, 而后以PBS液重悬病毒沉淀,制备完成慢病毒载体GRP78 shRNA,置于-80 ℃冰箱保存备用。
1.3 SKOV3细胞培养、分组及转染 SKOV3细胞加入10%灭活胎牛血清的DMEM培养液中进行培养,条件:37 ℃、5% CO2,饱和湿度,2~3 d传代1次。将细胞悬液以5×104/孔接种于24孔板,细胞融合80%~90%,随机分为对照组、空白载体组及实验组。将空白质粒、GRP78 shRNA分别转染至空白载体组、实验组。培养基中加入8 μg/mL ploybrene以提高感染效率,混匀后于37 ℃、5% CO2培养箱中孵育过夜。孵育24 h后将培养基更换为正常培养液,在原有条件下继续培养48 h[4]。采用Western blotting法检测各组细胞GRP78表达,以验证GRP78是否转染成功。
1.4 SKOV3细胞生长抑制率测算 采用MTT法。分别于转染24、48、72 h取各组细胞,调整细胞为4×107/L,取200 μL接种于96 孔板中(每组细胞5个复孔),培养72 h,每孔加入5 g/L MTT 20 μL,继续培养4 h后去上清液,逐一加入DMSO 100 μL振荡混匀,待蓝色晶体完全溶解反应后,应用酶标仪测定波长570 nm 处的吸光度值(A值),并计算细胞生长抑制率。细胞生长抑制率=(1-实验组A值/对照组A值)×100%[5]。
1.5 SKOV3细胞凋亡率检测 采用流式细胞术。转染72 h取各组细胞,经消化、PBS冲洗、悬浮、300目尼龙网过滤后加入Binding Buffer 悬浊细胞300 μL,加入Annexin V-FITC 5 μL混合,再加入Propidium Iodide 10 μL充分混匀;常温下避光反应20 min;采用流式细胞仪检测细胞凋亡情况,计算细胞凋亡率。
1.6 SKOV3细胞内GRP78、Caspase-3及CHOP蛋白检测 采用Western blotting法。转染72 h取各组细胞,加入RIPA裂解液及蛋白酶抑制剂PMSF,提取蛋白质,测定浓度。取样15 μL以10%的SDS-PAGE电泳,常规转膜后脱脂奶粉封闭,加一抗anti-GRP78(1∶500)、anti-Caspase-3(1∶500)及anti-CHOP(1∶200)4 ℃孵育过夜,TBST洗脱5 min×3次,辣根过氧化酶标抗二抗室温孵育2 h,TBST洗脱10 min×3次,ECL化学发光显像[6]。目的蛋白的相对表达量=目的蛋白灰度值/GAPDH灰度值。

2 结果
2.1 沉默GRP78对SKOV3细胞增殖及凋亡的影响 转染24、48、72 h,与对照组、空白载体组比较,实验组生长抑制率升高(P均<0.05);且实验组各时间点生长抑制率比较差异有统计学意义(P均<0.05)。转染72 h,与对照组、空白载体组比较,实验组凋亡率升高(P均<0.05)。见表1。
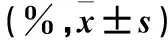
表1 各组细胞生长抑制率、凋亡率比较
注:与实验组同时间点比较*P<0.05;与同组前一时间点比较,#P<0.05。
2.2 沉默GRP78对SKOV3细胞内GRP78、CHOP及Caspase-3蛋白表达的影响 转染72 h,与对照组、空白载体组比较,实验组GRP78蛋白相对表达量降低,CHOP、Caspase-3蛋白相对表达量升高(P均<0.05)。见表2。

表2 各组GRP78、CHOP和Caspase-3蛋白相对表达量比较
注:与实验组比较,*P<0.05。
3 讨论
癌细胞由于其自身疯狂繁殖和易于转移等特点,使传统抗癌药物难以将癌细胞杀死。现代科学技术对于细胞的靶向诱导逐渐成熟,诱导肿瘤细胞凋亡已成为治疗肿瘤的希望和研究热点[7,8]。大量研究证实,恶性肿瘤细胞疯狂生长和繁殖,致使肿瘤细胞普遍缺氧并发生ERS,但发生ERS的肿瘤细胞并不走向凋亡,这可能与肿瘤细胞长期处于缺氧状态已产生耐缺氧及ERS耐受有关[9~11]。
卵巢癌因发现时多为中晚期,预后极差,现阶段手术治疗效果欠佳,临床治疗多以化疗为主[12]。但化疗药物具有不良反应大、靶向性不明确、易产生耐药性等缺点,在临床应用中受到了诸多限制。因此,寻找高效、靶向治疗卵巢癌的方法是亟待解决的问题。GRP78又称免疫球蛋白重链结合蛋白。Glembotski等[13]研究显示,GRP78通过重新折叠内质网中的“错误折叠蛋白”,起到保护细胞不受损伤的作用。但近年来研究发现,肿瘤的微环境可诱导GRP78高表达,高表达的GRP78又通过内质网应激通路调节肿瘤细胞的生长及死亡抵抗[2],可见GRP78的高表达是肿瘤发病因素之一。Kaira等[9]研究发现,GRP78是预测肿瘤不良预后的独立因素。通过抑制GRP78的表达可降低卵巢癌细胞的耐药性,增强化疗药物对卵巢癌细胞的杀伤能力[14,15]。因此,降低肿瘤细胞中GRP78的表达,诱导卵巢癌细胞凋亡,可能成为靶向治疗或辅助治疗卵巢癌的新方向。
在众多靶向沉默技术中慢病毒转染沉默技术的稳定性和成功率最高[16]。本研究通过慢病毒转染技术选择性沉默GRP78基因表达。卵巢癌SKOV3细胞沉默GRP78基因后,细胞凋亡率升高,且细胞生长受到抑制,生长抑制率随转染时间的延长而增加,说明沉默GRP78可有效打破卵巢癌细胞ERS耐受,并减慢肿瘤细胞繁殖速度;且随着时间延长,可加重未折叠蛋白在SKOV3细胞内质网中的堆积,激活ERS凋亡通路,促进肿胞凋亡。
CHOP又称生长停滞及诱导DNA损伤的基因153,可直接参与调节下游凋亡基因的表达,通过直接调节核内的靶基因,增加细胞对ERS介导凋亡的敏感性[17]。Caspase家族至今已发现14位家庭成员,其中Caspase-12为ERS下游的凋亡因子,经Caspase-12→Caspase-8→Caspase-3“瀑布式”激活,凋亡执行核心蛋白Caspase-3可通过多种机制引发细胞凋亡[18]。本研究发现,当沉默GRP78基因表达后,SKOV3细胞中CHOP及Caspase-3表达升高,推测沉默GRP78后,SKOV3细胞内质网内堆积的错误折叠蛋白不能降解,可能激活ERS凋亡信号通路,通过PERK→eIF2a→ATF-4→CHOP、IRE1→CHOP、ATF-6→CHOP、Caspase-12→Caspase-8→Caspase-3等途径促进细胞凋亡[19,20]。
总之,本研究结果表明,沉默GRP78基因可通过激活ERS凋亡信号通路,抑制卵巢癌SKOV3细胞增殖,促进细胞凋亡,此为靶向治疗卵巢癌提供了理论依据。将沉默GRP78作为“生物导弹”,局部靶向给药,可能成为临床治疗卵巢癌的新方法。本研究也有不足之处,ERS凋亡信号通路较多,本研究未逐一探明,下一步研究将证实SKOV3细胞沉默GRP78后,对ERS凋亡信号通路的影响。
[1] 张彤,沈丹华,陈云新,等. PTEN、PAX-2和β-catenin在Ⅰ型子宫内膜癌及其癌前病变中的表达及意义[J].现代妇产科进展,2014,23(2):85-88.
[2] 贾鹏宇,何苗,魏敏杰.GRP78在肿瘤发生发展及干性形成中的研究进展[J].生命的化学,2015,35(4):559-564.
[3] 王伊林,赵雅君,杨洋,等.磷酸肌酸钠对慢病毒介导Calumenin蛋白沉默阿霉素损伤心肌细胞内质网应激信号通路的作用[J].临床心血管病杂志,2015,31(10):1119-1122.
[4] 范丽梅,魏敏,杨淑丽,等.沉默GRP78基因对人卵巢癌SKOV3细胞侵袭力的抑制作用[J]. 中国老年学杂志,2010,30(23):3516-3519.
[5] Kim SH, Kim KY, Yu SN, et al. Silibinin induces mitochondrial NOX4-mediated endoplasmic reticulum stress response and its subsequent apoptosis[J]. BMC Cancer, 2016,16(1):452.
[6] 王伊林,单晓彤,柴花,等.丹参酮ⅡA磺酸钠腹腔注射对阿霉素心肌病大鼠心功能及左室纤维化的影响[J].山东医药,2016,56(7):34-36.
[7] 胡明英,王晓莉,毕学辉,等.RNA干扰沉默AKT基因对卵巢癌SKOV3细胞增殖与凋亡影响研究[J]. 中华肿瘤防治杂志,2013,20(24):1869-1873.
[8] 刘曼,胡明英,王晓莉,等. AKT基因沉默对人卵巢癌细胞增殖及Fas、Fasl、Caspase-3蛋白表达的影响[J].山东医药,2016,56(7):29-30.
[9] Kaira K, Toyoda M, Shimizu A, et al. Expression of ER stress markers(GRP78/BiP and PERK) in patients with tongue cancer[J]. Neoplasma, 2016,63(4):588-594.
[10] 吴芳,安永康,朱艳琴.内质网应激与肿瘤细胞凋亡的研究进展[J].现代肿瘤医学,2014,22(9): 2228-2231.
[11] Zhang B, Han H, Fu S, et al. Dehydroeffusol inhibits gastric cancer cell growth and tumorigenicity by selectively inducing tumor-suppressive endoplasmic reticulum stress and a moderate apoptosis[J]. Biochem Pharmacol, 2016,15(104):8-18.
[12] 高翔,刘永军,李晓丹,等.细胞因子诱导杀伤细胞联合多西他赛、卡铂治疗晚期卵巢癌的疗效及安全性[J].山东医药,2015,55(5):82-84.
[13] Glembotski CC. The role of the unfolded protein response in the heart[J]. J Mol Cell Cardiol, 2008,44(3):453-459.
[14] Stope MB, Hettenbach D, Kaul A, et al. The Tumor Suppressor MicroRNA-1 exhibits restricted inhibition of proliferation of ovarian cancer cells[J]. Anticancer Res, 2016,36(7):3329-3334.
[15] 范丽梅,张立会,崔松花,等.特异性下调GRP78基因表达对卵巢癌细胞耐药性的影响[J].吉林大学学报(医学版),2011,37(2):255-259.
[16] Lei CJ, Yao C, Pan QY, et al. Lentivirus vectors construction of SiRNA targeting interference GPC3 gene and its biological effects on liver cancer cell lines Huh-7[J]. Asian Pac J Trop Med, 2014,7(10):780-786.
[17] 黄金燕,赵连友,林可,等.高血压大鼠动脉血管平滑肌细胞中GRP78和CHOP表达的变化及对血管重构的影响[J].心脏杂志,2011,23(1):20-26.
[18] Zhang Q, Liu J, Chen S, et al. Caspase-12 is involved in stretch-induced apoptosis mediated endoplasmic reticulum stress[J]. Apoptosis, 2016,21(4):432-442.
[19] Ma J, Yang YR, Chen W, et al. Fluoxetine synergizes with temozolomide to induce the CHOP-dependent endoplasmic reticulum stress-related apoptosis pathway in glioma cells[J]. Oncol Rep, 2016,36(2):676-684.
[20] 赵彦超,顾耘.细胞凋亡通路研究进展[J].现代医学,2013,41(4):285-288.
李平(E-mail:wylteam@163.com)
10.3969/j.issn.1002-266X.2017.05.012
R737.31
A
1002-266X(2017)05-0040-03
2016-07-15)

