帕金森叠加综合征神经精神症状及PET影像学特征
张淼 陈曦 张惠红 蔡莉 周玉颖
·帕金森病及运动障碍性疾病·
帕金森叠加综合征神经精神症状及PET影像学特征
张淼 陈曦 张惠红 蔡莉 周玉颖
目的探讨帕金森叠加综合征患者的神经精神症状和18F-脱氧葡萄糖(18F-FDG)PET影像学特征。方法共8例很可能的帕金森叠加综合征患者,包括以小脑共济失调为主要表现的多系统萎缩(MSA-C型)1例、进行性核上性麻痹4例、皮质基底节变性1例、路易体痴呆2例,采用简易智能状态检查量表(MMSE)和蒙特利尔认知评价量表(Mo CA)评价认知功能,神经精神科问卷评价神经精神行为,汉密尔顿抑郁量表21项评价情绪状态。结果1例MSA-C型患者仅表现为焦虑。4例进行性核上性麻痹患者均存在不同程度认知功能障碍,其中3例还表现出明显抑郁、焦虑、易激惹和睡眠障碍。1例皮质基底节变性患者表现为执行功能和视空间能力、言语功能、注意力和定向力障碍,以及抑郁、焦虑、易激惹和睡眠障碍。2例路易体痴呆患者均不能复制MMSE量表之五边形,MoCA量表之画钟测验仅能勾画圆形轮廓,同时表现为幻觉、抑郁和淡漠。18F-FDG PET显像,1例MSA-C型患者为小脑葡萄糖代谢降低;4例进行性核上性麻痹患者均为双侧对称性额叶、前扣带回、顶叶代谢降低,尤以丘脑、基底节区和脑干显著;1例皮质基底节变性患者为右侧额颞顶枕叶外侧、左侧顶叶外侧、双侧扣带回和楔前叶代谢降低;2例路易体痴呆患者均为双侧颞枕叶代谢降低。结论帕金森叠加综合征早期易误诊为心理疾病而延误治疗,还可因使用镇静催眠药而加重运动障碍和锥体外系症状。神经心理学改变与认知功能障碍有关。PET显像对疾病的早期诊断有重要临床价值。
帕金森障碍;神经症性障碍;正电子发射断层显像术
This study was supported by Tianjin Municipal Science and Technology Key Support Program(No. 13ZCZDSY01600)and Key Project of Science and Technology Fund of Tianjin Health Bureau(No. 2013KG121).
帕金森叠加综合征也称非典型性帕金森样病,是一组异质性神经变性病,约占帕金森综合征的10%,在疾病早期阶段可能误诊为帕金森病(PD),包括多系统萎缩(MSA)、进行性核上性麻痹(PSP)、皮质基底节变性(CBD)和路易体痴呆(DLB)。多系统萎缩早期有自主神经功能障碍、锥体束征等特征;进行性核上性麻痹有核上性眼球运动障碍和额叶综合征等特征;皮质基底节变性有肌张力障碍和肌阵挛等特征;路易体痴呆出现痴呆前有锥体外系症状,且痴呆出现比较早,与帕金森病痴呆(PDD)有所不同[1]。由此可见,帕金森叠加综合征病情更严重,以皮质和皮质下萎缩为特征。目前关于帕金森叠加综合征神经精神症状和影像学特征的文献报道较为少见,鉴于此,本研究回顾分析近5年天津市环湖医院认知功能和运动障碍门诊诊断与治疗并经18F-脱氧葡萄糖(18F-FDG)PET证实8例很可能的(probable)帕金森叠加综合征患者的临床资料,以提高临床医师对该病的认识,有助于疾病的早期诊断与治疗。
临床资料
一、病例选择
1.纳入标准(1)经至少2位有临床经验的神经内科医师诊断为很可能的帕金森叠加综合征,并经头部MRI和18F-FDG PET证实。其中,多系统萎缩的诊断参照2008年Gilman等[2]修订的多系统萎缩临床诊断标准,包括以小脑共济失调为主要表现型(MSA-C型)和以帕金森综合征为主要表现型(MSA-P型);进行性核上性麻痹的诊断参照1996年美国国立神经病学与卒中研究所-进行性核上性麻痹学会(NINDS-SPSP)联合制定的诊断标准[3];皮质基底节变性的诊断参照2013年Armstrong等[4]制定的皮质基底节变性诊断标准;路易体痴呆的诊断参照2005年McKeith等[5]修订的路易体痴呆临床诊断标准。(2)本研究遵循天津市人体试验委员会伦理学标准并经天津市环湖医院道德伦理委员会审核批准。所有患者均有可靠照料者陪伴,患者或其家属均知情同意并签署知情同意书。
2.排除标准(1)病情严重或伴意识障碍、严重失语而无法完成神经心理学测验。(2)临床症状由其他系统性疾病或非神经变性病引起,不满足上述诊断标准。(3)心脏、肺、肝脏、肾脏疾病、内分泌系统疾病、血液系统疾病、结缔组织病和营养不良等严重内科疾病。(4)既往有肿瘤病史、癫病史、颅脑创伤史、煤气中毒史、长期嗜酒史等。(5)精神行为异常符合精神病诊断标准。(6)生物学标志物检查提示其他中枢神经系统退行性变。
3.一般资料选择2011年3月-2016年5月在天津市环湖医院认知功能和运动障碍门诊诊断与治疗的帕金森叠加综合征患者8例,男性2例,女性6例;年龄60~79岁,平均为70岁;受教育程度5~16年,平均为11.50年;病程1~10年,平均3.75年。所有患者均经18F-FDG PET显像证实额颞顶叶、基底节区和小脑葡萄糖代谢降低,其中MSA-C型1例、进行性核上性麻痹4例、皮质基底节变性1例、路易体痴呆2例。8例患者的一般资料参见表1。
二、临床表现
1.神经心理学测验所有患者均由经过规范化培训的神经内科医师进行神经心理学测验(表1)。(1)认知功能:采用简易智能状态检查量表(MMSE)和蒙特利尔认知评价量表(MoCA)评价认知功能。MMSE量表包括时间定向力、地点定向力、瞬时记忆、注意力和计算力、延迟回忆、言语功能及视空间能力共7个认知域,总评分30分,文盲≤17分、小学≤20分、初中及以上≤24分为认知功能障碍。MoCA量表包括注意力、执行功能、记忆力、言语功能、视空间能力、抽象思维、计算力及定向力共8个认知域,总评分30分,评分<26分为认知功能障碍,受教育程度≤12年者评分加1分以校正受教育程度偏倚。本组1例MSA-C型患者无认知功能障碍,MMSE评分29分、MoCA评分26分;4例进行性核上性麻痹患者均有不同程度认知功能障碍,MMSE评分8~24分、MoCA评分3~25分,其中MoCA量表中连线测验(TMT)、立方体模拟测验(Copy of the Cube Test)和画钟测验(CDT)是评价执行功能和视空间能力的敏感性测验,均0分;1例皮质基底节变性患者表现为执行功能和视空间能力、言语功能、注意力和定向力障碍,MMSE评分16分、MoCA评分8分;2例路易体痴呆患者MMSE评分20和25分,均不能复制MMSE量表之五边形,MoCA评分均21分,CDT测验仅能勾画圆形轮廓。(2)神经精神行为:采用神经精神科问卷(NPI)评价患者神经精神行为障碍程度。NPI量表包括妄想、幻觉、激越和(或)攻击性、心境恶劣、焦虑、欣快、情感淡漠、脱抑制、易激惹和(或)情绪不稳、运动行为异常、睡眠和(或)夜间行为、食欲减退和(或)进食障碍共计12项内容,每项根据发作频率(1~4分)、严重程度(1~3分)、引起照料者的苦恼程度(0~5分)进行评分,总评分为144分,评分越高、神经精神行为障碍越严重。本组1例MSA-C型患者仅表现为焦虑;有3例进行性核上性麻痹患者存在神经精神行为障碍,表现为明显的抑郁、焦虑、睡眠障碍和易激惹;1例皮质基底节变性患者表现为抑郁、焦虑、易激惹和睡眠障碍;2例路易体痴呆患者均出现幻觉、抑郁和情感淡漠。(3)日常生活活动能力:采用日常生活活动能力量表(ADL),包括基本日常生活活动能力量表(BADL,11项)和工具性日常生活活动能力量表(IADL,9项),总评分80分,评分越高、日常生活活动能力越差。本组仅1例MSA-C型和1例路易体痴呆患者日常生活活动能力尚可,其余患者均存在日常生活活动能力障碍。(4)情绪:采用汉密尔顿抑郁量表21项(HAMD-21)对情绪状态进行评价。HAMD-21量表包括抑郁心境、罪恶感、自杀倾向、失眠早期、失眠中期、失眠晚期、工作和活动、阻滞、激越、精神性焦虑、躯体性焦虑、胃肠道症状、全身症状、性症状、疑病症、自知力、体重减轻、昼夜变化、现实解体、类偏执及强迫症共计21项内容,评分≥7分,轻度抑郁;≥17分,中度抑郁;≥24分,重度抑郁。本组1例MSA-C型患者HAMD-21评分为2分,仅表现为精神性焦虑症状;其余患者HAMD-21评分均≥7分,3例进行性核上性麻痹和1例皮质基底节变性患者出现抑郁、焦虑、易激惹和睡眠障碍,2例路易体痴呆患者表现为幻觉、抑郁和情感淡漠。
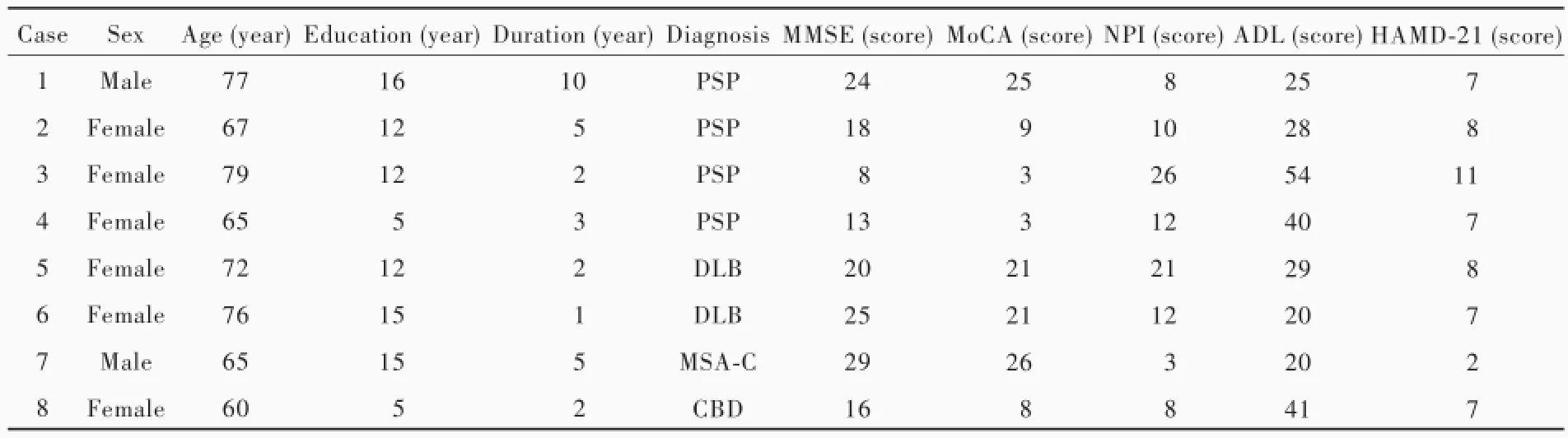
表1 8例帕金森叠加综合征患者的临床资料和神经心理学测验Table 1.Clinical data and neuropsychological tests in 8 patients with Parkinson-plus syndromes
2.影像学表现(1)头部MRI检查:本研究采用德国Siemens公司生产的Trio Tim 3.0T MRI扫描仪。1例MSA-C型患者可见小脑脑沟明显增宽,脑萎缩,脑白质疏松;4例进行性核上性麻痹患者首诊时均可见脑萎缩,其中1例随访6个月显示右侧侧脑室旁腔隙性梗死灶,1例随访2年显示脑白质疏松,1例随访4.50年显示脑桥腔隙性梗死灶和脑白质疏松;1例皮质基底节变性患者可见脑萎缩,尤以右侧额颞顶叶显著;2例路易体痴呆患者首诊时可见脑萎缩,其中1例梯度回波序列(GRE)显示右侧额部大脑镰旁低信号,随访6和18个月无明显变化。(2)18F-脱氧葡萄糖(18F-FDG)PET显像:采用美国GE公司生产的Discovery LS PET/CT扫描仪,由PET Advance和Lightspeed 4层螺旋CT在同一机架上组成。1例MSA-C型患者表现为小脑葡萄糖代谢降低(图1);4例进行性核上性麻痹患者均表现为双侧对称性额叶、前扣带回、顶叶葡萄糖代谢降低,尤以丘脑、基底节区和脑干显著,其中2例双侧颞枕叶代谢降低,1例顶叶代谢降低,1例基底节区代谢降低(图2);1例皮质基底节变性患者表现为右侧额颞顶枕叶外侧、左侧顶叶外侧、双侧扣带回和楔前叶葡萄糖代谢降低(图3);2例路易体痴呆患者均表现为双侧颞枕叶葡萄糖代谢降低,其中1例后扣带回代谢降低(图4)。
三、治疗与转归
所有患者均不规律服用改善循环药物(包括胞磷胆碱、奥拉西坦、银杏叶制剂等)和抗抑郁药(包括艾斯西酞普兰,舍曲林等)治疗。出院后经6个月至4.50年随访,病情仍逐渐进展。
讨论
帕金森叠加综合征临床表现为不典型性帕金森样病,包括多系统萎缩、进行性核上性麻痹、皮质基底节变性和路易体痴呆,早期双侧对称起病,左旋多巴替代治疗效果欠佳,亦可出现其他非典型症状,由于缺乏病理学标志物,各种类型疾病的临床症状常有重叠,临床通常根据各种疾病的诊断标准进行鉴别诊断。其中,进行性核上性麻痹和皮质基底节变性是tau蛋白相关神经变性病,多系统萎缩和路易体痴呆是α-突触核蛋白(α-Syn)和(或)β-淀粉样蛋白(Aβ)相关神经变性病。神经心理学改变和神经精神行为障碍可能是帕金森叠加综合征的唯一表现[6],早期易误诊为心理疾病而延误治疗,还会因为使用镇静催眠药而加重运动障碍和锥体外系症状。研究显示,帕金森叠加综合征患者神经心理学改变与认知功能障碍有关[7]。
一、认知功能障碍
进行性核上性麻痹的主要病理改变为tau蛋白累及苍白球、下丘脑和黑质,从而导致典型的皮质下痴呆。Josephs等[8]认为,认知功能障碍程度与视觉障碍程度相关,而与疾病严重程度或抑郁症状无关联性,其病理改变主要发生于中脑导水管周围。有研究显示,注意障碍与网状激活系统病理改变相关[9]。Josephs等[8]将进行性核上性麻痹患者进一步分为以认知功能障碍为主亚组和以锥体外系症状为主亚组,通过头部MRI观察脑萎缩情况以反映病理改变,结果显示,以认知功能障碍为主亚组患者表现出明显的皮质下萎缩,而以锥体外系症状为主亚组患者呈现脑干萎缩。Dubois等[10]的研究显示,进行性核上性麻痹患者出现更多的模仿语言和重复语言。此类患者还常表现出阅读困难,考虑可能是凝视麻痹所致。本组有2例进行性核上性麻痹患者存在词语流畅性障碍和阅读理解障碍。由于进行性核上性麻痹和皮质基底节变性在临床表现上存在一定重叠,Pillon等[11]比较进行性核上性麻痹、皮质基底节变性和阿尔茨海默病(AD)患者的认知功能,结果显示,皮质基底节变性患者运动功能和执行功能障碍、运动前区协调运动功能降低,不同于进行性核上性麻痹和阿尔茨海默病患者。本组2例路易体痴呆患者认知功能障碍均以执行功能和视空间能力障碍突出,如CDT测验和图形复制测验0分。与进行性核上性麻痹、皮质基底节变性和路易体痴呆相比,多系统萎缩认知功能障碍程度较轻,主要表现为执行功能障碍,也可累及其他认知域,如记忆力、视空间能力。Brown等[12]观察372例多系统萎缩患者,仅73例存在认知功能障碍,其中约28.6%存在单一认知域损伤、13.5%存在2个及以上认知域损伤、11%~32%存在全部认知域损伤。本组1例多系统萎缩患者无明显认知功能障碍。
二、神经精神行为
进行性核上性麻痹患者最常见的神经精神行为是淡漠和快感缺乏、抑郁及延髓受累[13]。淡漠是进行性核上性麻痹的主要临床症状,可能是抑郁症所致且持续存在,约80%呈中至重度淡漠。Aarsland等[14]采用NPI问卷评价61例可能的(possible)进行性核上性麻痹患者和103例可能的帕金森病患者,前者主要表现为淡漠和脱抑制、后者则为幻觉和妄想,而且进行性核上性麻痹患者NPI评分显著高于帕金森病患者。本组4例进行性核上性麻痹患者均表现为淡漠和脱抑制。皮质基底节变性患者最常见的神经精神行为是抑郁、淡漠、易激惹、人格改变和精神亢奋,较少出现错觉和幻觉。Geda等[15]回顾分析36例经病理学证实的皮质基底节变性患者,8例(22.22%)患者存在神经精神行为,主要表现为抑郁症状、强迫行为、额叶释放和执行功能障碍,而无幻觉的报道。本组1例皮质基底节变性患者抑郁症状明显,有罪恶感和自杀倾向。路易体痴呆患者最常见的神经精神行为是幻觉、睡眠障碍、淡漠、妄想、焦虑和抑郁,较少出现欣快感和脱抑制。神经精神行为是首发症状且常成为就诊的主要原因。不恰当的抗精神病药可能导致致命性并发症。睡眠障碍是路易体痴呆的特征性表现之一,本组2例路易体痴呆患者均表现为睡眠障碍。Chang等[16]的研究显示,MSA-C型患者存在明显焦虑症状,并认为焦虑和抑郁症状与认知功能障碍有关,但抑郁症状并未显著影响认知功能。
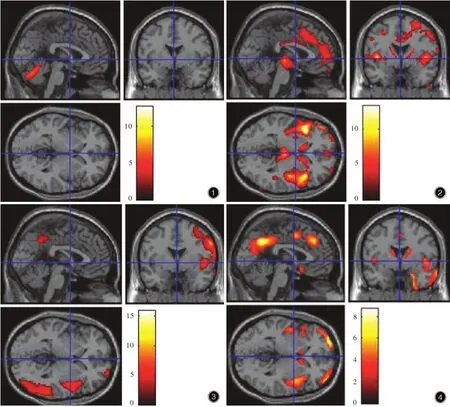
图1 男性患者,65岁,临床诊断为MSA-C型。18F-FDG PET显像显示,双侧小脑半球皮质和小脑蚓部葡萄糖代谢降低(红色区域所示)图2 女性患者,67岁,临床诊断为进行性核上性麻痹。18F-FDG PET显像显示,双侧额顶叶、双侧岛叶、扣带回、双侧尾状核、壳核后部、丘脑和中脑葡萄糖代谢降低(红色区域所示)图3 女性患者,60岁,临床诊断为皮质基底节变性。18F-FDG PET显像显示,右侧额颞顶枕叶外侧、左侧顶叶外侧、后扣带回和楔前叶葡萄糖代谢降低(红色区域所示)图4 女性患者,76岁,临床诊断为路易体痴呆。18F-FDG PET显像显示,双侧枕叶内侧、双侧额颞叶、后扣带回、楔前叶和右侧岛叶、双侧尾状核葡萄糖代谢降低(红色区域所示)Figure 1 A 65-year-old male patient was clinically diagnosed as MSA-C.18F-FDG PET imaging showed glucose metabolism decreased in bilateral cerebellar cortex and cerebellar vermis(red areas indicate).Figure 2 A 67-year-old female patient was clinically diagnosed as PSP.18F-FDG PET imaging showed glucose metabolism decreased in bilateral fronto-parietal lobes,bilateral insula,cingulate gyrus,bilateral caudate nuclei,posterior putamen,thalamus and midbrain(red areas indicate).Figure 3 A 60-yearold female patient was clinically diagnosed as CBD.18F-FDG PET imaging showed glucose metabolism decreased right lateral frontotemporo-parieto-occipital lobe,left lateral parietal lobe,posterior cingulate gyrus and precuneus(red areas indicate).Figure 4 A 76-year-old female patient was clinically diagnosed as DLB.18F-FDG PET imaging showed glucose metabolism decreased in bilateral medial occipital lobes,bilateral fronto-temporal lobes,posterior cingulate gyrus,precuneus and right insula,bilateral caudate nuclei (red areas indicate).
三、18F-FDG PET显像
原发性帕金森病和帕金森叠加综合征的鉴别诊断较为复杂。脑组织葡萄糖代谢与神经元活性相耦联,以18F-FDG PET所显示的大脑皮质能量代谢变化可以反映突触功能和密度,代表神经元功能状态。崔瑞雪等[17]认为18F-FDG PET对阿尔茨海默病和额颞叶痴呆(FTD)具有较好的鉴别诊断价值。由于帕金森叠加综合征在大脑皮质和皮质下结构存在不同的病理生理改变,不同脑区葡萄糖代谢改变有助于帕金森叠加综合征的鉴别诊断。进行性核上性麻痹患者18F-FDG PET显示双侧额叶内侧主要涉及前扣带回、中扣带回、辅助运动功能区、运动前区的腹侧和背侧、前额叶、纹状体(尾状核,特别是丘脑和脑干)葡萄糖代谢降低[18]。额叶功能分离可以产生额叶病变,如淡漠、脱抑制、执行功能障碍等;视空间能力障碍是眼球运动障碍所致,并非枕叶病变所致;执行功能障碍是凝视麻痹所致。皮质基底节变性患者18F-FDG PET表现为额顶叶皮质和基底节区非对称性葡萄糖代谢降低,患侧肢体对侧大脑皮质代谢降低。上述证据可以支持皮质基底节变性的诊断,但无法明确导致脑组织葡萄糖代谢降低的病理改变。Whitwell等[19]对皮质基底节变性患者进行头部MRI研究,发现MRI表现与尸检病理结果不尽一致,皮质基底节变性患者MRI表现为前额叶皮质,岛叶皮质和运动附属区脑萎缩;18F-FDG PET典型表现为额顶叶体积缩小、葡萄糖代谢降低,而颞叶较少受累,皮质联合区和纹状体区葡萄糖代谢亦降低。与崔瑞雪等[20]报告的1例皮质基底节变性患者以右侧大脑皮质和基底节代谢降低为特征,但其左侧中央沟邻近皮质也可见轻度代谢降低相一致,并非单侧额顶叶皮质广泛性代谢降低。额顶叶萎缩、葡萄糖代谢降低导致神经功能障碍,表现为运动不能、异己肢现象、执行功能障碍和言语障碍。枕叶葡萄糖代谢相对降低是路易体痴呆最常见的18F-FDG PET表现。Kawai等[21]的研究显示,MSA-P型患者认知功能障碍程度与背外侧前额叶皮质(DLPFC)低灌注有关。基于体素的形态学分析(VBM)显示,MSA-C型患者双侧额叶皮质萎缩与双侧小脑灰质减少有关[16]。Lyoo等[22]的研究显示,多系统萎缩脑组织葡萄糖低代谢始于额叶和小脑,病程<1年的患者表现为额叶代谢降低,病程≥1年的患者表现为更广泛的大脑皮质(包括额颞顶叶和扣带回)代谢降低。疾病早期神经胶质细胞葡萄糖代谢降低较皮质神经细胞明显,因此,18F-FDG PET有助于早期诊断帕金森叠加综合征。
尽管临床诊断并不总与最终病理诊断一致,早期临床诊断仍是临床医师研究神经变性病的关键。本文旨在根据帕金森叠加综合征患者可能出现的神经精神行为异常和认知功能障碍预测诊断。大样本临床研究显示,约28.2%的神经变性病伴痴呆患者最初诊断为原发性精神障碍,主要为抑郁症和双相情感障碍,从而延误治疗,还可因使用镇静催眠药而加重运动障碍和锥体外系症状[23]。PET显像对疾病的早期诊断有重要临床价值。
[1]Dickson DW.Parkinson's disease and parkinsonism:neuropathology.Cold Spring Harb Perspect Med,2012,2:ID009258.
[2]Gilman S,Wenning GK,Low PA,Brooks DJ,Mathias CJ, Trojanowski JQ,Wood NW,Colosimo C,Dürr A,Fowler CJ, Kaufmann H,Klockgether T,Lees A,Poewe W,Quinn N, Revesz T,Robertson D,Sandroni P,Seppi K,Vidailhet M. Second consensus statement on the diagnosis of multiple system atrophy.Neurology,2008,71:670-676.
[3]Litvan I,Agid Y,Calne D,Campbell G,Dubois B,Duvoisin RC,Goetz CG,Golbe LI,Grafman J,Growdon JH,Hallett M, Jankovic J,Quinn NP,Tolosa E,Zee DS.Clinical research criteria for the diagnosis of progressive supranuclear palsy (Steele-Richardson-Olszewski syndrome):report of the NINDSSPSP international workshop.Neurology,1996,47:1-9.
[4]Armstrong MJ,Litvan I,Lang AE,Bak TH,Bhatia KP,Borroni B,Boxer AL,Dickson DW,Grossman M,Hallett M,Josephs KA,Kertesz A,Lee SE,Miller BL,Reich SG,Riley DE,Tolosa E,Tröster AI,Vidailhet M,Weiner WJ.Criteria for the diagnosis of corticobasal degeneration.Neurology,2013,80:496-503.
[5]Mc Keith IG,Dickson DW,Lowe J,Emre M,O'Brien JT, Feldman H,Cummings J,Duda JE,Lippa C,Perry EK, Aarsland D,Arai H,Ballard CG,Boeve B,Burn DJ,Costa D, Del Ser T,Dubois B,Galasko D,Gauthier S,Goetz CG,Gomez-Tortosa E,Halliday G,Hansen LA,Hardy J,Iwatsubo T, Kalaria RN,Kaufer D,Kenny RA,Korczyn A,Kosaka K,Lee VM,Lees A,Litvan I,Londos E,Lopez OL,Minoshima S, Mizuno Y,Molina JA,Mukaetova-Ladinska EB,Pasquier F, Perry RH,Schulz JB,Trojanowski JQ,Yamada M;Consortium on DLB.Diagnosis and management of dementia with Lewy bodies:third report of the DLB Consortium.Neurology,2005, 65:1863-1872.
[6]Mathew R,Bak TH,Hodges JR.Diagnostic criteria forcorticobasal syndrome:a comparative study.J Neurol Neurosurg Psychiatry,2012,83:405-410.
[7]Margari F,Sicolo M,Spinelli L,Mastroianni F,Pastore A,Craig F,Petruzzelli MG.Aggressive behavior,cognitive impairment, and depressive symptoms in elderly subjects.Neuropsychiatr Dis Treat,2012,8:347-353.
[8]Josephs KA,Whitwell JL,Eggers SD,Senjem ML,Jack CR Jr. Gray matter correlates of behavioral severity in progressive supranuclear palsy.Mov Disord,2011,26:493-498.
[9]Bruns MB,Josephs KA.Neuropsychiatry of corticobasal degeneration and progressive supranuclear palsy.Int Rev Psychiatry,2013,25:197-209.
[10]Dubois B,Pillon B,Legault F,Agid Y,Lhermitte F.Slowing of cognitive processing in progressive supranuclear palsy:a comparison with Parkinson's disease.Arch Neurol,1988,45:1194-1199.
[11]Pillon B,Blin J,Vidailhet M,Deweer B,Sirigu A,Dubois B, Agid Y.The neuropsychological pattern of corticobasal degeneration:comparison with progressive supranuclear palsy and Alzheimer's disease.Neurology,1995,45:1477-1483.
[12]Brown RG,Lacomblez L,Landwehrmeyer BG,Bak T,Uttner I, Dubois B,Agid Y,Ludolph A,Bensimon G,Payan C,Leigh NP;NNIPPS Study Group.Cognitive impairment in patients with multiple system atrophy and progressive supranuclear palsy.Brain,2010,133(Pt 8):2382-2393.
[13]Williams DR,Lees AJ.Progressive supranuclear palsy:clinicopathological concepts and diagnostic challenges.Lancet Neurol,2009,8:270-279.
[14]Aarsland D,Litvan I,Larsen JP.Neuropsychiatric symptoms of patients with progressive supranuclear palsy and Parkinson's disease.J Neuropsychiatry Clin Neurosci,2001,13:42-49.
[15]Geda YE,Boeve BF,Negash S,Graffradford NR,Knopman DS, Parisi JE,Dickson DW,Peterson RC.Neuropsychiatric features in 36 pathologically confirmed cases of corticobasal degeneration.J Neuropsychiatry Clin Neurosci,2007,19:77-80.
[16]Chang CC,Chang YY,Chang WN,Lee YC,Wang YL,Lui CC, Huang CW,Liu WL.Cognitive deficits in multiple system atrophy correlate with frontal atrophy and disease duration.Eur J Neurol,2009,16:1144-1150.
[17]Cui RX,Niu N,Zhang Y,Yuan J,Li F.Value of18F-FDG PET in differentiating Alzheimer's disease with frontotemporal dementia.Zhongguo Xian Dai Shen Jing Ji Bing Za Zhi,2014, 14:214-221[.崔瑞雪,牛娜,张颖,袁晶,李方.18F-FDG PET显像鉴别阿尔茨海默病与额颞叶痴呆临床价值.中国现代神经疾病杂志,2014,14:214-221.]
[18]Flavia N,Politis M.A systematic review of lessons learned from PET molecular imaging research in atypical parkinsonism.Eur J Nucl Med Mol Imaging,2016,43:2244-2254.
[19]Whitwell JL,Jack CR Jr,Boeve BF,Parisi JE,Ahlskog JE, Drubach DA,Senjem ML,Knopman DS,Petersen RC,Dickson DW,Josephs KA.Imaging correlates of pathology in corticobasal syndrome.Neurology,2010,75:1879-1887.
[20]Cui RX,Niu N,Zhang Y,Yuan J,Li F.Typical cerebral metabolic patterns in various types of dementia:an SPM analysis of18F-FDG PET images.Zhongguo Xian Dai Shen Jing Ji Bing Za Zhi,2014,14:303-308[.崔瑞雪,牛娜,张颖,袁晶,李方.不同类型痴呆脑代谢改变图型:18F-FDG PET显像.中国现代神经疾病杂志,2014,14:303-308.]
[21]Kawai Y,Suenaga M,Takeda A,Ito M,Watanabe H,Tanaka F, Kato K,Fukatsu H,Naganawa S,Kato T,Ito K,Sobue G. Cognitive impairments in multiple system atrophy:MSA-C vs MSA-P.Neurology,2008,70(16 Pt 2):1390-1396.
[22]Lyoo CH,Jeong Y,Ryu YH,Lee SY,Song TJ,Lee JH,Rinne JO,Lee MS.Effects of disease duration on the clinical features and brain glucose metabolism in patients with mixed type multiple system atrophy.Brain,2008,131(Pt 2):438-446.
[23]Woolley JD,Khan BK,Murthy NK,Miller BL,Rankin KP.The diagnostic challenge of psychiatric symptoms in neurodegenerative disease:rates of and risk factors for prior psychiatric diagnosis in patients with early neurodegenerative disease.J Clin Psychiatry,2011,72:126-133.
Neuropsychiatric symptoms and PET imaging characteristics in patients with Parkinson-plus syndromes
ZHANG Miao1,CHEN Xi1,ZHANG Hui-hong1,CAI Li2,ZHOU Yu-ying1
1Department of Neurology,Tianjin Huanhu Hospital,Tianjin 300350,China
2PET-CT Center,Tianjin Medical University General Hospital,Tianjin 300052,China Corresponding author:ZHOU Yu-ying(Email:qiying789@sina.cn)
ObjectiveTo explore the neuropsychiatric symptoms and18F-fluoro-2-deoxy-D-glucose (18F-FDG)PET imaging features of Parkinson-plus syndromes.MethodsThere were 8 patients with probable Parkinson-plus syndromes,including one case of multiple system atrophy-cerebellar predominant (MSA-C),4 cases of progressive supranuclear palsy(PSP),one case of corticobasal ganglionic degeneration (CBD)and 2 cases of dementia with Lewy bodies(DLB).Mini-Mental State Examination(MMSE)and Montreal Cognitive Assessment(MoCA)were used to evaluate cognitive function,Neuropsychiatric Inventory (NPI)was used to evaluate neuropsychiatric behaviors,and Hamilton Depression Rating Scale-21 Items (HAMD-21)was used to evaluate the emotional state of patients.ResultsOne MSA-C patient showed only anxiety.Four PSP patients showed different degrees of cognitive disorders,of whom 3 cases also presented obvious depression,anxiety,irritability and sleep disorders.One case of CBD showed dysfunction in executive function,visual spatial ability,verbal function,attention and orientation,as well as depression,anxiety,irritability and sleep disorders.Two cases of DLB were found unable to copy pentagon in MMSE chart or draw a circle in Clock Drawing Test(CDT),and they also presented hallucination, depression and indifference.As for the result of18F-FDG PET,one MSA-C patient showed cerebellarglucose hypometabolism;4 PSP patients showed hypometabolism in bilateral symmetrical frontal lobes, anterior cingulate gyrus and parietal lobe,especially in thalamus,basal ganglia region and brain stem;one case of CBD showed hypometabolism in right lateral fronto-temporo-parieto-occipital lobes,left lateral parietal lobe,bilateral cingulate gyri and precuneus;2 cases of DLB showed hypometabolism in bilateral temporo-occipital lobes.ConclusionsPatients with early Parkinson-plus syndromes are easily misdiagnosed as mental illness and delayed treatment,in addition,their movement disorders and extrapyramidal symptoms would be aggravated due to misusage of sedative hypnotic drugs. Neuropsychological changes are found closely related to cognitive dysfunction.PET imaging has important clinical values to early diagnosis of Parkinson-plus syndromes.
Parkinsonian disorders;Neurotic disorders;Positron-emission tomography
2016-11-28)
10.3969/j.issn.1672-6731.2017.01.008
天津市科技支撑重点项目(项目编号:13ZCZDSY01600);天津市卫生局科技攻关项目(项目编号:2013KG121)
300350天津市环湖医院神经内科(张淼,陈曦,张惠红,周玉颖);300052天津医科大学总医院PET-CT影像诊断科(蔡莉)
周玉颖(Email:qiying789@sina.cn)

