多模态分子影像学在路易体痴呆诊断中的应用
高中宝 王炜 陈彤 富丽萍 徐白萱 王振福
·帕金森病及运动障碍性疾病·
多模态分子影像学在路易体痴呆诊断中的应用
高中宝 王炜 陈彤 富丽萍 徐白萱 王振福
目的探讨多模态分子影像学技术在路易体痴呆诊断中的应用价值。方法共5例可能的路易体痴呆患者,进行详细的临床病史采集、神经心理学测验、头部MRI检查,以及11C-甲基-N-2β-甲基酯-3β-(4-氟苯基)托烷(11C-β-CFT)、11C-匹兹堡复合物B(11C-PIB)和18F-脱氧葡萄糖(18F-FDG)PET显像。结果路易体痴呆患者早期认知功能障碍和幻视较为明显。11C-β-CFT PET可见双侧壳核和尾状核多巴胺转运体摄取降低;11C-PIB PET可见双侧额颞顶枕叶皮质弥漫性淀粉样蛋白摄取升高;18F-FDG PET可见双侧顶枕叶葡萄糖代谢降低。结论多模态分子影像学技术可以显著提高路易体痴呆临床诊断的特异性,有望实现生前明确诊断。
Lewy体病;痴呆;正电子发射断层显像术
This study was supported by Beijing Science and Technology Plan Project(No.Z151100004015206), Central Healthcare Scientific Research Project(No.W2013BJ14),Clinical Supportive Grant of Chinese PLA General Hospital(No.2015FC-TSYS-1016),and Medical Big Data Research and Development Project of Chinese PLA General Hospital(No.2016MBD-020).
路易体痴呆(DLB)是一种以波动性认知功能障碍、帕金森综合征和幻视为典型特征的神经变性病,是仅次于阿尔茨海默病(AD)的第2位痴呆,约占痴呆总病例数的4.2%,占每年新发痴呆病例数的3.8%[1]。国内关于路易体痴呆的文献报道较少,过去30余年临床资料翔实的病例仅百余例[2]。路易体痴呆临床表现多样,与阿尔茨海默病和帕金森病痴呆(PDD)具有相似的临床和病理学表现,诊断与鉴别诊断困难。研究显示,有20%~25%临床诊断阿尔茨海默病的患者经尸检证实为路易体痴呆[3]。随着核医学显像设备和技术的迅速发展,多种对比剂应用于中枢神经系统变性病的诊断,使PET-MRI能够更好地反映脑组织分子水平病变,在路易体痴呆的影像学诊断中发挥重要作用。近年解放军总医院南楼神经科将多模态PET-MRI显像应用于路易体痴呆的早期诊断与鉴别诊断,显示出较高的特异性。
临床资料
一、病例选择
1.病例选择标准(1)路易体痴呆的诊断符合路易体痴呆国际协作组(DLB Consortium)于2005年提出的诊断共识中可能的(probable)路易体痴呆诊断标准[4]。(2)血常规、甲状腺功能试验、血清叶酸和维生素B12、血液生化等实验室指标未见异常。(3)本研究经解放军总医院道德伦理委员会审核批准,所有患者或其家属均知情同意并签署知情同意书。
2.一般资料选择解放军总医院帕金森病及运动障碍性疾病门诊2014年2月-2016年1月诊断与治疗的可能的路易体痴呆患者5例,男性3例,女性2例;年龄61~81岁,平均70.40岁;受教育程度5~11年,平均8.80年;病程3~5年,平均4年。5例患者的一般资料参见表1。
二、临床表现
1.临床症状与体征5例患者中2例以帕金森样症状起病、1年内出现认知功能障碍,3例认知功能减退后出现运动障碍,3例认知功能障碍呈波动性,4例病程中出现明显幻视,2例出现妄想,1例精神行为异常,1例体位性低血压,1例尿失禁;5例均有不同程度便秘、肌强直和运动迟缓,3例有静止性震颤(表1)。
2.神经心理学测验所有患者均由同一位神经内科副主任医师详细采集病史和体格检查,对帕金森病症状和异常精神行为症状进行详细记录和评价。采用统一帕金森病评价量表第三部分(UPDRSⅢ)评价运动功能,简易智能状态检查量表(MMSE)和蒙特利尔认知评价量表(MoCA)评价认知功能。UPDRSⅢ量表包括言语表达、面部表情、静止性震颤、手部姿势性或运动性震颤、肌强直、手部拍打、手部运动、轮替运动、腿部灵活性、站立、姿势、步态、姿势稳定性和躯体少动共14项内容,每项评分0~5分,评分越高、运动障碍越严重。MMSE量表包括时间定向力、地点定向力、瞬时记忆、注意力和计算力、延迟回忆、言语功能和视空间能力共计7个认知域,总评分为30分,文盲≤17分、小学≤20分、初中及以上≤24分为认知功能障碍。MoCA量表包括注意力、执行功能、记忆力、言语功能、视空间能力、抽象思维、计算力和定向力共计8个认知域,总评分为30分,评分<26分为认知功能障碍,受教育程度≤12年者评分加1分以校正受教育程度偏倚(表1)。
3.多模态PET-MRI显像5例患者均以德国Siemens公司生产的Biograph mMR扫描仪行11C-甲基-N-2β-甲基酯-3β-(4-氟苯基)托烷(11C-β-CFT)、11C-匹兹堡复合物B(11C-PIB)以及18F-脱氧葡萄糖(18F-FDG)PET显像,分别显示脑组织多巴胺转运体(DAT)的分布、淀粉样蛋白的沉积和葡萄糖的代谢。(1)11C-β-CFT PET显像:静脉注射11C-β-CFT 3.70 MBq/kg,安静休息40 min后采用三维、列表(list)模式连续采集图像10 min。5例患者中4例双侧壳核多巴胺转运体摄取降低,1例双侧壳核摄取正常;1例双侧尾状核多巴胺转运体摄取降低,4例双侧尾状核摄取正常(表2)。(2)11C-PIB PET显像:静脉注射11C-PIB 3.70 MBq/kg,安静休息40 min后采用三维、列表模式连续采集图像20 min。5例患者中4例额颞顶枕叶皮质不同程度弥漫性淀粉样蛋白摄取升高,小脑无明显摄取;1例未见明显淀粉样蛋白摄取(表2)。(3)18F-FDG PET显像:检查前常规禁食4~6 h,控制空腹血糖<11 mmol/L,静脉滴注18F-FDG 3.70 MBq/kg,安静休息50 min后采用三维、列表模式连续采集图像10 min。5例患者中3例额叶葡萄糖代谢降低,2例额叶代谢正常;4例颞叶葡萄糖代谢降低,1例颞叶代谢正常;5例顶叶葡萄糖代谢均降低;3例枕叶葡萄糖代谢降低,2例枕叶代谢正常;1例基底节区葡萄糖代谢降低,4例基底节区代谢正常;1例后扣带回葡萄糖代谢降低,4例后扣带回代谢正常;5例小脑葡萄糖代谢均正常(表2)。本组有1例(例4)经11C-β-CFT PET显像排除路易体痴呆的诊断,修正诊断为阿尔茨海默病;1例(例5)经11C-PIB PET显像排除路易体痴呆的诊断,修正诊断为帕金森病痴呆。
三、治疗与转归
5例患者均服用左旋多巴、多巴胺受体激动剂和胆碱酯酶抑制剂治疗。共随访6~24个月、平均17个月,1例卧床,生活不能自理;1例病情有所好转,精神症状明显减轻;3例病情稳定,进展缓慢,与就诊时无明显变化。
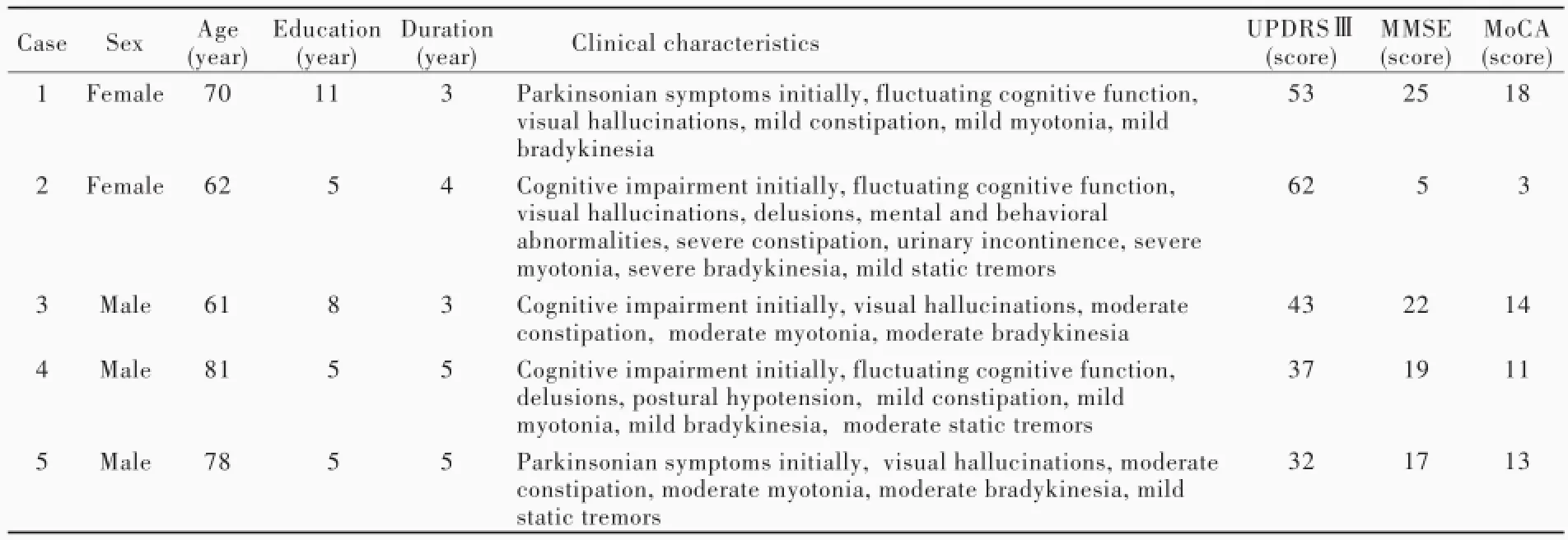
表1 5例可能的路易体痴呆患者的临床特点Table 1.Clinical characteristics of 5 patients with probable DLB
典型病例
患者女性,70岁,高中受教育程度,因运动迟缓21个月,进行性加重伴记忆力减退和幻视10个月,于2015年1月21日至我院帕金森病及运动障碍性疾病门诊就诊。患者21个月前(2013年4-5月)无明显诱因出现下肢沉重感、动作欠灵活,无明显震颤,上肢未见明显异常,未予特殊处理;7个月后(2013年12月)出现行走缓慢,右上肢动作减少,表情略减少,伴便秘,无明显震颤,当地医院考虑为帕金森病,但患者拒绝接受治疗;4个月后(2014年4-5月)明显行走缓慢,上肢动作缓慢,记忆力减退(主诉记忆力时好时坏),伴睡眠中喊叫和肢体大幅度动作,当地医院诊断为帕金森病,予多巴丝肼62.50 mg/次(3次/d)口服,症状未见明显改善;7个月后(2014年11-12月)行走缓慢进一步加重,需要他人搀扶,自理能力下降,并出现幻觉(主诉家里有坏人走动)、焦虑情绪、易激惹,继续服用多巴丝肼125 mg/次(3次/d),加服盐酸普拉克索0.125 mg/次(3次/d),间断服用金刚烷胺0.10 g/次(2次/d),症状无明显改善。此后出现明显幻视(主诉被子中间有水坑,可见青蛙跳跃),为求进一步诊断与治疗,至我院就诊。既往史、个人史及家族史无特殊。入院后体格检查:轮椅推入,行走困难;表情略呆板,语调略低,反应略迟钝;眼球活动佳,伸舌居中,无吞咽困难;四肢肌容积正常,四肢肌力5级,双上肢肌张力增高,尤以右侧显著,各关节活动尚可;双侧指鼻试验稳准,快复轮替动作、双手对指和握拳动作略笨拙,尤以右侧显著;无明显静止性和意向性震颤;深浅感觉正常;病理放射未引出。实验室检查:血常规、甲状腺功能试验、血清叶酸和维生素B12、血液生化等项指标未见异常。影像学检查:11C-β-CFT PET显示,双侧壳核多巴胺转运体摄取降低(图1a~1c);11C-PIB PET显示,双侧额叶皮质淀粉样蛋白摄取明显升高,双侧颞顶枕叶皮质轻度升高(图1d~1f);18F-FDG PET显示,双侧额叶和颞顶枕叶交界区葡萄糖代谢降低,双侧枕叶、后扣带回、基底节区和小脑代谢正常(图1g~1i)。临床诊断为路易体痴呆,予多巴丝肼187.50 mg/次(3次/d),盐酸普拉克索0.50 mg/次(3次/d)和利斯的明3 mg/次(3次/d)口服,精神症状明显减轻。
讨论
路易体痴呆最早由Okazaki等[5]于1961年率先报道,是一组临床症状和病理学表现与帕金森病痴呆和阿尔茨海默病相重叠的神经变性病,好发于老年人群,仅见于少数中青年人群。临床主要表现为波动性认知功能障碍、持续反复出现的幻视和锥体外系症状,其中,波动性认知功能障碍是核心症状,发生于80%~90%的患者,照料者常表述“有时清楚、有时糊涂”,尤以注意力和警惕性下降的波动最具特征性。波动性表现为数周甚至1天内认知功能障碍程度发生较大变化,异常与正常交替。本研究5例患者中3例存在波动性认知功能障碍,主要表现为数天或数周内认知功能明显波动。幻视是路易体痴呆最常见的精神症状,可发生于70%以上患者,常出现于疾病早期,约半数以上患者发病初期即有明显幻视。本研究有4例患者存在明确的幻视,内容较丰富,1例无幻视患者经11C-β-CFT PET显像排除路易体痴呆的诊断。Tiraboschi等[6]的研究显示,疾病早期出现幻视诊断路易体痴呆的灵敏度为22%、特异度达99%。本研究5例患者均出现锥体外系症状,表现为手足和面部运动迟缓、肌张力增高、姿势步态异常和静止性震颤。
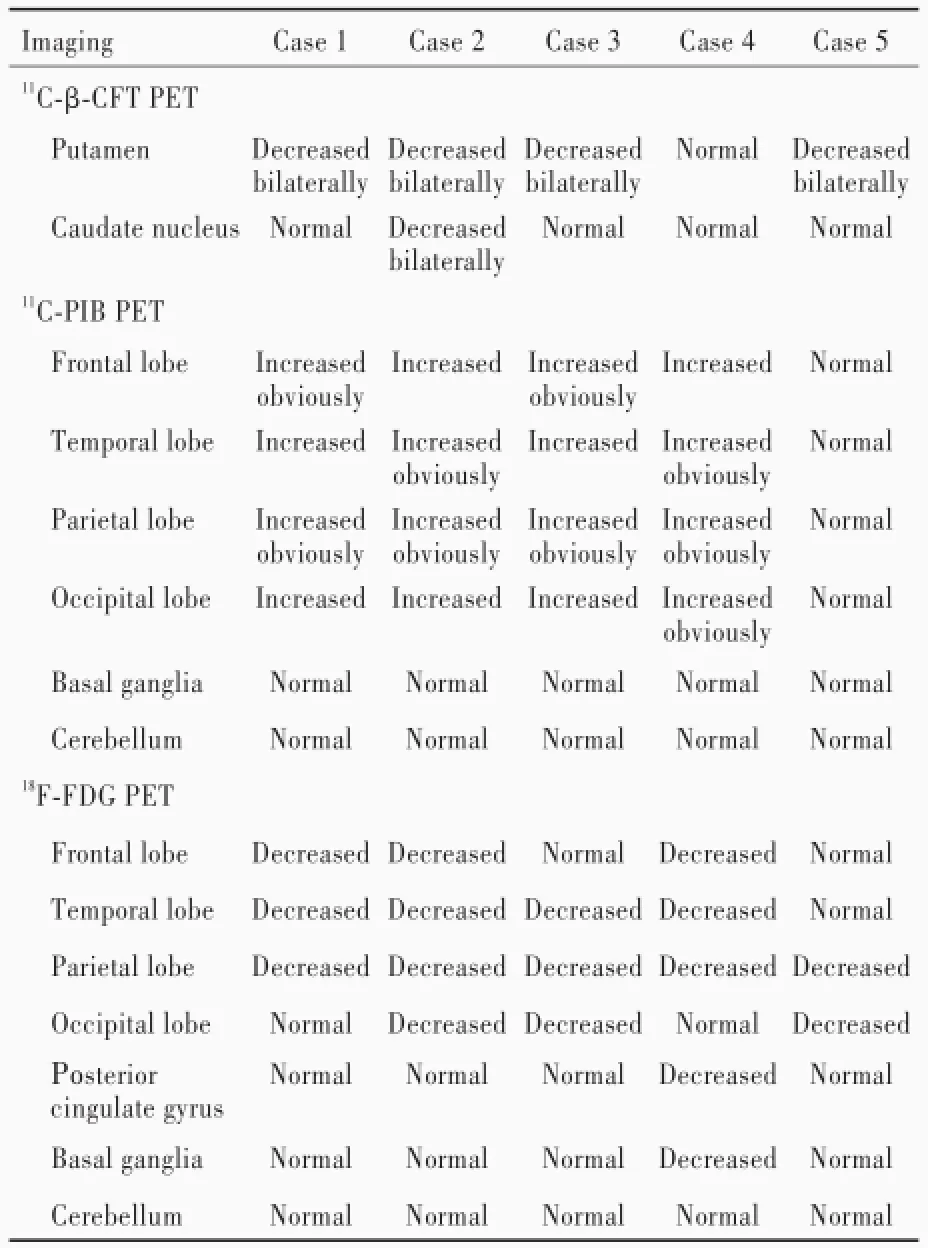
表2 5例可能的路易体痴呆患者PET-MRI影像学特征Table 2.PET-MRI imaging features of 5 patients with probable DLB
1995年首届国际路易体痴呆研讨会提出路易体痴呆诊断标准,并于2005年在第3届国际研讨会上对该诊断标准进行修订[4],将疾病临床表现分为必备特征、核心特征和提示特征。(1)必备特征(诊断可能或可疑的路易体痴呆的必备条件):痴呆进行性加重且影响日常生活和工作;病程早期严重或持续性记忆障碍不明显,但通常随病情进展而加重;注意力、执行功能和视空间能力障碍最为突出。(2)核心特征(具备2项诊断为可能的路易体痴呆,具备1项诊断为可疑的路易体痴呆):注意力和警觉性呈波动性变化;反复发生的幻视,内容形象生动;自发性帕金森综合征。(3)提示特征(具备1个及以上核心特征伴1个及以上提示特征诊断为可能的路易体痴呆,具备1个及以上提示特征而无核心特征诊断为可疑的路易体痴呆,仅有提示特征不能诊断为可能的路易体痴呆):快速眼动睡眠期行为障碍(RBD);对抗精神病药物高度敏感;PET或SPECT显示基底节区多巴胺转运体摄取降低。
典型路易体痴呆的临床诊断并不困难,但是由于临床表现多样且与阿尔茨海默病有诸多相似之处,常误诊为阿尔茨海默病,尤其是以认知功能障碍为首发表现、运动障碍出现较晚或不显著的患者更易误诊为阿尔茨海默病。研究显示,有20%~25%临床诊断为阿尔茨海默病的患者经尸检证实为路易体痴呆[3]。此外,当路易体痴呆患者以运动障碍为首发表现、继而出现认知功能障碍时,应注意与帕金森病痴呆相鉴别。二者的临床表现存在诸多共同特征[7]:(1)波动性认知功能障碍。(2)形象生动的幻视。(3)自主神经功能障碍。(4)快速眼动睡眠期行为障碍。(5)对镇静催眠药物敏感。(6)反复跌倒和意识障碍。(7)执行功能障碍。(8)视空间能力障碍。(9)抗胆碱能药物治疗效果相似。二者的病理改变也极为相似,均表现为大脑皮质弥漫性路易小体(LB)形成,其内可见α-突触核蛋白(α-Syn)聚集,以及基底前脑胆碱能神经元缺失。尽管帕金森病痴呆患者中脑黑质神经元缺失和路易小体形成更显著,而海马神经元缺失多见于路易体痴呆患者[8],但这些特征显然不能成为二者鉴别诊断的“金标准”。目前,临床对路易体痴呆与帕金森病痴呆的鉴别主要遵循“一年规则(1-year rule)”,即认知功能障碍出现于帕金森综合征之前或之后1年内者诊断为路易体痴呆,出现于帕金森综合征1年后者则诊断为帕金森病痴呆[7]。“一年规则”的时间分界值完全是区分帕金森病痴呆与路易体痴呆的人为设定,而对于疾病进展过程复杂的神经变性病,以“一年规则”作为时间分界值定性疾病的可靠性尚存有争议。

图1 头部PET-MRI显像所见1a~1c11C-β-CFT PET显示,双侧壳核和尾状核多巴胺转运体摄取降低(黄色区域所示)1d~1f11C-PIB PET显示,双侧额叶皮质淀粉样蛋白摄取明显升高(绿色区域所示),双侧颞顶枕叶皮质轻度升高(绿色区域所示)1g~1i18F-FDG PET显示,双侧额叶和颞顶枕叶交界区葡萄糖代谢降低(黄色区域所示),双侧枕叶、楔前叶和后扣带回代谢正常(红色区域所示)Figure 1 Head PET-MRI findings11C-β-CFT PET revealed a reduction of uptake in bilateral putamen and caudate nuclei (yellow areas indicate,Panel 1a-1c).11C-PIB PET revealed clearly increased uptake in bilateral frontal cortex(green areas indicate)and a slight increase in bilateral temporal,parietal and occipital cortex(green areas indicate,Panel 1d-1f).18F-FDG PET revealed glocuse hypometabolism in bilateral frontal lobes and the junction of temporal,parietal and occipital lobes (yellow areas indicate).Glocuse metabolism was normal in bilateral occipital lobe,precuneus and posterior cingulate gyrus (red areas indicate,Panel 1g-1i).
在本研究中,我们将多模态分子影像学技术应用于路易体痴呆的临床诊断,对临床诊断为可能的路易体痴呆患者进行11C-β-CFT、11C-PIB和18F-FDG PET显像,由于存在黑质纹状体多巴胺能神经元变性缺失,11C-β-CFT PET显示双侧壳核和尾状核多巴胺转运体摄取明显降低,而阿尔茨海默病和正常对照者壳核和尾状核摄取正常。研究显示,11C-β-CFT PET显像鉴别路易体痴呆与阿尔茨海默病的灵敏度为78%、特异度达90%以上[9];进一步尸检结果显示,该分子影像学技术的灵敏度达88%、特异度高达100%[10]。因此,11C-β-CFT PET显像呈阴性基本可以排除路易体痴呆的诊断,提示该分子影像学技术可以作为影像学的重要提示特征而引入路易体痴呆的诊断标准[11-12]。本研究对临床诊断为可能的路易体痴呆患者行11C-β-CFT PET显像,以判断是否存在黑质纹状体多巴胺能神经元变性缺失,结果显示,4例患者双侧壳核多巴胺转运体摄取降低,其中1例双侧尾状核摄取降低。本组有1例11C-β-CFT PET显示双侧尾状核多巴胺转运体摄取正常患者,11C-PIB PET可见双侧额颞顶叶淀粉样蛋白摄取明显增加、18F-FDG PET可见双侧额颞顶叶葡萄糖代谢降低,从而排除可能的路易体痴呆的诊断,最终修正诊断为阿尔茨海默病。路易体痴呆和帕金森病痴呆均表现为黑质纹状体多巴胺能神经元变性缺失导致的运动障碍,二者11C-β-CFT PET显示双侧壳核多巴胺转运体摄取降低,其中帕金森病痴呆多呈双侧不对称性降低,但不足以鉴别诊断[13]。Brooks[14]采用11C-PIB PET显像对帕金森病和路易体痴呆患者进行研究,其结果显示,13例路易体痴呆患者中11例大脑皮质淀粉样蛋白摄取明显升高,其中9例摄取升高部位与阿尔茨海默病一致;12例帕金森病痴呆患者中10例摄取正常,2例摄取升高;10例不伴痴呆的帕金森病患者大脑皮质摄取均正常。Gomperts等[15]采用11C-PIB PET显像观察路易体痴呆和帕金森病痴呆患者脑组织β-淀粉样蛋白(Aβ)沉积,结果显示,前者较后者存在更严重的Aβ沉积。因此目前认为,大多数路易体痴呆患者淀粉样蛋白摄取明显升高,而帕金森病痴呆患者无明显变化,提示路易体痴呆患者脑组织Aβ沉积较帕金森病痴呆患者严重[15-17]。本研究5例患者11C-PIB PET显像均表现为双侧额颞顶枕叶皮质不同程度弥漫性淀粉样蛋白摄取升高,其中1例(例5)未见明显摄取改变,该例患者以帕金森样症状起病,1年内出现认知功能障碍和幻视,而11C-PIB PET未见明显Aβ沉积,随访3年,认知功能相对稳定,幻视逐渐减轻,结合临床和影像学表现,最终修正诊断为帕金森病痴呆。路易体痴呆和帕金森病痴呆患者18F-FDG PET显像均表现为双侧额叶内侧葡萄糖代谢降低而顶叶代谢升高,尽管二者均可见壳核和尾状核头部代谢降低,但帕金森病患者双侧纹状体代谢降低不对称,尤以首发症状的对侧壳核显著,而路易体痴呆患者双侧纹状体代谢降低基本对称[18]。路易体痴呆患者存在广泛性大脑皮质葡萄糖代谢降低,其中主要累及枕叶皮质和视觉联合皮质,而扣带回后部未见明显降低,甚至高于周围脑组织,影像学称为“扣带回岛征”,是路易体痴呆特征性改变[19]。阿尔茨海默病患者在轻度认知损害(MCI)阶段即有扣带回后部葡萄糖代谢降低,可资与路易体痴呆相鉴别。本研究有4例后扣带回葡萄糖代谢正常或仅轻度升高,符合“扣带回岛征”;1例(例4)后扣带回葡萄糖代谢降低,而11C-β-CFT PET显示双侧尾状核和壳核多巴胺转运体摄取正常,故排除路易体痴呆的诊断。
综上所述,多模态分子影像学技术显著提高路易体痴呆临床诊断的特异性,能够较好地鉴别路易体痴呆与阿尔茨海默病和帕金森病痴呆,有望实现疾病的生前明确诊断。
[1]Vann Jones SA,O'Brien JT.The prevalence and incidence of dementia with Lewy bodies:a systematic review of population and clinical studies.Psychol Med,2014,44:673-683.
[2]Yue W,Ji Y.A 100-year history of dementia with Lewy bodies. Zhongguo Xian Dai Shen Jing Ji Bing Za Zhi,2015,15:514-517.[岳伟,纪勇.路易体痴呆百年史.中国现代神经疾病杂志, 2015,15:514-517.]
[3]Fujishiro H,Iseki E,Nakamura S,Kasanuki K,Chiba Y,Ota K,Murayama N,Sato K.Dementia with Lewy bodies:early diagnostic challenges.Psychogeriatrics,2013,13:128-138.
[4]McKeith IG,Dickson DW,Lowe J,Emre M,O'Brien JT, Feldman H,Cummings J,Duda JE,Lippa C,Perry EK, Aarsland D,Arai H,Ballard CG,Boeve B,Burn DJ,Costa D, Del Ser T,Dubois B,Galasko D,Gauthier S,Goetz CG,Gomez-Tortosa E,Halliday G,Hansen LA,Hardy J,Iwatsubo T, Kalaria RN,Kaufer D,Kenny RA,Korczyn A,Kosaka K,Lee VM,Lees A,Litvan I,Londos E,Lopez OL,Minoshima S, Mizuno Y,Molina JA,Mukaetova-Ladinska EB,Pasquier F, Perry RH,Schulz JB,Trojanowski JQ,Yamada M;Consortium on DLB.Diagnosis and management of dementia with Lewy bodies:third report of the DLB Consortium.Neurology,2005, 65:1863-1872.
[5]Okazaki H,Lipkin LE,Aronson SM.Diffuse intracytoplasmic ganglionic inclusions(Lewy type)associated with progressive dementia and quadriparesis in flexion.J Neuropathol Exp Neurol,1961,20:237-244.
[6]Tiraboschi P,Salmon DP,Hansen LA,Hofstetter RC,Thal LJ, Corey-Bloom J.What best differentiates Lewy body from Alzheimer's disease in early-stage dementia.Brain,2006,129:729-735.
[7]Lippa CF,Duda JE,Grossman M,Hurtig HI,Aarsland D, Boeve BF,Brooks DJ,Dickson DW,Dubois B,Emre M,Fahn S,Farmer JM,Galasko D,Galvin JE,Goetz CG,Growdon JH, Gwinn-Hardy KA,Hardy J,Heutink P,Iwatsubo T,Kosaka K, Lee VM,Leverenz JB,Masliah E,McKeith IG,Nussbaum RL, Olanow CW,Ravina BM,Singleton AB,Tanner CM, Trojanowski JQ,Wszolek ZK;DLB/PDD Working Group.DLB and PDD boundary issues:diagnosis,treatment,molecular pathology,and biomarkers.Neurology,2007,68:812-819.
[8]Guo L,Itaya M,Takanashi M,Mizuno Y,Mori H.Relationship between Parkinson disease with dementia and dementia withLewy bodies.Parkinsonism Relat Disord,2005,11:305-309.
[9]Mc Keith I,O'Brien J,Walker Z,Tatsch K,Booij J,Darcourt J, Padovani A,Giubbini R,Bonuccelli U,Volterrani D,Holmes C, Kemp P,Tabet N,Meyer I,Reininger C;DLB Study Group. Sensitivity and specificity of dopamine transporter imaging with123I-FP-CIT SPECT in dementia with Lewy bodies:a phaseⅢ, multicentre study.Lancet Neurol,2007,6:305-313.
[10]Walker Z,Jaros E,Walker RW,Lee L,Costa DC,Livingston G, Ince PG,Perry R,McKeith I,Katona CL.Dementia with Lewy bodies:a comparison of clinical diagnosis,FP-CIT single photon emission computed tomography imaging and autopsy.J Neurol Neurosurg Psychiatry,2007,78:1176-1181.
[11]Yong SW,Yoon JK,An YS,Lee PH.A comparison of cerebral glucose metabolism in Parkinson's disease,Parkinson's disease dementia and dementia with Lewy bodies.Eur J Neurol,2007, 14:1357-1362.
[12]O'Brien JT,Mc Keith IG,Walker Z,Tatsch K,Booij J,Darcourt J,Marquardt M,Reininger C;DLB Study Group.Diagnostic accuracy of123I-FP-CIT SPECT in possible dementia with Lewy bodies.Br J Psychiatry,2009,194:34-39.
[13]Klein JC,Eggers C,Kalbe E,Weisenbach S,Hohmann C, Vollmar S,Baudrexel S,Diederich NJ,Heiss WD,Hilker R. Neurotransmitter changes in dementia with Lewy bodies and Parkinson disease dementia in vivo.Neurology,2010,74:885-892.
[14]Brooks DJ.Imaging amyloid in Parkinson's disease dementia and dementia with Lewy bodies with positron emission tomography.Mov Disord,2009,24(Suppl 2):742-747.
[15]Gomperts SN,Rentz DM,Moran E,Becker JA,Locascio JJ, Klunk WE,Mathis CA,Elmaleh DR,Shoup T,Fischman AJ, Hyman BT,Growdon JH,Johnson KA.Imaging amyloid deposition in Lewy body diseases.Neurology,2008,71:903-910.
[16]Quigley H,Colloby SJ,O'Brien JT.PET imaging of brain amyloid in dementia:a review.Int J Geriatr Psychiatry,2011, 26:991-999.
[17]Gomperts SN.Imaging the role of amyloid in PD dementia and dementia with Lewy bodies.Curr Neurol Neurosci Rep,2014, 14:472.
[18]Cui RX,Niu N,Zhang Y,Yuan J,Li F.Typical cerebral metabolic patterns in various types of dementia:an analysis of18F-FDG PET images.Zhongguo Xian Dai Shen Jing Ji Bing Za Zhi,2014,14:303-308[.崔瑞雪,牛娜,张颖,袁晶,李方.不同类型痴呆脑代谢改变图型:18F-FDG PET显像.中国现代神经疾病杂志,2014,14:303-308.]
[19]Graff-Radford J,Murray ME,Lowe VJ,Boeve BF,Ferman TJ, Przybelski SA,Lesnick TG,Senjem ML,Gunter JL,Smith GE, Knopman DS,Jack CR Jr,Dickson DW,Petersen RC,Kantarci K.Dementia with Lewy bodies:basis of cingulate island sign. Neurology,2014,83:801-809.
The application of multimodal molecular imaging in the diagnosis of dementia with Lewy bodies
GAO Zhong-bao1,WANG Wei1,CHEN Tong1,FU Li-ping2,XU Bai-xuan2,WANG Zhen-fu1
1Department of Geriatric Neurology,2Department of Nuclear Medicine,Chinese PLA General Hospital,Beijing 100853,China
Corresponding author:WANG Zhen-fu(Email:zhenfuw@sina.com)
ObjectiveTo evaluate the value of multimodal molecular imaging in the diagnosis of dementia with Lewy bodies(DLB).MethodsFive patients with probable DLB received detailed clinical data collection,neuropsychological tests,head MRI examination,11C-methyl-N-2β-carbomethoxy-3β-(4-fluorophenyl)-tropane(11C-β-CFT)PET,11C-Pittsburgh compound B(11C-PIB)PET and18F-fluoro-2-deoxy-D-glucose(18F-FDG)PET examination.ResultsCognitive dysfunction and visual hallucinations were prominent symptoms in patients with DLB.11C-β-CFT PET showed that the radioactive uptake significantly reduced in bilateral putamen and caudate nuclei.11C-PIB PET showed increased radioactive retention in bilateral frontal,temporal,parietal and occipital cortex with various degrees.18F-FDG PET showed glucose hypometabolism in bilateral parietal and occipital cortex.ConclusionsMultimodal molecular imaging greatly improves the specificity of clinical diagnosis of DLB,and it is expected to achieve accurate diagnosis before death.
Lewy body disease;Dementia;Positron-emission tomography
2016-12-19)
10.3969/j.issn.1672-6731.2017.01.009
北京市科技计划项目(项目编号:Z151100004015206);中央保健科研课题(项目编号:W2013BJ14);解放军总医院临床扶持基金资助项目(项目编号:2015FC-TSYS-1016);解放军总医院医疗大数据研发项目(项目编号:2016MBD-020)
100853北京,解放军总医院南楼神经科(高中宝、王炜、陈彤、王振福),核医学科(富丽萍、徐白萱)
王振福(Email:zhenfuw@sina.com)

