巴西甘蔗DNA导入甘蔗03—75品系的SRAP分子验证
吕平+檀小辉+张继+韦丽君+黄秋伟+金刚+黄显雅
摘 要:利用SDS方法提取纯化供体巴西甘蔗B8总DNA,通过悬浮共培养方法将巴西甘蔗DNA转入到桂热甘蔗03-75品系中,筛选获得转化的甘蔗植株。对转化植株、供体和受体进行SRAP分子验证。结果表明,用琼脂糖凝胶电泳从112对引物组合中筛选出13对扩增多态性好、条带清晰、稳定好的引物组合,再通过非变性聚丙烯酰胺凝胶电泳进一步筛选出4对较好引物组合,选择引物M5E8组合对巴西甘蔗、转化植株和桂热甘蔗03-75品系进行SRAP检测,转化植株检出带有供体差异条带,证明巴西甘蔗DNA导入了桂热甘蔗03-75品系,引起了甘蔗基因组的变化,说明通过悬浮共培养方法进行甘蔗总DNA导入是可行的。
关键词:甘蔗 悬浮共培养 SRAP
甘蔗是我国重要的糖料作物和能源作物。中国蔗区主要分布在广西、云南、广东等12个省(自治区)[1-5]。广西是全国最大的蔗糖生产基地,但广西甘蔗栽培品种单一化严重,长时间推广新台糖22号品种,导致品种种性退化、产量下降等严重问题[6-9]。高产、高效甘蔗新种质的创新显得迫在眉睫。长期以来,甘蔗育种采用常规杂交育种,需要耗费大量人力、物力和财力,且育种周期长、筛选困难。还有另一个重要原因是许多野生甘蔗种质(或亲缘关系较远)与栽培甘蔗之间出现了杂交不亲和现象。通过常规杂交方法将优良的性状转入到甘蔗品种(品系)中难度大。此外,由于广西气候因素原因,种植在广西区域的甘蔗开花十分困难,经过人工技术调节开花难度大,且开花后花粉活力很弱,杂交育种非常困难,目前广西甘蔗杂交育种主要在海南南繁育种基地进行,给本地的育种带来许多不便,育种受到一定的障碍。随着现代分子育种技术的快速发展,为远缘种质的创新利用开辟了新的途径。在1974年,周光宇等人[10,11]在调查了植物远缘杂交广泛实践的基础上,提出了植物远缘杂交存在着染色体水平以下的DNA片段杂交假说,在此基础上进行了外源总DNA导入农作物技术研究,达到种质创新和改良品种的目的,外源总DNA导入技术已在水稻、大豆、玉米、小麦、花生和烟草等作物品种改良中得到了应用[12-17]。同时对外源DNA导入后获得的转化植株进行了分子验证。倪建福等人通过花粉管通道法将高粱DNA导入普通小麦后,RAPD鉴定表明高粱基因组部分片段整合到小麦染色体中[18]。
研究选择以巴西甘蔗为供体,桂热甘蔗03-75品系为受体, 通过悬浮共培养的方法将供体总DNA直接导入受体技术, 获得在株型、株高等性状有差异的类型,利用SRAP技术对其进行遗传转化分析,试图通过生物技术手段将巴西甘蔗总DNA导入桂热甘蔗03-75品系创新种质,探索甘蔗新的遗传转化方法的可行性,进一步为高产、高效等甘蔗育种生产提供理论依据和技术支撑。
1 材料与方法
1.1 材料
供体:巴西甘蔗B8品种;受体: 桂热甘蔗03-75品系。实验所用到甘蔗品种/品系均来自广西壮族自治区亚热带作物研究所/广西农垦甘蔗研究所种质资源圃。
1.2 方法
1.2.1 DNA提取方法
采用王关林的SDS提取方法[19]提取新鲜甘蔗叶片的总DNA,琼脂糖凝胶电泳法与紫外分光光度计法检测DNA分子的浓度和纯度。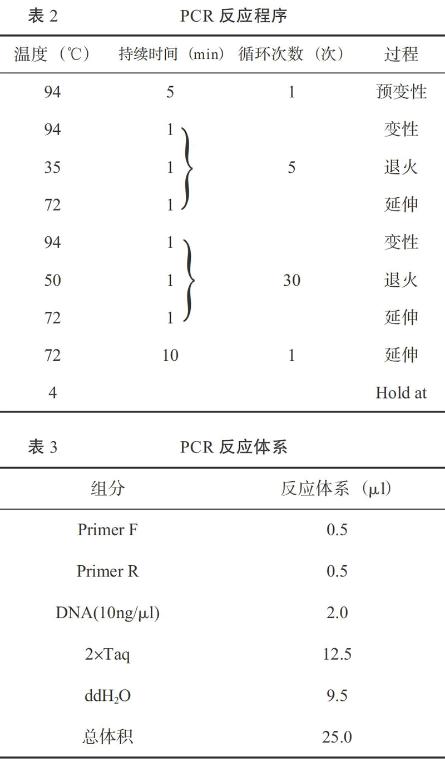
1.2.2 悬浮共培养导入法
采用体细胞胚与供体巴西甘蔗B8总DNA悬浮共培养导入方法,具体步骤为:选取长至10~20 cm桂热甘蔗03-75品系顶芽,消毒灭菌后接种到诱导培养基MS+2,4-D3.5 mg/L + NAA0.1 mg/L上诱导愈伤组织,愈伤组织培养在MS+2,4-D3.0 mg/L+NAA0.1 mg/L上增殖,挑选结构疏松、颜色淡黄的胚性愈伤组织(结合显微镜挑选),摇床震荡培养,用孔径50目细胞筛滤去较大孔径的组织,再用孔径80~150目的细胞筛滤,得到直径0.1~0.2 mm的较分散的微小细胞粒。转移至MS+2,4-D1.0 mg/L+NAA0.1 mg/L培養基上,加入B8总DNA(浓度为200 g/mL),在摇床120 rpm的转速进行悬浮共培养,后转至MS+ 6-BA 2.0 mg/NAA0.1 mg/L培养基上分化不定芽,生根移栽,获得甘蔗转化植株。
1.2.3 SRAP引物、PCR体系与程序及PCR产物电泳
1.2.3.1 引物与PCR反应程序、体系
本实验所用的SRAP引物参考朱弦弦、Li和Quiros等[20,21],由上海生工生物工程技术服务有限公司合成见表1,PCR反应程序与反应体系见表2、表3。
1.2.3.2 PCR产物电泳
琼脂糖凝胶电泳检测
取5 μl PCR产物,加入2 μl 6×Loading Buffer混匀后点样,进行电泳分离,电泳的参数为120 v恒压,EB染色法。
聚丙烯酰胺凝胶电泳
采用6 %的非变性聚丙烯酰胺凝胶,电泳的参数为180 v恒压,银染染色法。
2 结果与分析
2.1 供体巴西甘蔗B8总DNA提取与纯度情况
用紫外分光光度计测定甘蔗总DNA A260/230、A260/280,琼脂糖凝胶电泳鉴定相对分子量,其纯度、浓度鉴定结果为:纯度:A260/230=2.56>2,A260/280=1.95>1.8;浓度:ds =1250 μg/ml。从电泳图1可以看出 ,DNA沉淀均为白色,通过琼脂糖凝胶电泳检测,DNA片段、带型均一,没有拖尾现象,说明蛋白杂质与酚类物质含量少,DNA的纯度较高。上述检测结果表明,纯化后的总DNA溶液纯度、浓度符合导入条件,以MS溶液配成相应的DNA浓度,低温保存备用。
2.2 转化甘蔗试管苗的形态表现
转化的植株经过培养后与CK相比,其形态特征有明显的差异,结果见图2。从图2中可以看出,转化后的植株从叶片、茎粗等特征差异较大,转化的植株叶片浓绿,植株较粗壮,长势较好。另外,实验中也发现有些转化植株的长势比对照差。说明通过悬浮共培养法将巴西甘蔗B8 DNA导入受体桂热甘蔗03-75品系后,受体甘蔗发生了不同程度的变化,这可能是巴西甘蔗的某些基因片段在桂热甘蔗03-75品系进行了重组整合而发生了变化。
2.3 SRAP分析
2.3.1 适合SRAP实验要求的DNA纯度
甘蔗基因组DNA质量的好坏直接影响后续的分子生物学实验的成败。采用SDS法提取甘蔗DNA后用核酸测定仪测定所有供试的DNA样品。本实验提取的21份甘蔗样品DNA的浓度介于200 ng/μl到1300 ng/μl之间,21份样品A260/280的比值均在1.8~2.0之间、A260/230的比值均大于2.0,说明本次实验提取的甘蔗DNA的质量较好,经琼脂糖凝胶电泳检测,蛋白质等杂质少,纯度较纯(见图3),可以满足后续SRAP等分子生物学的实验要求。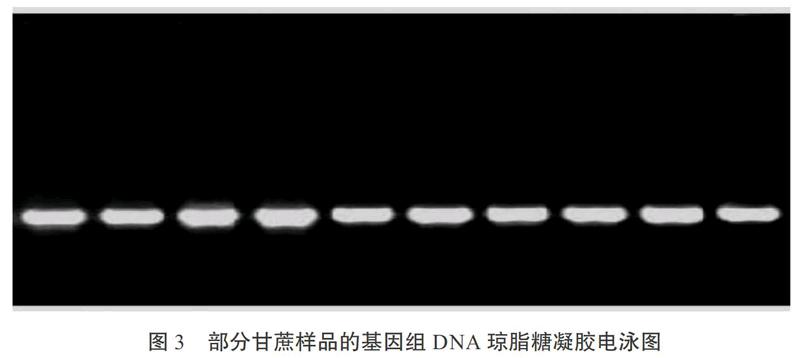
2.3.2 SRAP引物的筛选
上下游引物搭配组成112对引物组合,先用琼脂糖凝胶电泳从中筛选出13对扩增多态性好、条带清晰、稳定好的引物组合(见图4)。再用6 %的非变性聚丙烯酰胺凝胶电泳对13对引物组合进行进一步筛选,从中筛选出4对较好引物组合,分别为M4E8、M5E1、M5E8、M6E2。
2.3.3 SRAP图谱分析
从图5可以看出(图示仅标注了差异明显的条带),甘蔗03-75品系转化植株的SRAP分子标记多态性比较丰富,多态性有差异条带的主要集中在50 bp~150 bp范围间。甘蔗03-75转化植株在①②位置出现了供体巴西甘蔗B8品种特有的而受体甘蔗03-75品系未有条带。在①位置,编号5、7、12转化植株的条带强弱与供体巴西甘蔗B8品种一致;在②位置,编号8、9、12、13转化植株的条带出现比供体巴西甘蔗B8品种条带更强的条带;在③位置转化植株出现了供体巴西B8甘蔗品种、受体甘蔗03-75品系都没有的新条带;在④位置转化植株出现了条带颜色更深的加强条带;在⑤位置受体甘蔗03-75品系有弱条带而转化植株没有,出现了缺失条带。SRAP标记结果表明:通过悬浮共培养方法将巴西甘蔗总DNA导入甘蔗03-75品系后,获得的甘蔗转化植株可能为巴西甘蔗基因部分片段插入受体甘蔗03-75品系,或缺失了受体甘蔗的基因片段,或出现了供受体未有的新片段,说明巴西甘蔗的DNA导入受体甘蔗后使其基因组发生了不同程度的重组。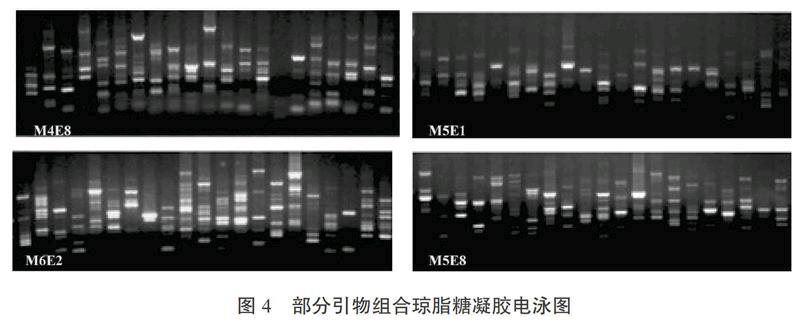
3 讨论
植物外源总DNA导入技术是在20世纪80年代发展起来的,并被许多科研工作者发展应用,在水稻、玉米、小麦和烟草等作物取得成功,培育出的许多优良品种(系)在生产上已推广应用,取得了良好的经济和社会效益。本实验通过悬浮共培养法将远源(或近源)植物的DNA导入作物技术,该技术在马铃薯上有研究报道,洪亚辉等人[22]利用这一技术将人参总DNA导入马铃薯单细胞,获得的马铃薯后代块茎中含有人参皂苷RB1,且氨基酸、蛋白质含量大幅度提高,而其他性状并没有因为块茎蛋白质含量和质量的提高而变化,但这一技术在其他植物还尚未应用。本课题组将自选育的优良甘蔗03-75品系的胚性愈伤组织直接在巴西甘蔗B8的总DNA进行悬浮培养,其目的是加强某些特殊性状,特别是加强巴西甘蔗B8的固氮能力,据杨荣仲等人[23]利用15N同位素稀释法测定在温室盆栽条件下巴西甘蔗B8的生物固氮能力,结果显示B8平均固氮百分率为26.91 %,而对照种桂糖11号不具固氮能力,对照种ROC16的固氮能力弱,仅为3.51 %。如何能将巴西甘蔗B8的这些优良特性導入到甘蔗03-75品系中,筛选优良的转化植株,对甘蔗种质材料进行创新,从而为更进一步选育新品种做准备。通过本试验有力的证实了将巴西甘蔗B8的总DNA通过该方法导入甘蔗03-75品系是可行的,转化的植株不仅在形态上有差异,还在DNA水平上的SRAP(相关序列扩增多态性)有遗传多态性。SRAP是一种基于PCR技术的新型的分子标记,由美国加州大学蔬菜作物系Li与Quiros博士[21]于2001年提出的,具有简便、稳定、中等产率和容易得到选择条带序列的特点,在构建分子遗传图谱、遗传多样性研究及种质资源的鉴定、作物起源与进化关系研究以及作物目标性状连锁标记研究上都有广泛的应用。SRAP结果表明,甘蔗03-75品系的转化植株不同引物的DNA扩增产物,显示出受体对照甘蔗具有的DNA条带在转化甘蔗中大部分出现,总体表现为转化后的甘蔗与受体对照甘蔗03-75品系具有大部分的相似性,说明转化后甘蔗与受体对照的同源性很高,转化后的甘蔗遗传了受体对照甘蔗的大部分基因。另外,在转化的甘蔗还出现了新的条带,转化甘蔗比受体对照甘蔗缺失了条带或插入了新的条带,两者的基因组上存在分子水平遗传差异。此外转化后的甘蔗与巴西甘蔗B8扩增出一些相同大小的DNA片段,而相应的受体对照甘蔗03-75品系没有扩增出此片段,这从分子角度进一步证实了巴西甘蔗B8的某些DNA片段在转化甘蔗03-75品系基因组里有部分的重组或整合,或是转化甘蔗已转入部分供体的性状。
现阶段,甘蔗优良的种质材料非常稀缺,远不能满足当前生产的需要。为了拓宽优良基础材料、丰富甘蔗种质资源,通过外源DNA 导入的方法引入远缘(近缘)物种有益性状的基因,克服远缘杂交不亲和、杂种不育等问题,为创新甘蔗种质资源提供了一种非常有效、可行的途径,这在普通的常规杂交育种上是很难实现的。这不仅为以后选育优良的甘蔗新品种(品系)提供良好的育种材料,同时进一步为甘蔗分子育种奠定基础并提供参考价值。
参考文献
[1] 李如丹,张跃彬,刘少春,等. 国内外甘蔗生产技术現状和展望[J]. 中国糖料, 2009(3):54- 56,64.
[2] 潘雪红,黄诚华,辛德育. 甘蔗螟虫主要优势天敌及其生物防治意义[J]. 广西农业科学,2009,40(1):49-52.
[3] Li Y R. China an emerging sugar super power[J]. Sugar Tech,2004,6(4):213-227.
[4] 李杨瑞,杨丽涛. 20世纪90年代以来我国甘蔗产业和科技的新发展[J]. 西南农业学报,2009,22(5):1469-1476.
[5] 李杨瑞,毛昌祥,唐其展,等. “2008-2009亚洲国家蔗糖产量降低的原因及应对措施”国际学术研讨会综述[J]. 广西农业科学,2010,41
(1):80-84.
[6] 王伯辉.我国甘蔗病害的发生现状与研究进展[J]. 中国糖料,2007(3):48-51.
[7] 黄诚梅,李杨瑞,谭裕模,等. 甘蔗脱毒技术及其检测方法[J]. 甘蔗,2002,9(4):1-6.
[8] LEE T S C. Micro pro pag ation of sugar cane(S acchar um SPP) [J].Plant Cell,Tissue and Org an Cultur e,1987(10):45-47.
[9] Comstock J C. Sugarcane ratoon stunting disease[J]. Sugar Technology, 2002,4(12):1-6.
[10] 周光宇.从生物化学的角度探讨远缘杂交的理论[J]. 中国农业科学,1978(2):16-20.
[11] 周光宇,龚纂纂,王自芬. 远缘杂交的分子基础-DNA片段杂交假说的一个论证[J]. 遗传学报,1979,6(4):405-413.
[12] 赵炳然,夏红爱,阳和华,等. 远缘物种DNA导入水稻保持系的种质创新及SSR分析[J].杂交水稻,2004,19(4):47-50.
[13] 江巨鳌, 麻浩,周治淼,等.应用改良浸种法将外源DNA导入大豆的遗传育种效应研究[J].湖南农业科学,2004(2):10-13.
[14] 杨立国,王金艳,石太渊,等. 利用外源DNA导入新技术选育玉米新品系及杂交种[J]. 杂粮作物,2005,25(5):283-285.
[15] 张希太,谢淑芹,张彦波,等.高粱DNA导入小麦“周麦16”引起后代变异的研究及SSR分析[J]. 安徽农业科学,2011,39(15):8872-8874.
[16] 杨清岭,甄志高,段莹,等. 外源DNA导入技术在花生育种中的应用[J]. 陕西农业科学,2007(6):39-40.
[17] 国华,池春玉,徐启江,等. 外源DNA导入烟草后D1代植株的蛋白质电泳分析[J]. 植物生理学通讯,2003,39(2):153-155.
[18] 倪建福,令利军,欧巧明,等. 外源DNA导入小麦的分子育种实践[J]. 麦类作物学报,2005, 25(5):27231.
[19] 王关林,方宏筠. 植物基因工程[M]. 北京:科学出版社,2004:742-743.
[20] 宋弦弦.甘蔗及其近缘植物遗传多样性的SRAP和TRAP标记分析[D]. 福州:福建农林大学,2009:18.
[21] Li G,Quiros CF.Sequence-related amplified polymorphisim (SRAP) a new marker system based on a simple PCR reaction: Its application to mapping and gene tagging in Brassica.Theor.App L[J].Genet.2001,103:455-461.
[22] 洪亚辉,熊兴耀,程鹏.悬浮共培养将人参总DNA导入马铃薯单细胞的方法:中国201010595717.7[P].2010-12-20.
[23] 杨荣仲,谭裕模,桂意云,等. 15N测定甘蔗生物固氮能力研究[J]. 安徽农业科学,2008,36(24):10405-10406.

