纳米金探针在药物检测中的应用探讨
高应梅,宋 义,孙 梅,刘松青
(重庆医科大学附属第三医院药剂科,重庆 401120)
·专论·
纳米金探针在药物检测中的应用探讨
高应梅,宋 义,孙 梅,刘松青
(重庆医科大学附属第三医院药剂科,重庆 401120)
纳米金具有特殊的物理、化学特性,作为光学探针及电化学传感器,已被广泛应用于生物、化学领域。该文阐述了近年来纳米金探针在药物检测中的应用进展,并对其在药物分析方面的应用进行了展望。
纳米金;探针;药物检测;进展
Key wods:gold nanoparticles;probe;drug detection;progress
纳米金为金的微小颗粒,直径1~100 nm,具有纳米材料特有的4大基本效应,即量子尺寸效应、小尺寸效应、表面与界面效应、介电限域效应。金粒子的尺寸减小到一定值时,会引起粒子性质的变化,产生明显的量子尺寸效应,宏观产生明显的颜色变化。当粒子的尺寸减小到比光波波长等物理尺寸更小时,就会破坏固体材料得以成立的周期性边界条件,展现出新的小尺寸效应,如局部表面等离子体共振(LSPR)[1]、表面增强拉曼散射等。等离子体共振与纳米金的粒径大小、形状、粒子间距及所处介质有密切关系,随着粒径从小到大变化,其共振吸收或散射光谱也会发生变化[2-3],利用此性质可实现对物质的检测。在此,主要就纳米金作为比色探针、共振光散射探针在药物检测中的应用研究作简要评述。
1 纳米金探针检测原理
1.1 纳米金比色法原理
纳米金的稳定性取决于颗粒间的作用力,在制备纳米金的过程中需要通过物理或化学方法改善其稳定性,包括静电吸附、物理吸附、适配体[4]或其他分子修饰等。
纳米金根据修饰基团的不同可以带负电或正电,带负电的一般是柠檬酸根修饰的,带正电的通常是巯基乙胺修饰的。核酸适配体作为一种新型识别分子,是一段20~100 bp长的单链DNA,可通过折叠形成一定构象与靶标进行特异性结合。核酸适配体通过SELEX技术从1014~1018文库中筛选出,因此具有极高的亲和力,相对抗体而言,其性质更稳定。核酸适配体有带负电磷酸骨架,在盐溶液中,核酸适配体吸附在纳米金表面,使其免受盐溶液冲击,阻止纳米金凝聚。
纳米金在分散状态下呈红色,在510~550 nm波长范围内有特征吸收峰。检测过程中,目标物破坏纳米金颗粒间的作用力,或与核酸适配体特异性结合,适配体从纳米金表面解离,使纳米金凝聚或粒径变大,颜色发生变化,宏观表现为由红色变为紫红色、蓝紫色或蓝色(见图1)。纳米金比色法将分子识别转换为颜色变化识别,肉眼即可观察,简单快速,被广泛用于分析蛋白质[5]、DNA[6-7]、金属离子[8-11]、细胞[12]等。
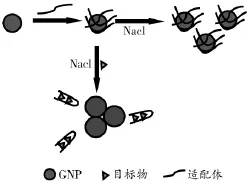
图1 基于纳米金粒子比色策略的药物检测方案
1.2 纳米金共振瑞利散射(RRS)法原理
RRS有高灵敏度和简易的特点,目前广泛应用于核酸[13]、蛋白质[14-15]、无机离子[16]、有机物分析。纳米金具有高电子密度和特殊的物理特性,通过静电引力可与多种大分子物质结合,这种结合主要受金纳米微粒尺寸、离子强度、大分子物质浓度及其分子量等因素影响。
采用柠檬酸盐还原法制备纳米金时,溶液中大量的柠檬酸根阴离子借静电引力自组装于纳米金周围,形成带负电荷层的超分子化合物,能进一步与带正电荷的生物大分子或有机阳离子反应形成新的更大的结合产物(见图2),引起溶液吸收光谱的改变和摩尔吸光系数一定程度的增大,可以观察到RRS的显著增强或出现新的RRS光谱。目前,有关适配体修饰纳米金共振瑞利散射光谱法检测药物也有报道。

图2 RRS基于纳米金粒子药物检测方案
2 在药物检测中的应用
2.1 纳米金比色法
2.1.1 多巴胺
多巴胺为重要的神经递质,在体内维持正常的生命活动,临床用于各种类型休克。Zhang等[17]在pH=7.2 及Cu2+存在条件下,采用纳米金比色法检测多巴胺,其检出限达30 nmol/L。试验证明,多巴胺量100倍的维生素C、尿素不会干扰检测,5.1 μmol/L 5-羟色胺(5-HT)能干扰检测,当pH=9.5时可避免5-羟色胺干扰。
2.1.2 雌二醇
雌二醇是体内由卵巢成熟滤泡分泌的一种天然雌激素,能增进和调节女性性器官及副性征的正常发育。牛书操等[18]将雌二醇适配体通过静电作用吸附到纳米金表面,在高盐浓度下,加入雌二醇,适配体与标靶结合,纳米金在高盐浓度下发生凝聚,溶液由红变蓝,据此可建立一种基于适配体的雌二醇纳米金比色快速检测法。结果表明,随着雌二醇浓度的增高,纳米金溶液的颜色也由红变蓝,最低可以检测到10 ng/mL的雌二醇。利用其他非特异标靶对该方法进行测试表明,结构类似物如雌三醇、雌酮、睾酮等的质量浓度增加至1 000 ng/mL时会引起纳米金溶液变蓝,而其他类雌激素物质如己烯雌酚、双酚A和溶剂甲醇等非特异标靶即使在高浓度下也不会致纳米金溶液变蓝,表明该方法特异性好。
2.1.3 可卡因
可卡因具有麻醉效果好、穿透力强的特点,在医疗中多被用作局部麻醉药或血管收缩剂,因其具有成瘾性而会导致滥用,故需快速鉴定可卡因。Zhang等[19]利用适配体修饰的纳米金,在低浓度范围内快速检测可卡因,目视比色法最低检测1 mmol/L可卡因,紫外-可见检测范围为50~500 μmol/L。可卡因的主要代谢产物苯甲酰芽子碱、芽子碱甲酯对检测无干扰,该方法为快速检测可卡因提供了一种新思路。
2.1.4 卡那霉素
Song等[20]利用Ky2适配体修饰的纳米金检测卡那霉素,检测范围为10~150 nmol/L,检出限达25 nmol/L,链霉素、磺胺地索辛、氨苄西林等抗生素对卡那霉素的检测无干扰。
2.1.5 氨苄西林
氨苄西林主要用于敏感菌所致的泌尿系统、呼吸系统、胆道、肠道感染及脑膜炎、心内膜炎等,也是畜牧业、农业中滥用的抗生素。Song等[21]将寡核苷酸适配子修饰的纳米金探针用于检测氨苄西林,该适配子对氨苄西林具有高敏感性和特异性;同时采用荧光、比色检测牛奶中氨苄西林残留量,纳米金比色法检出限为10 ng/mL,氯霉素、链霉素、四环素、阿莫西林对检测无干扰。
2.1.6 土霉素
Kim等[22]使用一种新的适配子修饰的纳米金探针检测土霉素,该适配子对土霉素高度敏感,检测限达25 nmol/L,多西环素、双氯芬酸等对检测无干扰,可实现抗菌制剂的现场检测。
2.1.7 链霉素
Sun等[23]采用巯基乙酸修饰纳米金,因巯基乙酸与链霉素有较强的静电作用,诱导纳米金探针凝聚,据此检测链霉素,检测范围为80~480 nmol/L(R=0.991),检出限为2 nmol/L,K+,Ca2+和青霉素、氨苄西林、新霉素、氯霉素、三磷酸腺苷(ATP)、葡萄糖等对检测无干扰。
2.1.8 四环素
He等[24]采用溴化十六烷基三甲铵(CTAB)、适配体、纳米金探针检测四环素,当体系中无四环素时,CTAB与适配体形成超分子,在盐溶液中纳米金凝聚;当体系中存在四环素时,适配体首先与四环素结合,阻止了CTAB-适配体超分子的形成,在盐溶液中纳米金保持分散状态。据此检测四环素,检测限达122 nmol/L。
2.1.9 半胱氨酸
Lee等[25]报道了一种高灵敏检测半胱氨酸的方法,首先在纳米金表面修饰上2条巯基化的含T-T错配的DNA,在Hg2+出现的条件下,两条DNA产生杂交,使得金纳米粒子的距离缩短而发生凝聚,溶液由红色变为紫色。由于半胱氨酸和Hg2+结合作用很强,所以当半胱氨酸加入后,会与Hg2+结合,DNA不能产生杂交,而使纳米金又分散开,溶液颜色变回红色,据此对半胱氨酸进行定量检测。
2.1.10 谷胱甘肽
Li等[26]基于纳米金比色发展了一种快速、灵敏的检测谷胱甘肽的新方法。将制备的哌嗪二巯基氨甲酸酯加入到纳米金溶液中使发生凝聚,加入谷胱甘肽后,由于谷胱甘肽和哌嗪二巯基氨甲酸酯结合作用强,使纳米金不再凝聚,可据此对谷胱甘肽进行检测。
2.2 纳米金RRS法
2.2.1 蒽环类抗癌药物
蒽环类抗癌药物是抗癌类抗菌药物,是源于波赛链霉菌的化疗药物,目前用于测定蒽环类抗癌药物的光谱分析研究较少。鲁群岷等[27]在近中性至弱碱性介质中,纳米金与表柔比星、柔红霉素和米托蒽醌等蒽环类抗癌药物借静电引力、疏水作用力结合,形成粒径更大的聚集体,导致显著增强,并产生新的RRS光谱,由此开发了一种用RRS技术灵敏、简便、快速测定蒽环类抗癌药物的新方法。
2.2.2 亚甲蓝
亚甲蓝是一种吩噻嗪类染料,也是一种杀菌解毒药。鲁群岷等[28]在pH=6.5~9.5的介质中,将纳米金与亚甲蓝阳离子形成粒径较大的聚集体,使RRS强度显著增强,最大散射峰位于371 nm波长处;用于血液中亚甲蓝的测定,检出限为21.17 ng/mL。
2.2.3 卡那霉素
卡那霉素是常用的抗感染药物,随着抗菌药物广泛且大量地使用,食物中也存在卡那霉素超标,故快速、准确检测食物、药品中卡那霉素的含量具有重要意义。
何佑秋等[29]在柠檬酸盐的溶液中,利用柠檬酸根自组装于纳米金表面,在pH为4.4~6.8的弱酸性介质中,与质子化的卡那霉素阳离子形成粒径更大的聚集体,在适当条件下,RRS强度与卡那霉素的浓度成正比;用于血液中卡那霉素的测定,检出限为10.52 ng/mL。
陈效兰等[30]利用纳米金与卡那霉素适配体可形成稳定的纳米金探针,而卡那霉素可与复合物中的核酸适配体形成稳定的结构,并释放出纳米金,在盐溶液中,纳米金凝聚成更大微粒,导致571 nm波长处的RRS散射强度增强,卡那霉素质量浓度在0.02~0.3 mg/L范围内与RRS强度线性关系良好,测定卡那霉素注射液中卡那霉素的含量,检出限为2.3 μg/L,磺胺嘧啶、葡萄糖、淀粉、金属离子等对检测均无干扰。
2.2.4 氯丙嗪
陈粤华等[31]发现,在 pH=1.8~3.3的酸性介质中,纳米金与氯丙嗪共存时,溶液RRS强度显著增强,并出现新的RRS光谱,在一定条件下,盐酸氯丙嗪质量浓度在0~0.08 mg/L范围内与RRS强度成正比,氯丙嗪检出限为1.75 μg/L。
2.2.5 异丙嗪
盐酸异丙嗪本身的RRS强度很弱。陈粤华等[32]在pH=1.8~3.0的酸性介质中,将纳米金和质子化的盐酸异丙嗪依靠静电和疏水作用相互结合,RRS强度显著增强,其最大散射峰位于368 nm波长处,盐酸异丙嗪质量浓度在0.04~0.10 μg/mL范围内与RRS强度成正比,其检出限为1.34 ng/mL。考察共存物质对盐酸异丙嗪测定的影响,常见阴、阳离子不干扰测定,70倍的糖类、尿素、淀粉均不影响检测结果,可用于片剂和针剂中盐酸异丙嗪含量的测定,结果满意。
2.2.6 半胱氨酸
半胱氨酸属天然氨基酸之一,是一种含硫的非必需氨基酸,可缓解修复射线对人体的损伤,还有解毒作用,是丙烯腈及芳香族酸中毒的治疗用药。Li等[33]胱氨酸研究发现,半胱氨酸可自组装形成网状结构,RRS散射强度明显增强,再利用纳米金选择性地检测半胱氨酸,检测范围为0.01~0.25 μg/mL,检测限达2.0 ng/mL,其他氨基酸对检测无干扰。
2.2.7 妥布霉素
马璐等[34]用硼氢化钠还原氯金酸制备纳米金,用妥布霉素适配体修饰纳米金可获得稳定的纳米金探针,在pH=6.8磷酸盐缓冲液及NaCl存在下,纳米金探针稳定而不聚集;当有妥布霉素存在时,其与纳米金探针中的适配体特异性结合并释放出纳米金,纳米金在NaCl作用下聚集,导致体系在368 nm波长处的 RRS光,用于测定妥布霉素滴眼液中的妥布霉素含量,检出限为0.8 ng/mL,L-谷氨酸、L-苯丙氨酸、甘氨酸、葡萄糖、土霉素及Cu2+,Mg2+不干扰测定。
2.2.8 普鲁卡因
盐酸普鲁卡因是国际奥林匹克委员会禁用的中枢神经兴奋剂,在运动员服用兴奋剂检测分析、打击毒品走私等工作中,都需对该成分进行分析。王楠等[35]利用纳米金在pH=3.54酸性介质中可与盐酸普鲁卡因作用形成体积更大的纳米金聚集体,使纳米金的RRS强度急剧增强,在适当条件下,散射强度与普鲁卡因的质量浓度成正比,对针剂中的普鲁卡因进行测定,线性范围为0~40 μg/L,检出限为16 ng/L。
3 结语
目前检测药物的方法有很多,如原子吸收法、高效液相色谱法、气相色谱法、电化学分析法等,但大多需要烦琐的前处理过程或大型仪器,耗费时间长,成本高,不利于快速检测。纳米金制备方法简单,具有优良的光学性能,在分析领域有着广泛的应用价值。纳米金探针检测药物分子,简单、快速,肉眼可观测结果,可实现实时检测,不仅适用于药品制剂检测,也适用于食品、环境、生物样品中残留药物的监测。
纳米金作为光学探针检测药物分子,虽可实现高灵敏、快速检测,但基于电荷结合设计的检测方法,可能会因为结构类似物存在非特异结合,使得方法特异性不足,而纳米金稳定性易受pH、离子强度等外界条件影响,所以大部分的检测方法都离不开对纳米金的表面修饰。适配体与标靶间的结合原理与抗原抗体免疫结合作用类似,适配体修饰的纳米金探针能满足检测方法的特异性,适配体与目标物的特异结合,提高了纳米金检测药物的选择性,结合纳米金检测法的高灵敏性、简单快速等优点,纳米金在药物检测领域有着其他方法不可比拟的价值。随着研究的不断深入,也将为纳米金探针在药物筛选、药代动力学、血药浓度监测等的研究奠定基础。
纳米金比色法、RRS法虽灵敏度高,但在某些情况下,仍不能满足检测要求,因此开发基于纳米金信号放大的研究有一定意义。纳米金具有良好的光学性能外,还具有很好的导电性,可在电化学检测中增强和放大信号,已有报道利用纳米金构建具有高灵敏度、高选择性的石英微天平(QCM)免疫传感器,实现对己烯雌酚的快速检测[36]。
纳米金作为较成熟的纳米探针不仅在分析领域有广阔的应用前景,在生命科学中也有许多应用领域,如临床医学诊断、病理研究、靶向药物研究等,这就要求科研工作者对交叉学科知识储备不断更新,以促进应用创新。
[1]Huang CJ,Bonroy K,Reekmans G,et al.Localized surface plasmon resonance biosensor integrated with microfluidic chip[J].Biomedical Microdevices,2009,11(4):893-901.
[2]Hutter E,Fendler JH.Exploitation of localized surface plasmon[J].Advanced Materials,2004,16(19):1685-1706.
[3]Shon YS,Choi HY,Guerrero MS,et al.Preparation of Nanostructured film Arrays for Transmission Localized Surface Plasmon Sensing[J].Plasmonics,2009,4(2):95-105.
[4]Ellington AD,Szostak JW.In vitro selection of RNA molecules that bind specific ligands[J].Nature,1990,346(6287):818-822.
[5]Kim BH,Yoon IS,Lee JS.Masking nanoparticle surfaces for sensitive and selective colorimetric detection of proteins[J].Anal Chem,2013,85(21):10542-10548.
[6]Li H,Rothberg L.Colorimetric detection of DNA sequences based on electrostatic interactions with unmodified gold nanoparticles[J].Proc Natl Acad Sci USA,2004,101(39):14036-14039.
[7]Deng H,Xu Y,Liu Y,et al.Gold nanoparticles with asymmetric polymerase chain reaction for colorimetric detection of DNA sequence[J].Anal Chem,2012,84(3):1253-1258.
[8]Liu JW,Lu Y.A colorimetric lead biosensor using DNAzyme-directed assembly of gold nanoparticles[J].J Am Chem Soc,2003,125(22):6642-6643.
[9]Liu JW,Lu Y.Accelerated color change of gold nanoparticles assembled by DNAzymes for Simple and Fast Colorimetric Pb2+Detection[J].J Am Chem Soc,2004,126(39):12298-12305.
[10]Zhao WA,Lam JCF,Chiuman W,et al.Enzymatic cleavage of nucleic Acids on gold nanoparticles:a generic platformfor facile colorimetric biosensors[J].Small,2008,4(6):810-816.
[11]Xue Y,Zhao H,Wu Z,et al.Colorimetric detection of Cd2+using gold nanoparticles cofunctionalized with 6-mercaptonicotinic acid and L-cysteine[J].Analyst,2011,136(18):3725-3730.
[12]Lu W,Arumugam SR,Senapati D,et al.Multifunctional ovalshaped gold-nanoparticle-based selection of breast cancer cells using simple colorimetric and highly sensitive two-photon scattering assay[J].ACS Nano,2010,4(3):1739-1749.
[13]刘绍璞,胡小莉,罗红群,等.阳离子表面活性剂与核酸反应的共振Rayleigh散射光谱特性及其分析应用[J].中国科学:化学,2002,32(1):18-26.
[14]王亚婷,赵凤林,李克安,等.有机染料作为光散射探针在分析应用中的研究应用进展[J].高等学校化学学报,2000,21(10):1491-1497.
[15]Liu SP,Liu ZY,Luo HQ,et al.Resonance Rayleigh-scattering method for the determination of proteins with gold nanoparticle probe[J].Analytical Biochemistry,2006,353(1):108-116.
[16]杨 卓,刘绍璞,胡小莉,等.某些酸性三苯甲烷染料与表面活性剂相互作用的共振瑞利散射光谱及其分析应用[J].高等学校化学学报,2004,21(6):1040-1042.
[17]Zhang YF,Li BX,Chen XL.Simple and sensitive detection of dopamine in the presence of high concentration of ascorbic acid using gold nanoparticles colorimetric[J].Micochim Acta,2010,168(1):107-113.
[18]牛书操,吕珍珍,刘金钏,等.基于适配体的纳米金比色法快速检测雌二醇研究[J].分析测试学报,2014,33(7):835-839.
[19]Zhang J,Wang L,Pan D,et al.Visual cocaine detection with gold nanoparticles and rationally engineered aptamer structures[J].Small,2008,4(8):1196-1200.
[20]Song KM,Cho M,Jo H,et al.Gold nanoparticle-based colorimetric detection of kanmycin using a DNA aptamer[J].Analytical Biochemistry,2011,415(2):175-181.
[21]Song KM,Jeong E,Jeon W,et al.Aptasensor for ampicillin using gold nanoparticle based dual flourescence-colorimetric methods[J].Anal Bioanal Chem,2012,402(6):2153-2161.
[22]Kim YS,Kim JH,Kim IA,et al.A novel colorimetric aptasensor using gold nanoparticle for a highly sensitive and specific detection of oxytetracycline[J].Biosens Bioelectron,2010,26(4): 1644-1649.
[23]Sun J,Ge J,Liu W,et al.Highly sensitive and selective colorimetric visualization of streptomycin in raw milk using Au nanoparticles supramole-cular assembly[J].Chem Commun,2011,47(35):9888-9890.
[24]He L,Luo YF,Zhi W,et al.A colorimetric aptamer biosensor based on gold nanoparticles for the ultrasensitive and specific detection of tetracycline in milk[J].Australian Journal of Chemistry,2013,66(4):485-490.
[25]Lee JS,Ulmann PA,Han MS,et al.A DNA-gold nanoparticlebased colorimetric competition assay for the detection of Cysteine[J].Nano Lett,2008,8(2):529-533.
[26]Li Y,Wu P,Xu H,et al.Anti-aggration of nanoparticle-based colorimetric sensor for glutathione with excellent selectivity and sensitivity[J].Analyst,2011,136(1):196-200.
[27]鲁群岷,刘忠芳,刘绍璞,等.金纳米微粒作探针共振瑞利散射法测定某些蒽环类抗癌药物[J].化学学报,2007,65(9):821-828.
[28]鲁群岷,何佑秋,刘绍璞,等.金纳米微粒作探针共振瑞利散射光谱法测定亚甲蓝[J].高等化学学报,2006,27(5):849-852.
[29]何佑秋,刘绍璞,刘忠芳,等.金纳米微粒作探针共振瑞利散射光谱法测定卡那霉素[J].化学学报,2005,63(11):997-1002.
[30]陈效兰,张 慧,刘 冰,等.纳米金核酸适配体共振瑞利散射光谱检测卡那霉素的研究[J].分析测试学报,2014,33(6):709-713.
[31]陈粤华,刘绍璞,刘忠芳,等.金纳米微粒与盐酸氯丙嗪相互作用的共振Rayleigh散射光谱研究及其分析应用[J].分析测试学报,2007,26(5):629-633.
[32]陈粤华,郝二军,叶存玲,等.金纳米微粒作探针共振瑞利散射光谱法测定盐酸异丙嗪[J].分析实验室,2012,31(4):1-3.
[33]Li ZP,Duan XR,Liu CH,et al.Selective determination of cysteine by resonance light scattering technique based on self-assembly of gold nanoparticles[J].Analytical Biochemistry,2006,351(1):18-25.
[34]马 璐,温桂清,刘庆业,等.用适配体修饰纳米金做共振瑞利散射光谱探针检测妥布霉素[J].光谱学与光谱分析,2014,34(9):2481-2484.
[35]王 楠,董再蒸,徐淑坤,等.纳米金探针瑞利共振散射法测定针剂中盐酸普鲁卡因[J].分析化学,2008,36(7):995-998.
[36]刘小燕,彭 媛,白家磊.纳米金信号放大石英晶体微天平快速检测己烯雌酚[J].中华预防医学杂志,2016,50(3):270-273.
Application of Gold Nanoparicles Probe for Drug Detection
Gao Yingmei,Song Yi,Sun Mei,Liu Songqing
(Department of Pharmacy,The Third Affiliated Hospital of Chongqing Medical University,Chongqing,China 401120)
Gold nanoparticles(GNPs)have special physical and chemical properties.As analytical probes and electrochemical sensors,gold nanoparticles have been extensively employed in biotechnological and chemical systems.The research progress of gold nanoparticals as the probe for drug detection was summarized.The tendency of its application for drug detection is also discussed.
R917
A
1006-4931(2017)05-0001-05
2017-01-05)
10.3969/j.issn.1006-4931.2017.05.001
高应梅(1984-),女,硕士研究生,初级药师,研究方向为医院药学,(电子信箱)25704907@qq.com。

