培美曲塞联合顺铂一线治疗恶性胸膜间皮瘤疗效
王昌平+黄珣+黄维+杨丽+李勇军
(宜宾市第一人民医院肿瘤科,四川宜宾 644000)
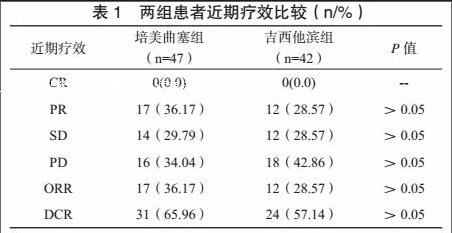
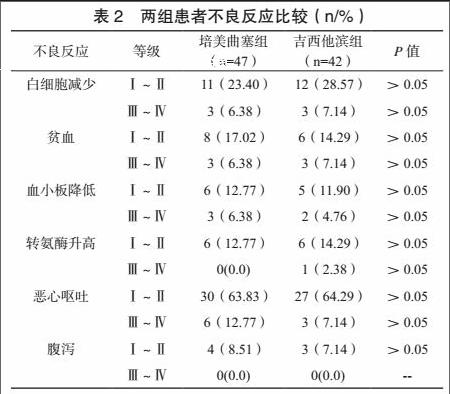
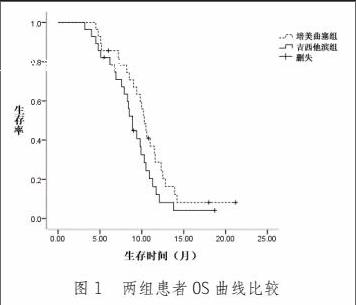
[摘 要] 目的:分析培美曲塞联合顺铂一线治疗恶性胸膜间皮瘤(Malignant pleural mesothelioma,MPM)的临床疗效与安全性,将其与吉西他滨联合顺铂方案进行比较。方法:回顾性分析2010年5月~2014年5月收治的89例MPM患者资料。按照患者一线治疗方案,将接受培美曲塞联合顺铂治疗者纳入培美曲塞组(n=47),将接受吉西他滨联合顺铂治疗者纳入吉西他滨组(n=42),比较两组患者近期疗效、不良反应发生情况及生存期。结果:培美曲塞组、吉西他滨组近期ORR、DCR比较,差异无统计学意义(P>0.05)。两组患者不良反应以Ⅰ~Ⅱ级恶心呕吐为主,其不良反应发生情况比较,差异无统计学意义(P>0.05)。培美曲塞组中位PFS、OS分别为5.93个月、11.95个月,吉西他滨组中位PFS、OS分别为5.84个月、11.86个月,组间比较差异无统计学意义(P>0.05)。结论:培美曲塞联合顺铂治疗MPM与吉西他滨联合顺铂疗效与安全性类似,亦可作为MPM的一线化疗方案。
[关键词] 培美曲塞;顺铂;一线治疗;恶性胸膜间皮瘤;生存期
中图分类号:R734.3 文献标识码:A 文章编号:2095-5200(2017)04-097-03
DOI:10.11876/mimt201704039
恶性胸膜间皮瘤(Malignant pleural mesothelioma,MPM) 是原发于胸膜间皮组织的恶性肿瘤,其发病率较低但恶性程度高、侵袭性强,患者预后极差[1]。当前临床治疗MPM的手段包括外科手术、放化疗等,治疗手段有限且尚无特效治疗方法,是导致多数患者生存期不足1年的主要原因[2]。吉西他滨从20世纪90年代即应用于MPM的治疗,作为一种新型抗叶酸代谢细胞毒药物,培美曲塞在肺腺癌、大细胞肺癌治疗中发挥的确切作用已得到一致认可,近年来在MPM胰腺治疗中也受到了广泛关注[3]。本研究回顾性分析89例患者资料,以比较两种MPM一线治疗方案的疗效。
1 资料与方法
1.1 一般资料
2010年5月至2014年5月就诊的89例MPM患者,均经病理学或细胞学检查确诊MPM且无手术指征[4],排除肿瘤病灶无法测量及癌细胞合并中枢神经系统转移者,进行回顾性分析。按照患者一线治疗方案,将接受培美曲塞联合顺铂治疗者纳入培美曲塞组(n=47),将接受吉西他滨联合顺铂治疗者纳入吉西他滨组(n=42)。培美曲塞组年龄(56.92±6.74)岁,Ⅲ期19例、Ⅳ期28例,上皮细胞型32例、混合型11例、肉瘤型4例,吉西他滨组年龄(56.68±6.82)岁,Ⅲ期16例、Ⅳ期26例,上皮细胞型27例、混合型10例、肉瘤型5例,两组临床资料比较,差异无统计学意义(P>0.05),组间具有可比性。
1.2 治疗方案
常规对症治疗基础上一线化疗持续2~6个周期。培美曲塞组:500mg/m2培美曲塞(商品名:赛珍;齐鲁制药有限公司;国药准字H20060672,药品规格:200mg/支)加入100 mL生理盐水内稀释溶解,静脉滴注(滴注时间>10 min),d1;75 mg/m2顺铂(江苏豪森药业股份有限公司;国药准字H20040813;药品规格:10mg)加入500 mL生理盐水内稀释溶解,避光静脉滴注,d1~d4。培美曲塞联合顺铂方案以21 d为1周期。化疗前1~2周补充叶酸400~1000 μg、维生素B12 1000 μg,每3个周期重复1次[5]。吉西他滨组:1000 mg/m2吉西他滨(商品名泽菲;江苏豪森药业股份有限公司,批准文号0.2g:国药准字H20030104,1.0g:國药准字H20030105)于100 mL生理盐水内稀释溶解,静脉滴注(滴注时间约为30 min),d1、d8、d15;顺铂用法用量同培美曲塞组。吉西他滨联合顺铂方案以28 d为1周期[6]。
1.3 观察指标
随访截止至2016年10月20日,观察指标及时点如下:1)于化疗周期结束后参照实体瘤疗效评价标准(RECIST v1.0)评价患者近期疗效[7],包括完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)及疾病进展(PD),客观有效率(ORR)=(CR+PR)/总例数×100%,疾病控制率(DCR)=(CR+PR+SD)/总例数×100%;2)于化疗周期结束后参照世界卫生组织(WHO)抗肿瘤药物急性及亚急性不良反应分度标准[8],评价患者治疗期间不良反应发生情况;3)于末次随访时记录患者无进展生存期(PFS)及总生存期(OS),其中PFS为开始一线治疗至疾病进展时间,OS为开始一线治疗至死亡或随访截止时间。
1.4 统计学分析
对本临床研究的所有数据采用SPSS18.0进行分析,计数资料以(n/%)表示,并采用χ2检验,计量资料以(x±s)表示,满足方差齐性则采用独立样本t检验,若方差不齐,则采用校正t检验,以P<0.05为差异有统计学意义。
2 结果
培美曲塞组、吉西他滨组近期ORR、DCR比较,差异无统计学意义(P>0.05)。见表1。两组患者不良反应以Ⅰ~Ⅱ级恶心呕吐为主,其不良反应发生情况比较,差异无统计学意义(P>0.05)。见表2。
3 讨论
MPM发病与石棉接触具有密切关联,随着我国工业化发展水平的提高,MPM的发病率也不断上升,而该病高度恶性、起病无特异性的特点,对患者生存质量造成了严重威胁[9-10]。
既往有学者将蒽环类药物阿霉素用于MPM的一线治疗,其ORR不足20%,而盲目增加药物剂量无法使临床疗效有所提升,反而会大大增加毒性与毒副反应发生风险,治疗价值不够理想[11-12]。第三代化疗药物的问世,为MPM一线治疗方案提供了更多选择。2015年MPM指南指出,吉西他滨联合顺铂方案可作为该病的一线化疗组合,单药吉西他滨也可用于二线化疗治疗[13]。本研究就吉西他滨联合顺铂方案治疗Ⅲ~Ⅳ期MPM的疗效与安全性进行了观察,发现患者ORR、DCR分别可达到28.57%、57.14%,与Billé等[14]报道一致,且患者不良反应多以Ⅰ~Ⅱ级恶心呕吐为主,安全性值得肯定。吉西他滨无须提前预处理,用药方便,但Takeda等[15]指出,吉西他滨长期应用具有较高的Ⅲ~Ⅳ级血液学毒性发生风险,虽然本研究并未观察到这一结论,但仍需早期注重吉西他滨/顺铂替代方案的探索。
作为一种叶酸拮抗剂,培美曲塞可通过抑制二氢叶酸还原酶、胸苷酸合成酶及甘氨酰胺核苷酸甲酰转氨酶活性,发挥干扰嘌呤、嘧啶合成作用,达到抑制细胞复制目的[16]。由于培美曲塞作用靶点广泛,化疗期间需定期补充维生素B12及叶酸,以降低培美曲塞所致血液系统和胃肠道不良反应发生风险[17]。Cioce等[18]发现,对于一线治疗失败的MPM患者,二线治疗时再次给予单药培美曲塞或培美曲塞联合铂类药物亦可获益,故该方案在MPM的治疗中具有更为广泛的应用前景。然而,吉西他滨、培美曲塞价格均较高,可能给患者带来较大的经济负担,因此,临床仍需进一步探索,以寻求一种血液学毒性更小、价格更低、依从性更佳的MPM一线治疗方案。
此次研究的局限性在于样本量有限,无法明确培美曲塞联合顺铂一线治疗MPM的普适性,在今后的研究中,将设计多中心、大样本方案,进一步了解该方案的推广价值。总体而言,培美曲塞联合顺铂一线治疗MPM具有确切的疗效与良好的安全性,能够在一定程度上延长患者PFS与OS。
参 考 文 献
[1] Krug L M, Kindler H L, Calvert H, et al. Vorinostat in patients with advanced malignant pleural mesothelioma who have progressed on previous chemotherapy (VANTAGE-014): a phase 3, double-blind, randomised, placebo-controlled trial[J]. Lancet Oncol, 2015, 16(4): 447-456.
[2] 徐晓玲, 姚银丽, 余新民, 等. 恶性胸膜间皮瘤化疗进展[J]. 中华肿瘤防治杂志, 2015, 22(2): 155-160.
[3] Zucali P A, Perrino M, Lorenzi E, et al. Vinorelbine in pemetrexed-pretreated patients with malignant pleural mesothelioma[J]. Lung Cancer, 2014, 84(3): 265-270.
[4] 廖美琳. 恶性胸膜间皮瘤[M]. 上海:上海科技教育出版社, 2005.
[5] Toyokawa G, Takenoyama M, Hirai F, et al. Gemcitabine and vinorelbine as second-line or beyond treatment in patients with malignant pleural mesothelioma pretreated with platinum plus pemetrexed chemotherapy[J]. Int J Clin Oncol, 2014, 19(4): 601-606.
[6] Tsao A S, Harun N, Lee J J, et al. Phase I trial of cisplatin, pemetrexed, and imatinib mesylate in chemonaive patients with unresectable malignant pleural mesothelioma[J]. Clin Lung Cancer, 2014, 15(3): 197-201.
[7] 黃振, 凌春华, 张芩. 恶性胸膜间皮瘤13例临床分析[J]. 实用癌症杂志, 2015, 30(8): 1234-1236.
[8] Krug L M, Wozniak A J, Kindler H L, et al. Randomized phase II trial of pemetrexed/cisplatin with or without CBP501 in patients with advanced malignant pleural mesothelioma[J]. Lung Cancer, 2014, 85(3): 429-434.
[9] 武新舒. 恶性胸膜间皮瘤28例临床资料分析[D]. 济南:山东大学, 2016.
[10] 王雯. 外周血淋巴细胞与单核细胞的比值与恶性胸膜间皮瘤预后的关系[D]. 济南:山东大学, 2016.
[11] Buikhuisen W A, Scharpfenecker M, Griffioen A W, et al. A Randomized Phase II Study Adding Axitinib to Pemetrexed-Cisplatin in Patients with Malignant Pleural Mesothelioma: A Single-Center Trial Combining Clinical and Translational Outcomes[J]. J Thorac Oncol, 2016, 11(5): 758-768.
[12] Linton A, Pavlakis N, OConnell R, et al. Factors associated with survival in a large series of patients with malignant pleural mesothelioma in New South Wales[J]. Br J Cancer, 2014, 111(9): 1860-1869.
[13] 张淼慈, 哈敏文. 培美曲塞或雷替曲塞联合顺铂一线治疗恶性胸膜间皮瘤的疗效与安全性观察[J]. 解放军医学院学报, 2014, 35(10): 1004-1007.
[14] Billé A, Krug L M, Woo K M, et al. Contemporary analysis of prognostic factors in patients with unresectable malignant pleural mesothelioma[J]. J Thorac Oncol, 2016, 11(2): 249-255.
[15] Takeda T, Itano H, Fukita S, et al. Long Progression-free Survival by Pemetrexed Continuation Maintenance Therapy Following Cisplatin-based Chemotherapy in Malignant Pleural Mesothelioma[J]. Intern Med, 2014, 53(20): 2347-2351.
[16] Rimner A, Zauderer M G, Gomez D R, et al. Phase II Study of Hemithoracic Intensity-Modulated Pleural Radiation Therapy (IMPRINT) As Part of Lung-Sparing Multimodality Therapy in Patients With Malignant Pleural Mesothelioma[J]. J Clin Oncol, 2016, 34(23): 2761-2768.
[17] Zauderer M G, Kass S L, Woo K, et al. Vinorelbine and gemcitabine as second-or third-line therapy for malignant pleural mesothelioma[J]. Lung Cancer, 2014, 84(3): 271-274.
[18] Cioce M, Ganci F, Canu V, et al. Protumorigenic effects of mir-145 loss in malignant pleural mesothelioma[J]. Oncogene, 2014, 33(46): 5319-5331.
第一作者:王昌平,本科,副主任醫师,研究方向:肿瘤内科临床,Email:wangchangph@tom.com。

