亚麻籽胶相对分子质量测定及单糖组成分析
梁 珊,黄 玉,李小凤,廖文镇,韩子晟,汪 勇,*
(1.广东油脂生物炼制工程技术研究中心,暨南大学食品科学与工程系,广东广州 510632;2.暨南大学-萨斯喀彻温大学“油料生物炼制与营养”联合实验室,广东广州 510632)
亚麻籽胶相对分子质量测定及单糖组成分析
梁 珊1,2,黄 玉1,2,李小凤1,2,廖文镇1,2,韩子晟1,2,汪 勇1,2,*
(1.广东油脂生物炼制工程技术研究中心,暨南大学食品科学与工程系,广东广州 510632;2.暨南大学-萨斯喀彻温大学“油料生物炼制与营养”联合实验室,广东广州 510632)
建立了尺寸排阻色谱法测亚麻籽胶相对分子质量的方法,并通过糖腈乙酸酯衍生化气相色谱法测定了亚麻籽胶的单糖组成。采用TSKgel G5000PWXL、TSKgel G3000PWXL二柱联用,超纯水为流动相,流速1.0 mL/min,进样浓度2.0 mg/mL,柱温40 ℃,配合蒸发光散检测器对葡聚糖标准品及样品进行了分析,结果表明不同分子量葡聚糖峰位洗脱时间与分子量对数值之间有良好的线性关系(R2=0.9842),精密度、重现性、稳定性及准确度良好,采用此法测得热水浸提、微波辅助热水浸提及市售亚麻籽胶峰位分子量分别为7793、2420、10392/6166/89183 ku,并给出了Mn、Mw、Mz及D值。单糖组成结果表明自制亚麻籽胶由鼠李糖、阿拉伯糖、木糖、半乳糖和葡萄糖组成,市售胶另含有甘露糖与岩藻糖,自制与市售胶在单糖种类和含量上有较大差异。
亚麻籽胶,尺寸排阻色谱,相对分子质量,单糖组成,测定
亚麻籽胶(Flaxseed gum),又名富兰克胶、胡麻胶,是从一年生草本植物亚麻的种子(图1A)中获得的一种天然高分子复合胶[1]。我国亚麻资源丰富,产量居世界第三[2],主要分布于内蒙古、甘肃、新疆、山西等地[3]。亚麻籽胶是亚麻籽中除了脂肪、蛋白质以外含量最丰富的一种物质,其主要成分是一种杂多糖,其次还含有少量的蛋白质和矿物质元素[4-6]。亚麻籽胶兼具良好的营养价值及功能特性,具有降低肥胖病、糖尿病和冠状动脉心脏病发病率的作用[7],还可作为增稠剂、乳化剂、稳定剂、保湿剂等广泛应用于食品、日化及医药行业[8]。
亚麻籽胶作为一种大分子复合物,相对分子质量及单糖组成是影响其营养、理化及功能特性的重要因素[9],因此测定亚麻籽胶相对分子质量及其单糖组成是评价其性质的重要手段。传统方法测定高分子相对分子质量需要专门的仪器设备及分析软件,这在一般的科研单位很难实现,因此亟需建立一种简单易行的测定亚麻籽胶及其类似产品相对分子质量的方法。尺寸排阻色谱(SEC)法是根据分子量大小对待分离物质进行分离的一种方法,具有简单、高效、精密、广适等特点,是目前评价和表征大分子相对分子量的一个重要方法,常用于蛋白质、多肽、核酸及多糖等聚合物的分子量表征[10]。针对传统分析方法的局限性,本文拟建立尺寸排阻色谱法测定亚麻籽胶相对分子质量的方法,并通过毛细管衍生化气相色谱法分析了亚麻籽胶的单糖组成,旨在为更好地探究亚麻籽胶的理化性质及应用提供理论参考和现实依据。
1 材料与方法
1.1 材料与仪器
亚麻籽 黑亚16号,产于山西省神池县;亚麻籽胶 新疆利世得生物科技有限公司,产于新疆伊犁;葡聚糖标准品:Mn=1000、5000、12000、50000、150000、270000、670000、1100000 美国Sigma-Aldrich公司;单糖标准品:L-鼠李糖、L-岩藻糖、L-阿拉伯糖、D-木糖、D-甘露糖、D-半乳糖、D-葡萄糖 美国Sigma-Aldrich公司;超纯水:电阻率18.2 MΩ·cm(25 ℃) Milli-Q®driect-8/16系统制。
岛津LC-20AD型液相色谱仪(配有SIL-20A自动进样器、CTO-20A柱温箱以及LC-Solution工作站) 日本岛津公司;蒸发光散射检测器(ELSD)Alltech 2000ES型 美国奥泰公司;尺寸排阻色谱柱(7.8 mm×30 cm,7 μm)TSKgel G6000 PWXL、TSKgel G5000 PWXL、TSKgel G3000PWXL,保护柱TSK PWXLGuard Column(6.0 mm×4 cm,12 μm) 日本东曹株式会社;气相色谱仪Agilent 7820A型,毛细管柱 DB-1701型 美国安捷伦科技有限公司。
1.2 实验方法
1.2.1 亚麻籽胶的提取 亚麻籽经粉碎后过20目筛,将过筛后的亚麻籽粉与甘油-乙醇(体积比5∶1)混合,离心20~30 min(图1B),取下层亚麻籽壳烘干后(图1D)分别采用热水浸提法与微波辅助热水浸提法进行提取,浸提工艺参考李小凤等人的方法,略有改动[11]。其中热水浸提法工艺为:浸提温度100 ℃,料液比1∶30(w/v),每次浸提2 h,浸提3次;微波辅助热水浸提法工艺为:料液比1∶20(w/v)、浸提温度80 ℃、输出功率800 W、搅拌速度800 r/min,浸提时间60 min、浸提3次。提取液过100目筛滤除物理杂质,合并提取液,稍浓缩后采用Savage法去蛋白[12](图1C),4 ℃醇沉12 h,3000 r/min离心10 min,再溶解后透析除去小分子,旋转蒸发浓缩,真空冷冻干燥后得到亚麻籽胶(图1F、图1G)。

图1 亚麻籽提取过程及结果图例Fig.1 Legends of flaxseed gum extraction process and results注:A.亚麻籽;B.溶剂法脱壳;C.Savage法脱蛋白; D.亚麻籽壳;E.亚麻籽仁; F.热水浸提亚麻籽胶;G.微波辅助热水浸提亚麻籽胶。
1.2.2 HPSEC色谱条件的确定 以葡聚糖标准品和待测亚麻籽胶作为分离对象,色谱图分离效果作为评价标准对洗脱溶液、色谱柱、流速、检测器、柱温进行选择,确定HPSEC最佳分离条件。其中洗脱溶液以超纯水、0.20 mol/L磷酸缓冲液(pH6.8)以及0.10 mol/L醋酸钠溶液(含20% 乙腈)为考察对象;色谱柱以TSKgel G6000PWXL+TSKgel G5000PWXL+TSKgel G3000PWXL三柱串联、TSKgel G5000PWXL+TSKgel G3000PWXL二柱串联以及TSKgel G6000PWXL单柱三种模式为考察对象;流速以0.50、0.75、1.0 mL/min为考察对象;检测器以蒸发光散射检测器(ELSD)和示差折光检测器(RID)为考察对象;柱温以40 ℃和室温为考察对象。
1.2.3 葡聚糖标准曲线的绘制 分别取Mn=1000、5000、12000、50000、150000、270000、670000、1100000的葡聚糖标准品及D-葡萄糖溶于超纯水配成2.0 mg/mL的溶液,按照1.2.2确定的色谱条件对标准葡聚糖标准品进行分析,得到各标准品的峰位洗脱时间,然后以峰位洗脱时间为横坐标,分子量对数值log M为纵坐标绘制标准曲线。
1.2.4 亚麻籽胶相对分子量的测定 分别取热水浸提亚麻籽胶、微波辅助热水浸提亚麻籽胶以及市售亚麻籽胶,充分溶解于超纯水中,配成2.0 mg/mL的样品溶液,过0.45 μm聚醚砜微孔滤膜,按照1.2.2确定的液相色谱条件进行分析,得到亚麻籽胶样品的洗脱曲线,然后按照1.3的方法计算各亚麻籽胶样品的相对分子质量。
1.2.5 HPSEC方法学考察 参考文献[13],按照1.2.2确定的分析条件对葡聚糖标准品进行分析,评价该分析方法的精密度、重复性、稳定性及准确性。对2.0 mg/mL的Mn=1000的葡聚糖标准品连续进样5次,记录峰位洗脱时间,计算精密度;对5份2.0 mg/mL的Mn=5000的葡聚糖标准品进行液相分析,记录各样品的峰位洗脱时间,评价重复性;对2.0 mg/mL的Mn=12000的葡聚糖标准品在1 d内每间隔2 h进样一次,共进5次,记录峰位洗脱时间,评价日内稳定性,连续5 d,每天在同一时间进样,记录峰位洗脱时间,评价日间稳定性;对5份2.0 mg/mL的Mn=50000的葡聚糖标准品进行液相分析,记录各样品的峰位洗脱时间,按照1.2.3得到的标准曲线计算峰位分子量,与已知分子量(50000)进行比较,计算相对误差,评价准确性。
1.2.6 亚麻籽胶单糖组成分析 采用糖腈乙酸酯衍生化气相色谱法分析亚麻籽胶的单糖组成[14-15],并结合峰面积归一化法[16]计算各单糖的相对摩尔百分比。GC条件为:采用DB-1701毛细管柱(30 m×0.25 mm,0.25 μm),检测器温度240 ℃,汽化室温度 240 ℃,柱温190 ℃,程序升温,190 ℃保持2 min,然后以 2 ℃/min升温至240 ℃后保持2 min,载气为氮气,流速为1.0 mL/min,不分流,进样量为1 μL。
1.3 亚麻籽胶对分子质量的计算方法
高聚物的相对分子量一般有四种不同表示方法:数均分子量Mn、重均分子量Mw、Z均分子量Mz以及黏均分子量Mη,其中较为常用的为Mn、Mw以及Mz。本文除了给出峰位分子量M外,还根据标准曲线按下述十点法[17-18]分别计算样品的Mn、Mw以及Mz。如图2所示,图中钟形曲线为假设样品洗脱曲线,可按洗脱时间将其十等分,得出十个点,根据标准曲线可得出每个点对应的分子量Mi,并可读出峰高度Hi,然后按照以下公式计算Mn、Mw以及Mz。
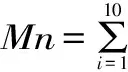
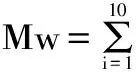
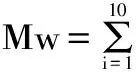
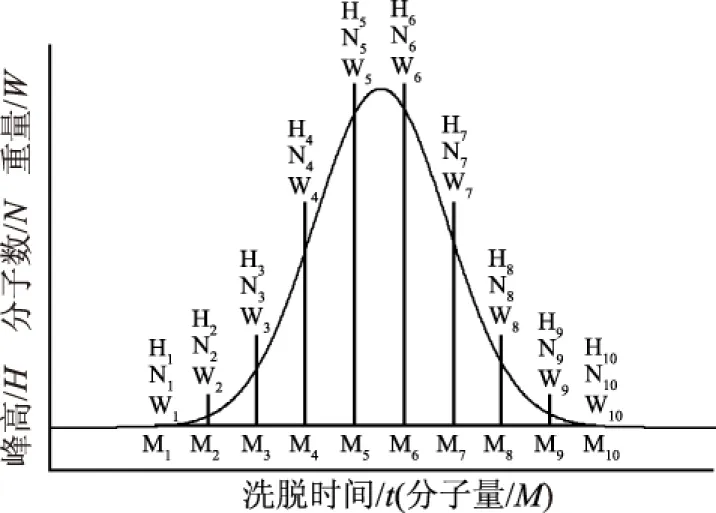
图2 Mn、Mw、Mz计算模型Fig.2 Calculation models of Mn,Mw and Mz
2 结果与分析
2.1 HPSEC色谱条件的确定
从流动相来看,1.2.2所述三种流动相均能够有效地洗脱葡聚糖标准品以及亚麻籽胶,出于对色谱柱的保护,选择超纯水作为洗脱溶液;从色谱柱的选择来看,色谱柱串联数量越多,葡聚糖洗脱曲线线性关系越好,但样品洗脱较为滞后,所需分析时间较长;单柱分析虽然耗时短,但洗脱曲线线性关系较差,分离度效果不好;从流速来看,流速越小,将样品完全洗脱出来所需要的时间越长,即峰越矮胖,且整体洗脱时间滞后,流速越大则峰跨度越小,分离效率也越高;从检测器来看,RID检测器较易受外界环境的影响而导致基线漂移等问题,ELSD检测器较为稳定且有更高的灵敏度;柱温方面,常温与40 ℃二者并无明显差异。
通过分析不同洗脱液、色谱柱、流速、检测器以及柱温对葡聚糖标准品及亚麻籽胶样品的分离效果,最终选择TSKgel G5000PWXL、TSKgel G3000PWXL二柱串联(配保护柱TSK PWXLGuard Column),Milli-Q超纯水作洗脱溶液,ELSD检测器(漂移管温度为115 ℃,气流速度为3.2 L/min),等度洗脱,流速为1.0 mL/min,柱温40 ℃,分析时间为50 min作为标准品及样品的色谱分析条件。
2.2 葡聚糖标准曲线的绘制
按2.1确定的液相条件进行分析,得到葡聚糖标准品的洗脱曲线如图3所示。以洗脱时间t为横坐标,分子量对数值logM为纵坐标,得到标准曲线方程logM=-0.2076t+11.2669,相关系数R2=0.9842。
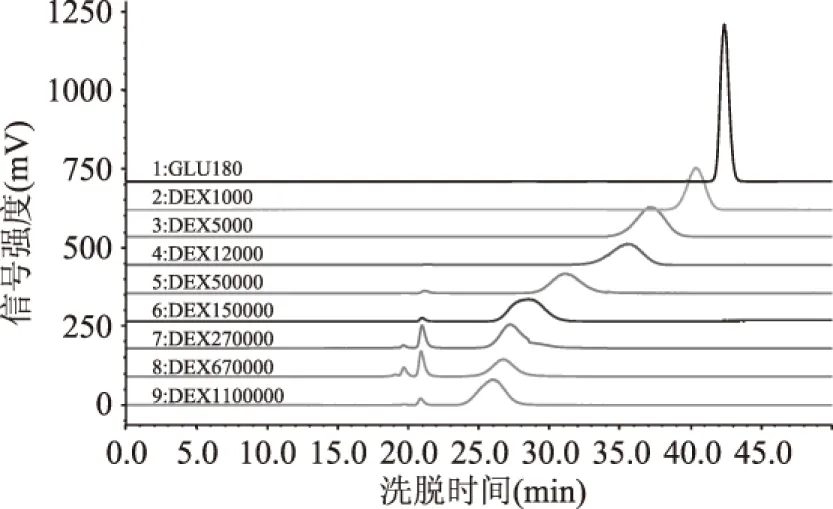
图3 葡聚糖标准品HPSEC洗脱曲线Fig.3 HPSEC elution curves of dextran standards
2.3 亚麻籽胶相对分子量的测定

图4 热水浸提法亚麻籽胶HPSEC洗脱曲线Fig.4 HPSEC elution curve of flaxseed gum from hot water extraction process
按照2.1确定的方法分别对热水浸提法、微波辅助热水浸提法以及市售亚麻籽胶进行液相分析,得到洗脱曲线如图4~图6,由图可知自制胶均只有一个单峰,其中微波辅助热水浸提法所得胶峰形更为对称;而市售胶则有三个峰位组分,分子量分布较不均一。由峰位洗脱时间根据标准曲线方程可直接计算出峰位相对分子量M,再结合1.3所述十点法分别得到Mn、Mw以及Mz,结果如表1所示。
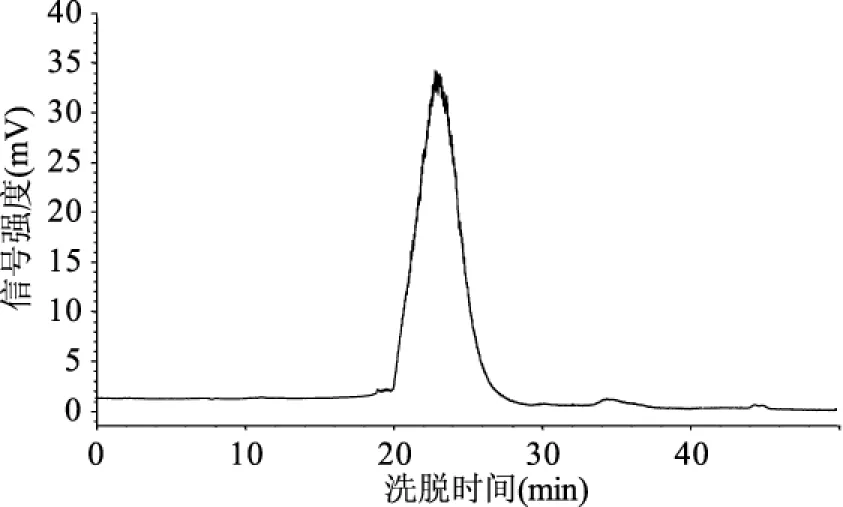
图5 微波辅助热水浸提法亚麻籽胶HPSEC洗脱曲线Fig.5 HPSEC elution curve of flaxseed gum from microwave assisted hot water extraction process
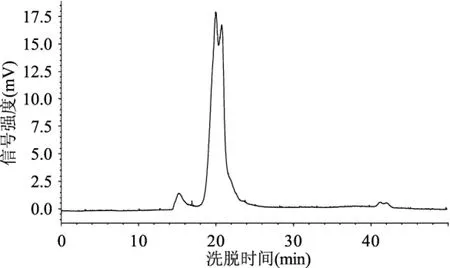
图6 市售亚麻籽胶HPSEC洗脱曲线Fig.6 HPSEC elution curve of commercially available flaxseed gum
由表1及图4~图6可知,三种亚麻籽胶洗脱曲线有所差异,峰位洗脱时间也各不相同。热水浸提法及微波辅助热水浸提法所得到的亚麻籽胶洗脱峰组分均一,只有一个主要洗脱峰,而市售亚麻籽胶有两个主要洗脱峰,另外还有一个小的大分子量洗脱峰。从峰位分子量来看,市售亚麻籽胶分子量最大,可达到千万级别(两个主要峰位分子量分别为10392、6166 ku),热水浸提法所得亚麻籽胶分子量稍小(7793 ku),微波辅助热水浸提法所得到的亚麻籽胶分子量最小(2420 ku)。比较热水浸提法及微波辅助热水浸提法两种方法得到的亚麻籽胶,其分子量上的差异可能是由于微波辅助热水浸提过程中亚麻籽胶多糖分子链受微波、温度等因素的影响而发生了一定程度的断裂,进而造成分子量的减小[19-20],至于这种破坏作用具体是如何进行的,以及是否会导致亚麻籽胶其它性质的改变,还有待于进一步的研究和讨论。Mw、Mn及Mz的模拟计算结果如表1所示,由表1可总结得知对于同一种胶来说,总有Mz>Mw>Mn,这与理论预测是一致的[17]。分散系数D(Mw/Mn)是反映大分子均一性的一个指标,其值越小,表明组成该聚合物的一系列大分子分子量越均一[21],由表1可知,微波辅助热水浸提法所得胶的D值最大(1.92),其次是热水浸提法(1.73),最小的是市售胶的第一个峰位组分(1.40)。由表1及图3总结可知,洗脱曲线跨度越小,其D值越小,即组分越均一。
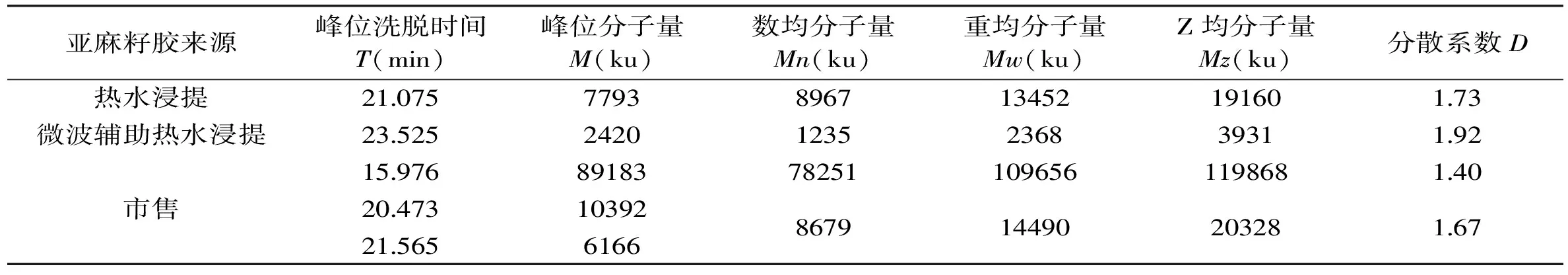
表1 亚麻籽胶分子量测定结果
注:分散系数D=Mw/Mn。

表2 精密度实验结果

表3 重现性实验结果
2.4 HPSEC方法学考察和评价结果
按照1.2.5的方法对HPSEC进行方法学考察和评价,结果如表2~表5所示。精密度、重现性、稳定性(日内/日间)、准确度RSD值分别为0.28%、0.17%、0.29%、0.50%、0.82%,表明本文所建立的HPSEC测定亚麻籽胶相对分子质量的方法在方法学上有较高的严谨性。

表4 稳定性实验结果

表5 准确度实验结果
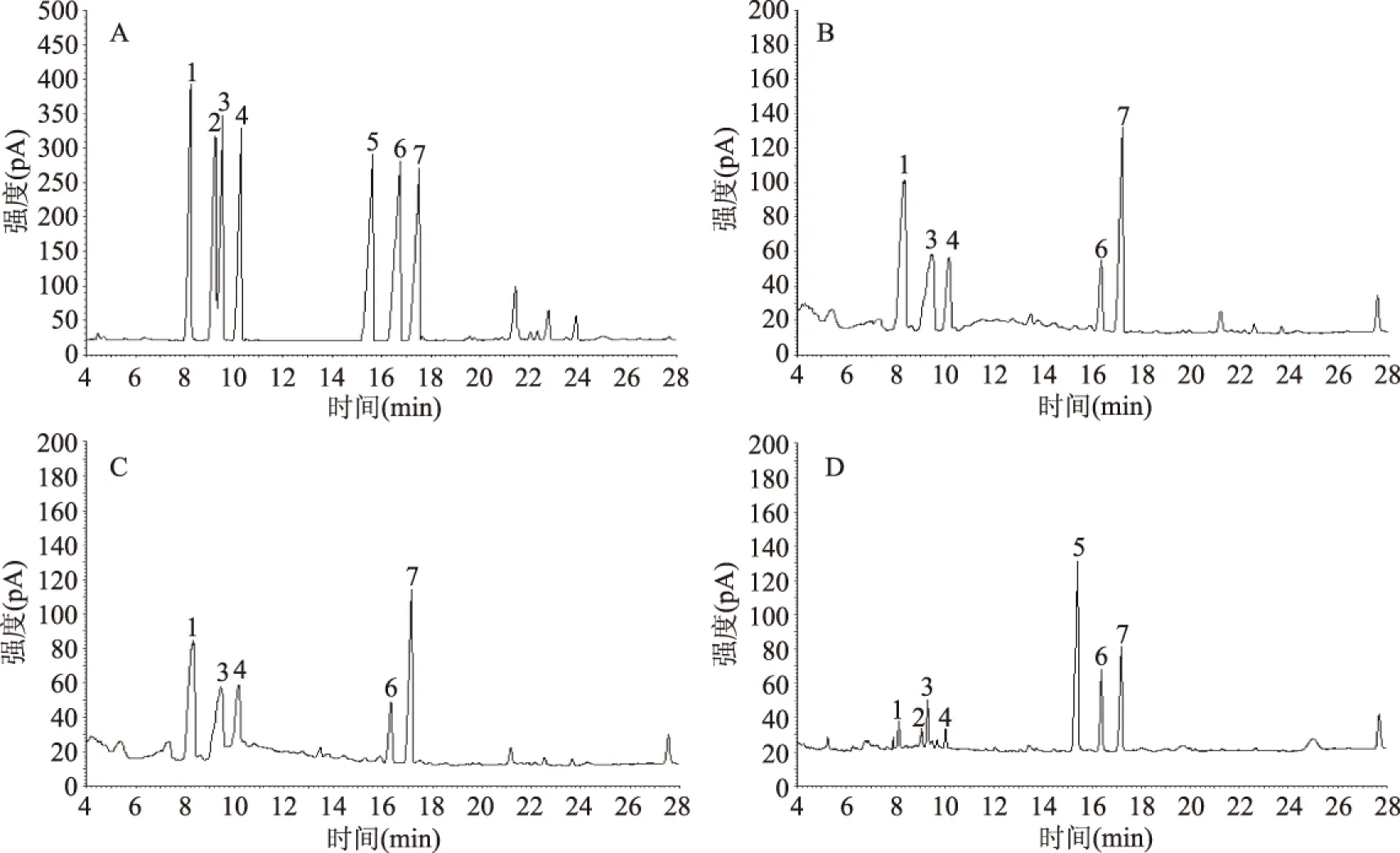
图7 单糖组成气相色谱图Fig.7 Gas chromatogram of monosaccharide composition注:A. 单糖标准品;B. 热水浸提亚麻籽胶;C. 微波辅助热水浸提亚麻籽胶;D. 市售亚麻籽胶; 1. L-鼠李糖;2. L-岩藻糖;3. L-阿拉伯糖;4. D-木糖;5. D-甘露糖;6. D-半乳糖;7. D-葡萄糖。
2.5 亚麻籽胶单糖组成分析结果
按照1.2.6的方法对上述三种亚麻籽胶进行了单糖组成的分析,结果如图7及表6所示。由图7A知各单糖标准品之间分离良好,说明该分析方法能够较好地分离目标单糖。热水浸提及微波辅助热水浸提所得亚麻籽胶的色谱分离图如图7B、图7C所示,由图7B、图7C可知这两种提取方法所得到的亚麻籽胶其单糖组成及含量并无明显差异,均由鼠李糖、阿拉伯糖、木糖、葡萄糖以及半乳糖5种单糖组成,其中鼠李糖、半乳糖、阿拉伯糖以及木糖含量较高,摩尔百分比详见表6。市售亚麻籽胶则由鼠李糖、岩藻糖、阿拉伯糖、木糖、甘露糖、葡萄糖以及半乳糖7种单糖组成,其中甘露糖、葡萄糖及半乳糖含量较高,分别为38.75%、14.00%以及25.60%,这与陈海华等的研究结果[22]有所不同。这是由于亚麻籽胶的单糖组成随亚麻的品种、生长环境、生长周期等的不同而有所差异[23],例如Oomah等[24]研究了十二个地区109份亚麻水溶性多糖的单糖组成,其中木糖的含量最低为10.9%,最高为32.0%,有较大差异。自制亚麻籽胶与市售亚麻籽胶由于来源不同,因此存在单糖在种类和含量上的差异。
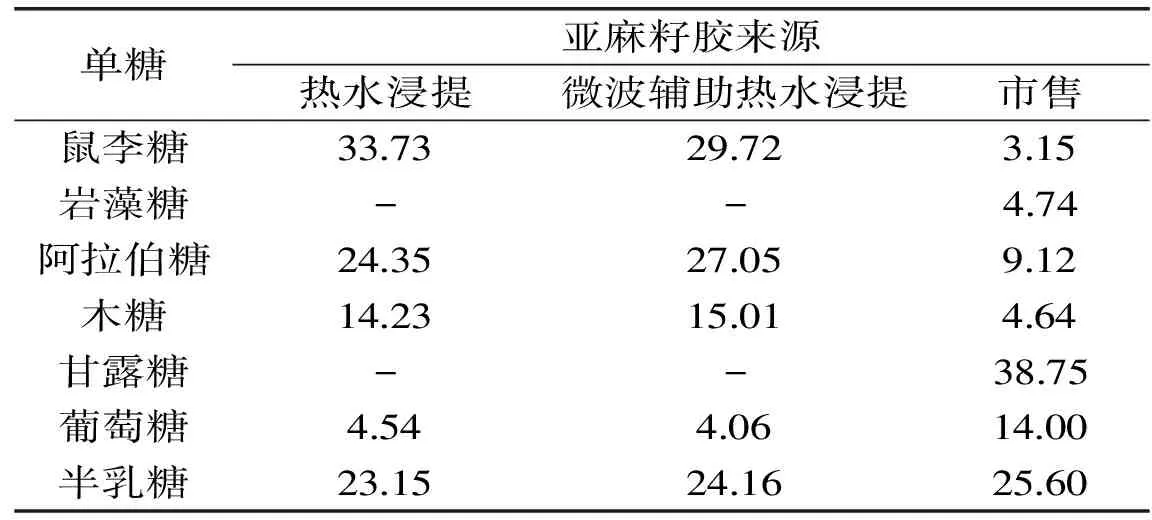
表6 亚麻籽胶单糖组成结果(摩尔百分比,%)
3 结论
本文建立了高效尺寸排阻色谱法(HPSEC)测定3种不同来源亚麻籽胶相对分子量,并利用糖腈乙酸酯衍生化气相色谱法对上述三种亚麻籽胶进行了单糖组成的分析。对HPSEC的精密度、重复性、稳定性以及准确性的考察结果表明该方法具有操作简单、结果准确、重复性好等特点,可为亚麻籽胶或其他大分子多糖胶分子量的测定提供依据。本文测得的三种亚麻籽胶峰位分子量分别为:热水浸提法7793 ku、微波辅助热水浸提法2420 ku、市售10392 ku和6166 ku(另有少量89183 ku组分);单糖组成结果表明热水浸提与微波辅助热水浸提所得亚麻籽胶均由鼠李糖、阿拉伯糖、木糖、葡萄糖以及半乳糖5种单糖组成,摩尔百分比分别为33.73%、24.35%、14.23%、4.54%、23.15%和29.72%、27.05%、15.01%、4.06%、24.16%,市售亚麻籽胶由鼠李糖、岩藻糖、阿拉伯糖、木糖、甘露糖、葡萄糖以及半乳糖7种单糖组成,摩尔百分比为3.15%、4.74%、9.12%、4.64%、38.75%、14.00%、25.60%。相比于陈海华等的研究[22],本文介绍了两种亚麻籽胶提取方法,并系统地建立了亚麻籽胶分子量的精确测定方法,为进一步探究亚麻籽胶的理化性质提供了依据。
[1]胡国华. 功能性食品胶[M]. 北京:化学工业出版社,2014,38-45.
[2]Priyanka Kajla,Alka Sharma,Dev Raj Sood. Flaxseed-a potential functional food source[J]. Food Science and Technology,2015,52(4):1857-1800.
[3]Yang Jin’e,Huang Qingde,Huang Fenghong. Process of extracting flaxseed gum powder by abrasion[J]. Transactions of the Chinese Society of Agricultural Engineering,2013,29(13):270-276.
[4]Martinchik A N,Baturin A K,Zubtsov V V,et al. Nutritional value and functional properties of flaxseed[J]. Voprosy Pitaniia,2012,81(3):4-10.
[5]Giada M L. Food applications for flaxseed and its components:products and processing[J]. Recent Patents on Food Nutrition & Agriculture,2010,2(2):181-186.
[6]Sonawane S,Marpalle P,Arya S S. Flaxseed:a nutrition booster and its role in quality of food[J]. Agro Food Industry Hi Tech,2014,25(1):20-23.
[7]邱财生,郭媛,龙松华,等. 亚麻籽的营养及开发研究进展[J]. 食品研究与开发,2014,17:122-126.
[8]陈海华. 亚麻籽胶的功能性质、结构及其应用[D]. 无锡:江南大学,2005.
[9]Qian K Y. Structure-Function Relationship of Flaxseed Gum from Flaxseed Hulls[D]. Guelph:The University of Guelph,2014.
[10]Yu R L,Li X,Ma W,et al. Retention of Large Biological Molecules by Size Exclusion Chromatography[J]. Analytical Letters,2016,accepted.
[11]李小凤,赵倩竹,滕英来,等. 亚麻籽胶微波辅助提取与热水浸提方法比较研究[J]. 中国粮油学报,2016,31(8):55-61.
[12]Qin C,Huang K,Xu H. Isolation and characterization of a novel polysaccharide from the mucus of the loach,Misgurnus anguillicaudatus[J]. Carbohydrate Polymers,2002,49(3):367-371.
[13]李楠,李卓,张燕,等. 高效分子排阻色谱法同时测定白及多糖分子量和含量[J]. 药物分析杂志,2012(10):1801-1803.
[14]Yi C,Xie M Y,Nie S P,et al. Purification,composition analysis and antioxidant activity of a polysaccharide from the fruiting bodies of Ganoderma atrum[J]. Food Chemistry,2008,107(1):231-241.
[15]卢茳虹. 海带多糖的分离纯化、结构特性及在卷烟中应用研究[D]. 广州:华南理工大学,2013.
[16]李健隽. 面积归一化法分析混合气体中各组分含量[J]. 计量与测试技术,2012,39(4):86-86.
[17]成跃祖. 凝胶渗透色谱法的进展及其应用[M]. 北京:中国石化出版社,1993:256-290.
[18]尺寸排阻色谱手册[G]. 东曹(上海)生物科技有限公司,2012:9-11.
[19]Jacquot C,Jacquot M,Marques P,et al. Influence of microwave heating time on the structure and properties of chitosan films[J]. Journal of Applied Polymer Science,2014,131(18):9365-9372.
[20]Xie Y,Yan M,Yuan S,et al. Effect of microwave treatment on the physicochemical properties of potato starch granules[J]. Chemistry Central Journal,2013,7(1):1-7.
[22]陈海华,许时婴,王璋. 亚麻籽胶化学组成和结构的研究[J]. 食品工业科技,2004(1):103-105.
[23]Cui W,Mazza G. Physicochemical characteristics of flaxseed gum[J]. Food Research International,1996,29(3):397-402.
[24]Oomah B D,Kenaschuk E O,Cui W,et al. Variation in the composition of water-soluble polysaccharides in flaxseed.[J]. Journal of Agricultural & Food Chemistry,2002,43(6):1484-1488.
Determination of relative molecular mass and monosaccharide composition of flaxseed gum
LIANG Shan1,2,HUANG Yu1,2,LI Xiao-feng1,2,LIAO Wen-zhen1,2,HAN Zi-sheng,WANG Yong1,2,*
(1.Guangdong Engineering Technology Research Center for Oils and Fats Biorefinery,Department of Food Science and Engineering,Jinan University,Guangzhou 510632,China;2.Guangdong-Saskatchewan Oilseed Joint Laboratory,Guangzhou 510632,China)
High performance size exclusion chromatography(HPSEC)method was established to determine the relative molecular mass of flaxseed gum. Subsequently,monosaccharide composition of flaxseed gum was analyzed by gas chromatography after derivatization with aldononitrile acetate. Combined SEC columns of TSKgel G5000 PWXLand TSKgel G3000PWXL,under conditions that ultrapure water as mobile phase,flow rate of 1.0 mL/min,sample concentration of 2.0 mL/min,column temperature of 40 ℃ and equipped with an evaporative light scattering detector,the relative molecular mass of dextran standards and flaxseed gum samples were determined. Results demonstrated that there was a good linear relationship between elution time and log M(R2=0.9842). Precision,repeatability,stability and accuracy of this method were all acceptable. Relative molecular mass of flaxseed gum from hot water extraction process,microwave assisted hot water extraction process and commercially available were 7793,2420,10392/6166/89183 ku respectively.Mn,Mw,MzandDwere also calculated. Monosaccharide composition analysis indicated that flaxseed gum that self-prepared were composed of rhamnose,arabinose,xylose,galactose and glucose,while commercially available flaxseed gum contained mannose and fucose in addition. Monosaccharide composition of flaxseed gum from different sources were quite different.
flaxseed gum;size exclusion chromatography;relative molecular mass;monosaccharide composition;determination
2016-08-26
梁珊(1991-),男,在读硕士研究生,研究方向:功能性碳水化合物,E-mail:liangshan@stu2014.jnu.edu.cn。
*通讯作者:汪勇(1977-),男,博士,研究员,研究方向:油脂生物炼制与营养,E-mail:twyong@jnu.edu.cn。
教育部“新世纪人才”支持计划项目(NCET-12-0675);广州市南沙区科技攻关项目(2014GG-05);广东省自然科学基金项目(2015A030313335)。
TS202.3
A
1002-0306(2017)05-0071-06
10.13386/j.issn1002-0306.2017.05.005

