蔷薇红景天低聚体原花青素的稳定性和抗衰老研究
韩 雪,孟玉彩,马 蕾,赵 文,周 茜,闫晨静,白冰瑶,蔡东伟
(河北农业大学食品科技学院,河北保定 071000)
蔷薇红景天低聚体原花青素的稳定性和抗衰老研究
韩 雪,孟玉彩,马 蕾,赵 文*,周 茜*,闫晨静,白冰瑶,蔡东伟
(河北农业大学食品科技学院,河北保定 071000)
本文主要考察光、pH、温度和金属离子等对蔷薇红景天低聚体原花青素稳定性的影响以及其对果蝇的抗衰老作用。稳定性研究结果表明,光照、Fe3+、Sn2+、Al3+等条件可降低原花青素稳定性,低pH、低温以及K+、Mg2+、Na+和Cu2+条件下原花青素较稳定。果蝇抗衰老研究结果显示,低(0.04%)、中(0.12%)、高剂量(0.36%)原花青素对果蝇平均寿命和最高寿命均有不同程度的延长作用,其中中剂量(0.12%)能显著延长果蝇寿命,最高寿命和平均寿命分别可达72 d和55 d;中(0.12%)、高剂量(0.36%)组果蝇SOD活性均显著提高(p<0.05),且中(0.12%)、高(0.36%)剂量MDA含量均显著下降(p<0.05)。研究为蔷薇红景天低聚体原花青素的深入研究和开发利用提供了科学依据。
蔷薇红景天,低聚体原花青素,稳定性,抗衰老活性
原花青素(Proanthocyanidin,PC)是一类黄烷醇单体及其聚合体的多酚类化合物的总称,广泛地分布于植物中,是迄今人类发现的最强、最有效的自由基清除剂之一[1-2],作为天然防腐剂、天然抗氧化剂和保护剂等[3],被越来越多的用于食品、医疗和化妆品等领域。根据构成原花青素的单体数量不同可以将其分为两大类,低聚原花青素(oligomeric proanthoeyanidins,OPC)和高聚原花青素(polymeric proanthoeyanidins,PPC),其中OPC更易被人体吸收,能更有效的发挥其生物功能。
蔷薇红景天(RhodiolaroseaL.)是蔷薇目(Rosales)景天科(Crassulaceae)红景天属的多年生草本植物,含有多种活性物质,包括红景天苷、酪醇、黄酮类等。研究发现红景天属植物具有抗衰老、抗缺氧、抗疲劳等药理作用,马桂芝等[4]研究发现蔷薇红景天具有抗冠心病的功效,还有研究发现蔷薇红景天对抗心肌缺血方面有突出作用[5],何承辉等[6]发现蔷薇红景天还具有抗氧化抗疲劳的作用,其中原花青素是主要抗氧化的物质。目前国内外对于蔷薇红景天低聚体原花青素(Oligomeric Proanthocyanidin fromRhodiolaroseaL.,OPCRR)研究相对简单,主要集中在OPCRR的提取、纯化、组分鉴定及活性筛选。本实验室前期确定了蔷薇红景天低聚体原花青素的提取精制条件并对其抗氧化活性进行了研究[7]。为了更好地制备和保存原花青素,进一步确定原花青素的抗衰老作用,本文主要从OPCRR稳定性实验和其对果蝇抗衰老实验两部分进行研究。
1 材料与方法
1.1 材料与试剂
蔷薇红景天块茎 河北省张家口地区;原花青素标准品(PC),纯度大于95% 上海源叶生物技术有限公司;玉米粉(超市食品级)、蔗糖、酵母浸粉、琼脂粉 天津市致远化学试剂有限公司;超氧化物歧化酶测定测试盒、总蛋白定量测试盒、丙二醛测试盒 南京建成生物工程研究所;试剂均为分析纯;黑腹果蝇(Drosophila melanogaster):OregonK品系实验用黑腹果蝇。
SPX-150S-Ⅱ生化培养箱 上海新苗医疗器械制造有限公司;XD-1200D型超声波细胞粉碎机 南京先欧仪器制造有限公司;DH-250电热恒温培养箱 上海胜启仪器仪表有限公司;H2050R台式高速冷冻离心机 长沙湘仪离心机仪器有限公司;1500-823型酶标仪 Thermo Scientific公司。
1.2 实验方法
1.2.1 原花青素含量的测定 分别配制0.05、0.10、0.18、0.34、0.43 mg/mL的PC标准溶液,采用香草醛-盐酸比色法[8],配制在10.5~420.0 μg/mL浓度范围内的原花青素标准溶液,分别在500 nm测吸光度,绘制标准曲线。在1 mL待测样品甲醇溶液中加2.5 mL 2%香草醛甲醇溶液和2.5 mL 8%的盐酸甲醇溶液,30 ℃下避光反应20 min,测得吸光度,根据标准曲线计算原花青素的含量。
1.2.2 OPCRR的制备 以蔷薇红景天根茎粉为实验材料,参考本实验室专利[9]。制备过程如下:利用乙醇回流法提取蔷薇红景天中的原花青素,提取溶剂为50%(v/v)乙醇,提取温度80 ℃,提取时间120 min,料液比1∶25;再对乙醇提取液进行乙酸乙酯萃取,萃取时间为25 min,体积比(乙酸乙酯∶提取液)1.5∶1,取下样液为低聚体原花青素,萃取4次;最终通过大孔树脂AB-8对萃取液进行纯化,解析液为50%乙醇溶液,提取液pH为4.5,解析液 pH为5,径高比为1∶40(cm),将纯化物浓缩,冷冻干燥后保存待用。
1.2.3 OPCRR的稳定性研究
1.2.3.1 OPCRR保存率的计算方法 保存率(%)=C2/C1×100,本实验通过保存率说明稳定性。C1:OPCRR溶液最初浓度;C2:OPCRR溶液保存一段时间后的浓度。
1.2.3.2 光照对OPCRR稳定性的影响 将0.3 mg/mL OPCRR溶液取等量放置在自然光、避光、日光灯环境中,分别于第1、2、3、4、5、6、7 d时取样,按1.2.1方法测定OPCRR含量,按1.2.3.1方法计算保存率,实验重复三次,取平均值。
1.2.3.3 pH对OPCRR稳定性的影响 将配制好的0.3 mg/mL OPCRR溶液取等量分别加入到pH为2.0、4.0、6.0、8.0的等量0.2 mol/L磷酸氢二钠和0.1 mol/L柠檬酸按不同比例混合的水溶液中[10],室温下避光保存,分别于第2、4、6、8、10 h取样,按1.2.1方法测定OPCRR含量,按1.2.3.1方法计算保存率。实验重复三次,取平均值。
1.2.3.4 温度对OPCRR稳定性的影响 将配制好的0.45 mg/mL OPCRR溶液取等量置于4、25、50 ℃的环境下,分别在室温密封避光2、4、6、8、10 h后取样,按1.2.1方法测定OPCRR含量,按1.2.3.1方法计算保存率。实验重复三次,取平均值。
1.2.3.5 金属离子对OPCRR稳定性的影响 在不超过国标中金属离子在食品中最大安全使用量的前提下,将NaCl、KCl、MgSO4、CuCl2、SnSO4、FeCl3、AlCl3[11]加入到5 mL的0.3 mg/mL OPCRR溶液中制成1 mmol/L的盐溶液,室温密封避光保存,定时取样,按1.2.1方法测定OPCRR含量,按1.2.3.1方法计算保存率。实验重复三次,取平均值,并观察溶液颜色。
1.2.4 OPCRR对果蝇的抗衰老研究
1.2.4.1 果蝇培养基的配制 称量8.5 g玉米粉、6.5 g蔗糖、0.75 g琼脂粉和0.75 g酵母浸粉,混合,加入蒸馏水搅拌均匀,置于铺有石棉网的电炉上煮沸1 min,当培养基成为糊状物时停止加热,加入1 mL丙酸,不同剂量组的培养基是由基础培养基分别加入0.04%、0.12%、0.36%的OPCRR粉末得来。搅拌并迅速倒入培养直管,高度约2 cm,制得基础培养基。
1.2.4.2 果蝇寿命实验 分别设置空白对照组、低(0.04%)、中(0.12%)、高(0.36%)剂量组。果蝇培养基在室温下干燥1~2 d后,等待其完全凝固后,将处女蝇倒入洁净锥形瓶,适当乙醚麻醉使之处于不活动状态,随即选960只体型相近的果蝇。若性状不明显、难以判断或蝇翅翘起与蝇体夹角超过45°的果蝇,均将其舍弃[12]。将筛选好的果蝇分装,每管20只。分组后保持同样培养条件,置于生化培养箱中,每日12 h光照,培养温度(25±1) ℃,相对湿度55%~65%。当培养至14 d时,随机分为空白对照组、低、中、高剂量OPCRR处理组,隔3 d换新鲜培养基。同时每天定时统计死亡数目,每隔12 h观察、记录各果蝇的存亡情况,直至其全部死亡。从第14 d起作为第1 d,计算每组平均寿命(mean life span,MLS)和最高寿命(maximum life span,MMLS)。MLS为全部正常死亡果蝇寿命的平均值,MMLS为最后10只正常死亡的果蝇平均寿命[13]。
1.2.4.3 果蝇体内SOD活性和MDA含量测定 乙醚麻醉处女蝇后分装800只果蝇,随机分成4组,每50只放入一个清洁的锥形瓶中,各准备四个基础培养基、低、中、高剂量OPCRR培养基,即每组各四瓶共200只。培养条件与果蝇寿命实验相同。培养30 d后将同组果蝇乙醚麻醉致死,放入离心管中,按体积比1∶9加入生理盐水,在冰浴中以2000 r/min匀浆10 s,间歇10 s,反复进行3次,制成匀浆,再离心、取上清液。按试剂盒说明书进行SOD和MDA检测。
1.3 数据处理
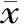
2 结果与分析
2.1 标准曲线和回归方程
以原花青素含量(mg/mL)为横坐标,吸光度值为纵坐标,绘制原花青素的标准曲线,见图1,并得到回归方程Y=1.7827X+0.0105,相关系数为r=0.99936。
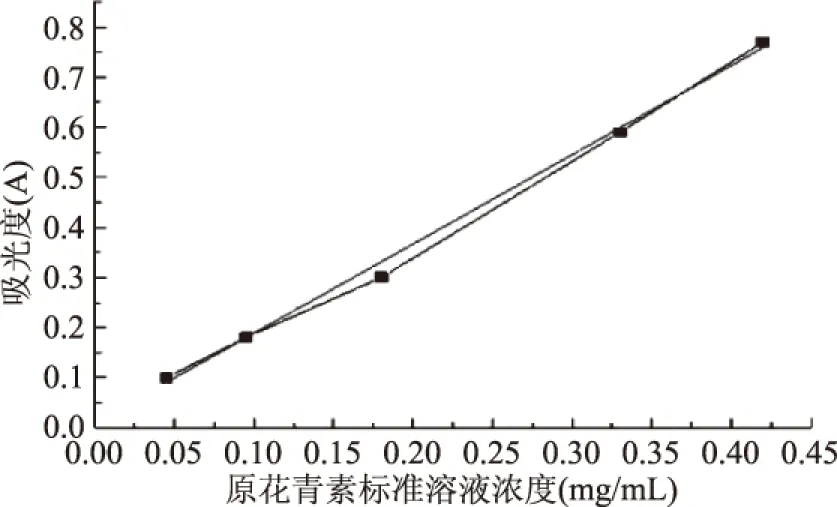
图1 原花青素标准曲线Fig.1 The standard curve of proanthocyanidins
2.2 OPCRR的制备
经提取、萃取和纯化三种方法结合,OPCRR的得率为4. 56%,测得OPCRR的纯度为88. 3%。
2.3 OPCRR稳定性研究
2.3.1 光照对OPCRR稳定性的影响 由图2可以看出,不同光照处理下,随着光照时间延长,OPCRR的含量均降低,且降低程度随光照强度的增加而增大。与初始含量相比,避光条件OPCRR含量变化较小,7 d后保存率为90.7%;在自然光条件下,OPCRR含量明显下降,7 d后其保存率为64.7%;在日光灯照射条件下,OPCRR含量显著下降,7 d后其保存率仅为50.6%。由此可知,不同光照条件会影响OPCRR的稳定性,且光照强度为决定性因素。
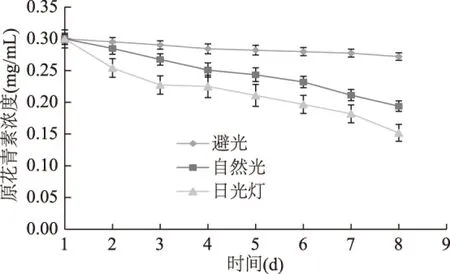
图2 光照对OPCRR稳定性的影响Fig.2 Effect of light on stability of OPCRR
2.3.2 pH对OPCRR稳定性的影响 图3可知,在pH为2~6范围内,随保存时间的延长,OPCRR含量变化不明显,比较稳定。随着pH的升高,当溶液呈碱性(pH=8)时,溶液的吸光度迅速减小并且溶液颜色加深。

图3 pH对OPCRR稳定性的影响Fig.3 Effect of pH on stability of OPCRR
2.3.3 温度对OPCRR稳定性的影响 由图4可知,不同保存温度下OPCRR稳定性具有较大差异。在低温条件下OPCRR较为稳定,4 ℃条件下放置10 h后相对保存率为97.3%,在25 ℃下放置10 h后相对保存率为91.9%。但随着温度升高,OPCRR稳定性逐渐下降,尤其是保存温度为70 ℃以上时,OPCRR含量下降速度加快。当在90 ℃条件下放置10 h后,保存率为75.6%,由此可知,在实验温度范围内,低温条件对OPCRR稳定性无明显影响,而高温能显著降低OPCRR稳定性。
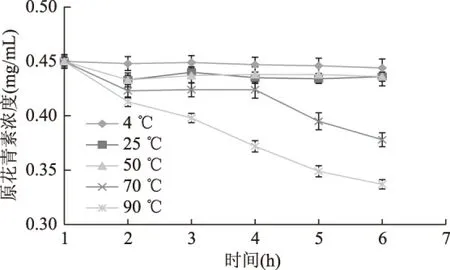
图4 温度对OPCRR稳定性的影响Fig.4 Effect of temperature on stability of OPCRR
2.3.4 金属离子对OPCRR稳定性的影响 由图5可知,K+和Mg2+存在条件下OPCRR的保存率最大,其次为Na+和Cu2+,这四种离子对OPCRR的稳定性影响较小。Fe3+、Al3+、Sn2+对OPCRR的稳定性影响较大,Fe3+加入后溶液颜色由红色变为兰黑色,且即刻产生絮状沉淀;Sn2+加入后溶液颜色变成浅红色,且立刻产生絮状沉淀,8 h后OPCRR的保存率仅为50.5%;Al3+加入使溶液颜色发黄,同时也有少许沉淀生成,说明这三种离子对OPCRR具有明显的破坏作用,其原因还有待进一步研究。因此,在OPCRR的保存和使用时应尽量避免与Fe3+、Al3+、Sn2+共存。
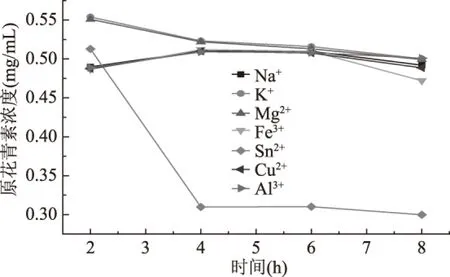
图5 金属离子对OPCRR稳定性的影响Fig.5 Effect of metal iron on stability of OPCRR
2.4 OPCRR对果蝇的抗衰老研究
2.4.1 OPCRR对果蝇寿命的影响 表1结果显示,随OPCRR浓度的增加,果蝇的MLS和MMLS均延长,直至浓度达到0.12%后变化平稳。与空白对照组相比,低、中、高剂量组果蝇MLS分别增加了1.3%、6.1%和5.0%,MMLS分别增加了1.1%、4.6%和4.0%(p<0.01)。其中果蝇MLS最高为55 d,MMLS为72 d。
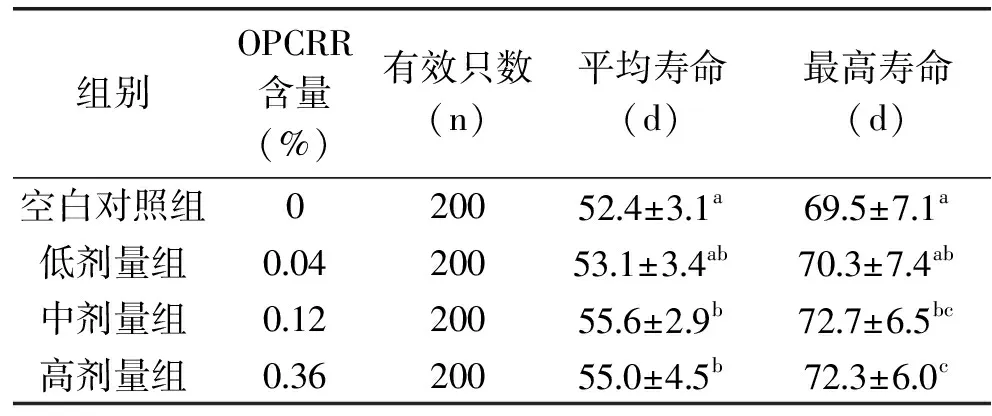
表1 OPCRR对果蝇寿命的影响
注:同列后的不同小写字母表示在0.05水平存在显著性差异,表2同。
2.4.2 OPCRR对果蝇体内SOD活性和MDA含量的影响 表2表示OPCRR处理对果蝇体内SOD活性和MDA含量的影响。与空白对照组相比,不同剂量组OPCRR处理的果蝇SOD活性均有显著提高(p<0.05),MDA含量均有降低。低剂量组果蝇SOD活性提高了5.0%,差异不显著,中、高剂量组分别提高了19.2%和19.4%,均具有显著差异(p<0.05)。与空白对照组相比,各剂量组果蝇MDA含量分别降低了13.3%、16.5%和18.6%,且中、高剂量MDA含量均显著下降(p<0.05)。

表2 OPCRR对果蝇体内SOD活性和MDA含量的影响(±s)
3 讨论与结论
本实验室前期研究结果显示,蔷薇红景天低聚体原花青素具有显著的体外清除自由基活性和体内抗氧化活性,作为来源于新资源食品的植物提取物,具有潜在的研究价值和应用前景。本实验研究了光照、温度、pH和金属离子等影响因素对OPCRR稳定性的影响以及OPCRR对果蝇延缓衰老作用,为OPCRR的深度开发和应用提供了科学依据。结果显示光照、温度和pH的增加使OPCRR降解损失,造成OPCRR含量下降;金属离子K+、Mg2+、Na+和Cu2+对OPCRR稳定性无显著性影响,而Fe3+、Sn2+、Al3+可使OPCRR溶液的颜色改变或发生明显的沉淀。廖义秀[14]等研究表明光照、温度、pH、添加剂和金属离子等对酚类物质稳定性的影响较显著,张海晖[15]等也证明光照、温度、pH和金属离子是影响原花青素稳定性的主要影响因素。陈婵[11]等研究结果证明光照、温度和pH的增强使紫色甘薯原花青素含量下降,金属离子Fe3+、Sn2+、Al3+、Mg2+、Na+对原花青素稳定性影响较大。
生物体内自由基作用于脂质发生过氧化反应,氧化终产物为丙二醛,会引起蛋白质、核酸等生物大分子的交联聚合,且具有细胞毒性。超氧化物歧化酶是机体内抗氧化系统中具有代表性的酶类,可特定清除各种自由基,避免由自由基引起的细胞损伤和机体损害。因此,测定超氧化物歧化酶活性及丙二醛含量可间接了解过氧化程度。目前,衰老自由基理论认为可通过提高抗氧化酶活性或者减少自由基来缓解衰老。本实验采用果腹果蝇为研究对象,以MLS和MMLS为统计标准,考察了OPCRR对果蝇寿命的影响。结果显示,不同剂量的OPCRR对果蝇寿命影响程度不同,但在一定范围之内与剂量呈正相关关系,具有良好的延长寿命作用;中剂量OPCRR对果蝇寿命的影响最大,在抗衰老方面体现最明显,延长的寿命率达到了6.3%。孙智达[16]、谭壮生[17]等研究了原花青素对果蝇寿命的影响,结果证明低(0.04%)、中(0.12%)、高(0.36%)三个剂量组均能延长果蝇的MLS,其中高剂量果蝇寿命最长;对于MMLS,中、高剂量组可延长雌果蝇寿命,与本实验果蝇的寿命实验结果基本一致。本果蝇抗衰老实验中,SOD活性较空白组有所提高,MDA含量较空白组有所下降。其中,中、高剂量组雄果蝇的SOD活性均显著提高(p<0.05),其中,高剂量组果蝇SOD活性与空白对照组差异极显著(p<0.01)。与空白对照组相比,各剂量组MDA均不同程度地降低,其中中、高剂量OPCRR处理后MDA含量表现出显著性下降(p<0.05)。高江霞[18]等结果证明,原花青素提取物可使小鼠血清、脑组织、肝组织中的SOD活性增加,MDA含量下降;孙智达[17]研究原花青素对小鼠体内抗氧化指标影响结果显示0.2%、0.6%两个剂量均可显著地提高SOD活性和降低MDA含量,0.6%剂量效果显著,与本实验结果基本一致。
原花青素作为一种安全的天然提取物,具有很强的抗氧化和清除自由基的能力,这使得它在保健食品研发领域具有良好前景。对此本研究确立了影响OPCRR稳定性的因素,因此,我们在生产实践中需要注意选择食品添加剂的种类以及贮藏条件;抗衰老作用结果表明,原花青素可清除体内过多的自由基发挥其抗衰老作用,但原花青素清除自由基的机理仍不清楚,还需更全面的研究来探索其机理。
[1]赵平,任鹏,张月萍. 原花青素抗氧化活性测定方法比较[J]. 现代化工,2012,32(5):119-122.
[2]张峰源,赵先英,张定林,等. 原花青素抗肿瘤作用及机制研究进展[J]. 重庆医学,2012,41(27):2887-2889.
[3]赵平,张月萍,刘俊英,等. 原花青素分级分离[J]. 中国食品添加剂,2011,(6):75-79.
[4]马桂芝,滕亮,马亮英,等. 新疆蔷薇红景天抗冠心病有效成分的提取纯化研究[J]. 中成药,2012,34(1):1009-1011.
[5]马桂芝. 蔷薇红景天化学成分和抗心肌缺血有效部位的研究[D]. 乌鲁木齐:新疆医科大学,2006.
[6]何承辉. 蔷薇红景天化学成分及抗氧化作用的研究[D]. 乌鲁木齐:新疆医科大学,2006.
[7]殷志萍. 蔷薇红景天原花青素的分离纯化及抗氧化、抗肿瘤活性研究[D]. 保定:河北农业大学,2012.
[9]赵文. 一种蔷薇红景天原花青素的制备方法:中国:CN2011100915740[P].2013-08-14.
[10]刘佳,许盈芃,卢红冲,等. 火棘原花青素稳定性研究[J]. 食品研究与开发,2015(7):29-32.
[11]陈婵,黄琼,彭宏,等. 紫色甘薯原花青素稳定性及抗氧化性的研究[J]. 安徽农业科学,2012,40(35):17308-17310.
[12]熊丽丹. 雪灵芝抗衰老研究[D]. 成都:四川师范大学,2010.
[13]陈勤. 抗衰老研究实验方法[M]. 北京:中国医药科技出版社,1996.
[14]廖义秀. 茶油多酚分析及其抗氧化稳定性研究[D]. 株洲:中南林业科技大学,2013.
[15]张海晖,李金凤,段玉清,等. 板栗壳原花青素提取及其稳定性研究[J]. 食品科学,2011,32(8):5-9.
[16]孙智达,杨尔宁,谢笔钧. 荷叶中原花青素对果蝇寿命及小鼠及的影响[J]. 食品科学,2005,26(12):221-223.
[17]谭壮生,张懿,宋乃宁,等. 花青素对果蝇寿命和小鼠某些氧化及抗氧化指标的影响[J]. 毒理学杂志,2012,(6):440-441.
[18]高江霞,王艳红,孟敏,等. 马栗籽提取物对衰老模型小鼠氧化损伤的改善作用[J]. 中国药房,2015,(16):2175-2177.
Stability and anti-aging effect of oligomeric proanthocyanidin fromRhodiolaroseaL.
HAN Xue,MENG Yu-cai,MA Lei,ZHAO Wen*,ZHOU Qian*,YAN Chen-jing,BAI Bing-yao,CAI Dong-wei
(College of Food Science and Technology,Agricultural University of Hebei,Baoding 071000,China)
The stability and anti-aging effect of oligomeric proanthocyanidin fromRhodiolaroseaL. (OPCRR)was studied.The results of stability showed that the OPCRR content would decrease under the condition of light,Fe3+,Sn2+,Al3+,keep stable at low pH,low temperature,K+,Mg2+,Na+and Cu2+. The results of anti-aging effect showed that the concentration of 0.04%,0.12% and 0.36% OPCRR had various degrees of prolonging effect on the average life and the highest life of Drosophila melanogaster,and the most effective dose was 0.12% OPCRR,in which the highest life and average life of Drosophila melanogaster was up to 72 d and 55 d respectively.In 0.12% and 0.36% OPCRR groups,the SOD activities were significantly increased(p<0.05)and MDA contents were significantly decreased(p<0.05).The study provided the theoretical basis for deeply research and application of oligomeric proanthocyanidin fromRhodiolaroseaL.in future.
RhodiolaroseaL;oligomeric proanthocyanidins;stability;anti-aging activity
2016-09-06
韩雪(1991-),女,在读研究生,研究方向:食品加工与安全,E-mail:245690659@qq.com。
*通讯作者:赵文(1962-),女,硕士,教授,研究方向:营养分析与食品安全,E-mail:13582820221@163.com。 周茜(1986-),女,博士,从事营养和食品安全研究工作,E-mail:zhouqianyz513@126.com。
河北省高等学校科学技术研究项目(QN2015198);河北省食品科学与工程学科“双一流”建设资金项目(2016SPGCA18)。
TS202.3
A
1002-0306(2017)05-0120-05
10.13386/j.issn1002-0306.2017.05.014

