儿童麻疹疫苗接种后远期抗体水平及Th1/Th2细胞因子分泌特征
汪培勤+++汤菊妹++王健容++唐艳丽++郭锦锦++孙万邦

[摘要]目的 通過检测儿童接种后远期血清抗体水平和T细胞亚群分泌细胞因子,评价其体液免疫持久性及其对细胞免疫功能的影响。方法 2013年1月~2015年7月在深圳市龙岗区妇幼保健院儿童保健科体检的儿童,筛选麻疹疫苗接种的儿童32名,接种时间为3~10年,取外周血2 ml分离血清,用ELISA法检测麻疹抗体;根据麻疹抗体水平检测结果将所有受试者分组,即低应答组(9.00~19.99 IU/L)、中应答组(20.00~199.99 IU/L)和高应答组(200.00~320.00 IU/L);将麻疹疫苗接种的32例儿童血液标本分离的外周血单个核细胞(PBMC)进行培养,培养中设计不加麻疹疫苗的对照组、加疫苗刺激的实验组。用细胞因子微球检测技术检测细胞培养上清液中Th1细胞因子TNF-α和Th2细胞因子IL-10。结果 抗体阳性率为81.2%,抗体水平为(115.03±95.20)IU/L;高应答组抗体水平显著高于中应答组和低应答组(P<0.05);实验组和对照组因子水平的中位数分别2021.81 pg/ml(TNF-α)、2566.93 pg/ml(IL-10)和1481.72 pg/ml(TNF-α)、1861.89 pg/ml(IL-10),实验组的TNF-α和IL-10水平显著高于对照组(P<0.05)。结论 儿童麻疹疫苗接种后抗体阳性率较高,且接种后体内存在免疫记忆性T细胞,在接触抗原刺激后可介导细胞免疫应答。
[关键词]麻疹疫苗;抗体;细胞因子;远期免疫;免疫记忆
[中图分类号] R725.111 [文献标识码] A [文章编号] 1674-4721(2017)04(b)-0004-05
Antibody levels and the secreting characterization of Th1/Th2 cytokines in the children long term after vaccination with measles vaccine
WANG Pei-qin1 TANG Ju-mei1 WANG Jian-rong1 TANG Yan-li1 GUO Jin-jin2 SUN Wan-bang2▲
1.Department of Pediatrics,Shenzhen Longgang Maternal and Child Health Care Hospital,Guangdong Province,Shenzhen 518172,China;2.Immunology Teaching and Research Section,Zhuhai Campus of Zunyi Medical College,Guangdong Province,Zhuhai 519041,China
[Abstract]Objective To detect the serum antibody level and cytokine secretion of T cell subsets in children after vaccination,and to evaluate the effect of humoral immunity and cellular immunity.Methods A total of 32 children with measles vaccination for 3-10 years were selected in Children′s Health Care Department of Longgang District Maternal and Child Health Care Hospital of Shenzhen from January 2013 to July 2015. 2 ml blood samplewas used for measure measles antibody titers by ELISA from isolated serum,who were divided into low response group (9.00-19.99 IU/L),middle response group (20.00-199.99 IU/L) and high response group (200.00-320.00 IU/L) according to the results of measles antibody levels.The peripheral blood mononuclear cells (PBMC) were isolated from the other 3 ml blood sample.The experimental group,stimulated by measles vaccine (3.0 μg/ml) and control group were set,without stimulation.Both groups were cultured and taken to detect TNF-α and IL-10 by Cytometric Bead Array (CBA).Results The positive rate of antibody was 81.2%,of which the level was (115.03±95.20) IU/L.The antibody level in the high response group was significantly higher than those in the medium response group and low response group (P<0.05).The medians of factors in the experimental group and control group were respectively 2021.81 pg/ml (TNF-α),2566.93 pg/ml (IL-10) and 1481.72 pg/ml (TNF-α),1861.89 pg/ml (IL-10),and the TNF-α and IL-10 levels in the experimental group were significantly higher than those in the control group (P<0.05).Conclusion Thepositive rate of antibody is high in children after vaccination with measles vaccine,and there are immune memory T cells,which can mediate cell-mediated immune response when exposure to antigen stimulation.
[Key words]Measles vaccine;Antibody;Cytokine;Long-term effect;Immunological memory
麻疹(measles vaccine,MV)是幼儿时期常见的急性呼吸道传染病,主要由麻疹病毒感染所致传染性极强。肺炎、脑炎等均是麻疹麻疹患儿常见并发症,也是导致病死率居高不下的主要原因。据统计,截止19世纪90年代,全球约有4000万麻疹病例,约有100万死亡,较麻疹疫苗接种前显著降低[1]。我国于2006年参考WHO建议,提出综合性消除麻疹策略,该策略中将儿童常规免疫干预作为基础,并鼓励强化麻疹疫苗免疫處理,旨在提高幼儿群体的机体抵抗能力[2]。此后我国麻疹发病率降至2012年的最低点接近4.5/100万,但从2013年开始又明显回升,至2015年的发病率接近38/100万,死亡人数也从2012年的8人升至2015年的32人[3],未能达到世界卫生大会确定的目标,即截至2015麻疹发病率<5/100万[4]。近年的麻疹病例除儿童外,也有成人麻疹病例[5-6]。因此,对于麻疹疫苗接种后的远期免疫效果有必要重新认识。既往关于儿童麻疹疫苗接种的研究中,大多着重于抗体水平检测以及近远期效果观察,关于对记忆免疫细胞功能检测评价接种效果的切入点研究尚鲜有报道。鉴于此,本研究特对麻疹疫苗接种的儿童进行基于记忆免疫细胞功能水平的检测研究,从免疫记忆的角度来评价接种麻疹疫苗后的远期效果。
1资料与方法
1.1一般资料
从2013年1月~2015年7月在深圳市龙岗区妇幼保健院儿童保健科体检的儿童,筛选接种过麻疹疫苗的儿童32名作为受试对象,其中男性18名,女性14名,年龄7~10岁,平均年龄(8.3±1.0)岁。入选标准:末次接种麻疹疫苗后时间为3年以上,家长均知情同意者;排除标准:有麻疹病史,合并有其他类型严重系统性疾病者,存在有免疫系统缺陷疾病者。本研究符合医院医学伦理条件。根据麻疹抗体水平检测结果将所有受试者分组,即低应答组(10例,9.00~19.99 IU/L)、中应答组(8例,20.00~199.99 IU/L)和高应答组(14例,200.00~320.00 IU/L)。低应答组中男性6例,女性4例;年龄7~10岁,平均年龄(8.6±1.3)岁。中应答组中男性5例,女性3例;年龄7~10岁,平均(8.5±1.2)岁。高应答组中男性7例,女性7例;年龄7~10岁,平均(8.6±1.2)岁。三组间一般资料比较,差异均无统计学意义(P>0.05),具有可比性。
1.2方法
1.2.1主要试剂与仪器 麻疹病毒(MV Ab)ELISA试剂盒由深圳晶美生物科技公司提供;TNF-α CBA、IL-10 CBA试剂盒均由美国Becton Dickinson公司提供;胎牛血清、改良型RPMI-1640培养液均由宝生物(大连)公司提供;麻疹减毒活疫苗购自上海生物制品研究所;CO2培养箱购自美国RAD公司;流式细胞仪(FACS Calibur型)购置美国贝克曼库尔特公司。
1.2.2分组方法 将麻疹疫苗接种的32例儿童血液标本分离的PBMC进行培养,培养中设计不加麻疹疫苗为对照组,加疫苗刺激为实验组。
1.2.3检测方法 标本无菌采受试者静脉血5 ml,分装。其中2 ml自然凝固,并离心分离,取上清液用测麻疹抗体水平,所用方法为ELISA,分离血清后,参照说明书步骤测得标准品的OD值及样品OD值,然后计算出标准曲线回归方程,可将OD值代入上述方程中,从而得出样品浓度;另3 ml置于抗凝管中,于5 min后加入3 ml D'Hank's液。摇晃均匀后向其中加入2 ml淋巴细胞分离液,离心,并对淋巴细胞实施洗涤处理。加2 ml培养液,离心分离,取沉淀细胞,调整淋巴细胞,使其浓度达细胞数1×106/ml。将上述样品加入96孔培养板中,每孔样品量为100 μl。每组设置3个复孔,其中实验组加入浓度为3.0 μg/ml的麻疹疫苗;对照组则加等量无菌生理盐水,并于每孔中加入100 μl浓度为10%的培养液,置CO2培养箱中(浓度为5%),培养条件:37℃,50 h。取上述样品离心分离,转速为800 r/min,处理时间为5 min。用流式CBA法检测细胞因子操作步骤参照说明书制作标准品与待测样本,BD-FACS Calibur流式细胞仪检测细胞因子TNF-α、IL-10。收集完毕后,用FCAP Array v1.0软件绘制标准曲线并分析数据。
1.3观察指标
观察本组患儿血清麻疹抗体浓度、不同组间血清麻疹抗体水平高低检测结果、接种麻疹疫苗不同时间抗体水平结果、接种麻疹疫苗不同次数的抗体检测结果、实验组和对照组麻疹疫苗接种儿童TNF-α和IL-10水平检测结果。
1.4统计学方法
采用SPSS 19.0统计学软件进行数据分析,计量资料用均数±标准差(x±s)表示,两组间比较采用t检验,不服从符合正态分布数据改用中位数表示,两组间比较采用秩和检验;计数资料用率表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2结果
2.1血清检测结果
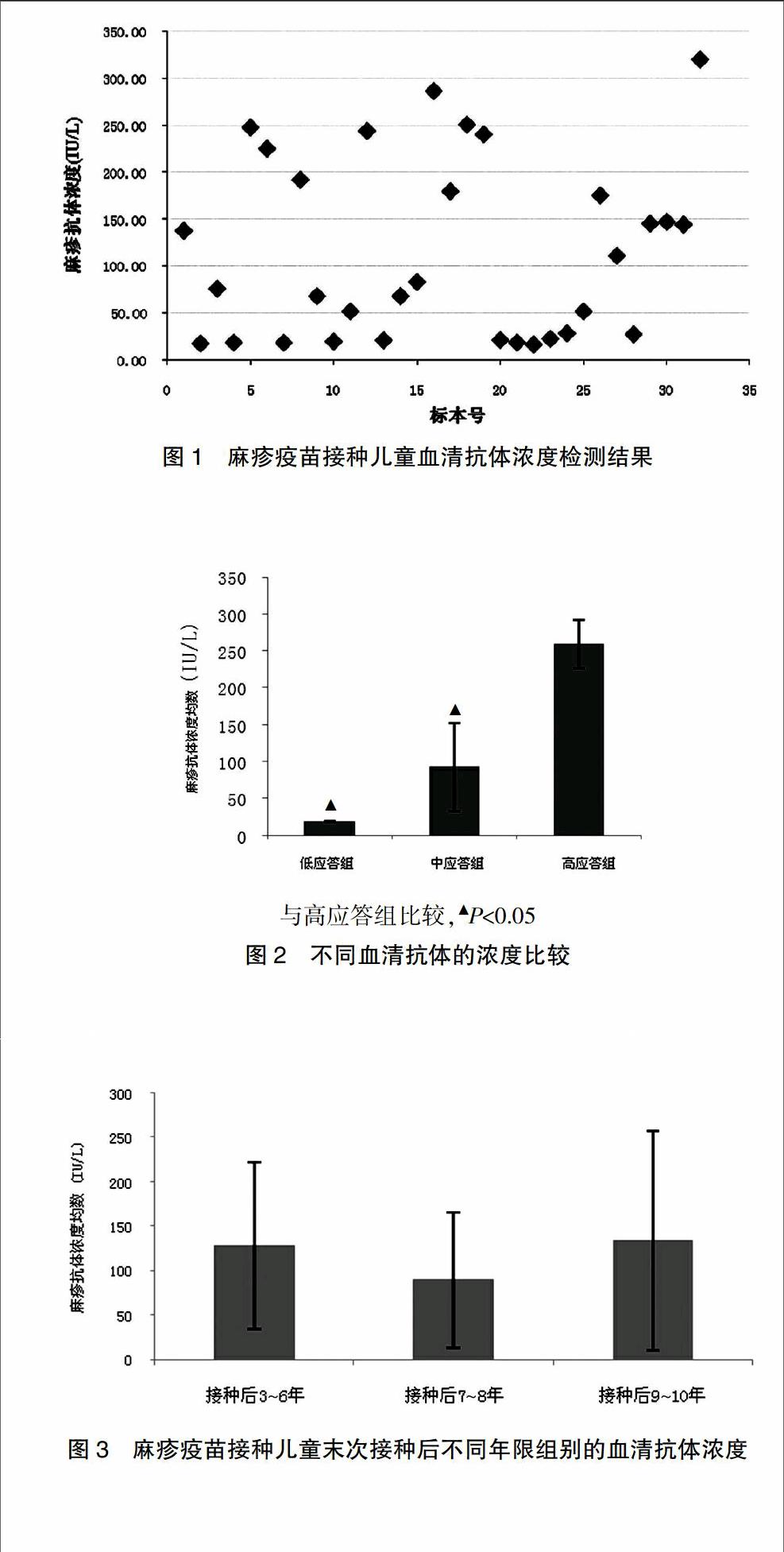
血清检测的麻疹抗体结果为符合正态分布的数据,结果显示:在9.00~320.00 IU/L区间内均能检测到麻疹病毒抗体,但抗体水平差异较大,抗体水平为(115.03±95.20)IU/L(图1)。
2.2不同组间抗体水平检测结果
32例受试者均检出抗体,低应答组浓度为(18.49±1.09)IU/L,中应答组浓度为(92.40±59.31)IU/L,高应答组浓度为(259.25±32.60)IU/L,分组比较结果显示,高应答组抗体水平高于低应答组及中应答组(P<0.05),其中抗体阳性率为81.2%(图2)。
与高应答组比较,▲P<0.05
图2 不同血清抗体的浓度比较
2.3接种麻疹疫苗不同时间抗体水平结果
为了观察32例儿童接种麻疹疫苗后不同时间抗体水平变化,根据接种时间分组,最后1次接种后持续时间3~6年的抗体浓度为(128.12±93.94)IU/L,持续时间7~8年的抗体浓度为(89.29±76.47)IU/L,持续时间9~10年的抗体浓度为(134.01±123.46)IU/L,结果显示组间差异无统计意义(P>0.05)(图3)。
2.4接种麻疹疫苗不同次数的抗体检测结果
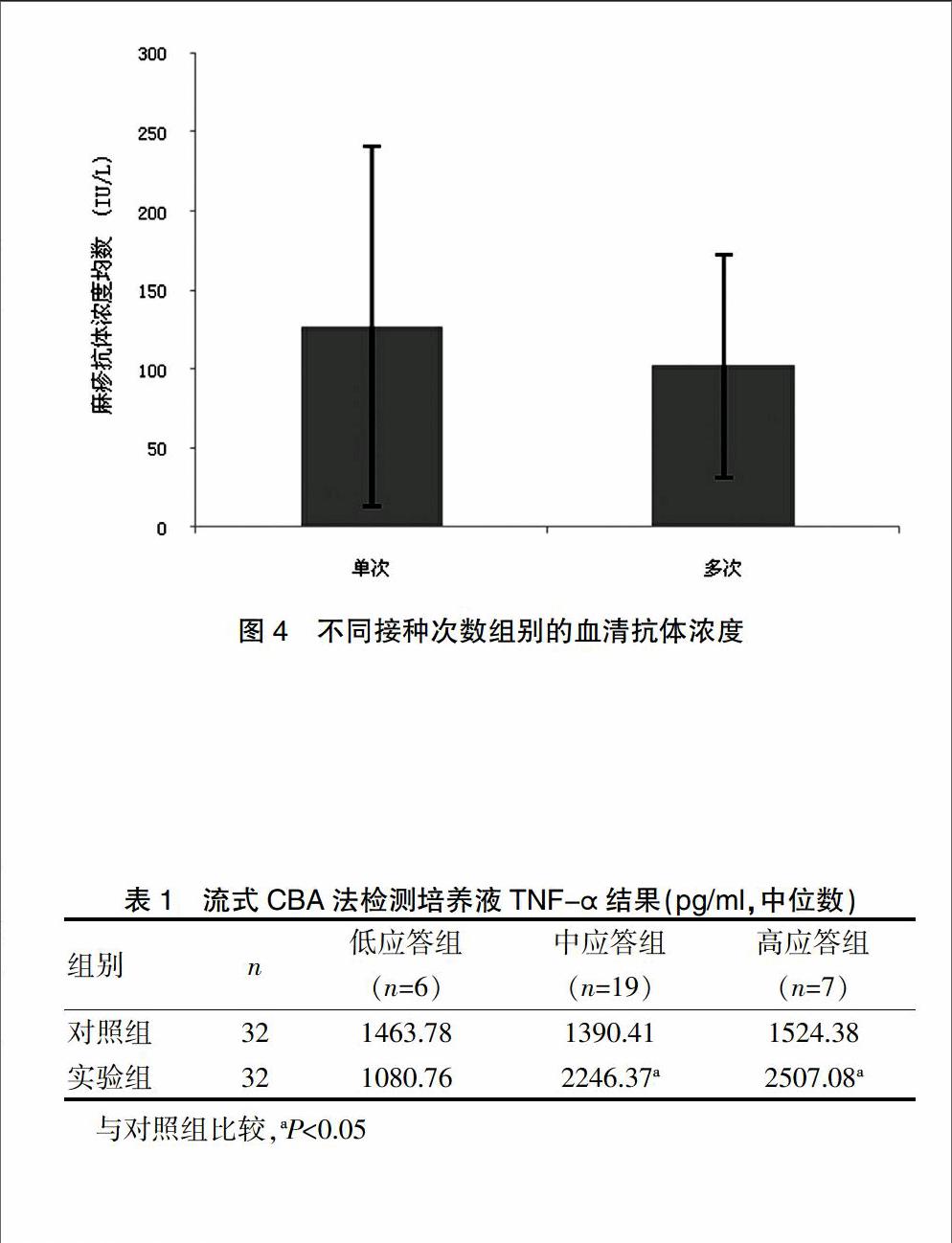
为了观察麻疹疫苗接种次数抗体水平的情况,根据对象接种疫苗的次数不同进行分组,单次组抗体浓度为(126.82±113.71)IU/L,多次(2~4次)组抗体浓度为(101.68±70.23)IU/L,对组间抗体水平再进行分析,结果显示:单次接种与多次接种麻疹疫苗的抗体水平无明显差异(P>0.05)(图4)。
2.5麻疹疫苗接种儿童TNF-α检测结果
结果为非正态分布数据,统计分析显示在麻疹疫苗刺激的实验组的TNF-α中位数为2021.81 pg/ml,对照组的中位数为1481.72 pg/ml,两组差异有统计学意义(P<0.05),提示PBMC在接受麻疹疫苗刺激后产生Th1细胞因子TNF-α明显增高;与对照组比较,中应答组、高应答组均明显增高,差异有统计学意义(P<0.05)(表1)。
2.6麻疹疫苗接种儿童IL-10检测结果
结果为非正态分布数据,统计分析显示在麻疹疫苗刺激的实验组的IL-10中位数为2566.93 pg/ml,明显高于对照组的1861.89 pg/ml(P<0.05),提示麻疹疫苗接种儿童的PBMC在接受麻疹疫苗刺激后产生的Th2细胞因子IL-10明显增高;与对照组比较,低应答组、中应答组、高应答组均明显增高,差异有统计学意义(P<0.05)(表2)。
表2 流式CBA法检测培养液IL-10结果(pg/ml,中位数)
与对照组比较,aP<0.05
3讨论
麻疹病毒属副黏病毒科,为单股负链RNA病毒。麻疹病毒感染后,机体内细胞及体液免疫均可参与免疫应答,从而使得炎症因子水平异常升高。此外,因麻疹病毒为细胞内感染,在清除病毒方面,细胞免疫起重要作用。人免疫系统存在免疫记忆,免疫记忆是免疫接种策略研究的基础[7]。麻疹疫苗为减毒活疫苗,接种后适应性体液免疫应答主要由B淋巴细胞所介导,B细胞接受抗原刺激后,在Th细胞的辅助下,可在出现活化、增殖的同时产生浆细胞分泌特异性抗体或分化成为记忆性B细胞。在抗原清除后,由于存在免疫记忆,体内仍会持续维持麻疹保护性抗体分泌[8-9],故通过检测抗体可评估其免疫效果。本实验抗体检测结果阳性率为81.4%,阳性率较高,这与刘东磊等[10-11]的研究结果近似,而Knuf等[12]报导麻疹疫苗接种3年后的抗体阳性率达98.5%,甚至Davidkin等[13]随访麻疹疫苗接种20年后抗体阳性率仍达95%,提示接种麻疹疫苗后远期仍有较高的保护性抗体水平。本研究根据研究对象未次接种麻疹疫苗后年份的不同进行分析,也未发现抗体水平会随接种后时间的推移而出现下降。同时观察到多次接种与单次接种的儿童健康志愿者间血清抗体水平并无明显差异,说明麻疹疫苗多次接种可能并不能提升接种者体内麻疹抗体水平。
麻疹疫苗接种后细胞免疫主要由T淋巴细胞介导,T细胞通过细胞膜表面的T细胞受体(TCR)特异性识别抗原,通过信号转导活化、增殖并分化成为效应性T细胞或记忆性T细胞[14]。记忆性T细胞可分为效应型记忆性T细胞(TEM)和中央型记忆T细胞(TCM)。其中前者的细胞毒潜力较高,一旦接收到抗原的刺激,将会迅速合成效应分子;而后者细胞毒潜力较低,但是增殖潜力较高,一旦接触到同种抗原,将会在短时间内大量增殖,并且在产生效应细胞的同时分泌具有多种生物学功能的效应因子[15]。研究显示[16],CD8+T细胞能清除细胞内感染的病原,并且还可以对感染的细胞产生直接杀伤作用,也可通过释放细胞因子达到理想的杀伤感染细胞的效果,进而阻断麻疹病毒复制和增殖。但是该细胞的产生及其功能的维持往往需要CD8+T细胞的辅助,而二者均受控于调节性T细胞。CD4+T细胞在细胞免疫应答中是重要的效应细胞[17-18],CD4+T细胞中Th1和Th2细胞两个功能亚群分泌的细胞因子不同,Th1细胞可分泌多种与迟发型超敏反应T细胞及TCL细胞成熟、增殖和分化相关的细胞因子,如IFN-γ和TNF-α等。由此可知,介导细胞免疫应答是此类细胞的主要生理学功能,能够发挥重要的抵抗细胞內病原体感染的作用。另有研究显示[19-20],Th2细胞可分泌与B细胞成熟、增殖和分化等密切相关的细胞因子,进而促使生成抗体,介导并提高体液免疫应答反应。本研究检测Th1细胞因子TNF-α及Th2细胞因子IL-10时,发现实验组明显较对照组增高,表明麻疹疫苗的刺激使机体迅速产生效应因子,提示机体内存在免疫记忆。TNF-α在抗病毒方面扮演着重要的角色,通过与靶细胞TNF受体结合,干扰病毒复制和诱导细胞凋亡[21-22],IL-10具有多种免疫功能,它在病毒等感染过程中主要行使免疫调节功能[23],它可以同时抑制Th1和Th2细胞产生多种因子,对CD4+T细胞的增殖及具有多种生物学功能和效应的细胞因子的合成也有不同程度的抑制作用。此外,IL-10对淋巴细胞中增殖也有一定的抑制作用[24]。本研究中实验组IL-10明显增高,提示Th2也明显活化、增殖并分化效应性T细胞,对Th1细胞相关的因子的分泌产生调节和抑制作用,以免机体发生过度炎症反应甚至造成组织细胞过度损伤。另一方面,该物质还可对B细胞增殖转化产生促进作用,促使B细胞分化为浆细胞,从而能够保证合成和分泌更多的抗体,充分发挥其保护性作用。Th1/Th2细胞因子的高分泌从因子水平上表明麻疹疫苗接种的高效性,提示麻疹疫苗接种能促使机体产生对于麻疹病毒的免疫记忆。最后,高应答组的抗体分泌水平远远高于低应答组和中应答组,证实在麻疹疫苗接种的儿童机体中抗体水平高者再次接触抗原后,能够更为迅速地产生能力更强的效应因子。
综上所述,麻疹疫苗接种后的高保护性抗体阳性率以及疫苗刺激后Th1/Th2细胞因子分泌表明免疫记忆状态。尽管我国麻疹疫苗接种主要实行计划免疫,但是仍然存在较多没有接种麻疹疫苗的儿童。为早日实现WHO确立的目标(至2020年消除麻疹)[4],应该强化免疫,保证全面覆盖。目前仍存在麻疹疫苗接种后再感染的情况,甚至有成人感染的现象,推测其中原因可能为接种后部分人群因免疫力比较低;也可能与有些个体的遗传易感性有关或者可能存在对当前麻疹疫苗无反应的基因,这个课题也是值得我们深入研究的方向。
[参考文献]
[1]WHO.Progress in reducing global measles death:1999-2004[J].Wkly Epidemiolo Rec,2006,81:90-94.
[2]卫生部.卫生部关于印发《2006-2012年全国消除麻疹行动计划》的通知[P].中华人民共和国卫生部公报,2006, 12:30-35.
[3]中华人民共和国国家卫生和计划生育委员会.2010-2015年度全国法定传染病疫情情况[EB/OL].http://www.nhfpc.gov.cn/zhuzhan/yqxx/lists.shtml
[4]Perry RT,Gacic-Dobo M,Dabbagh A,et al.Global control and regional elimination of measles,2000-2012[J].MMWR,2014,63(5):103-107.
[5]李夫国.枣庄市2005~2011年麻疹流行病学特征分析[J].现代预防医学,2013,40(14):2720-2722.
[6]Fill MM,Sweat D,Morrow H,et al.Measles Outbreak of Unknown Source-Shelby County,Tennessee,April-May 2016[J].MMWR,2016,65(38):1039-1040.
[7]吴长有.免疫记忆与疫苗研究开发[J].中国免疫学杂志,2005,21(1):4-7.
[8]戴萍.记忆性B细胞形成的分子机制[J].国外医学免疫学分册,2001,24(2):105-108.
[9]Tolar P,Sohn HW,Piece SK.Viewing the antigen-induced initiation of B-cell activation in living cells[J].Immunol Rev,2008,22(1):64-75.
[10]刘东磊,孙美平,卢莉,等.北京市≥15岁常住人口麻疹抗体水平研究[J].中国疫苗和免疫,2011,17(1):16-21.
[11]Lee MS,Nokes DJ,Wu YC,et al.Measles IgG seropreva-lence prior to mass vaccination in Taiwan[J].IJID,2002,6(1):42-47.
[12]Knuf M,Zepp F,Helm K,et al.Antibody persistence for 3 years following two doses of tetravalent measles-mumps-rubella-varicella vaccine in healthy children[J].Eur J Pediatr,2012,171(3):463-470.
[13]Davidkin I,Jokinen S,Broman M,et al.Persistence of measles,mumps,and rubella antibodies in an MMR-vaccinated cohort:a 20-year follow-up[J].J Infect Dis,2008,197(7):950-956.
[14]刘昀,吴长有.记忆性T细胞的形成、维持和功能[J].生命科学,2010,22(6):506-514.
[15]吴长有,刘杰.利用多种表面标志鉴别正常人外周血初始和记忆T细胞亚群[J].免疫学杂志,2006,22(2):120-128.
[16]Greyer M,Whitney PG,Stock AT,et al.T cell help amplifies innate signals in CD8+ DCs for optimal CD8+ T cell priming[J].Cell Rep,2016,14(3):132-142.
[17]Overwijk WW.Human CD4+ T cells spontaneously detect somatic mutations in cancer cells[J].Nat Med,2015,21(1):12-14.
[18]Dominguez-Villar M,Gautron AS,De MM,et al.TLR7 induces anergy in human CD4+ T cells[J].Nat Immunol,2015, 16(1):118-128.
[19]Woodland DL,Dutton RW.Heterogeneity of CD4+ and CD8+ T cells[J].CurrOpin Immunol,2003,15(3):336-342.
[20]Seder RA,Ahmed R.Similarities and differences in CD4+ and CD8+ effecter and memory T cell generation[J].Nat Immunol Rev,2003,4(9):835-842.
[21]Herbein G,O′Brien WA.Tumor Necrosis Factor(TNF)-α and TNF Receptors in Viral Pathogenesis[J].Exp Biol Med,2000,223(3):241-257.
[22]陸茜.李宁丽.Fas介导细胞凋亡及相关免疫调节作用[J].细胞生物学,2006,28(4):543-546.
[23]Couper KN,Blount DG,Riley EM.IL-10:the master regulator of immunity to infection[J].J Immunol,2008,180:5771-5777.
[24]陈富超,孙万邦,封建凯,等.重组IL-10在毕赤酵母菌X-33的表达及其活性鉴定[J].中国免疫学杂志,2011, 27(8):691-695.
(收稿日期:2017-02-08 本文编辑:任 念)

