芎芷地龙汤不同时间预防给药对偏头痛动物模型iNOS mRNA、c-fos mRNA表达的影响*
赵永烈王永丽胡 坤岳广欣王玉来
(1.北京中医药大学东方医院,北京 100078;2.北京中医药大学第三附属医院,北京 100029;3.中国中医科学院,北京 100053)
·研究报告·
芎芷地龙汤不同时间预防给药对偏头痛动物模型iNOS mRNA、c-fos mRNA表达的影响*
赵永烈1,2王永丽2胡 坤2岳广欣3王玉来1
(1.北京中医药大学东方医院,北京 100078;2.北京中医药大学第三附属医院,北京 100029;3.中国中医科学院,北京 100053)
目的 观察芎芷地龙汤不同时间预给药对偏头痛动物模型iNOS mRNA、c-fos mRNA表达的影响。方法 将健康雄性SD大鼠36只,随机分为0.9%氯化钠注射液组(6只)、模型组(6只)、舒马普坦组(6只)、中药1 d预给药组(6只),中药3 d预给药组(6只)、中药7 d预给药组(6只),按照预定给药,造模结束后2 h取材,real-time PCR法测定三叉神经节、三叉神经脊束核丘脑、硬脑膜c-fos mRNA、iNOS mRNA表达情况。结果 与0.9%氯化钠注射液组比较,模型组iNOS mRNA在三叉神经节、三叉神经脊束核、硬脑膜表达水平明显升高,在丘脑表达水平明显降低(P<0.01),给药干预后,三叉神经节、三叉神经脊束核、硬脑膜iNOS mRNA表达水平均降低,其中以预防给药7日组和舒马普坦组明显降低(P<0.01);丘脑iNOS mRNA表达水平有所升高,但各组与模型组差异均无统计学意义(P>0.05)。与0.9%氯化钠注射液组比较,模型组c-fos mRNA在三叉神经节、三叉神经脊束核表达水平明显升高,在丘脑、硬脑膜表达水平降低;给药干预后,c-fos mRNA在三叉神经节、三叉神经脊束核表达水平降低,以预防给药7 d组和舒马普坦组降低明显(P<0.05或P<0.01);c-fos mRNA在丘脑、硬脑膜表达水平升高,其中以预防给药7 d组和舒马普坦组升高幅度显著(P<0.05)。结论 芎芷地龙汤预防给药可以减少NTG诱发的三叉神经节、三叉神经脊束核c-fos mRNA、i-NOS mRNA表达,可以减少硬脑膜iNOS mRNA表达,而以预防给药7 d效果好于预防给药3 d、1 d。
偏头痛 芎芷地龙汤 预防给药 iNOS mRNA c-fosmRNA
偏头痛是一种反复发作的神经功能障碍性疾病,为具有多种神经系统和非神经系统表现的综合征。世界卫生组织把严重的偏头痛、瘫痪、精神障碍、痴呆列为最严重的慢性神经功能障碍性疾病。有关偏头痛的治疗根据其发作的过程,可分为发作期治疗和预防性治疗,对于患者本身来说,偏头痛的预防性治疗是十分重要的治疗方法。早在《黄帝内经》中就提出治未病的思想,如《素问·四气调神大论》所言“圣人不治已病治未病;不治已乱治未乱……夫病已成而后药之,乱已成而后治之,譬如渴而穿井,斗而铸锥,不亦晚乎”。因此对于偏头痛的预防性治疗的研究是我们应重点研究的问题。
前期我们观察了应用芎芷地龙汤1 d、3 d、7 d预防给药对偏头痛模型痛阈及血管活性物质的影响[1]。为进一步明确芎芷地龙汤对偏头痛的预防治疗机理,本实验拟研究芎芷地龙汤不同时间点预防给药后,三叉神经血管系统中三级神经元中iNOS;c-fos mRNA表达情况。现报告如下。
1 材料与方法
1.1 实验动物 清洁级成年雄性SD大鼠,体质量(200±20)g;由维通利华实验动物技术有限公司提供。动物许可证号:SCXK(京)2012-0001。
1.2 药剂与仪器 芎芷地龙汤(川芎、白芷、生石膏、地龙、延胡索)由北京中医药大学东方医院制剂室提取(每毫升含生药2.0 g);硝酸甘油注射液,5 mg/mL,北京益民药业有限公司生产;琥珀酸舒马普坦片,25 mg/片,海南先声药业有限公司生产;DEPC(焦碳酸二乙酯),购于北京欣经科生物技术有限公司;氯仿(三氯甲烷),购于北京化工厂;异丙醇,购于无锡县化学试剂厂;TRIZOL Reagent(Invitrogen);High Pure RNA Tissue Kit(Roche REF12033674001);Go Taq 2-Step RT-qPCRsystem(Promega A6010);Go TaqqPCR Master Mix(Promega A6002)。手持电动匀浆器(KONTES);高速低温离心机(SIGMA 3K15);分光光度计(Nano Vue plus);三用电子恒温水箱(SHH.W21北京中兴伟业器仪有限公司);恒温震荡金属浴(Bioer,MB-102);PCR仪(Bio-RAD CFX96 Real-Time System)。
1.3. 分组 SD大鼠随机分为6组:0.9%氯化钠注射液对照组(Saline)、偏头痛模型组(Migraine)、舒马普坦组(Sumatriptan)、芎芷地龙汤1 d预给药组(1 d XZDLT)、芎芷地龙汤3 d预给药组(3 d XZDLT)、芎芷地龙汤7 d预给药组(7 d XZDLT)。
1.4 造模及给药 Saline组:给予10 mL/kg 0.9%氯化钠注射液灌胃(1 d,3 d,7 d),普通饲养,灌胃30 min后颈背部皮下注射2 mL/kg 0.9%氯化钠注射液。Migraine组:给予10 mL/kg 0.9%氯化钠注射液灌胃,末次灌胃30 min后颈背部皮下注射10 mg/kg(5 mg/mL)硝酸甘油。芎芷地龙汤组:其他处理同偏头痛模型组,给予10.8 mL/kg芎芷地龙汤灌胃(1 d,3 d,7 d),末次灌胃30 min后颈背部皮下注射10 mg/kg(5 mg/mL)硝酸甘油。Sumatriptan组:其他处理同偏头痛模型组,给予琥珀酸舒马普坦6 mg/kg灌胃,灌胃30 min后颈背部皮下注射10 mg/kg(5 mg/mL)硝酸甘油。
1.5 取材 于实验结束后2 h,用2%戊巴比妥钠腹腔注射进行深度麻醉(40 mg/kg),迅速断头,在超净台内冰上取脑,分别剥离出丘脑,三叉神经节、三叉神经脊束核、硬脑膜分别放入1.5 mL灭菌的离心管中,埋入液氮中迅速冷冻,-70℃冰箱保存备用。
1.6 观察指标 检测各组iNOS和c-fos的mRNA表达,方法如下。1)总RNA的提取,按试剂盒(High Pure RNA Tissue Kit)说明书严格操作:盛有标本组织的离心管中各加400 μL Trizol裂解细胞,之后依次加入适量氯仿、异丙醇、75%的预冷乙醇、DEPC水,分别纯化、沉淀、洗涤、溶解总RNA。微量分光光度计测定RNA的浓度和纯度。根据A260的值计算RNA浓度(单位:μg/μL),并根据A260/A280比值计算其纯度,要求为1.8~2.0,比值低于1.6者弃去。2)逆转录反应(RT)步骤。按试剂盒说明书严格操作,20 μL反应体系,步骤如下,取1.5 mL离心管配制模板,加入RNA 11 μL,引物(Random Primer)1 μL,加入总RNA量1.1 μg;放入震荡型恒温金属浴,70℃,5 min,迅速转至冰上至少1 min;离心使液体收集于管底,加入5×Reaction buffer 4 μL,Mgcl225 mM 2 μL,PCR,Nucleotide Mix 10 mM 1 μL,RNase Inhibitor 0.5 μL,GoScrpt RT 0.5 μL;RNA引物混合液12 μL与逆转录混合液8 μL充分混合,放入震荡型恒温金属浴,25℃ 5 min,放入三用恒温电子水箱,42℃1 h,放入震荡型恒温金属浴,70℃15 min,冷却;立即PCR反应,放入-20℃冰箱保存。3)PCR引物设计。根据Genebank的序列和文献参考,设计c-fos、iNOS、GAPDH的引物序列。引物委托生工生物工程(上海)股份有限公司合成。引物序列如下。c-fos-F:5′-GGGAGCTGACAGATACGCTC-3′。c-fos-R:5′-TCAAGTCCAGGGAGGTCACA-3′。扩增长度:195 bp。iNOS-F:5′-AACCCAAGGTCTACGTTCAAG-3′,iNOS-R:5′-AAAGTGGTAGCCACATCCCG-3′。扩增长度:133 bp。GAPDH-F:5′-GTTACCAGGGCT GCCTTCTC-3′。GAPDH-R:5′-GATGGTGATGGGTTT CCCGT-3′。扩增长度:177 bp。4)实时荧光定量聚合酶链式反应(real-time PCR)。取等量的RT反应产物,分别扩增c-fos、iNOS、GAPDH基因。5倍稀释RT反应产物 cDNA:Nuclease-Free Water 40 μL,cDNA原液10 μL。real-time PCR体系:(20 μL反应体系):cDNA稀释液,4 μL,primer F(20 pmol/μL),0.5 μL,primer R(20 pmol/μL),0.5 μL,Mix,10 μL,加Nuclease-Free Water至20 μL;轻轻混匀,2000 r/min离心20 s后进行PCR扩增;在95℃30 s,95℃10 s,60℃30 s,15℃30 s下扩增共40个循环。反应结束后,读取每份样品中的相应目的基因的Ct值,减去GAPDH的Ct值,得出相对Ct值作为n值,再作1/2^n运算,得到每份样品中目的基因的相对表达量即 Qμantity(目的基因/ GAPDH),校正后得到每份样品中目的基因c-fos、iNOS的相对表达量。
1.7 统计学处理 应用SPSS19.0统计软件处理。计量资料以(±s)表示。采用单因素方差分析(ANOVA)进行统计处理,组间比较采用LSD-t检验。运用SigmaPlot 13.0绘制统计图。P<0.05为差异存在统计学意义的界限。
2 结 果
2.1 应用real-time PCR方法检测大各组大鼠鼠三叉神经节、三叉神经脊束核、丘脑、硬脑膜的iNOS mRNA的表达 见表1。注射硝酸甘油后Migraine组iNOS mRNA在三叉神经节、三叉神经脊束核、硬脑膜表达水平明显升高,在丘脑表达水平明显降低,与Saline组比较均有统计学意义(P<0.01),给药干预后三叉神经节、三叉神经脊束核、硬脑膜iNOS mRNA表达水平均降低,其中以预防给药7 d组和舒马普坦组降低明显(P<0.01);给药干预后,丘脑iNOS mRNA表达水平有所升高,但各组与Migraine组比较差异均无统计学意义(P>0.05)。
2.2 应用real-time PCR方法检测各组大鼠三叉神经节、三叉神经脊束核、丘脑、硬脑膜的c-fos mRNA的表达 见表2。注射硝酸甘油后Migraine组c-fos mRNA在三叉神经节、三叉神经脊束核表达水平明显升高,与Saline组比较 (P<0.01,三叉神经节),(P<0.05,三叉神经脊束核);在丘脑、硬脑膜表达水平降低,与Saline组比较(P<0.05,丘脑),(P<0.01,硬脑膜);给药干预后,c-fos mRNA在三叉神经节、三叉神经脊束核表达水平降低,以7 d XZSGT组和Sumatriptan组降低明显(P<0.01);给药干预后,c-fos mRNA在丘脑、硬脑膜表达水平升高,其中以7 d XZSGT组和Sumatriptan组升高水平有统计学意义(P<0.05)。
表1 各组大鼠不同组织中iNOS mRNA表达情况(±s)

表1 各组大鼠不同组织中iNOS mRNA表达情况(±s)
与Migraine组比较,*P<0.05,**P<0.01;与Saline组比较,△P<0.05,△△P<0.01。下同。
组别 n Saline 6 Migraine 6 1 d XZSGT 6三叉神经节 三叉颈复合体 丘脑 硬脑膜0.9167±0.06059**0.8267±0.06576**1.1067±0.04185**0.8917±0.07587**1.5433±0.14205△△1.3583±0.09148△△0.7383±0.04729△△1.3517±0.09810△△1.3750±0.12044△1.2167±0.10822△△0.9167±0.07706 1.1367±0.04417**3 d XZSGT 6 1.2333±0.10938 1.0450±0.08314**0.7433±0.34556 0.8733±0.03955**7 d XZSGT 6 1.0167±0.13478**0.5383±0.06789**△1.0617±0.07337 0.7200±0.14000**Sumatriptan 6 0.9583±0.13295**0.4483±0.02442**1.1383±0.09235 0.7050±0.10158**
表2 各组大鼠不同组织中c-fos mRNA表达情况(±s)
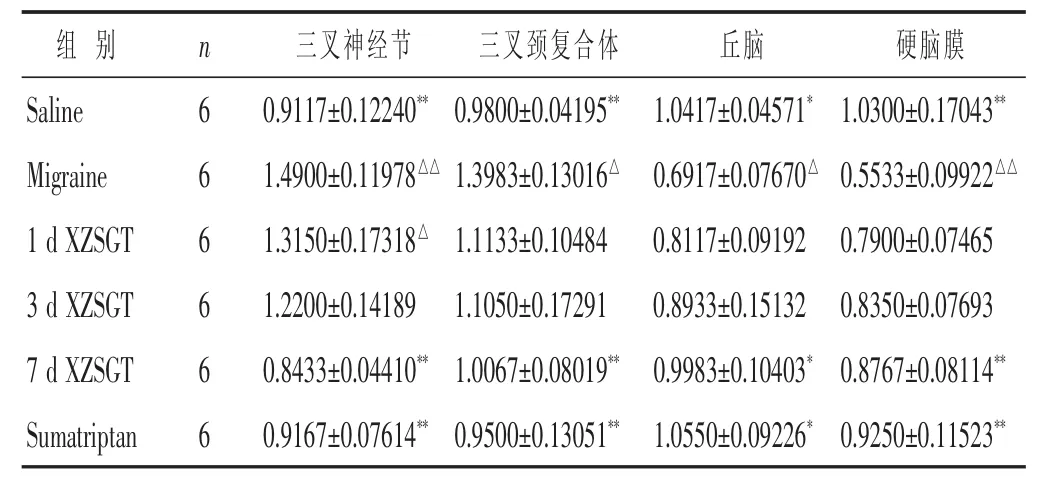
表2 各组大鼠不同组织中c-fos mRNA表达情况(±s)
组别 n Saline 6 Migraine 6 1 d XZSGT 6三叉神经节 三叉颈复合体 丘脑 硬脑膜0.9117±0.12240**0.9800±0.04195**1.0417±0.04571*1.0300±0.17043**1.4900±0.11978△△1.3983±0.13016△0.6917±0.07670△0.5533±0.09922△△1.3150±0.17318△1.1133±0.10484 0.8117±0.09192 0.7900±0.07465 3 d XZSGT 6 1.2200±0.14189 1.1050±0.17291 0.8933±0.15132 0.8350±0.07693 7 d XZSGT 6 0.8433±0.04410**1.0067±0.08019**0.9983±0.10403*0.8767±0.08114**Sumatriptan 6 0.9167±0.07614**0.9500±0.13051**1.0550±0.09226*0.9250±0.11523**
3 讨 论
偏头痛的病理生理机制复杂,近年研究认为,偏头痛发生相关的解剖结构是三叉神经血管系[2-4]。三叉神经血管系统包括三级神经元:一级神经元是接受源自硬脑膜血管传入冲动的三叉神经节(TG),它将冲动继续传至二级神经元——三叉神经尾核(TNC)及Cl,C2节段的脊髓后角表浅层,两者共同构成三叉颈复合体(TCC)。二级神经元再将冲动传导至丘脑的三级神经元。因此研究三叉神经血管系统中三级神经元的激活状态在偏头痛发病的研究中具有重要的意义。
NO被认为是在偏头痛发病过程中起至关重要作用的一种活性分子,它既可以通过扩张硬脑膜等部位的血管激活三叉神经血管系统,又可以作为信号转导分子传导痛觉,还可以促使脑干中的TNC神经元出现痛觉过敏[5]。同时,一些研究者证实给予偏头痛患者NO合酶(NOS)抑制剂可缓解偏头痛的发作[6]。NO体内供体包括钙/钙调蛋白依赖的结构型NOS(eNOS,nNOS)以及不依赖Ca的诱导型NOS(iNOS)[7-8],iNOS只有当受到一定程度的刺激时才发挥作用,也是内源性NO的主要来源。在体内NO释放可扩张脑膜血管[9]并激活神经元[10],进而增加痛觉的传导,导致中枢敏化[11-12]。NO信号传导激活可溶性鸟苷环化酶(sGC)产生环鸟苷酸(cGMP),进而引起蛋白激酶的磷酸化。而蛋白激酶是重要的细胞内信号传导分子,是作为第二信使通路与c-fos(即早基因蛋白表达)偶联,被广泛应用作为神经元和痛觉激活的标志,在调节疼痛中发挥着重要的作用[13]。c-fos蛋白的表达已被广泛用于识别神经元激活区域,并研究伤害性刺激与神经的相关性[14],三叉神经脊束核尾侧亚核(TNC)c-fos蛋白表达的增加,可以作为三叉神经血管系统激活的标志[15]。最近相关研究报道,由硝酸甘油诱发的小鼠偏头痛模型表现为对热和机械刺激敏化[16-17],同时三叉神经脊束核尾侧亚核c-fos达增加[16,18]。
本实验研究观察到,注射硝酸甘油后,c-fos mRNA在三叉神经节、三叉神经脊束核表达水平明显升高,与既往研究结果相一致[19-21];给药干预后,c-fos mRNA在三叉神经节、三叉神经脊束核表达水平降低,以7 d XZSGT组和Sumatriptan组降低明显。注射硝酸甘油后iNOS mRNA在三叉神经节、三叉神经脊束核、硬脑膜表达水平明显升高,与既往研究结果[21-22]及相关研究相一致[23-24],给药干预后三叉神经节、三叉神经脊束核、硬脑膜iNOS mRNA表达水平均降低,其中以预7 d XZSGT组和Sumatriptan组降低明显。而在丘脑,c-fos mRNA和iNOS mRNA的表达与三叉神经节、三叉神经脊束核中表达不一致,可能与丘脑复杂的功能有关,因丘脑是感觉传导的接替站,偏头痛反复发作的过程中,头痛的感觉传导通路需要更为频繁地通过丘脑完成中继,并投射到大脑皮层中,丘脑在偏头痛患者的疼痛处理中的重要性反映在复杂网络的拓扑结构上就是较大的介数中心度[25],可能在偏头痛复杂感觉传递过程中,丘脑起着调节作用。
综上所述,芎芷地龙汤预防给药可以减少NTG诱发的三叉神经节、三叉神经脊束核c-fos mRNA、iNOS mRNA表达,可以减少硬脑膜iNOS mRNA表达,而以预防给药7 d效果好于预防给药3 d、1 d。
[1] 赵永烈,刘金民,岳广欣,等.芎芷地龙汤不同时间预防给药对偏头痛动物模型痛阈及血管活性物质的影响[J].中医药学报,2016,44(5):28-35.
[2] Messlinger K.Migraine:where and how does the pain originate[J].Exp Brain Res,2009,196(1):179-193.
[3] Pietrobon D,Striessnig J.Neurobiology of migraine[J].Nat Rev Neurosci,2003,4(5):386-398.
[4] Bolay H,Reuter U,Dunn AK,et al.Intrinsic brain activity triggers trigeminal meningeal afferents in a migraine model[J]. Nat Med,2002,8(2):136-142.
[5] Neeb L,Reuter U.Nitric oxide in migraine[J].CNS Neurol Disord Drug Targets,2007,6(18):258-264.
[6] Lassen L,Ashina M,Christiansen I,et al.Nitric oxide synthase inhibition in migraine[J].Lancet,1997,349(8):401-402.
[7] Alderton WK,Cooper CE,Knowles RG.Nitric oxide synthases:Structure,function and inhibition[J].Biochem,2001,357(4):593-615.
[8] KnowlesRG,MoncadaS.Nitricoxidesynthasesinmammals[J]. Biochem,1994,298(2):249-258.
[9] Toda N,Ayajiki K,Okamura T.Cerebral blood flow regulation by nitric oxide:recent advances[J].Pharmacol Rev,2009,61(1):62-97.
[10]Prast H,Philippu A.Nitric oxide as modulators of neuronal function[J].Prog Neurobiol,2001,64:51-68.
[11]Luo ZD,Cizkova D.The role of nitric oxide in nociception[J]. Curr Rev Pain,2000,4(6):459-466.
[12]Wu J,Fang L,Lin Q,et al.Nitric oxide synthase in spinal cord central sensitization following intradermal injection of capsaicin[J].Pain,2001,94(1):47-58.
[13]Velazquez KT,Mohammad H,Sweitzer SM.Protein kinase C in pain:involvement of multiple isoforms[J].Pharmacol Res,2007,55(6):578-589.
[14]Harris JA.Using c-fos as a neural marker of pain[J].Brain Res Bull,1998,45:1-8.
[15]Ramachandran R,Bhatt DK,Ploug KB,et al.A naturalistic glyceryl trinitrate infusion migraine model in the rat[J]. Cephalalgia,2012,32:73-84.
[16]Goloncser F,Sperlagh B.Effect of genetic deletion and pharmacological antagonism of P2X7 receptors in a mouse animal model of migraine[J].J Headache Pain,2014,15:24.
[17]Pradhan AA,Smith ML,McGuire B,et al.Characterization of a novel model of chronic migraine[J].Pain,155(2):269-274.
[18]Markovics A,Kormos V,Gaszner B,et al.Pituitary adenylate cyclase-activating polypeptide plays a key role in nitroglycerolinduced trigeminovascular activation in mice[J].Neurobiology of Disease,2012,45(1):633-644.
[19]赵永烈,王玉来,高颖,等.芎芷地龙汤对偏头痛模型大鼠脑组织痛觉传导通路c-fos和5-HT蛋白表达的影响[J].中医杂志,2011,52(10):868-870.
[20]赵永烈,王玉来,高颖.芎芷地龙汤对偏头痛模型三叉神经脊束核c-fos和β-EP蛋白共存表达的影响[J].光明中医,2010,25(2):213-215.
[21]赵永烈,王玉来,高颖.芎芷地龙汤对偏头痛模型三叉神经脊束核c-fos和NOS蛋白共存表达的影响[J].世界科学技术-中医药现代化,2009,11(4):551-554.
[22]赵永烈,王玉来,姚卓亭,等.芎芷地龙汤对偏头痛风热证Glu-NMDAR-nNOS通路的影响[J].中华中医药学刊,2015,33(5):1221-1223.
[23]Dieterle A,Fischer MJ,Link AS,et al.Increase in CGRP-and nNOS-immunoreactive neurons in the rat trigeminal ganglion after infusion of an NO donor[J].Cephalalgia,2011,31:31-42.
[24]Pardutz A,Krizbai I,Multon S,et al.Systemic nitroglycerin increases nNOS levels in rat trigeminal nucleus caudalis[J]. Neuroreport,2000,11:3071-3075.
[25]陈敦耀,杨嘉君,曾卫明,等.基于复杂网络的偏头痛患者脑功能连通性研究[J].中国医学影像学杂志,2015,23(6):418-422.
Effect of Xiongzhi Dilong Decoction Preadministration at Different Time on iNOS mRNA,c-fos mRNA Expression in Migraine Animal
ZHAO Yonglie,WANG Yongli,HU Kun,et al. Dongfang Hospital,BeijingUniversity of Traditional Chinese Medicine,Beijing 100078,China.
Objective:To study the effect of Xiongzhi Dilong decoction preadministration at different time on i-NOS mRNA,c-fos mRNA expression in migraine animal.Methods:36 healthy male SD rats were randomly divided into six groups:saline group(n=6),migraine model group(n=6),sumatriptan group(n=6),1 day preadministration group(n=6),3 day preadministration group(n=6),7 day preadministration group(n=6).The drug was administered according to different groups,tissues were collected after subcutaneous injection of corresponding drug given 2h later.The c-fos mRNA,iNOS mRNA expression in trigeminal ganglion,spinal trigeminal nucleus,thalamus,dura mater was assayed by real-time PCR method.Results:Compared with saline group,the iNOS mRNA expression in trigeminal ganglion,spinal trigeminal nucleus,dura mater increased significantly,and the iNOS mRNA expression in thalamus decreased significantly in the model group(P<0.01);after the drug intervention,the iNOS mRNA expression in trigeminal ganglion,spinal trigeminal nucleus,dura mater was decreased,and the preadministration of 7days group and sumatriptan group decreased significantly(P<0.01).The iNOS mRNA expression in thalamus was increased,but there were no statistical significance compared with the model group(P>0.05).Compared with saline group,the c-fos mRNA expression increased significantly in trigeminal ganglion(P<0.01),and spinal trigeminal nucleus(P<0.05),and the c-fos mRNA expression decreased significantly in thalamus(P<0.05)and dura mater(P<0.01);after the drug intervention,the c-fos mRNA expression in trigeminal ganglion,spinal trigeminal nucleus was decreased,and the preadministration of 7days group and sumatriptan group decreased significantly(P<0.01).The c-fos mRNA expression in thalamus and dura mater was increased,and theresults in the preadministration of 7days group and sumatriptan group were statistically significant(P<0.05). Conclusion:Preadministration of Xiongzhi Dilong decoction can reduce the c-fos mRNA,iNOS mRNA expression in trigeminal ganglion,spinal trigeminal nucleus which were induced by NTG,and can reduce the iNOS mRNA expression in dura mater.The prevention of preadministration of 7 days is better than the prevention of preadministration of 3 days and 1 day.
Migraine animal model;Xiongzhi Dilong decoction;Preadministration;iNOS mRNA;c-fos mRNA
R285.5
A
1004-745X(2017)04-0568-04
10.3969/j.issn.1004-745X.2017.04.002
2016-12-29)
国家自然科学基金资助项目(81373591)

