阻断胃泌素受体对胃癌细胞增殖和凋亡及其信号通路的影响*
袁 航,汪 闯,王琴容,赵 艳,李雅洁,龙妮娅,周建奖
(贵州医科大学分子生物重点实验室/地方病与少数民族疾病教育部重点实验室,贵阳 550004)
阻断胃泌素受体对胃癌细胞增殖和凋亡及其信号通路的影响*
袁 航,汪 闯,王琴容,赵 艳,李雅洁,龙妮娅,周建奖△
(贵州医科大学分子生物重点实验室/地方病与少数民族疾病教育部重点实验室,贵阳 550004)
目的 探讨阻断胃泌素受体对胃癌细胞增殖、凋亡及其相关通路中关键蛋白表达的影响。方法 试验组使用终浓度为5 mmol/L的丙谷胺(胃泌素受体阻断剂)处理胃癌细胞SGC-7901和AGS 6 d,以不加丙谷胺培养的胃癌细胞SGC-7901和AGS为对照组。四甲基偶氮唑蓝比色(MTT)法检测各组细胞的生长并绘制细胞生长曲线;流式细胞术检测各组细胞的细胞周期,Annexin V-FITC/PI 双染法检测各组细胞的凋亡;实时荧光定量PCR(RT-qPCR)方法检测典型Wnt/β-catenin通路、核因子κB、磷脂酰肌醇3激酶-丝氨酸-哺乳动物雷帕霉素靶蛋白中关键蛋白β-连环蛋白(β-catenin)、核转录因子RelA、哺乳动物雷帕霉素靶蛋白、糖原合酶激酶3β mRNAs的表达;免疫蛋白印迹检测β-catenin蛋白质的表达。结果 用丙谷胺处理后,试验组细胞的生长速度低于对照组细胞,细胞周期中S期细胞百分数也低于对照组细胞,而G0/G1期细胞百分数高于对照组细胞(P<0.05);试验组的细胞凋亡数高于对照组(P<0.05); RT-qPCR结果显示:丙谷胺处理后,胃癌细胞中β-catenin的 mRNA表达量降低(P<0.05)。Western blot结果显示丙谷胺处理后,β-catenin蛋白质的表达量降低(P<0.05)。结论 阻断胃泌素受体能下调胃癌细胞中β-catenin的表达,抑制细胞增殖,同时促进细胞凋亡。
胃肿瘤;胃泌素类;细胞凋亡;细胞增殖;丙谷胺;β-catenin
胃泌素是一种由胃窦部的G细胞合成分泌的肽类激素,胃泌素受体主要是胆囊收缩素-B(cholecystokinin-B receptor,CCK-B)受体,通常表达在胃肠道细胞的细胞膜上[1]。 已有证据表明,幽门螺旋杆菌(HP)感染会引起高胃泌素血症[2-3],本课题组前期研究也表明HP感染会上调胃泌素基因mRNA的表达水平[4],而HP感染作为胃癌高发的生物因素,已经得到公认,因此胃泌素可能与胃癌的发生、发展密切相关。本课题组前期的体外研究也发现,胃泌素及其受体在胃癌细胞株AGS、SGC-7901均有表达,用商品化胃泌素处理细胞后,两种细胞的增殖、迁移、侵袭能力增强[5-6]。丙谷胺具有跟胃泌素相似的结构,能够与胃泌素竞争结合胃泌素受体,是胃泌素受体的阻断剂[7]。为了探究阻断胃泌素受体对胃癌细胞的作用及其可能的信号通路,本研究用丙谷胺处理胃癌细胞株SGC-7901和AGS,检测细胞的增殖、凋亡及相关信号通路中几个关键基因的表达,包括Wnt、核因子kappa B(NF-κB)、磷脂酰肌醇3激酶-丝氨酸-哺乳动物雷帕霉素靶蛋白(PI3K-AKT-MTOR)信号通路中关键蛋白β-连环蛋白(β-catenin)、核转录因子(Rel A P65)、MTOR、糖原合酶激酶-3β(GSK-3β),寻找胃泌素的作用途径及胃癌可能的治疗靶点。
1 材料与方法
1.1 材料 人胃癌细胞株 SGC-7901和AGS购于中国科学院上海细胞库,由本实验室保存。RPMI-1640培养基、胎牛血清、胰蛋白酶(Gibco,美国),丙谷胺(国家食品药品检定研究所),青链霉素(Hyclone,美国),细胞总RNA提取试剂盒、逆转录试剂盒(Tiangen,中国),四甲基偶氮唑蓝比色(MTT)试剂盒、Western blot相关试剂、蛋白提取试剂盒(碧云天,中国),琼脂糖(Sigma,美国),八连管(ABI,美国),SYBER Green (ABI,美国),细胞周期检测试剂盒、Annexin V-FITC/PI细胞凋亡试剂盒(BD,美国),二喹啉甲酸 (BCA)蛋白定量试剂盒(Thermo,美国),β-catenin一抗、羊抗兔二抗(Proteintech,美国)。
1.2 方法
1.2.1 胃癌细胞株SGC-7901和AGS的培养 用含5%胎牛血清、1%双抗的RPMI 1640培养基,于5%CO2、37 ℃条件下培养,待细胞贴壁生长达80%以上融合度时进行传代,备用。
1.2.2 MTT试验 取对数生长期的两种细胞以2×103/孔接种于96孔板,试验组加入含5 mmol/L丙谷胺的RPMI 1640完全培养基200 μL,对照组用RPMI 1640完全培养基,每组设5个复孔,37 ℃,5%CO2培养24 h后弃去培养液,每孔加20 μL MTT 液。孵育4 h后,去上清液,加入DMSO每孔150 μL,振荡器振荡10 min,于酶标仪490 nm波长处测各孔吸光度(A)值,连续检测7 d后绘制细胞的生长曲线。
1.2.3 流式细胞仪检测细胞周期和凋亡 试验组与对照组细胞于5%CO2、37 ℃恒温培养,3 d后换液,继续培养3 d,弃培养基后PBS洗3次,加入胰酶消化收集细胞,流式细胞仪检测细胞周期与凋亡,按试剂说明书操作。试验重复3次。
1.2.4 RT-qPCR检测各信号通路中关键基因mRNA的表达 取各组细胞,按试剂盒步骤提取总RNA,去除gDNA。反应体系如下:5×gDNA Buffer 2.0 μL,总RNA 2 μg,RNase-Free ddH2O补足10.0 μL,37 ℃ 孵育30 min。随后用Oligo dt逆转成cDNA。体系为 MIX 10.0 μL,上、下游引物各0.5 μL,cDNA模板2.0 μL,去离子水补足至20.0 μL。反应条件为94 ℃预变性2 min;94 ℃变性30 s,60 ℃延伸30 s,共40个循环。收集各基因的荧光信号,以β-action为内参基因,SDS 1.4软件计算试验组细胞中各靶基因的相对表达量。用融解曲线监测各样本PCR反应的特异性,相对标准曲线计算PCR反应的扩增效率,试验重复3次,每次3个复孔。计算公式:△Ct=待测基因Ct值-β-actin Ct值,△△Ct=试验组△Ct-对照组△Ct,相对表达量=2-ΔΔCt。qPCR引物序列见表1。
1.2.5 Western blot 检测β-catenin蛋白质的表达 取试验组及对照组细胞,提取总蛋白,BCA蛋白定量试剂盒定量后,取20 μg总蛋白上样,10%十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳3.0 h后转膜封闭,兔抗β-catenin多克隆抗体(1∶1 500)4 ℃孵育过夜,加入山羊抗兔二抗(1∶5 000稀释)及HRP-β-actin(1∶10 000)孵育1 h后暗室胶片曝光。用Image J软件处理条带并读取灰度值,试验重复3次。
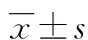
2 结 果
2.1 阻断胃泌素受体对细胞生长的影响 丙谷胺处理细胞后,试验组SGC-7901、AGS细胞在培养第4天时A值低于对照组细胞(P<0.05),培养第7天时两组差异最大,见图1。

表1 qPCR引物序列
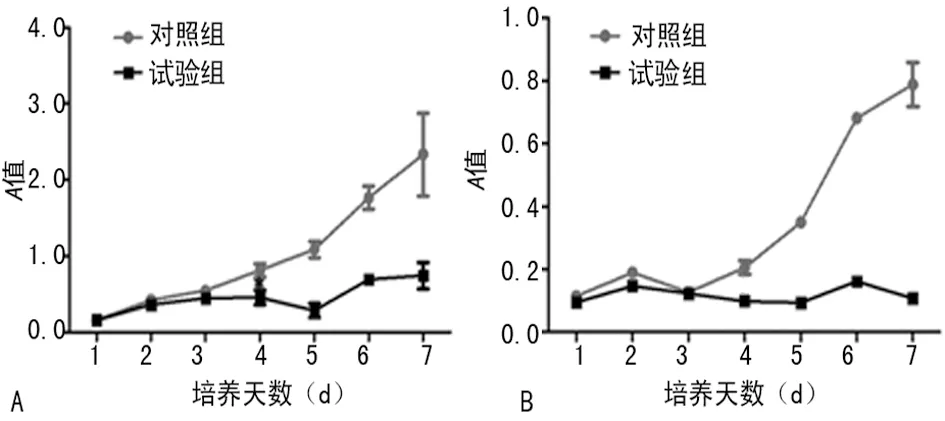
A:SGC-7901;B:AGS。
图1 SGC-7901(A)和AGS(B)的细胞生长曲线
2.2 阻断胃泌素受体对细胞周期的影响 丙谷胺处理6 d后,试验组细胞的S期细胞百分数明显低于对照组细胞,G0/G1期的细胞百分数明显高于对照组细胞,比较差异均有统计学意义(P<0.05),见图2。
2.3 阻断胃泌素受体对细胞凋亡的影响 丙谷胺处理细胞6 d后,流式细胞仪检测各组细胞凋亡,结果显示试验组的凋亡细胞数均高于对照组细胞,比较差异有统计学意义(P<0.05),见图3。
2.4 阻断胃泌素受体对信号蛋白β-catenin、P65、MTOR、GSK-3β mRNA表达的影响 试验组与对照组细胞的总RNA,A260/A280比值为1.8~2.0,经1%琼脂糖凝胶电泳检测, RNA 28 s与18 s 的比例为1.5~2.0,提示RNA质量较好。RT-qPCR检测结果显示各基因的溶解曲线均为单峰,各基因的扩增特异性较好。 丙谷胺处理后,试验组的β-catenin mRNA的表达量比对照组显著降低,比较差异有统计学意义(P<0.05),而其他基因的表达比较差异无统计学意义(P>0.05),见图4。
2.5 阻断胃泌素受体对β-catenin蛋白表达的影响 丙谷胺处理细胞6 d后,试验组两种胃癌细胞中的β-catenin蛋白质表达较对照组明显下调,比较差异有统计学意义(P<0.05),见图5。

*:P<0.05,与对照组比较。
图2 流式细胞仪检测细胞周期结果

*:P<0.05,与对照组比较。
图3 流式细胞仪检测细胞凋亡结果

*:P<0.05,与对照组比较。
图4 信号通路中相关基因mRNA的表达

*:P<0.05,与对照组比较。
图5 丙谷胺处理对β-catenin蛋白表达的影响
3 讨 论
胃泌素促进胃癌细胞生长的作用在诸多研究中已经证实, Cao等[8]在结肠癌细胞的研究中也发现胃泌素有类似的作用,并且阐明是通过激活β-catenin/Tcf-4通路发挥作用。然而阻断胃泌素受体对胃癌细胞作用的潜在机制的报道较少。为了进一步探究丙谷胺对胃癌细胞株SGC-7901、AGS的作用,本研究根据前期结果用丙谷胺处理胃癌细胞,检测细胞的生长,细胞周期,细胞凋亡。与杨莹莹等[9]的结果相似,试验组细胞的增殖受到抑制。细胞周期检测结果提示阻断胃泌素受体可能阻止细胞从G1期进入S 期,从而抑制细胞增殖。流式细胞仪检测的结果还显示,试验组的凋亡细胞数增加,提示阻断胃泌素受体不仅能抑制胃癌细胞的增殖,还能促进胃癌细胞的凋亡,这些结果与国内外的相关研究结果一致[10-11]。
为了探讨丙谷胺的作用机制,本研究用定量PCR技术筛查了与细胞增殖、凋亡相关信号通路中几个关键蛋白的mRNA表达,包括Wnt、NF-κB、PI3K-AKT-MTOR信号通路中关键蛋白β-catenin、P65、MTOR及GSK-3β,结果仅有β-catenin mRNA的表达水平在处理的2株细胞中一致性的明显降低,随后用Western blot证实β-catenin蛋白表达量在丙谷胺处理后也一致性的明显降低。β-catenin的功能主要体现在2个方面:(1)与E-cadherin组成复合物参与细胞间的黏附[12];(2)作为经典Wnt信号通路中的关键蛋白参与通路的激活[13]。在肿瘤细胞中,当Wnt蛋白与受体结合后,会抑制此β-catenin降解复合物的形成,使β-catenin在胞内聚集进而转移至核内与转录因子Tcf/Lef-1 结合,引起c-Myc、Cyclin-D1、survivin等转录,引起肿瘤的发生[14-16]。同时也会调节众多上皮间质转移(EMT)相关蛋白如MMP7、Snail、Twist等表达,诱导EMT的发生[17]。研究发现,β-catenin在胃癌组织高表达,同时与胃癌恶性程度正相关,并且随着浸润深度的增加而增加,推测可能是E-cadherin与β-catenin的复合物中E-cadherin的丢失使得癌细胞黏附减弱,易于脱落,促进了肿瘤的浸润和转移[18]。同时,β-catenin从膜E-cadherin的结合部位分离,会更多地在胞内聚集,从而激活Wnt信号通路,使肿瘤进展。因此,有诸多学者认为β-catenin的异常表达可能作为胃癌进展的一个生物学指标[19]。
在体外试验中,潘安萍等[20]用慢病毒载体沉默胃癌细胞中β-catenin蛋白的表达,结果发现沉默β-catenin后能够减慢细胞增殖,促进细胞凋亡,使众多癌基因的表达下调。结合本研究,推测丙谷胺阻断胃泌素受体后,可能通过下调β-catenin的表达,抑制Wnt信号通路,进而抑制胃癌细胞的增殖,促进胃癌细胞的凋亡,提示β-catenin有可能成为胃癌治疗的靶点之一,但是具体机制有待进一步的研究。
[1]Schmitz F,Goke MN,Otte JM,et al.Cellular expression of CCK-A and CCK-B/gastrin receptors in human gastric mucosa[J].Regul Pept,2001,102(2/3):101-110.
[2]Tucker TL.Inducible regulation of gastrin gene expression during helicobacter pylori infection[D].Michigan:University of Michi-gan,2009.
[3]Chuang CH,Sheu BS,Yang HB,et al.Hypergastrinemia after Helicobacter pylori infection is associated with bacterial load and related inflammation of the oxyntic corpus mucosa[J].J Gastroenterol Hepatol,2004,19(9):988-993.
[4]Zhou J,Xie Y,Zhao Y,et al.Human gastrin mRNA expression up-regulated by Helicobacter pylori CagA through MEK/ERK and JAK2-signaling pathways in gastric cancer cells[J].Gastric Cancer,2011,14(4):322-331.
[5]刘骏,周建奖,谢渊,等.过表达胃泌素促进胃癌细胞的增殖、迁移和侵袭[J].中国生物化学与分子生物学报,2013,29(4):354-360.
[6]刘骏,周建奖,赵艳,等.胃泌素促进胃癌细胞的迁移和侵袭[J].中国病理生理杂志,2013,29(4):730-733.
[7]Gonzalez-Puga C,Garcia-Navarro A,Escames G,et al.Selective CCK-A but not CCK-B receptor antagonists inhibit HT-29 cell proliferation:synergism with pharmacological levels of melatonin[J].J Pineal Res,2005,39(3):243-250.
[8]Cao J,Yu JP,Liu CH,et al.Effects of gastrin 17 on β-catenin/Tcf-4 pathway in Colo320WT colon cancer cells[J].World J Gastroenterol,2006,12(46):7482-7487.
[9]杨莹莹,吴会超,穆媛媛,等.胃泌素及其受体拮抗剂对人胃癌细胞株MKN45增殖及TFF1、TFF3表达的影响[J].肿瘤防治研究,2014,41(6):545-548.
[10]Mao JD,Wu P,Huang JX,et al.Role of ERK-MAPK signaling pathway in pentagastrin-regulated growth of large intestinal carcinoma[J].World J Gastroenterol,2014,20(35):12542-12550.
[11]Kovac S,Xiao L,Shulkes A,et al.Gastrin increases its own synthesis in gastrointestinal cancer cells via the CCK2 receptor[J].FEBS Lett,2010,584(21):4413-4418.
[12]Brembeck FH,Rosario M,Birchmeier W.Balancing cell adhesion and Wnt signaling,the key role of beta-catenin[J].Curr Opin Genet Dev,2006,16(1):51-59.
[13]Tan RJ,Zhou D,Zhou L,et al.Wnt/beta-catenin signaling and kidney fibrosis[J].Kidney Int Suppl,2014,4(1):84-90.
[14]Salisbury TB,Binder AK,Grammer JC,et al.GnRH-regulated expression of Jun and JUN target genes in gonadotropes requires a functional interaction between TCF/LEF family members and beta-catenin[J].Mol Endocrinol,2009,23(3):402-411.
[15]Manachai N,Saito Y,Nakahata S,et al.Activation of EVI1 transcription by the LEF1/beta-catenin complex with p53-alteration in myeloid blast crisis of chronic myeloid leukemia[J].Biochem Biophys Res Commun,2017,482(4):994-1000.
[16]Cheng XJ,Lin JC,Ding YF,et al.Survivin inhibitor YM155 suppresses gastric cancer xenograft growth in mice without affecting normal tissues[J].Oncotarget,2016,7(6):7096-7109.
[17]Lv YF,Dai H,Yan GN,et al.Downregulation of tumor suppressing STF cDNA 3 promotes epithelial-mesenchymal transition and tumor metastasis of osteosarcoma by the Wnt/GSK-3beta/beta-catenin/Snail signaling pathway[J].Cancer Lett,2016,373(2):164-173.
[18]董理.Wnt信号通路中心调控分子β-catenin在胃癌中的表达及其意义[D].南昌:南昌大学医学院,2014.
[19]刘映辉,所剑,李寿柏,等.β-catenin和核因子-κB表达与胃癌的相关性研究[J].中国老年学杂志,2007,27(20):1987-1989.
[20]潘安萍.沉默β-catenin表达对人胃癌细胞生物学行为的影响[D].南昌:南昌大学医学院,2014.
Influence of blocking gastrin receptor on the proliferation and apoptosis and expression of key proteins in related pathway of gastric cancer cell*
YuanHang,WangChuang,WangQinrong,ZhaoYan,LiYajie,LongNiya,ZhouJianjiang△
(KeyLaboratoryofMolecularBiologyofGuizhouMedicalUniversity/KeyLaboratoryofEndemicandMinorityDiseases,MinistryofEducationGuiyang,Guiyang,Guizhou550004,China)
Objective To investigate the effects of blocking gastrin receptor on the proliferation,apoptosis and expression of key proteins in the related pathway in gastric cancer cell lines.Methods In the experimental group,the gastric cancer cell lines SGC-7901 and AGS cells were treated with 5 mmol/L proglumide,a kind of a gastrin receptor antagonist.And the normal cultured gastric cancer cells SGC-7901 and AGS were used in control group.The growth of each group was detected by MTT assay;the cell growth curve was drawn by flow cytometry;the cell cycle of each group was detected by flow cytometry.Annexin V-FITC/PI double staining was used to detect the cell growth of apoptosis.The relative mRNA expression of β-catenin,nuclear factor-P65,mammalian target of rapamycin and glycogen synthase kinase 3 beta in Wnt,NF-κB and PI3K-AKT-MTOR pathways were detected by RT-qPCR.The expression of β-catenin protein was detected by Western blotting.Results After treatment with proglumide,the growth of the cells in the experimental group was lower than that in the control group;and the proportion of S phase cells in the cell cycle was also lower than that in the control group,but the proportion of cells in G0/G1phase was higher than that in the control group (P<0.05).The percentage of apoptotic cells was also increased after treatment with proglumide(P<0.05).Furthermore,proglumide treatment significantly reduced the expression of β-catenin at both mRNA and protein levels(P<0.05).Conclusion Blocking gastrin receptor can down-regulate the expression of β-catenin,inhibit the cell proliferation and promote the cell apoptosis in gastric cancer cells.
stomach neoplasms;gastrins;apoptosis;cell proliferation;proglumide;β-catenin
著·
10.3969/j.issn.1671-8348.2017.15.001
国家自然科学基金资助项目(81260303,31560326);贵州省科技合作计划项目(黔科合LH字[2015]7360)。 作者简介:袁航(1989-),住院医师,硕士,主要从事胃癌方面研究。△
,E-mail:jianjiangzhou@sina.cn。
R735.2
A
1671-8348(2017)15-2017-04
2016-11-18
2017-01-06)

