泛素特异性蛋白酶4对人增生性瘢痕成纤维细胞增殖的影响*
陈 燕,章 杰
(1.浙江大学医学院附属邵逸夫医院皮肤外科,杭州 310020;2.南昌大学第一附属医院口腔颌面整形外科,南昌 330006)
泛素特异性蛋白酶4对人增生性瘢痕成纤维细胞增殖的影响*
陈 燕1,章 杰2△
(1.浙江大学医学院附属邵逸夫医院皮肤外科,杭州 310020;2.南昌大学第一附属医院口腔颌面整形外科,南昌 330006)
目的 探讨泛素特异性蛋白酶4(USP4)对增生性瘢痕(HS)成纤维细胞增殖的影响。方法 体外培养人HS成纤维细胞(HSFB),并取第4代细胞用于试验。利用Vialinin A(USP4抑制剂)干预HS成纤维细胞,Western blot检测干预细胞中不同时间段(0、12、24、48 h)USP4、TβRI及Smad7蛋白的表达,四甲基偶氮唑蓝比色(MTT)法检测Vialinin A对HS成纤维细胞增殖的影响,分为试验组和对照组(不作干预)。结果 Vialinin A作用后,随着时间推移,HSFB中的USP4蛋白表达逐渐减低,TβRI的蛋白也逐渐减低,在作用12 h后明显降低(P<0.05);Smad7的蛋白表达则逐渐升高(P<0.05)。Vialinin A同一浓度作用后,随着时间推移,HSFB增殖活性逐渐受到抑制,试验组与对照组同一时间段比较差异有统计学意义(P<0.05)。结论 USP4可能通过调控TGF-β/Smad信号通路影响瘢痕细胞增殖,抑制其表达可使HS成纤维细胞增殖减慢。
泛素化;瘢痕,肥大性;成纤维细胞;泛素特异性蛋白酶4;增生性瘢痕;Vialinin A;增殖
增生性瘢痕(hypertrophic scar,HS)是人体对创伤过度愈合反应的结果,在临床上非常多见,常表现为瘢痕形状不规则、质地坚硬,严重影响外观,有时伴有功能障碍,部分患者还会有疼痛和瘙痒感,甚至产生瘢痕溃烂、癌变可能[1-2]。虽然增生瘢痕的危害很大,但其病因和发病机制目前仍未完全清楚。转化生长因子β(TGF-β)的重要生物学功能正逐渐引起人们的重视。创面愈合过程中,TGF-β/Smad信号通路的持续激活,会导致HS的形成[3]。近年来研究发现,泛素特异性蛋白酶(USP)4可增强TGF-β信号通路的水平,并与TβRI结合,抑制其泛素化降解,进而提高胞膜上TβRI的表面分布水平[4]。但其在HS成纤维细胞中的影响少见报道。而Vialinin A是一种半选择性的泛素特异性蛋白酶抑制剂,可较强地抑制USP4及USP5[5-6],最初是从中国云南省发现的一种可食用的蘑菇莲座革菌分离出来的小分子化合物,是一种三联苯衍生物[6]。本试验从HS患者中切取HS组织,体外培养HS成纤维细胞,加入泛素特异性蛋白酶抑制剂Vialinin A抑制USP4表达,现报道如下。
1 材料与方法
1.1 材料
1.1.1 病理组织 取自2014年4至7月于本科行HS整形手术患者,男10例,女5例,年龄6~16岁。均体质健康,近期未使用任何瘢痕药物治疗;瘢痕组织处于稳定期(形成时间6~16个月);以四肢、颈部为主,高于周围正常皮肤,质地硬,局部无感染及溃疡,经临床和病理证实为HS组织并无恶变。本试验均征得患者同意并已签署知情同意书。
1.1.2 主要试剂及仪器 DMEM培养基(美国Hyclone公司),胎牛血清(美国Hyclone公司),Vialinin A(美国Cayman公司),胰蛋白酶-含0.25%乙二胺四乙酸(EDTA,美国Gibco公司),二甲基亚砜(DMSO,北京Solarbio公司),二氨基联苯胺(DAB)试剂盒(北京Solarbio公司),四甲基偶氮唑蓝(MTT,美国Gibco公司),兔抗人USP4多克隆抗体(美国Abcam公司),兔抗人TβRI多克隆抗体(美国Abcam公司),兔抗人Smad7多克隆抗体(武汉Boster公司),兔抗人β-actin多克隆抗体(武汉Boster公司),山羊抗兔免疫球蛋白G(IgG)-辣根过氧化物酶(HRP,北京Solarbio公司),增强型ECL化学发光液(北京Solarbio公司);CO2细胞培养箱(美国Thermo公司),超净工作台(美国Fisher公司),倒置显微镜及照相系统(日本Olympus公司),TS-10高速离心机(湖南湘仪公司),酶联免疫检测仪(芬兰MμLtiskan Ascent公司)。
1.2 方法
1.2.1 人HSFB体外培养 采用林尊文等[7]的改良组织块贴壁结合胰蛋白酶消化法体外培养成纤维细胞:从整形手术中切取HS在无菌操作条件下,迅速带至实验室超净台中(超净台预先紫外灯照射约1 h)放置在无菌培养皿中,彻底去除表皮和脂肪组织,残留白色质硬的瘢痕组织PBS漂洗3次;用眼科剪将组织块剪成0.5~1.0 mm3大小的微粒 ,加入0.25%的胰蛋白酶约1 mL浸没组织块,置于4 ℃冰箱中冷消化过夜;第2天PBS漂洗3次后(以去除残留胰酶),用1 mL注射器将组织块接种至培养瓶中,组织块间隙在0.3~0.5 cm,将已经接种好的培养瓶竖立置于37 ℃,5% CO2,饱和湿度的培养箱中干燥约1 h;缓慢取出培养瓶,分别加入约3 mL含10%胎牛血清的高糖DMEM培养液于各培养瓶中,使组织块没入培养液中,平放置于恒温箱中继续培养。每隔3~5 d换液1次。显微镜下观察,适时去除漂浮及无细胞生长组织块,待组织块周围爬出的细胞基本融合成片,密度达80%以上时,将瓶底细胞按1∶2传代培养。取第4代细胞用于试验研究。
1.2.2 VialininA 干预HSFB
1.2.2.1 Western blot检测细胞内USP4、TβRI及Smad7蛋白表达 取生长状态良好的HS成纤维细胞消化、离心及弃去上清液,加入2 mL含10%胎牛血清的培养液混匀制成细胞悬液,取10 μL计数,确定细胞浓度,以每孔2×105密度将细胞接种到6孔板,继续培养24 h后,加入适量含5 μmol/L Vialinin A的培养液,分别在0、12、24、48 h后收集细胞总蛋白,采用二喹啉甲酸(BCA)蛋白浓度测定试剂盒结合酶标仪检测对上述细胞蛋白浓度进行测定,将上述已定量的蛋白样本加入5×十二烷基硫酸钠(SDS)上样缓冲液,沸水中煮10 min使蛋白充分变性,取总蛋白20 μg上样,进行SDS-聚丙烯酰胺(PAGE)电泳后湿法转膜,随后用5%脱脂奶粉封闭硝酸纤维素膜约2 h;将封闭好硝酸纤维素膜放入适当稀释度的兔抗人一抗溶液中4 ℃过夜,USP4、TβRI、Smad7及内参β-actin分开孵育;应用TBST洗膜后,将硝酸纤维素膜放入适当稀释度的山羊抗兔IgG二抗中室温下孵育1 h。应用增强型化学发光试剂盒进行发光,采用凝胶成像系统进行图像采集和灰度分析,结果以目的蛋白灰度值与β肌动蛋白灰度值之比表示。
1.2.2.2 MTT检测细胞增殖 取生长良好的已被干预的HS成纤维细胞与未被干预的细胞分别常规消化、离心及吸弃上清液,收集细胞及重悬细胞,以每孔1×104/mL密度将已被Vialinin A干预的增生瘢痕成纤维细胞(试验组)与未干预的细胞(对照组)接种于96孔板,每孔为200 μL,即2 000 /孔,两组细胞均设5个复孔,并各设置1个调零孔(即只加20 μL DMEM完全培养基),以此方式再接种2块96孔板;然后置于恒温箱中培养,24 h后从培养箱中取出1块板,在避光下向每孔加入20 μL MTT工作溶液,避光置于恒温箱中继续培养4 h后终止培养;加入150 μL DMSO于每个细胞孔中,避光置于摇床低速振荡10 min,充分溶解结晶物;用酶联免疫检测仪测量各孔吸光度值(A值),波长为490 nm,记录并分析结果。48、72 h后分别取出1块96孔板,按以上步骤测量各孔A值并记录。以上试验重复3次。
2 结 果
2.1 细胞生长观察 HS培养的原代瘢痕成纤维细胞在光镜下自第5天时可见单个呈梭形状细胞从组织块周围爬出,第7天时可见较多细胞爬出,放射状排列于组织块周围,倒置相差显微镜下观察,细胞呈长梭形,核圆,核仁清晰,细胞质均匀,胞体丰满。传代后大部分细胞生长良好,性状稳定。近3周时,细胞生长基本融合,可消化传代。
2.2 Vialinin A对细胞内USP4、TβRI及Smad7蛋白表达的影响 Vialinin A作用后,随着时间推移,HSFB中的USP4蛋白表达逐渐减低;TβRI的蛋白也逐渐减低,在作用12 h后明显降低,与0时比较差异有统计学意义(P<0.05);Smad7的蛋白表达则逐渐升高,与0时比较差异有统计学意义(P<0.05),见图1。
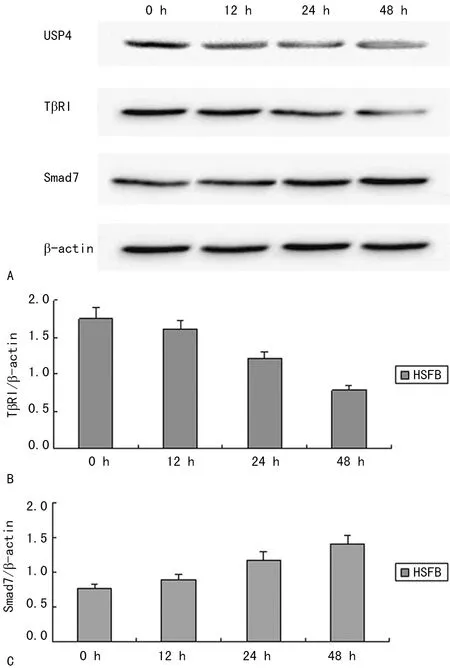
A:Western blot蛋白条带;B:不同时间段的HSFB中TβRI不同时间段的蛋白表达;C:不同时间段的Smad7与β-actin灰度值比较。
图1 干预USP4后HSFB中TβRI与Smad7不同时间段的表达
2.3 Vialinin A对HS成纤维细胞增殖的影响 Vialinin A作用后,试验组中HSFB增殖活性明显受到抑制,试验组与对照组组同一时间段A值比较差异有统计学意义(P<0.05),见表1。
表1 两组Vialinin A对HSFB的A值比较值)
3 讨 论
HS是成纤维细胞异常增殖,分泌大量胶原、基质,引起胶原等基质代谢合成与降解失衡,导致过多细胞外基质分泌和沉积的一种纤维化疾病。至今,学术界对其发病机制的研究尚未有明确的定论,临床上也尚无有效的治疗方法。现已证实多种细胞因子、信号转导通路、细胞外基质参与瘢痕形成,而TGF-β/Smad信号通路是已被证明与瘢痕形成密切相关的机制[8-9]。其中,Smads根据不同分型,对成纤维细胞胶原代谢具有双向调控作用。Smad7主要负调控TGF-β/Smad信号通路,TGF-β刺激后,Smad7移至胞质中,与Smad3竞争TβRI,进而阻止Smad3活化,抑制TGF-β信号通路转导,调控正、负性Smads蛋白之间的平衡[10-11]。Smad7 还可通过E3泛素连接酶-Smurf (Smurf1和Smurf2)诱导Smad2与TβRI的泛素化降解,下调TβRI在胞膜上的分布水平,进而负反馈作用于TGF-β/Smad信号通路[12]。
而泛素-蛋白酶体途径是真核细胞内一个重要的蛋白质降解调节系统,是进化过程中高度保守的级联反应,紧密地调节TGF-β家族信号[13]。它可通过对底物蛋白的泛素化进行蛋白酶体降解,可影响多种细胞活动,如细胞受体功能、细胞周期调节、DNA损伤修复及肿瘤生长等[14]。该途径也通过去泛素化酶(DUBs)逆转泛素化过程。USP4是第1个在哺乳动物中被确定的去泛素化酶,由原癌基因USP4编码,作为DUBs中重要一员,USP4最初被报道可以与肿瘤抑制因子pRb和相关袋状蛋白 p107、p130相互作用[15]。它主要通过与特异性靶蛋白结合使之去泛素化阻止其降解或改变性状,在多种信号通路中发挥重要调节作用,比如Wnt/β-catenin 信号通路、固有免疫应答通路及p53 信号通路,尤其在TGF-β/Smad信号通路[16]。其在TGF-β/Smad信号通路的潜在机制是TβRI通过Smad7/Smurf2复合体进行泛素化降解,而USP4可与TβRI直接结合,使之去泛素化,介导泛素化与去泛素化平衡,维持TβRI在质膜上的水平,调控TGF-β/Smad信号通路的水平。一系列体内外试验也表明在哺乳动物细胞和斑马鱼胚胎中,USP4在调节TGF-β/Smad信号通路方面发挥关键作用。在对恶性乳腺癌细胞分析显示,体外试验表明USP4可调节TGF-β诱导的上皮间质转化、迁移,体内试验表明USP4可激活TGF-β/Smad信号通路,促进癌细胞侵袭、转移[17]。这项研究还表明USP4可被蛋白激酶B(AKT)磷酸化,磷酸化后使细胞核中的USP4重新定位于胞质和胞膜,与TβRI结合,进而去泛素化,增强TGF-β诱导的致瘤反应。如果USP4缺失,则由AKT诱导的癌细胞迁移也会受到抑制。由此可见,USP4通过选择性介导TGF-β/Smad信号通路中关键组件的去泛素化,参与调控了TGF-β/Smad信号通路的水平。一旦其功能紊乱,就会使TGF-β/Smad信号通路转导异常,进而引起一系列病生改变,导致多种疾病的发生与发展。
最新研究表明,USP4可去泛素化促进Th17细胞功能并且可提高风湿性心脏病患者的CD4+T细胞水平,进一步利用Vialinin A抑制USP4活性,将可抑制Th17细胞分化,这意味着USP4有望成为Th17介导的自身免疫疾病的治疗靶点[18]。Wang等[19]研究发现USP4可通过去泛素化正向调节维甲酸诱导基因I(RIG-I)介导的抗病毒效应,稳定RIG-I的表达水平。Hou等[20]发现在头颈部鳞状细胞癌中USP4蛋白表达水平增加,并直接与受体相互作用蛋白1(RIP1)相互作用,使之去泛素化,负调控RIP1介导的NF-κB活性,促进TNF-α诱导的凋亡。因此这相关研究发现USP4是属于抑癌蛋白。然而Zhang等[21]的研究发现USP4可直接与TβRI结合,使之去泛素化,最终促进TGF-β诱导的乳腺癌的发展。由此可见,抑制USP4可负调控TGF-β信号通路,抑制肿瘤的生长,属于癌蛋白。从以上研究不难看出关于USP4在哺乳动物细胞中功能尚无确切定论。
本试验以HS成纤维细胞为载体,利用Vialinin A(USP4抑制剂)干预HS成纤维细胞,分别在不同时间段收集细胞总蛋白行Western blot检测及MTT检测细胞增殖情况。 Western blot检测结果显示:USP4在Vialinin A作用12 h后,表达逐渐减低,说明Vialinin A抑制USP4有效;TβRI的蛋白表达也在作用12 h后明显降低,而Smad7蛋白表达则逐渐升高。并且本课题组前期发现USP4与TβRI蛋白在HS成纤维细胞中高表达,而Smad7蛋白在HS成纤维细胞中低表达。综合表明USP4可能通过调控TGF-β/Smad信号通路影响瘢痕细胞增殖。其次,MTT结果显示:加入泛素特异性蛋白酶抑制剂Vialinin A后,HSFB的增殖活性逐渐减低,尤其在72 h明显。以上结果可能暗示着USP4与TβRI相互作用,通过抑制Smad7介导的信号通路阻止TβRI的泛素化降解,从而维持TβRI的高水平和Smad7的低水平,抑制USP4表达,导致TβRI的低表达及Smad7的高表达,从而负调控TGF-β介导的信号通路,抑制HS成纤维增殖,但其具体的分子机制还需深入研究。
[1]Wolfram D,Tzankov A,Pulzl P,et al.Hypertrophic scars and keloids:a review of their pathophysiology,risk factors,and therapeutic management[J].Dermatol Surg,2009,35(2):171-81.
[2]Aarabi S,Longaker MT,Gurtner GC.Hypertrophic scar formation following burns and trauma:new approaches to treatment[J].PLoS Med,2007,4(9):e234.
[3]Penn JW,Grobbelaar AO,Rolfe KJ.The role of the TGF-beta family in wound healing,burns and scarring:a review[J].Int J Burns Trauma,2012(2):18-28.
[4]Zhang L,Zhou F,Drabsch Y,et al.USP4 is regulated by AKT phosphorylation and directly deubiquitylates TGF-beta type Ⅰ receptor[J].Nat Cell Biol,2012,14(7):717-726.
[5]Okada K,Ye YQ,Taniguchi K,et al.VialininA is a ubiquitin-specific peptidase inhibitor[J].Bioorg Med Chem Lett,2013,23(15):4328-4331.
[6]Yoshioka Y,Ye YQ,Okada K,et al.Ubiquitin-specific peptidase 5,a target molecule of vialinin A,is a key molecule of TNF-α production in RBL-2H3 cells[J].PLoS One,2013,8(12):e80931.
[7]林尊文,徐少宏,游敏,等.人增生性瘢痕成纤维细胞的改良培养和鉴定[J].实用医学杂志,2011,27(24):4367-4369.
[9]Poniatowski XA,Wojdasiewicz P,Gasik R,et al.Transforming growth factor Beta family:insight into the role of growth factors in regulation of fracture healing biology and potential clinical applications[J].Mediators Inflamm,2015:137823.
[10]Itoh S,ten Dijke P.Negative regulation of TGF-beta receptor/Smad signal transduction[J].Curr Opin Cell Biol,2007,19(2):176-184.
[11]Yan X,Chen YG.Smad7:not only a regulator,but also a cross-talk mediator of TGF-beta signalling[J].Biochem J,2011,434(1):1-10.
[12]Dabiri G,Campaner A,Morgan JR,et al.A TGF-beta1-dependent autocrine loop regulates the structure of focal adhesions in hypertrophic scar fibroblasts[J].J Invest Dermatol,2006,126(5):963-970.
[13]Aggarwal K,Massagué J.Ubiquitin removal in the TGF-β pathway[J].Nat Cell Biol,2012,14(7):656-657.
[14]李衍常,高媛,徐忠伟,等.蛋白质组学在去泛素化酶研究中的应用[J].生物工程学报,2014,30(9):1341-1350.
[15]DeSalle LM,Latres E,Lin D,et al.The de-ubiquitinating enzyme Unp interacts with the retinoblastoma protein[J].Oncogene,2001,20(39):5538-5542.
[16]Zhang J,Zhang X,Xie F,et al.The regulation of TGF-β/Smad signaling by protein deubiquitination[J].Protein Cell,2014,5(7):503-517.
[17]Zhang L,Huang H,Zhou F,et al.RNF12 controls embryonic stem cell fate and morphogenesis inzebrafish embryos by targeting Smad7 for degradation[J].Mol Cell,2012,46(5):650-661.
[18]Hou X,Wang L,Zhang L,et al.Ubiquitin-specific protease 4 promotes TNF-α-induced apoptosis by deubiquitination of RIP1 in head and neck squamous cell carcinoma[J].FEBS Lett,2013,587(4):311-316.
[19]Wang L,Zhao W,Zhang M,et al.USP4 positively regulates RIG-I-mediated antiviral response through deubiquitination and stabilization of RIG-I[J].J Virol,2013,87(8):4507-4515.
[20]Hou X,Wang L,Zhang L,et al.Ubiquitin-specific protease 4 promotes TNF-α-induced apoptosis by deubiquitination of RIP1 in head and neck squamous cell carcinoma[J].FEBS Lett,2013,587(4):311-316.
[21]Zhang X,Berger FG,Yang J,et al.USP4 inhibits p53 through deubiquitinating and stabilizing ARF-BP1[J].Embo J,2011,30(11):2177-2189.
The effect of USP4 on the proliferation of human hypertrophic scar fibroblasts*
ChenYan1,ZhangJie2△
(1.DepartmentofSkinSurgery,SirRunRunShawHospitalSchoolofMedicine,ZhejiangUniversity,Hangzhou,Zhejiang310020,China;2.OralandMaxillofacialPlasticSurgery,theFirstAffiliatedHospitalofNanchangUniversity,Nanchang,Jiangxi330006,China)
Objective To investigate the effects of USP4 on the proliferation of human hypertrophic scar fibroblasts(HSFB).Methods HSFB were cultured in vitro.The fourth generation of HSFB in logarithmic growth phase was selected in the experiment.HSFB were intervened by Vialinin A which was the inhibitor of USP4 for 0,12,24,48 h,then collected cells and the their expression of USP4 and TβRI and Smad7 protein was detected by Western blot.MTT assay was used to detect the effect of Vialinin A on the proliferation of HS fibroblasts and the cells were divided into experimental group and control group (without intervention).Results After treatment with Vialinin A in HSFB,the expression of USP4 and TβRI protein in HSFB decreased gradually,especially in 12 h(P<0.05),and Smad7 protein expression was increased gradually(P<0.05).The proliferative activity of intervened HSFB reduced gradually,the difference between experimental group and control group was statistically significant(P<0.05).Conclusion USP4 might inhibit the proliferation of scar cells and down-regulation of USP4 expression in hyperplastic scar fibroblasts,which can slow proliferative activity of intervened HSFB by regulating TGF-β/Smad signaling pathway.
ubiquitination;cicatrix,hypertrophic;fibroblast;USP4;hypertrophic scar;Vialinin A;proliferation
10.3969/j.issn.1671-8348.2017.15.002
国家自然科学基金资助项目(81460295);江西省卫生计生委科技计划资助项目(20155201)。 作者简介:陈燕(1988-),住院医师,硕士,主要从事瘢痕修复及皮肤美容方面研究。△
,E-mail:zhjprs@163.com。
R619.6
A
1671-8348(2017)15-2021-03
2016-11-22
2017-02-10)

