甲状腺激素T3对大鼠脑缺血再灌注损伤后NGF和BDNF表达的影响研究*
窦 超,张 敏,赵源征,郭亚培,吴世陶,刘恒方
(郑州大学第五附属医院神经内科,郑州 450000)
甲状腺激素T3对大鼠脑缺血再灌注损伤后NGF和BDNF表达的影响研究*
窦 超,张 敏,赵源征,郭亚培,吴世陶,刘恒方△
(郑州大学第五附属医院神经内科,郑州 450000)
目的 探讨甲状腺激素T3对大鼠脑缺血再灌注损伤的神经保护作用及机制。方法 雄性SD大鼠分为假手术+生理盐水组、假手术+T3组、大脑中动脉栓塞(MCAO)+生理盐水组、MCAO+T3组。应用MCAO法建立大鼠脑缺血再灌注损伤模型,分别于缺血后1 h及再灌注后6 h给予腹腔注射甲状腺激素10 μg/100 g,生理盐水为安慰剂。再灌注24 h后,观察不同组别大鼠神经功能损伤情况,梗死体积变化,以及缺血侧脑皮质中神经生长因子(NGF)和脑源性神经营养因子(BDNF)的mRNA及蛋白表达水平变化。结果 与MCAO+生理盐水组比较,MCAO+T3组大鼠神经功能缺损表现减轻,脑梗死体积减小,NGF、BDNF的mRNA和蛋白表达上升(P<0.05)。结论 甲状腺激素对大鼠脑缺血再灌注损伤有神经保护作用,其机制与增加脑缺血再灌注损伤中NGF、BDNF的表达相关。
脑缺血;再灌注损伤;甲状腺激素类;神经生长因子;神经保护作用;脑源性神经营养因子
缺血性脑血管病是目前威胁人类健康与生存的主要疾病之一。及时恢复脑组织血液供应是修复脑组织损伤的最佳办法,但缺血后血流再通又可能导致缺血再灌注损伤,因此减轻再灌注损伤并促进脑缺血后神经功能恢复已成为目前研究热点之一[1]。研究发现,脑缺血后,神经生长因子(nerve growth factor,NGF)和脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)水平增加,通过激活不同的信号系统,促进受损神经元再生及分化,改善神经元的病理状态[2-3]。甲状腺激素在婴幼儿神经系统发育成熟的过程中至关重要[4]。近年来,人们发现其对成年甚至老年期中枢神经系统亦有至关重要的作用[5-6]。Mendes-De-Aguiard等[7]将甲状腺激素T3加入培养的胶质细胞中发现,T3可增加其对抗高浓度谷氨酸毒性的能力,并增加与胶质细胞共培养神经元的存活率,可见T3对培养的神经元有保护作用。但对T3在脑缺血再灌注损伤中的作用研究较少。本实验通过研究T3对脑缺血再灌注大鼠脑组织中NGF和BDNF表达的影响,探讨T3对脑缺血再灌注损伤是否存在保护作用及其机制,现报道如下。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级成年SD大鼠32只,雄性,8周,体质量250~280 g,由郑州大学实验动物中心提供。
1.1.2 主要试剂 T3购自美国Sigma公司;兔抗神经生长因子抗体(anti-NGF)和兔抗脑源性神经营养因子抗体(anti-BDNF)购自英国abcam公司;兔抗β-actin抗体、辣根过氧化物酶(HRP)标记山羊抗兔二抗购自美国CST公司;Trizol购自美国Invitrogen公司;NGF、BDNF及β-肌动蛋白(β-actin)引物由上海捷瑞生物工程有限公司合成;Western blot相关试剂购自中国博士德公司;HotStarTaq Master Mix试剂盒购自德国Qiagen公司;TaqMan Reverse Transcription Reagents试剂盒购自加拿大Abm公司;红四氮唑(TTC)购自美国Sigma公司;其余试剂为国产分析纯试剂。
1.1.3 主要仪器 Nonodrop超微量分光光度计和CL31.1R低温超速离心机购自美国Thermo公司;普通/梯度PCR仪购自德国Eppendorf公司;DYY-6C水平电泳仪购自北京市六一仪器厂;Mini-PROTEAN Tetra蛋白垂直电泳仪购自美国BIO-RAD公司;Amersham Imager 600化学发光成像系统购自美国GE公司。
1.2 方法
1.2.1 实验分组及给药 将32只SD大鼠分为4组,每组8只。分别为:假手术+生理盐水组、假手术+T3组、大脑中动脉栓塞(MCAO)+生理盐水组、MCAO+T3组。分别于缺血后1 h及再灌注后6 h腹腔注射T3 10 μg/100 g,以及等量生理盐水。
1.2.2 大鼠脑缺血再灌注模型制备 根据改良的Longa法通过MCAO制备脑缺血再灌注损伤模型[8]。大鼠用10%水合氯醛(30 mg/100 g)腹腔注射麻醉,仰卧位固定,常规消毒,颈部正中切口。分离右侧颈总、颈外及颈内动脉,结扎颈总及颈外动脉,颈内动脉远心端用动脉夹夹闭后,在颈总动脉分叉距颈内动脉0.5 cm处作1个切口,将尼龙线导入颈内动脉,插入线栓深度约为(18.0±0.5)mm,感到轻微阻力时立即停止插线。缝合伤口,留置线头于体外,2 h后将线栓提至颈总动脉内,完成再灌注。假手术各组采用相同的手术步骤,但不插入线栓。术后将室温控制在22~25 ℃,将动物置于放有清洁垫料的鼠笼中,自由进食、水。
1.2.3 大鼠神经功能评分 参照Longa等[8]的5分制评分标准进行神经行为学评分:(1)无神经功能缺失症状、活动正常者,0分;(2)不能完全伸展左侧前爪,1分;(3)动物爬行时出现向左转圈(追尾现象),2分;(4)身体向左侧倾倒者,3分;(5)不能自发行走,意识丧失者,4分。评分为0分和4分者均被剔除,神经功能评价在再灌注后24 h取材前进行。
1.2.4 2,3,5-氯化三苯基四氮唑(TTC)染色梗死体积测量 神经行为学评分完成后,断头取脑,-20 ℃速冻30 min,从额极后2 mm处行连续冠状切片,厚2 mm。将切片放入2%TTC溶液中,37 ℃避光染色30 min后,用4%多聚甲醛固定24 h后拍照,正常脑组织染色后呈鲜红色,而梗死区呈苍白色。采用图像分析系统计算梗死面积,将各脑片的梗死面积与厚度的乘积进行累加,获得梗死体积。
1.2.5 RT-PCR技术
1.2.5.1 引物设计 根据大鼠基因组序列设计引物,由上海捷瑞生物工程有限公司合成,见表1。
1.2.5.2 RT-PCR 取缺血侧皮层脑组织置于1.5 mL RNA-free EP管中,利用TRIzol法提取总RNA,紫外分光光度计测定RNA水平,采用TaqMan Reverse Transcription Reagents试剂盒将mRNA反转录成cDNA。取反转录产物采用HotStarTaq Master Mix试剂盒进行PCR反应扩增目的基因。所有PCR扩增产物均进行琼脂糖凝胶电泳,以β-actin为内参照,观测其表达水平变化。
1.2.6 Western blot检测 取缺血侧皮层脑组织,置于组织匀浆器中,加入适量RIPA蛋白提取裂解液,置于冰上低温匀浆裂解。裂解完全后,将裂解液移至1.5 mL EP管中,12 000 r/min,4 ℃离心10 min,取上清液,置于-80 ℃保存。二喹啉甲酸 (BCA)试剂盒测定蛋白浓度后,按相同蛋白浓度等量体积依次上样。十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳分离蛋白后,转移到聚偏二氟乙烯(PVDF)膜,然后用5%脱脂牛奶室温封闭1 h,之后4 ℃过夜孵育特异性兔抗NGF(1∶1 000)、兔抗BDNF(1∶1 000)、兔抗β-actin(1∶1 000)、TBST洗膜3次后,HRP标记山羊抗兔二抗(1:1 000)室温孵育1 h后,电化学发光(ECL)显色,Amersham Imager 600化学发光成像系统成像。以β-actin为内参,用Image J图像处理系统分析蛋白条带的相对灰度值,观测不同组别目的蛋白表达水平变化。
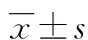
2 结 果
2.1 T3对脑缺血再灌注大鼠神经行为学评分的影响 大鼠脑缺血再灌注损伤24 h后,假手术+生理盐水组和假手术+T3组均无神经功能缺损表现,Longa评分0分;MCAO+生理盐水组大鼠可见明显的左侧偏瘫样表现,左侧追尾,躯体向左侧倾倒,Longa评分(2.71±0.56)分,明显高于假手术各组(P<0.05);MCAO+T3组神经功能缺损表现减轻,Longa评分(1.63±0.58)分,较MCAO+生理盐水组降低(P<0.05)。
2.2 T3对脑缺血再灌注大鼠脑梗死体积的影响 大鼠脑缺血再灌注损伤24 h后,假手术+生理盐水组和假手术+T3组TTC染色呈均匀橘红色,无缺血梗死灶。MCAO+生理盐水组和MCAO+T3组脑组织均有不同程度的缺血梗死,TTC染色可见梗死灶成白色,周边组织呈橘红色。与MCAO+生理盐水组[(45.12±2.32)%]相比,[MCAO+T3组(26.36±1.04)%]大鼠的脑梗死体积百分比减少(P<0.05),见图1。

A:MCAO+生理盐水组;B:MCAO+T3组。
图1 脑缺血再灌注大鼠脑组织TTC染色
2.3 T3对脑缺血再灌注大鼠脑组织NGF和BDNF mRNA表达水平的影响 与假手术+生理盐水组和假手术+T3组相比,MCAO+生理盐水组大鼠NGF和BDNF mRNA水平均增加(P<0.05);而与MCAO+生理盐水组相比,MCAO+T3组大鼠NGF和BDNF mRNA水平进一步升高(P<0.05),见图2。
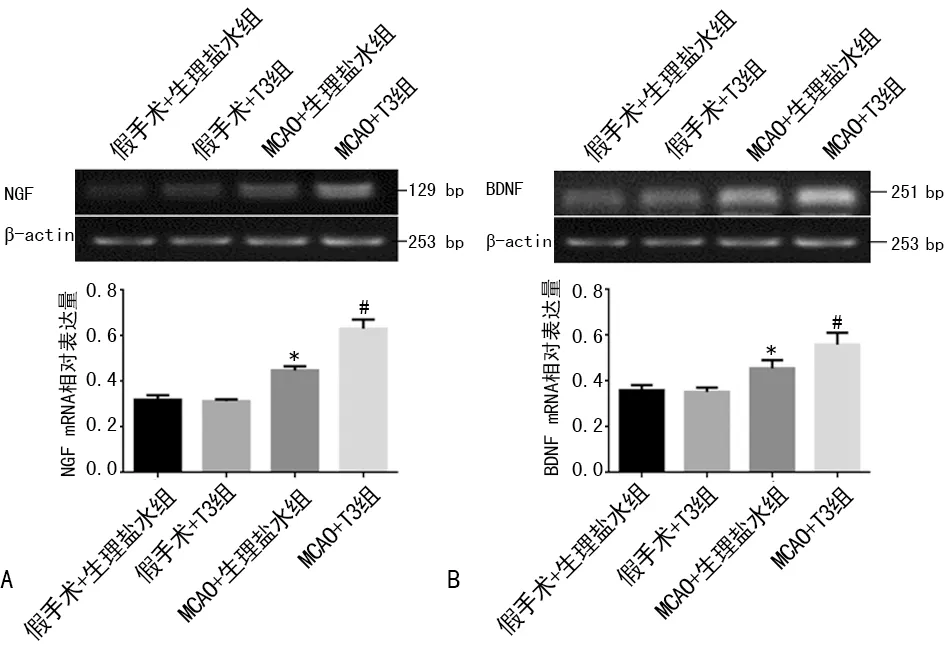
A:NGF mRNA;B:BDNF mRNA。*:P<0.05,与假手术+生理盐水组比较;#:P<0.05,与MCAO+生理盐水组比较。
图2 各组大鼠脑组织NGF和BDNF mRNA水平
2.4 T3对脑缺血再灌注大鼠脑组织NGF和BDNF蛋白表达水平的影响 与假手术+生理盐水组和假手术+T3组相比,MCAO+生理盐水组大鼠NGF和BDNF蛋白表达水平均增加(P<0.05);而与MCAO+生理盐水组相比,MCAO+T3组大鼠NGF和BDNF表达水平进一步升高(P<0.05),见图3。
A:NGF蛋白;B:BDNF蛋白。*:P<0.05,与假手术+生理盐水组比较;#:P<0.05,与MCAO+生理盐水组比较。
图3 各组大鼠脑组织NGF和BDNF蛋白表达水平
3 讨 论
脑血管病是目前危害人类健康的常见病之一,其中80%约为缺血性脑血管病。本研究通过MCAO建立局灶性脑缺血再灌注大鼠模型,观察甲状腺激素对大鼠脑缺血再灌注损伤的神经保护作用,结果显示,甲状腺激素T3对脑缺血再灌注损伤有保护作用,可减轻缺血再灌注损伤所致神经缺损表现,减少梗死体积,保护受损神经元,促进神经元再生等作用。同时发现,T3的这种神经保护作用与增加脑组织中NGF和BDNF的表达水平,促进新生神经元再生相关。
脑缺血再灌注损伤所致局部梗死灶主要由中心坏死区和周边缺血半暗带组成[9-10]。缺血早期,中心区的神经元坏死,神经功能完全丧失;而周边区神经元暂时处于休眠状态[11-12],只要尽早恢复其血供,即可及时修复受损细胞。NGF和BDNF均属于神经生长因子家族,在中枢神经发育过程至关重要[13-14]。Tongiorgi等[15]发现,多发性硬化症患者中,BDNF可通过激活PI3K-Akt信号通路,维持神经元生存。Li等[16]发现,局灶性脑缺血后,BDNF通过调节TrkB相关信号,抑制神经细胞凋亡,促进神经元再生。此外,BDNF还可通过NMDA受体及胞核钙信号拮抗兴奋性氨基酸的神经毒性反应[17]。据报道,NGF可作用于NMDA受体,降低细胞内的Ca2+超载,加速自由基清除、减轻兴奋性氨基酸毒性,从而保护神经元[18]。可见,适度增加脑组织中NGF和BDNF表达水平,对维持神经元存活、促进受损神经修复、减轻神经毒性是有利的。
甲状腺激素,特别是T3,在哺乳动物神经系统发育成熟的过程中至关重要,它已被证实参与胚胎脑细胞的增殖分化、树突轴突生长、神经元迁移及髓鞘形成等[4,19]。然而,其作用并不局限于幼年个体。近年来,人们逐渐开始关注甲状腺激素对于成年动物脑组织的影响[5-6,20]。研究发现,成年人甲状腺激素水平紊乱(过低或过高)会导致情绪障碍、痴呆或混乱[21]。慢性脱髓鞘动物模型中,给予外源性的T3能够促进症状的缓解和髓鞘再生修复[22]。Deb等[23]发现,甲状腺激素可通过调节一氧化氮和pERK1/2信号通路保护星形胶质细胞免受吗啡诱导的细胞凋亡。此外,研究还发现,T3通过一种非基因组机制,减轻神经毒性反应[7,24]。综上所述,甲状腺激素对正常中枢神经系统维持及损伤神经系统修复均具有保护作用,然而其在脑缺血再灌注后损伤中的作用尚未见报道。
因此,本研究通过大鼠脑缺血再灌注模型,观测甲状腺激素对脑缺血再灌注损伤的作用。结果表明,甲状腺激素T3可通过增加脑组织中NGF和BDNF表达水平,促进神经元再生、修复受损神经细胞、减轻脑梗死体积,从而对缺血再灌注大鼠起到神经保护作用。
[1]Male S,Nickele C,Elijovich L.Critical care of brain reperfusion[J].Curr Neurol Neurosci Rep,2016,16(3):23.
[2]Fang M,Yuan Y,Lu J,et al.Scutellarin promotes microglia-mediated astrogliosis coupled with improved behavioral function in cerebral ischemia[J].Neurochem Int,2016(97):154-171.
[3]Pendharkar AV,Levy SL,Ho AL,et al.Optogenetic modulation in stroke recovery[J].Neurosurg Focus,2016,40(5):E6.
[4]Rovet JF.The role of thyroid hormones for brain development and cognitive function[J].Endocr Dev,2014(26):26-43.
[5]Sánchez-Huerta K,García-Martínez Y,Vergara P,et al.Thyroid hormones are essential to preserve non-proliferative cells of adult neurogenesis of the dentate gyrus[J].Mol Cell Neurosci,2016(76):1-10.
[6]Hung PL,Huang CC,Huang HM,et al.Thyroxin treatment protects against white matter injury in the immature brain via brain-derived neurotrophic factor[J].Stroke,2013,44(8):2275-2283.
[7]Mendes-De-Aguiar CB,Alchini R,Decker H,et al.Thyroid hormone increases astrocytic glutamate uptake and protects astrocytes and neurons against glutamate toxicity[J].J Neurosci Res,2008,86(14):3117-3125.
[8]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84.
[9]Yu Y,Han Q,Ding X,et al.Defining core and penumbra in ischemic stroke:a voxel and volume-based analysis of whole brain CT perfusion[J].Sci Rep,2016(6):20932.
[10]Lin L,Bivard A,Krishnamurthy V,et al.Whole-brain CT perfusion to quantify acute ischemic penumbra and core[J].Radiology,2016,279(3):876-887.
[11]le Feber J,Tzafi Pavlidou S,Erkamp N,et al.Progression of neuronal damage in an in vitro model of the ischemic penumbra[J].PLoS One,2016,11(2):e0147231.
[12]Hillis AE,Baron JC.Editorial:the ischemic penumbra:still the target for stroke therapies[J].Front Neurol,2015(6):85.
[13]Hernandez-Morato I,Sharma S,Pitman MJ.Changes in neurotrophic factors of adult rat laryngeal muscles during nerve regeneration[J].Neuroscience,2016,333(12):44-53.
[14]Lian D,He D,Wu J,et al.Exogenous BDNF increases neurogenesis in the hippocampus in experimental Streptococcus pneumoniae meningitis[J].J Neuroimmunol,2016(294):46-55.
[15]Tongiorgi E,Sartori A,Baj G,et al.Altered serum content of brain-derived neurotrophic factor isoforms in multiple sclerosis[J].J Neurol Sci,2012,320(1/2):161-165.
[16]Li X,Zheng W,Bai H,et al.Intravenous administration of adipose tissue-derived stem cells enhances nerve healing and promotes BDNF expression via the TrkB signaling in a rat stroke model[J].Neuropsychiatr Dis Treat,2016(12):1287-1293.
[17]Lau D,Bengtson CP,Buchthal B,et al.BDNF Reduces toxic extrasynaptic NMDA receptor signaling via synaptic NMDA receptors and nuclear-calcium-induced transcription of inhba/activin A[J].Cell Rep,2015,12(8):1353-1366.
[18]Wong H,Kang I,Dong XD,et al.NGF-induced mechanical sensitization of the masseter muscle is mediated through peripheral NMDA receptors[J].Neuroscience,2014(269):232-244.
[19]Préau L,Fini JB,Morvan-Dubois G,et al.Thyroid hormone signaling during early neurogenesis and its significance as a vulnerable window for endocrine disruption[J].Biochim Biophys Acta,2015,1849(2):112-121.
[20]Remaud S,Gothié JD,Morvan-Dubois G,et al.Thyroid hormone signaling and adult neurogenesis in mammals[J].Front Endocrinol (Lausanne),2014(5):62.
[21]Leyhe T,Müssig K.Cognitive and affective dysfunctions in autoimmune thyroiditis[J].Brain Behav Immun,2014(41):261-266.
[22]El-Tahry H,Marei H,Shams A,et al.The effect of triiodothyronine on maturation and differentiation of oligodendrocyte progenitor cells during remyelination following induced demyelination in male albino rat[J].Tissue Cell,2016,48(3):242-251.
[23]Deb I,Das S.Thyroid hormones protect astrocytes from morphine-induced apoptosis by regulating nitric oxide and pERK 1/2 pathways[J].Neurochem Int,2011,58(8):861-871.
[24]Kumar BK,Reddy AG,Krishna AV,et al.Developmental neurotoxicity of monocrotophos and lead is linked to thyroid disruption[J].Vet World,2016,9(2):133-141.
The influence of thyroid hormones on the expression of NGF and BDNF after cerebral ischemia-reperfusion injury in rats*
DouChao,ZhangMin,ZhaoYuanzheng,GuoYapei,WuShitao,LiuHengfang△
(DepartmentofNeurology,theFifthAffiliatedHospitalofZhengzhouUniversity,Zhengzhou,Henan450000,China)
Objective To investigate the neuroprotective effect of thyroid hormones T3 on cerebral ischemia-reperfusion injury in rats and its mechanism.Methods SD rats were divided into four groups:sham+saline group,sham+T3 group,MCAO+saline group,MCAO+T3 group.The cerebral ischemia-reperfusion injury rat models were established by right middle cerebral artery occlusion.Thyroid hormones (10 μg/100 g) or normal saline were given respectively by intraperitoneal injection twice at 1 h after the onset of ischemia and 6 h after reperfusion.Neurobehavioral score was evaluated at 24 h after reperfusion;TTC staining was used to label infarction area;RT-PCR was used to detect the mRNA level of nerve growth factor (NGF) and brain derived neurotrophic factor (BDNF) in brain tissue;Western blot was employed to determine alterations in protein levels of NGF and BDNF.Results Compared with MCAO+saline group,the neurological deficit and the volume of cerebral infarction of MCAO+T3 group was decreased,and the mRNA and protein expression of NGF and BDNF of MCAO+T3 group were increased(P<0.05).Conclusion Thyroid Hormones could promote the nerve repair,stimulate the nerve regeneration and improve the nervous behavioral function by up-regulating the expression of NGF and BDNF.
brain ischemia;reperfusion injury;thyroid hormones;nerve growth factor;neuroprotective effect;brain-derived neurotrophic factor
10.3969/j.issn.1671-8348.2017.15.005
河南省医学科技攻关计划项目(16A310021)。 作者简介:窦超(1988-),住院医师,硕士,主要从事脑血管疾病方面研究。△
,E-mail:liuhf1965@163.com。
R743.3
A
1671-8348(2017)15-2030-04
2016-11-26
2017-01-12)

