胃癌根治术后腹腔恒温热灌注联合全身化疗的临床疗效研究
王启船,屈中玉,张 辉,陶海云,刘 越,李 果,万里新
(河南省南阳市中心医院肿瘤内科一病区 473009)
胃癌根治术后腹腔恒温热灌注联合全身化疗的临床疗效研究
王启船,屈中玉,张 辉,陶海云,刘 越,李 果,万里新△
(河南省南阳市中心医院肿瘤内科一病区 473009)
目的 观察并探讨晚期胃癌腹腔转移腹腔恒温热灌注(HPPC)联合姑息化疗方案的临床疗效及对生存质量、术后复发率的影响。方法 回顾性分析该院2012年1月至2015年12月间接收晚期胃癌腹腔转移的104例患者资料,接受姑息化疗治疗方案者50例(对照组),接受HPPC+姑息化疗方案者54例(联合组)。采用电化学发光法、双抗体夹心酶联免疫吸附试验分别检测两组治疗前后肿瘤标志物癌胚抗原(CEA)、糖蛋白抗原19-9(CA19-9)、血管内皮生长因子(VEGF)的水平,统计分析两组化疗期间药物不良反应与化疗结束后临床疗效、肿瘤标志物、生存质量变化情况,记录4年随访期间两组复发、转移与生存情况。结果 两组化疗后肿瘤标志物与VEGF水平较术前明显下降,且联合组化疗后CEA 、CA19-9、VEGF水平明显低于对照组,差异有统计学意义(P<0.05)。两组化疗后生存质量、治疗疗效、预后比较差异均有统计学意义(P<0.05)。结论 晚期胃癌腹腔转移行HPPC治疗有利于治疗后改善生存质量与提高远期生存率。
胃肿瘤;输注,胃肠外;高温,诱发;腹腔恒温热灌注化疗;疗效;生活质量
胃癌居我国消化道恶性肿瘤发病率之首,根治性手术是最佳治疗手段,但胃癌术后仍有50%~60%的患者会发生局部复发、种植转移或远处转移[1]。腹腔热灌注化疗(hyperthermic peritoneal perfusion chemotherapy,HPPC)是根据癌细胞与正常细胞对温度的耐受性差异及对化疗药物的热增敏效应设计出的集热疗、化疗、低渗冲洗于一体的肿瘤治疗方法[2]。该疗法通过向腹腔内持续灌注化疗药物并利用灌注液的机械冲刷作用清除脱落的癌细胞和微小转移灶,目前已广泛应用于大肠癌、肝癌、卵巢癌等各种实体瘤的治疗,并表现出明显优势。本研究对晚期胃癌腹腔转移行HPPC+姑息化疗方案治疗,并与单纯化疗的效果进行了对比研究,现报道如下。
1 资料与方法
1.1 一般资料 选择本院消化肿瘤科2012年1月至2015年12月间接受晚期胃癌腹腔转移的104例患者,其中,接受姑息化疗治疗方案者50例(对照组),接受HPPC+姑息化疗方案者54例(联合组)。对照组中男30例,女20例,年龄45~68岁;腺癌20例,鳞腺癌17例,黏液腺癌8例,印戒细胞癌5例;肿瘤细胞人类表皮生长因子受体-2(HER-2/neu)高表达(+++及以上)13例。联合组男32例,女22例,年龄44~67岁;腺癌24例,鳞腺癌13例,黏液腺癌8例,印戒细胞癌9例;HER-2/neu高表达11例。两组患者一般资料差异无统计学意义(P>0.05),具有可比性。病例入选标准:晚期胃癌腹腔转移患者;年龄小于70岁;病理学检查确定胃癌;卡氏(KPS)评分大于或等于65分;预计生存期大于6个月;Child-pugh分级A级或B级;签订治疗随访协议。排除标准:化疗禁忌证者;术前造血功能异常者;不耐受化疗方案者;合并有脑转移患者及随访期间失访者。本研究患者均知情同意。
1.2 方法
1.2.1 对照组 化疗前静脉推注盐酸格拉司琼10 mg,紫杉醇 135 mg/m2(1 d),顺铂DDP 70 mg/m2(分2~3 d),均采用静脉滴注方式,每21天为1个化疗周期,连续化疗4个周期。
1.2.2 联合组 置热灌注管路,由广东百合医疗科技股份有限公司提供的一次性无菌腹腔引流导管11G(艾贝尔),术后当日采用吉林省迈达医疗器械有限公司提供的RHL-2000A型体外循环热灌注机进行腹腔循环热灌注化疗,紫杉醇 135 mg/m2(1 d)静脉应用,顺铂 75 mg/m2腹腔热灌注,入体温度42~46 ℃,出体温度40 ℃,灌注速度100~200 mL/min,持续灌注90 min,灌注开始后每10~15分钟协助患者变换体位,使药物在腹腔内弥散分布。灌注结束后,开放引流管,留1 000 mL化疗液于腹腔,每2天灌注1次,共灌注2~3次。灌注结束后,每21天为1个化疗周期,连续化疗4个周期,第2~4个周期行姑息化疗方案辅助化疗。
1.2.3 观察项目和标准
1.2.3.1 血清肿瘤标志物检测 术前与化疗结束后1个月采集空腹静脉血,采用罗氏E170 型电化学发光仪及配套试剂盒测定肿瘤标志物癌胚抗原(CEA)、糖蛋白抗原19-9(CA19-9),阳性界值分别为CEA>5 μg/L,CA19-9>39 U/mL。采用美国Beckman全自动生化分析仪测定血管内皮细胞生长因子(VEGF),采用双抗体夹心酶联免疫吸附试验(试剂盒购自上海晶美公司)。
1.2.3.2 药物不良反应 参照美国国立癌症研究所2006年制定的NCI-CTCAE3.0版药物毒性标准记录药物不良反应。
1.2.3.3 KPS评分及生存质量评价[3]以KPS评分变化评价生存质量。改善:治疗后KPS评分增加10分以上;稳定:治疗后KPS评分增加不足10分;降低:治疗后KPS评分较治疗前减小。其中改善和稳定视为生存质量良好,良好率=(改善例数+稳定例数)/总例数×100%。
1.2.3.4 疗效评估标准[4]肿瘤病灶消失,无新病灶出现为完全缓解;靶病灶最大径之和减少大于或等于30%为部分缓解;肿瘤病灶最大径之和缩小小于30%或增大小于20%为稳定;肿瘤病灶最大径之和至少增加大于或等于20%或出现新病灶为进展。其中有效缓解率=(完全缓解例数+部分缓解例数)/总例数×100%。
1.2.3.5 临床预后 治疗结束后通过电话或复诊等方式进行2年的随访,记录局部复发和远处转移情况,比较两组治疗结束后1、2年的生存率。
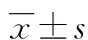
2 结 果
2.1 两组患者肿瘤标志物比较 两组患者手术前CEA、CA19-9、VEGF水平比较差异无统计学意义(P>0.05);两组化疗后肿瘤标志物与VEGF水平较术前明显下降,且联合组化疗后CEA 、CA19-9、VEGF水平明显低于对照组,比较差异有统计学意义(P<0.05),见表1。
2.2 两组患者药物不良反应与并发症比较 两组患者各种药物不良反应比较差异无统计学意义,其不良反应程度主要以Ⅰ、Ⅱ级为主,Ⅲ、Ⅳ级较少。所有患者均未出现药物性腹膜炎、粘连性肠梗阻及切口裂开等并发症,比较差异无统计学意义(P>0.05),见表2。
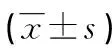
表1 两组患者HPPC前与化疗后肿瘤标志物比较

表2 两组患者化疗期间药物不良反应比较(n)

表3 两组患者预后比较
2.3 两组患者化疗后生存质量情况比较 化疗结束1个月后,联合组改善27例,稳定21例,降低6例,生存质量良好率为88.89%;对照组改善21例,稳定16例,减低13例,生存质量良好率为74.00%。两组比较差异有统计学意义(P<0.05)。
2.4 两组患者治疗疗效比较 联合组完全缓解11例,部分缓解23例,稳定18例,进展2例,有效率为62.96%;联合组完全缓解3例,部分缓解18例,稳定23例,进展6例,有效率为42.00%,两组比较差异有统计学意义(P<0.05)。
2.5 两组患者预后比较 随访期间内,联合组复发率、远处转移率均明显低于对照组,比较差异有统计学意义(P<0.05);联合组化疗后2年生存率明显高于对照组,比较差异有统计学意义(P<0.05),见表3。
3 讨 论
胃癌腹腔转移尚无统一的治疗标准,治疗方法包括全身化疗、腹腔内化疗、生物免疫及腹腔热灌注治疗等。由于腹膜-血浆屏障作用,全身化疗方案疗效均欠佳,且不良反应大。HPPC作为治疗腹腔恶性肿瘤的新兴技术,在防治腹膜种植转移及恶性腹腔积液方面临床获益率达73.0%~87.5%[5-6]。
有研究结果显示,胃癌根治术患者术后辅助化疗可有效通过化疗药物对肿瘤细胞进行全身性灭杀,对微小残留癌灶及腹腔内游离肿瘤细胞具有良好的灭杀效果,可在一定程度上减少复发和转移[7]。也有研究表明,胃癌是对化疗相对敏感的肿瘤,常规化疗效果不佳,但HPPC作为一种新型化疗技术,可通过其中的热疗作用弥补常规化疗的不足,提高对肿瘤细胞的灭杀效果,有利于提高患者疗效及改善预后[8-9]。对此,本研究通过回顾性分析HPPC与常规化疗治疗胃癌腹腔转移患者的临床疗效及预后情况,发现联合组化疗后CEA、CA19-9、VEGF水平明显低于对照组,前者治疗有效率明显高于后者,表明HPPC有助于加强化疗药物对癌细胞的凋亡作用,提高临床疗效;联合组生存质量良好率、化疗后2年生存率明显高于对照组,前者复发率、远处转移率均明显低于后者,表明HPPC可有效减少癌细胞的转移及病灶复发,有利于改善患者生存质量及延长患者寿命。本研究结果提示,TP方案是一种低毒高效的消化道化疗方案,其铂类药物、紫杉类抗肿瘤药物等可通过选择性地与微管蛋白亚基N-末端第31位氨基酸结合,形成稳定的微管束,从而阻滞肿瘤细胞的有丝分裂,将增殖期的肿瘤细胞阻滞在G和M期,继而达到凋亡肿瘤细胞的作用,且对血液、胃肠道的毒性刺激作用较低[10-11]。而CEA、CA19-9是临床常用的肿瘤标志物,可反映肿瘤存在,其表达水平可用于对癌症的疗效判断、病情发展、监测和预后的评估;VEGF是目前发现促进内皮细胞有丝分裂的强力有效因子,也是刺激肿瘤血管生长的关键调节因子,可直接参与肿瘤血管的形成,其表达水平可反映肿瘤的侵袭能力[12-13]。在HPPC治疗过程中,可通过借助大量生理盐水作为灌注载体,使化疗药物与腹腔内脏器、腹膜、肠袢褶皱处隐藏的癌细胞和残留灶与化疗药物直接接触,达低渗冲洗的作用,且可利用腹膜的弥散屏障作用,促使腹腔内积聚高浓度的抗癌药物,延长了药物和癌细胞的接触时间,提高药物对癌细胞的杀伤效果[14]。此外,胃癌细胞的临界致死温度及感受性最强温度约为42 ℃,正常细胞临界致死温度及感受性最强的温度约为46 ℃,HPPC过程中的温度为42~46 ℃,可结合热疗的作用改变癌细胞细胞膜的通透性,协同化疗药物的渗透,加速瘤细胞DNA双链断裂,使癌细胞变性、凋亡,且可增强NK细胞、T淋巴细胞和巨噬细胞的活性及免疫能力,进一步灭杀癌细胞,使患者CEA、CA19-9、VEGF水平下降,提高对患者的临床疗效[15]。
此外,由于HPPC治疗的化疗药物是经门静脉入肝,可有效杀死肝内的游离癌细胞,预防肝转移,且通过大量循环灌注模式,可有效冲刷未来得及着床的癌细胞并将其带出腹腔,灭杀残留或脱落的癌细胞,有利于抑制癌细胞的着床复发和转移。且本研究结果显示,两组患者各种药物不良反应比较差异无统计学意义,其不良反应程度主要以Ⅰ、Ⅱ级为主,Ⅲ、Ⅳ级较少,且无严重并发症发生,提示HPPC治疗对患者体内正常细胞的毒性刺激作用较轻,不增加患者不良反应和并发症发生的风险,具有良好的安全性。在提高癌细胞灭杀效果和良好安全性的作用下,可有效改善患者的生存质量,减少治疗后复发和转移的发生概率,延长患者的寿命,有利于降低患者后续治疗的难度,达到改善预后的作用。
综上所述,HPPC是一种集热疗、化疗、低渗灌洗于一身的局部化疗方法,胃癌腹腔转移患者采用HPPC联合TP方案化疗可进一步杀灭残留肿瘤细胞,且不增加患者不良反应及并发症发生的风险,有助于减少局部复发与远处转移,提高术后生存质量与远期生存率,值得临床作进一步推广。
[1]唐鸿生,崔书中,唐云强,等.腹腔热灌注化疗治疗晚期胃癌合并腹水的临床疗效观察[J].消化肿瘤杂志,2013,5(1):26-30.
[2]Li TJ,Huang CC,Ruan PW,et al.In vivo anti-cancer efficacy of magnetite nanocrystal - based system using locoregional hyperthermia combined with 5-fluorouracil chemotherapy[J].Biomaterials,2013,34(32):7873-7883.
[3]Zhang LP,Zhao YY,Zhang QZ,et al.Clinical observation of capecitabine combined with hyperthermic intraperitoneal chemotherapy with cisplatin in the treatment of elderly patients with advanced gastric cancer and malignant ascites[J].Tumor,2014,34(10):946-951.
[4]Wu ZB,Wu K,Li XD,et al.Treatment of gastric cancer with DF regimen combined with hyperthermic intraperitoneal perfusion chemotheraphy with cisplatin[J].Sci Tech Rev,2014,32(30):55-58.
[5]罗旭,张震.腹腔循环热灌注联合化疗治疗晚期胃癌合并腹腔积液的有效性和安全性[J].中国处方药,2015,13(3):90-91.
[6]朱小鹏,唐昃,杨利华.多西紫杉醇腹腔热灌注化疗治疗老年胃癌并恶性腹水的临床效果[J].疑难病杂志,2016,14(5):487-489.
[7]Zhang ZS,Xue CN,Zhang J,et al.Intraperitoneal hyperthermal chemotherapy with cisplatin combined with capecitabine in the treatment for ascites in patients with advanced gastric carcinoma[J].J Pract Med,2012,28(20):3447-3449.
[8]詹宏杰,梁寒,王宝贵,等.进展期胃癌术中腹腔热灌注化疗的预后分析[J].中国肿瘤临床,2012,29(22):1730-1733.
[9]崔海滨,葛怀娥,白希永,等.进展期胃癌术后奥沙利铂早期循环式腹腔热灌注化疗联合全身化疗的临床观察[J].中国全科医学,2013,16(23):2740-2742.
[10]宋展,钱国武,吕柯,等.局部进展期胃癌术中腹腔热灌注化疗的疗效评价[J].中华普通外科杂志,2015,30(6):425-427.
[11]张跃,柴杰,张毅,等.进展期胃癌术中术后腹腔热灌注化疗初步结果分析[J].中华肿瘤防治杂志,2015,22(18):1475-1478.
[12]Sheng Q,Jin YJ,Zhu JH,et al.The effects of endogenic field hyperthermia combined with intraperitoneal chemotherapy on the treatment outcomes and serum tumor markers of patients with advanced gastric cancer and celiac lymph node metastasis[J].Tumor,2011,31(9):859-862.
[13]Yao XJ,Yao GZ.Influence and significance of TAM,CEA and CA72-4 for chemotherapy in advanced gastric cancer[J].Cancer Res Prev Treat,2013,40(1):65-67.
[14]吴晓江,贾永宁,季加孚.腹腔热灌注化疗在胃癌腹腔转移治疗中的价值[J].中国实用外科杂志,2015,35(10):1071-1075.
[15]姚路斌,洪波.进展期胃癌术后早期循环式腹腔热灌注化疗联合全身化疗的疗效[J].中国现代医学杂志,2015,25(31):58-61.
10.3969/j.issn.1671-8348.2017.15.040
王启船(1975-),副主任医师,硕士,主要从事肿瘤内科及肿瘤微创治疗方面研究。△
,E-mail:nanyang1967@163.com。
R735.2
B
1671-8348(2017)15-2134-04
2016-11-05
2017-01-23)

