急性淋巴细胞白血病TPMT基因多态性的研究
张世恒 韩怡波 杨月明 刘 伶
急性淋巴细胞白血病TPMT基因多态性的研究
张世恒 韩怡波 杨月明 刘 伶
目的 分析急性淋巴细胞白血病TPMT基因多态性与6-MP不良反应的相关性。方法 收取急性淋巴细胞白血病患儿48例作为研究对象,对其TPMT基因型及6-MP不良反应进行分析。结果 48例患儿中31.25%按照常规6-MP使用剂量完成维持治疗,68.75%患儿出现不耐受后调整为低剂量完成维持治疗。常规剂量组重度不良反应发生率高于低剂量组,但差异无统计学意义(P>0.05)。6-MP所致骨髓抑制及肝功能损害发生率分别为93.75%及83.33%。仅有1例患儿发生杂合型TPMT×3C点突变,突变发生率为2.08%,该患儿同时发生4级骨髓抑制及4级肝功能损害。结论 TPMT×3C基因突变可能与6-MP所致重度不良反应有关,但6-MP所致重度不良反应可能是多种因素共同作用的结果。
急性淋巴细胞白血病;TPMT;6-MP;不良反应
(ThePracticalJournalofCancer,2017,32:539~541)
急性淋巴细胞白血病(ALL)是1种起源于B淋巴细胞系或T淋巴细胞系的骨髓内异常增生的恶性肿瘤性疾病,是小儿时期最为常见的白血病类型,占儿童急性白血病发生率的80%左右[1]。患儿对6-MP个体耐受性往往具有较大差异,部分患儿对标准剂量可表现出骨髓抑制或肝功能损伤等不良反应,对于患者预后均产生了较大影响[2]。有研究表明,巯嘌呤甲基转移酶(TPMT)是6-MP代谢及发挥活性的关键酶[3]。因此,本研究对近年来我院收治的急性淋巴细胞白血病患儿TPMT基因型与6-MP不良反应的相关性进行考察与探究,以期对个体化治疗方案的开展提供理论指导。
1 材料与方法
1.1 病例收集
收取2010年1月至2015年12月间我院收治的急性淋巴细胞白血病患儿48例作为研究对象,纳入标准如下:①符合WHO标准中采用MICM分型的急性淋巴细胞白血病诊断标准[4];②患儿年龄1~18岁;③按照SJCRH-TOTXV化疗方案的全部危险度分型患儿;④经诱导化疗等前期治疗已达到完全缓解(CR)并进入定期强化及维持治疗的患儿。排除初诊时合并其他系统严重疾病的患儿。维持治疗使用6-巯基嘌呤,以8周为一个循环。本研究已经过我院医学伦理委员会批准通过,并与患儿家属签署了知情同意书。
1.2 TPMT基因型检测
抽取患儿EDTA抗凝骨髓液3 mL,使用血液基因组DNA提取试剂盒(北京天根生化科技有限公司生产,目录号DP319)进行基因组DNA提取,操作严格按照说明书执行。参考文献[5]进行TPMT引物设计,采用Sanger法-双脱氧链终止法进行测序。
1.3 判断标准
对48例患儿维持治疗情况进行观察,观察维持治疗情况不同的患儿不良反应发生情况,具体包括骨髓抑制、肝功能损害、胃肠道反应以及皮疹等,按照严重程度进行分级,1~2级为轻度不良反应,3~4级为重度不良反应。
1.4 统计学分析
应用SPSS 18.0统计学分析软件进行数据处理,计数资料以率的形式进行表示,检验方法选择卡方检验。假设检验标准为α=0.05。
2 结果
2.1 一般资料
48例患儿中男性28例,女性20例;年龄为13个月~16岁,平均年龄(9.3±2.4)岁;免疫分型B淋巴细胞白血病45例,T淋巴细胞白血病3例;低危型11例,中危型25例,高危型12例。48例患儿中共有15例按照常规6-MP使用剂量完成维持治疗,占全部患儿的31.25%;33例患儿出现常规6-MP方案不耐受而暂时停药,并且使用相关药物对出现的重度不良反应进行对症治疗,之后继续使用低剂量6-MP完成维持治疗,占全部患儿的68.75%。
2.2 不同剂量6-MP所致重度不良反应比较
常规剂量组重度不良反应发生率高于低剂量组,但差异无统计学意义(P>0.05),见表1。
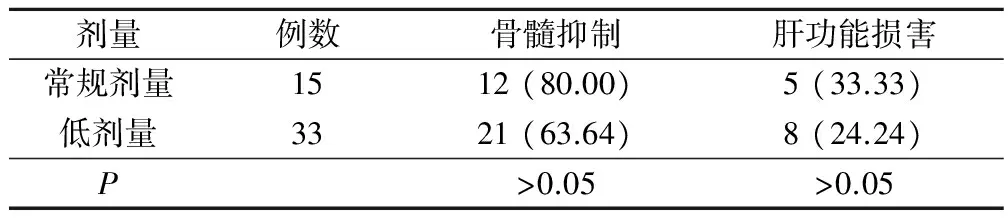
表1 不同剂量6-MP所致重度不良反应比较(例,%)
2.3 6-MP不良反应发生情况
48例患者中骨髓抑制及肝功能损害发生率较高,分别为93.75%及83.33%,见表2。

表2 6-MP不良反应发生情况(例,%)
2.4 TPMT基因型检测情况
对48例患者TMPT×2、TPMT×3A、TPMT×3B及TPMT×3C 4种点突变发生情况进行检测,结果显示,仅有1例患儿发生TPMT×3C点突变,且为杂合型(图1),突变发生率为2.08%。
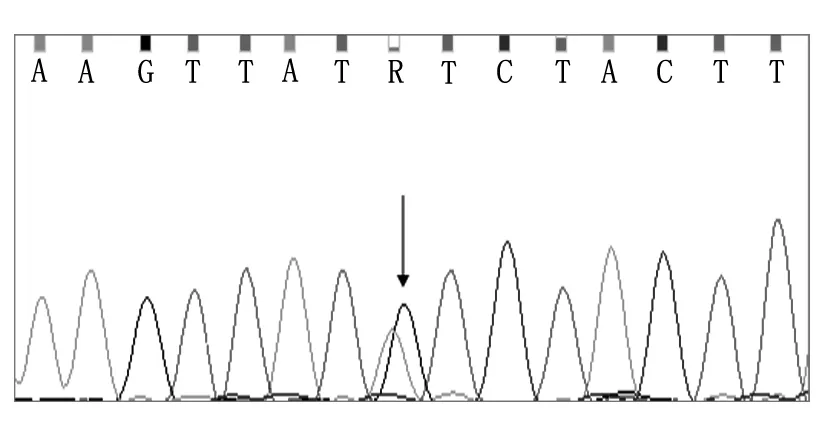
箭头所示为突变型等位基因
图1 TMPT×3C点突变测序结果图
2.5 TPMT基因突变与6-MP所致不良反应的关系
对1例TPMT×3C基因突变患儿重度不良反应发生情况进行观察,结果显示,该患儿同时发生4级骨髓抑制及4级肝功能损害。
3 讨论
据流行病学统计,我国每年新增白血病患儿约1.6~2万人,以ALL最为常见,是小儿时期最常见的恶性肿瘤[6]。6-MP是1种嘌呤核苷类似物,是最早用于ALL治疗的药物。尽管随着治疗方法的不断发展,6-MP的地位仍未动摇。该药物是通过抑制嘌呤合成的细胞周期,竞争性抑制次黄嘌呤转变,从而发挥阻碍DNA合成及抑制淋巴细胞增殖的效果。有研究报道显示,含6-MP的维持治疗方案是减少患者复发及提高无病生存率的关键环节[7]。然而,6-MP靶向性较差,治疗窗狭窄,因而导致治疗浓度和中毒浓度接近,极易使患儿发生不耐受现象[8]。文献报道显示,接受6-MP治疗而未发生任何不良反应的患儿仅为7%左右[9]。因此,对6-MP所致不良反应发生的来源进行分析,采取相关措施进行预防或治疗,可能对改善6-MP耐受性具有一定意义。
TPMT是6-MP等巯嘌呤药物代谢过程中的关键酶,其基因多态性是ALL相关研究的重点问题,有研究报道称,TPMT可与黄嘌呤氧化酶及次黄嘌呤鸟嘌呤磷酸核糖转移酶竞争底物而导致代谢产物的变化,进而影响药物的疗效及副作用[10]。然而国内也有研究报道显示,TPMT基因突变与6-MP所致不良反应物显著相关性[11]。故本研究对近年来我院接诊的ALL患儿进行了回顾性分析,对其6-MP治疗情况、所致不良反应发生率以及TPMT基因型进行考察,并分析其相关性。
本研究结果显示,仅有少部分患儿能按照常规剂量完成6-MP治疗,未出现严重的不耐受现象,另有大部分患儿出现重度不良反应,经过短暂停药后改用低剂量完成治疗。我们对这两部分患者发生的重度不良反应发生率进行了比较,结果显示,常规剂量组重度不良反应发生率略高于低剂量组,提示6-MP不良反应可能受到使用剂量的影响,然而两组差异无统计学意义,这可能是由于本研究例数过少所致。之后我们对6-MP所致患儿全部不良反应进行了观察,结果显示,重度骨髓抑制和重度肝功能损害发生率较高,与文献报道类似。48例患儿中仅有1例观察到TPMT×3C基因突变,并且该患儿同时发生4级骨髓抑制及4级肝功能损害。该结果提示我们,TPMT基因突变很可能导致6-MP严重不良反应的发生。对于此种类型的患儿可能应该重新进行治疗方案的规划。但由于在较多重度不良反应患儿中也仅仅观察到1例突变,由此说明6-MP所致重度不良反应可能是多因素共同作用的结果。
此外,由于我们收集病例资料相当有限,所以仅能开展小样本研究。且研究为回顾性分析,难免造成现有临床数据的限制。并且文献报道TPMT基因突变发生率仅为3%左右,故缺乏大量基因突变病例进行对照[12]。关于此点,我们认为需要通过更加严谨设计的大样本量后续试验完成。
综上所述,TPMT×3C基因突变可能与6-MP所致重度不良反应有关,但6-MP所致重度不良反应可能是多种因素共同作用的结果。
[1] Rocha JM,Xavier SG,de Lima Souza ME,et al.Current strategies for the detection of minimal residual disease in childhood acute lymphoblastic leukemia 〔J〕.Mediterr J Hematol Infect Dis,2016,8(1):e2016024.
[2] de Beaumais TA,Jacqz-Aigrain E.Intracellular disposition of methotrexate in acute lymphoblastic leukemia in children 〔J〕.Curr Drug Metab,2012,13(6):822-834.
[3] Moriyama T,Relling MV,Yang JJ.Inherited genetic variation in childhood acute lymphoblastic leukemia 〔J〕.Blood,2015,125(26):3988-3995.
[4] Shi LH,Wu XJ,Liu JS,et al.Withaferin A activates stress signalling proteins in high risk acute lymphoblastic leukemia 〔J〕.Int J Clin Exp Pathol,2015,8(12):15652-15660.
[5] Román M,Cabaleiro T,Ochoa D,et al.Validation of a genotyping method for analysis of TPMT polymorphisms 〔J〕.Clin Ther,2012,34(4):878-884.
[6] Douer D,Thomas DA.New developments in acute lymphoblastic leukemia 〔J〕.Clin Adv Hematol Oncol,2014,12(6 Suppl 12):13-22.
[7] Mei L,Ontiveros EP,Griffiths EA,et al.Pharmacogenetics predictive of response and toxicity in acute lymphoblastic leukemia therapy 〔J〕.Blood Rev,2015,29(4):243-249.
[8] Stocco G,Franca R,Verzegnassi F,et al.Pharmacogenomic approaches for tailored anti-leukemic therapy in children 〔J〕.Curr Med Chem,2013,20(17):2237-2253.
[9] 王娴静,董秀娟,陈 蕾,等.两种化疗方案治疗儿童急性淋巴细胞白血病效果比较〔J〕.白血病·淋巴瘤,2015,24(09):554-558.
[10] Lennard L,Cartwright CS,Wade R,et al.Thiopurine methyltransferase and treatment outcome in the UK acute lymphoblastic leukaemia trial ALL2003 〔J〕.Br J Haematol,2015,170(4):550-558.
[11] Levinsen M,Rosthøj S,Nygaard U,et al.Myelotoxicity after high-dose methotrexate in childhood acute leukemia is influenced by 6-mercaptopurine dosing but not by intermediate thiopurine methyltransferase activity 〔J〕.Cancer Chemother Pharmacol,2015,75(1):59-66.
[12] Roy LM,Zur RM,Uleryk E,et al.Thiopurine S-methyltran- sferase testing for averting drug toxicity in patients receiving thiopurines:a systematic review 〔J〕.Pharmacogenomics,2016,17(6):633-656.
(编辑:吴小红)
Study of TPMT Polumorphism of Children with Acute Lymphoblastic Leukemia
ZHANGShiheng,HANYibo,YANGYueming,etal.
DalianMunicipalWomenandChildren’sMedicalCenter,Dalian,116000
Objective To analyze the relationship between TPMT polumorphism with 6-MP adverse reaction of children with acute lymphoblastic leukemia (ALL).Methods 48 children with ALL were selected.TPMT polumorphism and adverse reaction of 6-MP were observed and their relationship was analyzed.Results 31.25% of 48 children were completed maintenance treatment using normal dose of 6-MP,68.75% of 48 children were completed maintenance treatment using low dose.Severe adverse reaction rate of normal dose group was higher than low dose group,but they had no statistically significance (P>0.05).Myelosuppression rate and liver damage rate were 93.75% and 83.33% respectively.There was only 1 case of hybrid TPMT×3C point mutation,the mutation rate was 2.08%.Grade 4 myelosuppression and liver damage were occurred on this mutation case.Conclusion TPMT×3C mutation may have relations with severe adverse reaction of 6-MP.But the adverse reactions may be caused by multiple effect factors.
Acute lymphoblastic leukemia(ALL);TPMT;6-MP;Adverse reaction
116000 大连市妇女儿童医疗中心
刘 伶
10.3969/j.issn.1001-5930.2017.04.005
R733.71
A
1001-5930(2017)04-0539-03
2016-06-02
2017-03-10)

