一株聚乙烯降解菌的筛选及其降解特性研究
钟越,李雨竹,张榕麟,罗贝旭,张尔亮*,陶宗娅,竹文坤
1. 四川师范大学生命科学学院,四川 成都 610101;2. 西南科技大学生命科学学院,四川 绵阳 621010
一株聚乙烯降解菌的筛选及其降解特性研究
钟越1,李雨竹1,张榕麟1,罗贝旭1,张尔亮1*,陶宗娅1,竹文坤2
1. 四川师范大学生命科学学院,四川 成都 610101;2. 西南科技大学生命科学学院,四川 绵阳 621010
为解决聚乙烯塑料在自然环境中难降解的问题,从土壤中分离出一株降解菌用于聚乙烯塑料生物降解研究。经筛选纯化,对该菌进行生理生化实验、16SrDNA序列分析和系统发育进化树构建;将菌株接种于以不同相对分子质量聚乙烯粉末(相对分子质量分别为2000、5000、100 000)和膜片(相对分子质量>400 000)为唯一碳源的基础液体培养基中,于30 ℃、180 rpm下培养;采用分光光度法每隔24 h测定菌体生长浓度、总蛋白含量、还原糖含量以及pH值;培养14 d,采用ABTS法和愈创木酚法测定漆酶和锰过氧化物酶酶活力;培养60 d,称量聚乙烯残留物质量,于扫描电子显微镜下观察膜片表观,对膜片力学性能变化进行测定。鉴定结果表明,该菌为放线菌属的东方拟无枝酸菌(Amycolatopsis orientalis);菌生长浓度随聚乙烯相对分子质量的增大而减小;胞外蛋白质量浓度为(27.625±0.400)~(0.958±0.180) μg·mL-1;还原糖质量浓度为(15.664±1.764)~(2.660±0.000) μg·mL-1;pH值显著下降;漆酶和锰过氧化物酶酶活力酶活力分别为3 500~3 000 U·L-1和2 600~2 000 U·L-1;聚乙烯失重率为(35.81%±0.39%)~(5.57%±0.22%);电镜观察发现膜片表面出现大量降解孔洞和大面积菌体附着;膜片力学性能显著下降;亲水性增大,表面能增大。证明东方拟无枝酸菌能够直接作用于普通聚乙烯塑料表面,是一株高效的降解菌株。推测该菌通过分泌胞外酶氧化聚乙烯长烃链,降低聚乙烯表面能,且在降解过程中产生酸性物质,长烃链最终转化成小分子物质;在菌株降解聚乙烯中起直接作用的酶为漆酶和锰过氧化物酶。
聚乙烯塑料;东方拟无枝酸菌;生物降解;漆酶;锰过氧化物酶
塑料因其经济方便和稳定性好而被广泛应用,但同时也造成了严重的“白色污染”(Yoshida et al.,2016)。据统计,全球一年有1.7×108t塑料是一次性使用过程所产生的,其中最常见的是聚乙烯塑料(杨军等,2007)。聚乙烯(polythene简称PE)是线性的饱和碳氢化合物,基本结构为-[CH2-CH2]n-,其相对分子质量大、疏水性强、表面能低,缺乏被微生物酶系统所利用的官能团,在自然环境中难以无机矿化,严重危害着我们的生态环境(崔福斋等,2004)。传统的填埋、焚烧会造成二次污染,限塑令和回收再利用等措施以及研发可生物降解的填充型塑料只能减缓环境中塑料的累积速度,并不能清除已存在于环境中的塑料垃圾(Ioakeimidis et al.,2016)。因此寻求绿色环保的降解方法迫在眉睫。
近几年,利用微生物降解塑料污染物将其无机矿化成H2O和CO2的研究逐渐成为热点。Harshvardhan et al.(2013)筛选出可高效降解低密度聚乙烯的细菌。Abrusci et al.(2011)分离出的3株细菌在以钙铁离子作为氧化助剂的情况下,可高效地降解农用地膜。目前,有关塑料的微生物降解机理研究鲜有报道,漆酶能够以LMS(Lacase-Mediator system)和HBT(1-羟基苯并三唑)为媒介降解高相对分子质量聚乙烯塑料(Fujisawa et al.,2001);漆酶和锰过氧化物酶是哈茨木酶降解聚乙烯的关键酶(Sowmya et al.,2014)。目前,本研究从覆有农用膜的农地土壤中分离出一株具有聚乙烯降解性能的菌株,将其直接应用于降解高相对分子质量甚至超高相对分子质量聚乙烯塑料,以研究该菌的降解特性,初步探索其降解机理,旨在扩大聚乙烯降解菌资源库,为聚乙烯塑料降解相关领域提供良好的理论支持和参考。
1 材料与方法
1.1 实验仪器
分光光度计UV-2000;恒温培养摇床THZ-300;VEGA3LMH型扫描电子显微镜;XLW(B)智能电子拉力试验机;JY-82B接触角测试仪。
1.2 培养基和药品
以聚乙烯为唯一碳源的基础培养基(后文简称无碳源培养基)(K2HPO40.7 g、KH2PO40.7 g、MgSO4·7H2O 0.7 g、NH4NO31.0 g、NaCl 0.005 g、FeSO4·7H2O 0.002 g、ZnSO4·7H2O 0.002 g、MnSO4·H2O 0.001 g、蒸馏水1000 mL、琼脂粉18 g、pH 7.2);PE粉末(相对分子质量分别为2000、5000、100000);PE膜片(相对分子质量>400000);ABTS、愈创木酚。高氏I号培养基(沈萍等,2007)。
1.3 菌种
实验菌株分离自成都某覆盖有地膜的农田土壤。
1.4 菌株的分离纯化与鉴定
参考罗贝旭(2013)的方法进行聚乙烯降解菌的筛选。称取相对分子质量分别为2000、5000、100000的纯聚乙烯粉末进行紫外灭菌3 h后备用;将10 cm×3 cm聚乙烯膜片分别用50%、75%、95%的乙醇,蒸馏水各清洗3次(Suresh et al.,2011),烘干后称量其初始质量,紫外灭菌备用。对筛选得到的优势菌株L1进行形态学观察(李晓玲,2011)、生理生化实验(晋果果等,2011)和16S rDNA序列分析(冯思玲,2009)。
1.5 菌株降解特性的研究
1.5.1 培养液成分测定
配制0.1%(W/V)PE粉末(相对分子质量分别为2000、5000、100000)以及10 cm×3 cm聚乙烯膜片(相对分子质量>400000)的无碳源液体培养基,每组3个平行。接种0.2%(V/V)的L1菌悬液,每隔24 h测定OD600值;采用考马斯亮蓝法测上清液总蛋白含量;DNS法测还原糖含量;测量pH值以及漆酶和锰过氧化物酶酶活力。
参考张鹏(2007)的漆酶测定反应体系,采用ABTS法测定菌株L1是否产漆酶及其酶活力;参考周金燕等(1993)的锰过氧化物酶测定反应体系,采用愈创木酚法测定菌株L1是否产锰过氧化物酶及其酶活力;1个酶活单位(U)定义为每分钟使OD值增加0.001所需要的酶量(林俊芳等,2009),即:

1.5.2 残留聚乙烯固体物质的性能测定
将培养液离心,去除上清液,沉淀进行超声破碎,于滤纸上反复冲洗过滤,40 ℃下烘干。称量剩余聚乙烯粉末质量。聚乙烯膜片清洗参考Briassoulis et al.(2004)的方法,真空冷冻干燥过夜,称量剩余固体质量,计算PE失重率:

干燥后的膜片使用离子溅射仪进行喷金,于扫描电子显微镜下观察。另取洗净干燥的完整膜片,进行拉伸强度、断裂伸长率以及水接触角测定(曹民干等,2006)。
1.6 数据处理
研究数据运用SPSS 17.0进行综合统计分析,Origin 8.0进行绘图。
2 结果
2.1 菌株鉴定结果
2.1.1 形态学观察和生理生化实验鉴定结果
菌株L1在高氏培养基中的单菌落边缘呈不规整乳白色干粉状圆形菌落,菌落中间凹陷、龟裂呈肉粉色,培养基被染成紫色,划线方式接种的菌苔生长连续,边缘不齐整呈放射干粉状(如图1a、图1d)。在PE粉末培养基中,L1围绕粉末旺盛生长,呈白色颗粒状圆形菌落。PE膜片培养基中,L1沿膜片边缘生长,使膜片边缘变黄(如图1b、图1e)。L1菌丝基本无分支;分生孢子呈长圆形,排列紧密呈结节状(如图1c、图1f)。
表1为菌株L1各项生理生化实验鉴定结果。

表1 菌株L1的各项生理生化指标结果Table 1 The Physiological and biochemical indexes of strain L1
2.1.2 系统发育树构建
将菌株L1的16S rDNA进行BLAST同源性比较分析,挑选出相似度在99%以上的11组同源序列,制作系统发育进化树,见图2。通过比对,发现菌株L1与Amycolatopsis orientalis出自同一个分支,自展值为77,两者的亲缘关系最接近。根据上述形态学观察和生理生化鉴定以及进化树的对比结果,菌株L1被鉴定为放线菌属的东方拟无枝酸菌(Amycolatopsis orientalis)。

图1 菌株L1的形态学观察Fig. 1 Morphological observation of strain L1
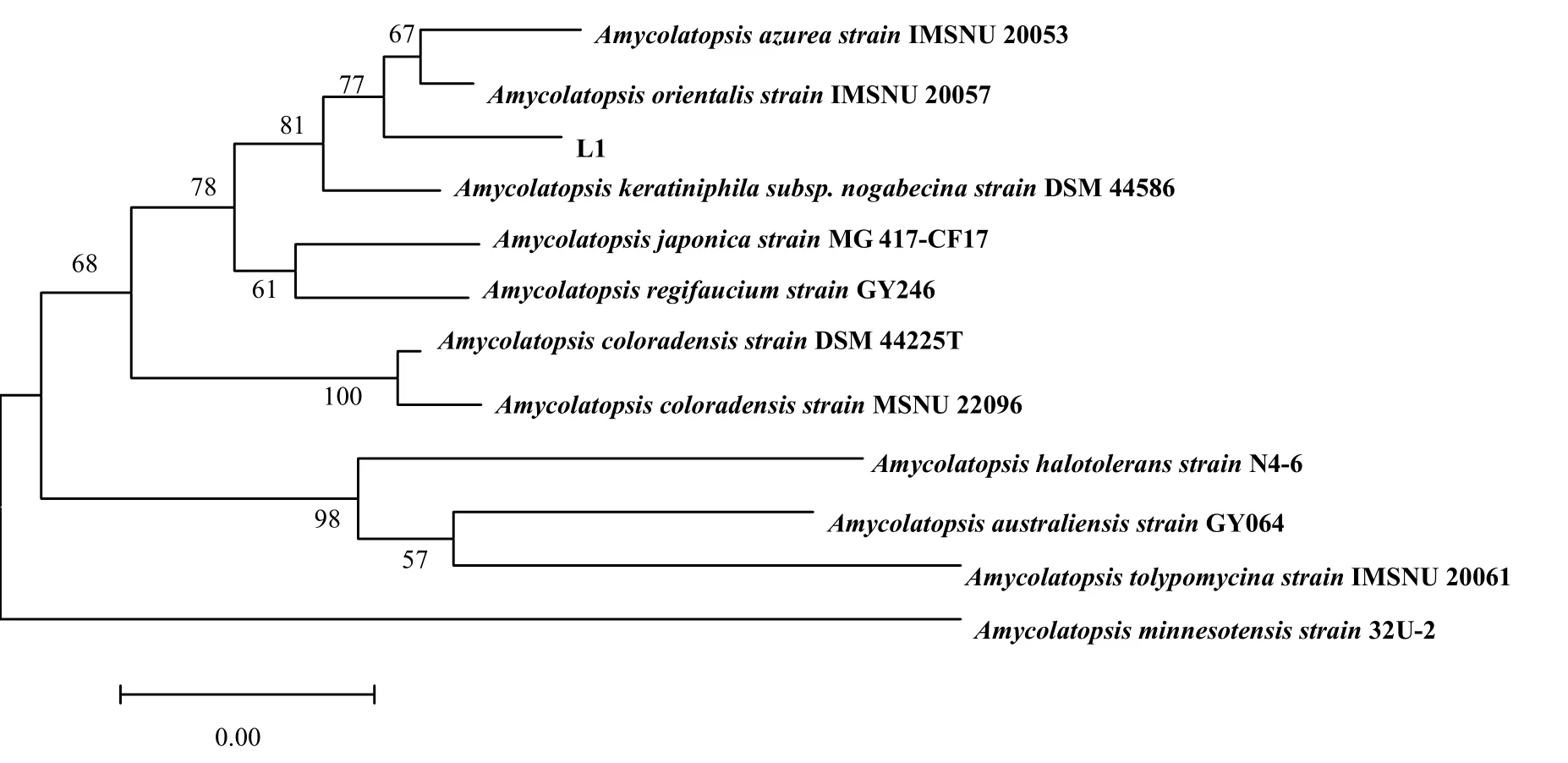
图2 菌株L1的系统发育进化树Fig. 2 Phylogenetic tree of strain L1 based on 16S r RNA sequences
2.2 菌株降解特性的研究结果
2.2.1 无碳源培养基中的液体成分测定
菌株L1在含聚乙烯(相对分子质量分别为2000、5000、100000粉末和>400000膜片)的无碳源培养基中,分别经过了6 d、14 d、20 d和30 d进入对数期。各组测得OD600最大值分别为(0.727±0.013)、(0.447±0.010)、(0.382±0.011)和(0.322±0.007),上清液总蛋白质量浓度最大值分别为(27.625±0.400)、(4.958±0.300)、(2.938±0.150)、(0.958±0.180) μg·mL-1。高氏组还原糖质量浓度为(22.091±1.913) μg·mL-1,聚乙烯相对分子质量分别为2000、5000、100000的粉末组和膜片组的还原糖质量浓度分别为(15.664±1.764)、(12.152±1.833)、(7.668±1.764)和(2.660±0.000) μg·mL-1。经测定,培养液中含有漆酶和锰过氧化物酶,酶活力分别为3000~3500 U·L-1和2000~2600 U·L-1。各组pH值均有不同程度下降,如图3(d)所示,14 d后pH值为7.20,高氏组、2K组、5K组、10W组、膜片组分别下降到5.22、5.57、5.83、6.22、6.67(偏正值为±0.02)。

图3 菌株L1在无碳源培养液成分及含量测定Fig. 3 Growth curve and protein determination results of strain L1 in the culture medium with polyethylene as sole carbon source
2.2.2 残留聚乙烯固体物质的性能测定结果
电镜观察发现PE膜片上形成大量贯穿孔洞和降解微孔,且有菌株聚合附着,如图4b所示。
PE表面能的大小可由水接触角的大小来反映,接触角越大,表面能越低,疏水性越强。如表2所示,空白对照组为0 d组,其膜片水接触角为(78.58°±0.10°),疏水性强,60 d后,膜片水接触角缩至(41.25°±0.16°);膜片亲水性增强,表面能增大。膜片的拉伸强度以及断裂伸长率等力学性能也下降,膜片表现出卷边、多褶皱、易破损等现象。

图4 SEM观察聚乙烯膜片表面Fig. 4 SEM observation of the surface of polyethylene film
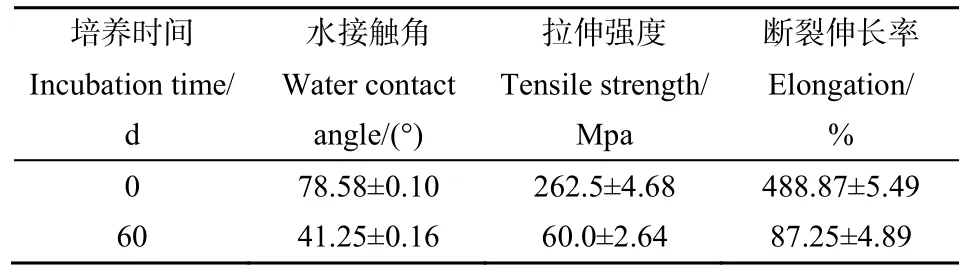
表2 膜片对照组和试验组的水接触角、拉伸强度、断裂伸长率测定结果Table 2 Water contact angle, tensile strength and elongation at break of the diaphragm between the control group and the test group

表3 聚乙烯生物降解60 d的失重率统计Table 3 Weight loss ratio of polyethylene biodegradation after 60 days
由表3可知,相对分子质量为2000的PE粉末降解率最大,降解效果最好,菌株长势最旺。其次依次为5000、100000、膜片,失重率分别为(35.81%±0.39%)、(22.14%±0.48%)、(12.19%±0.74%)和(5.57%± 0.22%)。烘干后的PE粉末跟实验前相比,颜色由白色变成暗黄色,附着有菌体。空白对照组,粉末外观在实验前后无变化。
3 分析与讨论
微生物在非偏好的环境下会启动适应机制来维持自身生命活动,一般微生物难以利用PE为碳源,PE并非东方拟无枝酸菌的偏好碳源,但该菌在PE培养基中的生长浓度高,证明菌株L1在生长过程中启动了适应机制,利用PE为碳源进行生长代谢。菌体生长时会包裹聚乙烯粉末,形成微小菌球,沉积于培养液底部,悬浮菌体减少,导致OD600值偏低。PE培养基中不含糖类物质,但经过14 d的培养后,在不同PE相对分子质量的培养液中检测出还原糖,说明东方拟无枝酸菌利用唯一碳源PE进行一系列生化反应,最终生成糖类物质,且在这个过程中还产生了酸性物质,导致pH值降低。相关研究表明,微生物在降解聚乙烯时,会分泌胞外聚合物;不管是酶类还是胞外聚合物,都有助于微生物侵蚀塑料表面(Volke et al.,2002)。
上清液蛋白含量可反映菌株分泌胞外蛋白的情况,测得的蛋白质浓度越高,说明菌体分泌胞外蛋白越多,降解PE的代谢活动越活跃;相对分子质量越低的PE,越容易被菌株利用。培养液残留PE固体物质分析结果表明,在菌株L1的作用下,PE重量减轻,后期清洗时,难以彻底洗脱PE材料上的菌体,导致称取的残留PE重量比实际重量大,导致失重率偏低。
电镜图像显示,膜片多处被降解,形成孔洞破损。力学性能和水接触角测定结果表明,L1作用后的PE材料,膜片上出现孔洞,导致膜片质地不均,受力不均,抗拉性能下降;亲水性增强,表面能增大,推测降解过程中,菌株将PE的烃链氧化,生成了-OH、-CHO、-COOH、-COOC-等亲水性基团(卢景江,2014)。
ABTS法和愈创木酚法检测结果表明,培养液中有漆酶和锰过氧化物酶产生,且二者的酶活力较高。Santo et al.(2013)发现漆酶能够作用于聚乙烯分子并产生羰基,从而降低聚乙烯分子的相对分子质量;还有研究指出(杨金水等,2003)锰过氧化物酶(MnP)被培养基中的电子供体Mn2+还原,Mn2+变成Mn3+,再与有机酸结合形成稳定高氧化还原电势,在脂肪酸等介质的助力下,可以切断稳定的化学键,如C-H。推测本实验中,漆酶首先对烃链进行末端氧化,使长链断裂成短链,适当相对分子质量大小的短链能被菌体利用生成脂肪酸,而后进入脂肪酸β氧化途径,最终生成H2O、CO2和腐殖质;降解体系中,在逐步产生-COOH并初步形成脂肪酸后,MnP就开始发挥其断裂长烃链C-H键的作用。
4 结论
本研究从土壤中分离出了东方拟无枝酸菌,发现其在环境保护与治理方面具有特殊潜能。在相对分子质量越小的无碳源培养基中,东方拟无枝酸菌菌体浓度和蛋白浓度越高,聚乙烯失重率越大,降解效果越好。该菌株能以低相对分子质量、中高相对分子质量以及高相对分子质量甚至超高相对分子质量PE为唯一碳源和能源进行生长。该菌株在降解膜片过程中改变了PE分子结构,增加了PE表面官能团数量,使其力学性能降低,亲水性增大,有利于菌体粘附并降解PE。东方拟无枝酸菌分泌具有水解和氧化作用的胞外酶,对PE长烃链进行氧化和断链。本研究推测氧化酶类——漆酶、氧化还原酶类——锰过氧化物酶与东方拟无枝酸菌降解PE有关。本研究结果为后期研究东方拟无枝酸菌降解聚乙烯的机理奠定了理论基础,拓宽了聚乙烯降解菌株资源库,对将来研究塑料生物降解机理具有一定辅助作用。
ABRUSCI C, PABLOS J L, CORRALES T, et al. 2011. Biodegradation of photo-degraded mulching films based on polyethylenes and stearates of calcium and iron as pro-oxidant additives [J]. International Biodeterioration & Biodegradation, 65(3): 451-459.
BRIASSOULIS D, ARISTOPOULOU A, BONORA M, et al. 2004. Degradation characterisation of agricultural low-density polyethylene films [J]. Biosystems engineering, 88(2): 131-143.
FUJISAWA M, HIRAI H, NISHIDA T. 2001. Degradation of polyethylene and nylon-66 by the laccase-mediator system [J]. Journal of Polymers and the Environment, 9(3): 103-108.
HARSHVARDHAN K, JHA B. 2013. Biodegradation of low-density poly-ethylene by marine bacteria from pelagic waters, Arabian Sea, India [J]. Marine Pollution Bulletin, 77(1): 100-106.
IOAKEIMIDIS C, FOTOPOULOU K N, KARAPANAGIOTI H K, et al. 2016. The degradation potential of PET bottles in the marine environment: An ATR-FTIR based approach [J]. Science Reports, 6(23501): 1-8.
SANTO M, WEITSMAN R, SIVAN A. 2013. The role of the copper-binding enzyme-laccase-in the biodegradation of polyethylene by the aetinomycete Rhodococcus ruber [J]. International Biodeterioration & Biodegradation 84: 204-210.
SOWMYA H V, KRISHNAPPA M, THIPPESWAMY B. 2014. Degradation of polyethylene by Trichoderma harzianum—SEM, FTIR, and NMR analyses [J]. Environmental monitoring and assessment [J]. 186(10): 6577-6586.
SURESH B, MARUTHAMUTHU S, KANNAN M, et al. 2011. Mechanical and surface properties of low-density polyethylene film modified by photo-oxidation [J]. Polymer Joumal, 43: 398-406.
VOLKE-S T, SAUCEDO-C G, GUTIERREZ-R M, et al. 2001. Thermally treated low density polyethylene biodegradation by Penicillium pinophilum and Aspergillus niger [J]. Journal of Applied Polymer Science, 83(2): 305-314.
YOSHIDA S, HIRAGA K, TAKEHANA T, et al. 2016. A bacterium that degrades and assimilates poly (ethylene terephthalate) [J]. Science, 351(6278): 1196-1199.
曹民干, 张永福. 2006. 聚乙烯薄膜的生物降解研究[J]. 塑料工业, 34(增刊): 249-251.
崔福斋, 冯庆玲. 2004. 生物材料学[M]. 北京: 清华大学出版社: 3-5 .
冯思玲. 2009. 系统发育树构建方法研究[J]. 信息技术, 6(32): 38-40, 44.
晋果果, 翁海波, 李萍萍等. 2011. 高温木质素降解菌Geobacillus caldoxylosilyticus J16的筛选及其产酶发酵性质研究[J]. 中国农学通报, 27(8): 334-339.
李晓玲. 2011. 红树林来源白浅灰链霉菌MGR072次级代谢产物的研究和核糖体工程优化[D]. 福建厦门: 国家海洋局第三海洋研究所: 3-5.
林俊芳, 刘志明, 陈晓阳, 等. 2009. 真菌漆酶的酶活测定方法评价[J].生物加工过程, 7(4): 1-8.
卢景江. 2014. 胶质类芽孢杆菌KNP414抗逆比较基因组及氮饥饿的转录组分析[D]. 杭州: 浙江理工大学: 1.
罗贝旭. 2013. 聚乙烯降解菌的筛选、鉴定和降解特性的研究[D]. 成都:四川师范大学: 13-32.
沈萍, 陈向东. 2007. 微生物学实验[M]. 北京: 高等教育出版社: 241.
杨金水, 袁红莉, 陈文新. 2003. 锰过氧化物酶 (MnP) 的研究进展[J].生物技术, 13(2): 45-47.
杨军, 宋怡玲, 秦小燕. 2007. 聚乙烯塑料的生物降解研究[J]. 环境科学, 28(5): 1165-1168.
张鹏. 2007. 以ABTS为底物测定漆酶活力的方法[J]. 印染助剂, 24(1): 43-45.
周金燕, 张发群, 舒远才. 1993. 愈创木酚测定锰过氧化物酶活力[J]. 纤维素科学与技术, 1(1): 34-37.
Screening A Polyethylene Degrading Strain and Study on the Degradation Characteristics
ZHONG Yue1, LI Yuzhu1, ZHANG Ronglin1, LUO Beixu1, ZHANG Erliang1*, TAO Zongya1, ZHU Wenkun2
1. College of life sciences, Sichuan Normal University, Chengdu 610101, China;
2. College of life science, Southwest University of Science and Technology, Mianyang 621010, China
This is a study about the solution to degrade the refractory polyethylene plastic in natural environmental .We disintegrated a strain from soil that could degrade polyethylene plastic. After screening and purification, we began our experiments by doing physiological and biochemical identification, 16S rDNA sequence cloning and constructing a phylogeny tree. In this case, polyethylene powder (relative molecular mass was 2 000, 5000 and 100 000, respectively) and polyethylene film (relative molecular mass was greater than 400 000) served as the sole carbon source successively, the strain could grow in the based liquid medium then cultured in 28 ℃, 180 rpm. Every 24 h, we measured the thalli growth concentration, reducing sugar and pH value in spectrophotometry. After 14 days ,we measured the activity of laccase and manganese peroxidase in ABTS assay and methoxyphenol method. 60 days later, we weighed the polyethylene’s remaining, observed the apparent film by using the scanning electron microscopy and measured the changes about the film of mechanical properties. The results showed that it was identified as Amycolatopsis orientalis. The growth concentration got smaller when the relative molecular mass of polyethylene got bigger. Extracellular protein content was (27.625±0.400)~(0.958±0.180) μg·mL-1. The reducing sugar was loaded with (15.664±1.764)~(2.660±0.000) μg·mL-1. And the pH value was decreased dramatically. The enzyme activity of laccase and manganese peroxidase was 3 500~3 000 U·L-1and 2 600~2 000 U·L-1. The weight loss rate of polyethylene was (35.81%±0.39%)~(5.57%±0.22%). We observed that a large number of pores and large area of cell adhered to the surface of the PE film via SEM. Mechanical properties of the film was decreased dramatically, the surface energy was decreased, the contact angle of the film became smaller. It was proved that Amycolatopsis orientalis could degrade polyethylene directly and efficiently. Our study speculates this stain can secrete exoenzyme, and oxidate the polyethylene long hydrocarbon chains. At the same time, it can increase the surface energy of polyethylene. At the end, long hydrocarbon chains will transform into small molecular. We predicted that laccase and manganese peroxidase play an important role in degrading the polyethylene.
polyethylene plastics; Amycolatopsis orientalis; biodegradation; laccase; manganese peroxidase
10.16258/j.cnki.1674-5906.2017.04.020
X172
A
1674-5906(2017)04-0681-06
钟越, 李雨竹, 张榕麟, 罗贝旭, 张尔亮, 陶宗娅, 竹文坤. 2017. 一株聚乙烯降解菌的筛选及其降解特性研究[J].生态环境学报, 26(4): 681-686.
ZHONG Yue, LI Yuzhu, ZHANG Ronglin, LUO Beixu, ZHANG Erliang, TAO Zongya, ZHU Wenkun. 2017. Screening a polyethylene degrading strain and study on the degradation characteristics [J]. Ecology and Environmental Sciences, 26(4): 681-686.
国家级大学生创新创业训练计划项目(201610636017);四川省生物质改性材料工程技术研究中心课题(11ZXBK03)
钟越(1990年生),女,硕士研究生,从事应用与环境微生物学研究。E-mail: 1990yaoyao@163.com
*通信作者:张尔亮(1959年生),男,教授,硕士,从事应用与环境微生物学研究。E-mail: 1074356205@qq.com
2016-11-01

