高效液相色谱化学发光法检测牛奶中磺胺类药物残留
段婕++李兴华++刘坤++张淑娟++马莉++石红梅

摘要 以4种磺胺类药物(ulfonamides, As), 即磺胺脒(ulfaguanidine, GD)、磺胺嘧啶(sulfadiazine, DZ)、磺胺噻唑(sulfathiazole, Z)和磺胺二甲嘧啶(ulfamethazine,MZ)为分析物,基于其在碱性介质中对Ag配合物鲁米诺(Luminol)与Ni配合物鲁米诺两化学发光体系发光强度均具有抑制作用的性质,建立了高效液相色谱化学发光法检测牛奶中4种磺胺类药物的方法。将化学发光体系作为高效液相色谱的新型检测器,并对两种化学发光体系的检测器性能进行了比较。4种磺胺药物经高效液相色谱分离后,分别与AgLuminol及NiLuminol化学发光体系作用。色谱条件为:反相C18分离柱(250 mm × 46 mm,5 μm); 01%甲酸甲醇为流动相(V/V); 梯度洗脱; 流速1 mL/min。化学发光条件:Ag、NiLuminol两体系中,Ag配合物浓度14×10
ymbolm@@ 4 mol/L(含012 mol/L NaO); Ni配合物浓度15×10
ymbolm@@ 5 mol/L(含012 mol/L NaO); Luminol濃度均为12×10
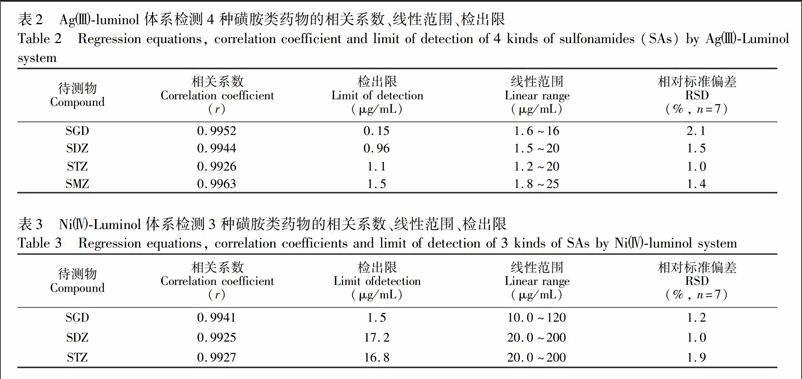
ymbolm@@ 7 mol/L; 试剂流速均为10 mL/min。在最佳的分离检测条件下,AgLuminol体系检测4种磺胺类药物的检出限分别为015、096、110和150 μg/mL,加标回收率为810%~1015%; NiLuminol体系检测GD、DZ、Z 3种磺胺类药物的检出限分别为15、172和168 μg/mL,加标回收率为839%~1108%。相比之下,AgLuminol体系作为高效液相色谱检测器更佳。应用本方法对牛奶中4种磺胺类药物残留量进行检测,结果令人满意。
关键词 高效液相色谱; 化学发光; Ag配合物; Ni配合物; 磺胺类药物
1引 言
磺胺类药物(ulfonamides,As)为人工合成的一类抗菌药物,在兽医临床上广泛用于预防和治疗动物细菌感染性疾病,常用磺胺药物有磺胺脒(ulfaguanidine,GD)、磺胺嘧啶(ulfadiazine,DZ)、磺胺噻唑(ulfathiazole,Z)、磺胺二甲嘧啶(ulfamethazine,MZ)等。动物饲养过程中若长期使用抗生素类药物,会使动物体内致病细菌产生耐药,给动物疾病检疫与防治带来不利影响,且会使药物残留在动物体内。磺胺类药物残留期长,在畜禽等动物源性食品中的残留,严重危害食品安全与公众健康。
文献报道了许多用于检测动物源性食品中磺胺类药物多组分残留的方法,其中以高效液相色谱法(igh performance liquid chromatography,PLC)应用最普遍[1]。反相PLC连接紫外(UV)\[2\]、二极管阵列(DAD)\[3\]、荧光(FL)\[4\]检测器广泛用于食品、环境中As残留的例行分析,PLCM/M以其高灵敏度及选择性用于检测或确证分析中\[5,6\]。UV、DAD检测器用于磺胺类及其它抗生素残留检测时灵敏度受限; FL检测器灵敏度高,但As需柱前衍生,合适的衍生试剂不易筛选; M或M/M检测器最有优势,但仪器及运行成本的压力,使其不易普及。
近年来,化学发光分析法(Chemiluminescence,CL)以其灵敏度高、线性范围宽、仪器设备简单、分析速度快等优点,广泛用于环境、生物、生化样品分析中\[7~9\]。鲁米诺(Luminol)体系是最经典的化学发光体系\[10~12\],其发光机理为:鲁米诺在碱性条件下被氧化剂氧化,氧化产物吸收氧化还原反应放出的热量后被激发,激发态回到基态辐射发光。本课题组在前期研究中发现,过渡金属超常氧化态与适当多齿配体络合形成的配合物,在一定条件下能稳定存在并具有较强的氧化性能,如Ag和Ni与过碘酸形成的配合物\[Ag(IO6)2\]5
ymbolm@@ , \[Ni(IO6)2(O)2\]
ymbolm@@ 6在碱性条件下是良好的氧化剂\[13~16\]。将Ag、Ni配合物与鲁米诺组成化学发光体系,通过待测组分对Ag、NiLuminol发光体系的增敏或抑制作用,已成功用于β2受体激动剂、皮质醇等多种药物或生物分子的检测,且具有极高的灵敏度\[17,18\]。
化学发光灵敏度高,但方法的选择性差。若将PLC的高效分离能力与CL的高灵敏性结合,首先采用PLC将混合物中的各组分得到有效分离,再利用化学发光检测系统对各组分进行灵敏检测,是一种兼顾高灵敏度与高分辨力的物质分离与检测新方法。本实验以动物源性食品中最易残留的4种磺胺类药物,即磺胺脒、磺胺嘧啶、磺胺噻唑和磺胺二甲嘧啶为分析物,基于其对AgLuminol与NiLuminol两化学发光体系发光强度均具有抑制作用的性质,建立了PLCCL检测体系同时分离分析牛奶中4种磺胺类药物的方法,并对两种检测器的性能进行了比较,为PLC法在抗生素残留检测中新检测器的开发提供了思路。同时,对比AgLuminol与NiLuminol两体系在检测灵敏度及检测稳定性等方面的不同,以期更好地与高效液相色谱联用。
2实验部分
21仪器与试剂
PD15C高效液相色谱仪(岛津公司 ); IFFME型流动注射化学发光分析仪(西安瑞迈分析仪器有限责任公司); B5200D超声波清洗机(宁波新芝生物科技股份有限公司); U1901型双光束紫外可见分光光度计(北京普析仪器公司); N500超声波信号发生器(上海汗诺仪器有限公司)。
磺胺脒(GD)、磺胺嘧啶(DZ)、磺胺噻唑(Z)、磺胺二甲嘧啶(MZ),纯度>98%,均购于德国Dr Ehrenstorfer公司; 鲁米诺(日本CI公司); 甲醇(瑞典Oceanpa公司)等。甲醇为色谱纯,其它试剂均为分析纯,实验用水为超纯水。
GD、DZ、Z、MZ储备溶液:称取适量GD、DZ、Z、MZ标准品,用40%甲醇配制成10 mg/mL 的标准储备液。其中磺胺嘧啶配制过程中加入几滴01 mol/L NaO溶液促进溶解,
ymbolm@@ 4℃保存。使用时,以纯水稀释至所需浓度。
鲁米诺储备溶液:称取适量鲁米诺标准品,溶于10 mol/L NaO溶液中,以超纯水定容。
Ag和Ni配合物储备液分别依据文献\[19,20\]制备,\[Ag(IO6)2\]5
ymbolm@@ 储备液浓度由其362 nm处的摩尔吸光系数(ε=126×104 L·mol
ymbolm@@ 1·cm
ymbolm@@ 1)测定得到。依据\[Ni(IO6)2(O)2\]6
ymbolm@@ 配合物在410 nm处的摩尔吸光系数(ε=106×105 L·mol
ymbolm@@ 1·cm
ymbolm@@ 1)测定储备液中Ni配离子浓度。工作液均用超纯水稀释。
22高效液相色谱化学发光检测装置
本实验系统由高效液相分离装置和化学发光检测体系装置通过三通接头和聚四氟乙烯管连接而成。液相部分由高压输送泵、进样系统、色谱柱等组成,化学发光部分由蠕动泵、光电倍增管、检测池等组成。实验通路如图1所示:样品由六通阀进样后,经色谱柱分离、进入检测器,与此同时Ag或Ni与鲁米诺溶液经三通阀“5”处混合并发生反应,流经三通阀“6”时与样品溶液混合,进入检测池检测发光强度。
色谱条件: C18色谱柱(250 mm×46 mm, 5 μm); 流动相01%甲酸甲醇混合液,甲醇用前以微孔有机滤膜(045 μm)过滤,01%甲酸溶液用微孔水系滤膜(045 μm)过滤,超声脱气; 流速: 10 mL/min; 温度:30℃; 进样量:20 μL。梯度洗脱程序见表1。 化学发光条件:试剂流速10 mL/min; \[Ag\]=14×10
ymbolm@@ 4 mol/L; \[Ni\]=15×10
ymbolm@@ 5 mol/L; \[NaO\]=012 mol/L; \[Luminol\]=12×10
ymbolm@@ 7 mol/L; L1=3 cm, L2=2 cm。
23樣品处理
根据国家标准方法\[21\],取样品(50±05) mL,置于50 mL聚四氟乙烯离心管中,加入25 mL 01% ClO4溶液,用水调节至p 2,于涡旋振荡器振荡提取1 min,超声波萃取10 min,备用。LB固相萃取柱依次用3 mL甲醇和5 mL 01% ClO4 (p 2)活化,取备用液过柱,再用5 mL 超纯水淋洗,抽干,用3 mL甲醇洗脱。收集洗脱液,于40℃氮气吹至02 mL,甲醇01%甲酸(1∶19,V/V)溶液补至10 mL,过045 μm滤膜过滤,待测。
3结果与讨论
31高效液相色谱条件的优化
初步实验表明,在本实验体系中,高效液相色谱有机相的比例对化学发光体系的影响较大,当甲醇或乙腈的有机相的比例过大时,一方面造成PLCCL体系的基线噪声大,且重复性较差,另一方面,由于高效液相色谱装置与化学发光装置通过有机玻璃三通阀连接,甲醇、乙腈等有机溶剂易腐蚀玻璃,对实验设备及实验结果产生一定影响,故在实验过程中应控制高效液相色谱中有机相的比例。
PLC法测定磺胺类药物的流动相体系主要有:乙酸乙腈,甲醇磷酸盐溶液等\[22~26\]。实验发现,乙腈磷酸盐、甲醇乙酸及甲醇甲酸体系均能使4种磺胺类物质得到较好的分离,但结合化学发光体系表明,乙腈较甲醇对化学发光信号的影响较大,乙酸较甲酸对化学发光信号的影响较大,均造成基线不稳定、噪声大等情况,故最终确定流动相为甲醇01%甲酸。
进一步研究表明,随着甲醇比例的增大,化学发光信号的基线噪声随之增大。且由于磺胺脒柱上的保留较弱,为使4种检测物质均能在最佳时间内出峰,采用了梯度洗脱程序。综合考虑分离效果及化学发光信号稳定情况,采用表1梯度洗脱程序,流速10 mL/min时,4种被检物质均能在25 min之内流出,且峰形良好,同时保证了对化学发光信号稳定程度的影响最小。
32化学发光条件的优化
321化学发光装置流路参数的选择在其它条件一定的情况下,考察了试剂流速对信噪比的影响。结果表明,试剂流速在10 mL/min时信噪比为最佳。
322Ag和Ni浓度的优化考察了50×10
ymbolm@@ 5~20×10
ymbolm@@ 4 mol/L浓度范围内的Ag和50×10
ymbolm@@ 6~30×10
ymbolm@@ 5 mol/L的Ni配合物浓度对光强及信噪比的影响(图2)。结果表明,随着Ag和Ni浓度增大,化学发光信号逐渐增大。但随着信号的增强,信噪比随之减小。当Ag和Ni的浓度分别为14×10
ymbolm@@ 4 mol/L和15×10
ymbolm@@ 5 mol/L时,两体系中被测物质相对化学发光信号较强,信噪比最大,最终确定此浓度为实验最佳浓度。
323Ag和Ni配合物溶液中NaO浓度的优化分别考察Ag和Ni配合物溶液中NaO浓度(005~030 mol/L)对AgLuminol和NiLuminol化学发光体系相对化学发光强度的影响。结果表明,NaO浓度增加,4种磺胺类药物对两种体系的化学发光强度的抑制作用增强,且噪声随之增大,当NaO浓度为012 mol/L时,磺胺类药物对两种体系的化学发光信号的抑制作用最强,且信号稳定,信噪比较大(图3)。故本实验最终选择Ag和Ni配合物溶液碱度均为012 mol/L。
324魯米诺溶液浓度的优化在50×10
ymbolm@@ 8~20×10
ymbolm@@ 7 mol/L范围内考察鲁米诺溶液浓度对化学发光信号强度及噪声的影响(图4)。结果表明,随着鲁米诺浓度升高,相对化学发光强度逐渐增大。但当其浓度为15×10
ymbolm@@ 7 mol/L时,基线噪声显著上升,造成信号不稳定,影响峰高,且信噪比逐渐减小。故实验中最佳鲁米诺浓度选择为12×10
ymbolm@@ 7 mol/L。
33工作曲线、精密度与检出限
在优化的条件下,对磺胺类物质系列标准溶液进行测定,回归方程、检出限等参数见表2和表3。检出限的峰高值为3倍的基线噪声(/N=3)。对样品进行7 次平行测定,两体系相对标准偏差分别为10%~21%和10~19%。
34AgLuminol及NiLuminol化学发光机理推断
Ag、Ni过碘酸配合物在碱性介质中均为良好的氧化剂,Ag配合物氧化还原电位E=174 V\[26\], 较Ni配合物的电位高,氧化能力更强。氧化目标物时,Ag反应速度较Ni配合物快,但实验表明,Ni配合物氧化体系更稳定; 分别与鲁米诺组成化学发光体系后,Ag体系较Ni体系更灵敏,但Ni体系检测范围更广。
采用AgLuminol和NiLuminol两化学发光体系作为PLC检测器对磺胺类药物进行检测时,前者更为灵敏,检出限明显较低,线性范围较宽,而Ni检测体系较前者稳定性好。Ag与Ni的氧化能力与其浓度、NaO浓度有关,随着配合物浓度增大,AgLuminol体系及NiLuminol体系的化学发光强度呈增强降低再增强再降低的趋势,这可能与配合物在不同条件下配位平衡发生改变,从而影响其氧化能力有关。
据前期研究\[27,28\]推断,此检测体系可能的检测机理为:在碱性介质中,
作为氧化剂的Ag及Ni配合物与鲁米诺组成化学发光体系,配合物氧化鲁米诺产生化学发光,即为基线信号(I0)。4种磺胺类药物经PLC分离后进入CL检测体系,分别与两化学发光体系作用,产生发光信号(It),且对基线强度均有抑制作用,相对减弱强度ΔI(ΔI =I0-It) 与磺胺药物浓度C呈线性关系。Ag、Ni配合物和鲁米诺及磺胺药物的反应均为自由基反应,
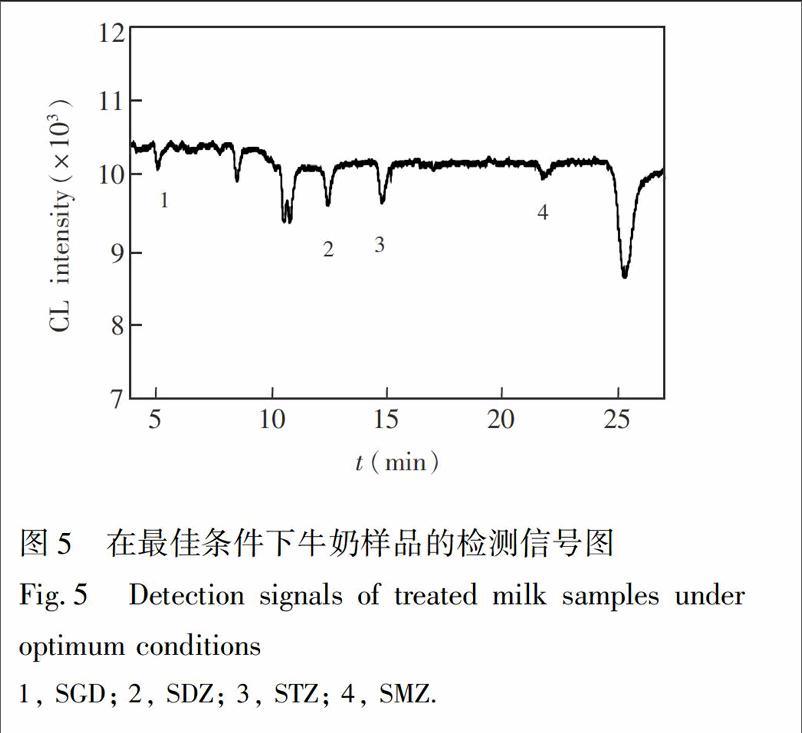
1, GD; 2, DZ; 3, Z; 4, MZ而磺胺类药物与Ag和Ni配合物的反应速率较与鲁米诺反应速率慢,反应过程中,鲁米诺产生的自由基转移给磺胺类药物一部分,从而使鲁米诺的自由基减少,发光体的量减少,使得体系的发光强度降低。
35样品分析和回收率实验
在优化的条件下,对处理过的牛奶样品进行了测定。5份购于超市的牛奶样品,均未检出4种磺胺类物质,对照高效液相色谱紫外检测器法,结果为未检出。按照已优化的条件对加标后处理过的样品进行分离测定,图5为PLCAgLuminol测定牛奶中4种磺胺类药物色谱图。
取牛奶样品9份, 依次加入4种磺胺类物质标准品,每份样品按照样品前处理的方法进行处理,制得低、中、高 3 种浓度水平的加标样品,每份样品平行测定3次(表4和表5),计算得回收率为810%~1108%。
上述结果表明,采用Ag鲁米诺和Ni鲁米诺两化学发光体系作为高效液相色谱新型检测器,适用于食品中磺胺类药物残留的检测,为高效液相色谱法新检测器的开发提供了参考。
References
1XU Weiai, LIN LiMing, ZU XiaoBin, WANG Xining Journal of Instrumental Analysis, 2004, 23(5): 122-124
徐维海, 林黎明, 朱校斌, 王新亭 分析测试学报, 2004, 23(5): 122-124
2Karimi M, Aboufazeli F, Zhad R I Z, adeghi O, Najafi E Food Anal Methods, 2014, 7: 73-80
3Macedo A N, Brondi G, Vieira E M Food Anal Methods, 2013, 6: 1466-1476
4ArroyoManzanares N, GmizGracia L, GarcíaCampaa A M Food Chem, 2014, 143: 459-464
5PANG GuoFang, CAO YanZhong, ZANG JinJie Chinese J Anal Chem, 2005, 33(9): 1252-1256
庞国芳, 曹彦忠, 张进杰 分析化学, 2005, 33(9): 1252-1256
6Nebot C, Regal P, Miranda J M, Fente C, Cepeda A Food Chem, 2013, 141: 2294-2299
7ahereh K, Reza A, Mohammad J C, Ehsan R, amid G J Photochem Photobiol A, 2014, 282: 9-15
8un W, Wang , Liu X Y, Chen P Y J Lumin, 2013, 134: 154-159
9Zheng W, Zhang Q Y, Quan J P, Zheng Q, Xi W P Food Chem, 2016, 205: 112-121
10Knight A W, Greenway G M Analyst, 1994, 119: 879-890
11Ahn K , Lee J , Park J M, Choi N, Lee W Y Biosens Bioelectron, 2016, 75: 82-87
12anif , an , John P, Gao W Y, Kitte A, Xu G B, Wang J, Peng Y, Zhu J J Electrochim Acta, 2016, 196: 245-251
13William L, picer M D Coord Chem Rev, 1987, 76: 45-120
14arihar A L, Kembhavi M R, Nandibewoor Monatsh Chem, 2000, 131(11): 1129-1137
15Kumar A, Vaishali, Ramamurthy P Int J Chem Kinet, 2000 , 32(5): 286-293
16CEN FuBin, YANG ChunYan, ZANG ZhuJun J Instrum Anal, 2014, 33(3): 354-357
陈复彬, 杨春艳, 章竹君 分析测试学报, 2014, 33(3): 354-357
17Diao Y J, Dong X, Dai , Kang W J, hi M Monatsh Chem, 2016, 147(10): 1669-1674
18hi M, Xu X D, Ding Y, Liu , Li L, Kang W J Anal Biochem, 2009, 387(2):178-183
19Blikungeri A, Pelletier M, Monnier D Inorg Chim Acta, 1977, 22(1): 7-14
20Murthy C P, ethuram B, Rao N Z Phys Chem, 1986, 267(6): 1212-1218
21GB/ 229662008, Determination of ixteen ulfonamide Residues in Milk and Milk PowderLCMM Method National tandards of the Peoples Republic of China
牛奶和奶粉中16 种磺胺类药物残留量的测定液相色谱串联质谱法 中华人民共和国国家标准 GB/ 229662008
22Kim J, Jeong M , Park J, Kim W C, Kim J E Food Chem, 2016, 196: 1144-1149
23Manzanares N A, Gracia L G Food Chem, 2014, 143: 459-464
24Mahmoud W M M, Khaleel N D , adad G M, alam R A A, ai A, Kümmerer K Clean (Weinh), 2013, 41(9): 907-916
25etzner N F, Maniero M G, ilva C R, Rath J Chromatogr A, 2016, 1452: 89-97
26Wen C , Lin L, Fuh M R alanta, 2016, 164: 85-91
27ethuram B ome Aspects of Electron ransfer Reactions Involving Organic Molecules, New Delhi: Allied Publishers Pvt Ltd, 2003: 151
28DAI inging, LIN uaPing, DUAN Jie, XU XiangDong, I ongMei Chinese J Anal Chem, 2016, 44(5): 747-753
代婷婷, 林華萍, 段 婕, 徐向东, 石红梅 分析化学, 2016, 44(5): 747-753

