亚低温疗法联合依达拉奉对大鼠脑缺血再灌注损伤的保护作用
吴达荣 曾志芬 陶恩祥△
1)深圳市龙岗中心医院,广东 深圳 518116 2)中山大学附属第二医院,广东 广州 510120
亚低温疗法联合依达拉奉对大鼠脑缺血再灌注损伤的保护作用
吴达荣1)曾志芬2)陶恩祥2)△
1)深圳市龙岗中心医院,广东 深圳 518116 2)中山大学附属第二医院,广东 广州 510120
目的 探讨亚低温疗法联合依达拉奉对大鼠脑缺血再灌注损伤后的保护作用。方法 采用线栓法建立局灶性脑缺血再灌注模型,缺血6 h后再灌注,并分为假手术组、模型组、依达拉奉组、亚低温联合依达拉奉组,再灌注24 h后进行神经功能缺损评分,采用TTC染色测定脑梗死体积和用免疫组化的方法检测Bax和Bcl-2的阳性细胞数。结果 与模型组比较,依达拉奉未能减少脑梗死体积,但能通过下调Bax及上调Bcl-2减少细胞的凋亡,对脑细胞有保护作用;与模型组、依达拉奉组比较,亚低温联合依达拉奉组能通过上调Bcl-2及下调Bax明显降低大鼠神经缺陷评分及减少脑梗死体积。 结论 亚低温疗法联合依达拉奉对大鼠脑缺血再灌注损伤具有很好的保护作用。
亚低温;脑缺血;依达拉奉;Bax;Bcl-2;大鼠
缺血性脑卒中发病率、致残率和病死率均高,已成为严重危害人类健康的疾病之一。脑梗死溶栓后,可产生血流再灌注损伤,加重脑损伤,与自由基产生、细胞凋亡有关。近年来研究表明,亚低温对缺血性脑损伤具有保护作用,是一种疗效肯定的治疗措施。依达拉奉是一种新型自由基清除剂,具有抗细胞凋亡和神经保护的作用。本研究旨在探讨亚低温疗法联合依达拉奉对大鼠脑缺血再灌注损伤后的保护作用,为临床治疗提供实验依据。
1 材料和方法
1.1 动物分组 健康雄性SD大鼠80只(清洁级,中山大学实验动物中心提供),体质量280~330 g 。依达拉奉注射液(必存),南京先声东元制药有限公司。TTC (2,3,5-氯化三苯基四氮唑),威佳生物技术公司。兔抗鼠Bax、Bcl-2多克隆抗体,美国Santa Cruz公司。将大鼠随机分为假手术组、模型组、依达拉奉组、亚低温联合依达拉奉组各20只。
1.2 方法 假手术组仅进行手术,不造成缺血状态,其余3组均采用线栓法建立大鼠大脑中动脉的局灶性脑缺血模型,于缺血6 h后实施再灌注。依达拉奉给药组于缺血时及再灌注后立即予依达拉奉3 mg·kg-1腹腔内注射。模型组给予等剂量生理盐水腹腔内注射。亚低温联合依达拉奉组在缺血后立即采用喷洒酒精和电扇降温的方法在10 min内使肛温降至30 ℃,相应的脑温为33 ℃[1-2]。33 ℃为最适脑温,恢复快,并发症少[3]。维持亚低温6 h后,实施再灌注,然后把大鼠转移到温度为5 ℃的房间内,调节肛温30 ℃,维持24 h[4]。
1.3 动物模型的制作 线栓法建立大鼠大脑中动脉(middle cerebral artery occlusion,MCAO)的局灶性脑缺血模型[5]。大鼠腹腔注射10 %水合氯醛(0.3 mL/100 g) 麻醉后,仰卧固定在手术台上,75 %乙醇消毒颈部皮肤,正中颈部切口,分离并暴露右侧颈总动脉(common carotid artery,CCA)、颈外动脉(external carotid artery,ECA)、颈内动脉(internal carotid artery,ICA),游离ECA主干及分支,距离分叉部约4mm处结扎ECA,电凝ECA 的分支,分离ICA主干至翼腭动脉(pterygopalatine artery,PPA)并将其从根部结扎。在术野中CCA近心端、ICA远心端分置动脉夹夹闭,于ECA主干置一不扎紧的缝线,残端用眼科手术剪剪一0.3 mm的切口,将预先制备好的头端成球状、直径为0.26处mm的栓线插入,扎紧ECA主干上的缝线,松开ICA远心端的动脉夹,轻推鱼丝线沿ICA入颅,鱼丝线插入深度(18.5±0.5)mm,扎紧ECA上丝线,松开CCA上的动脉夹,缝合皮肤切口。待达到缺血时间后,把线头往外轻拉,感到阻力时,表明鱼丝线的头端已经回到ECA的主干中,贴近皮肤剪去鱼丝线,实现再灌注,术后常规青霉素肌注预防感染,麻醉清醒后大鼠出现以左前肢为主的偏瘫作为模型成功的标志。假手术组鱼丝线插入深度为13 mm,其余步骤同实验组。
1.4 观察指标
1.4.1 神经功能缺损评分:再灌注后30 h行神经功能评分,采用Longa评分分级标准,即0分:无神经系统功能缺损症状,活动正常;1分:对侧前肢不能完全伸展;2分:爬行时向对侧转圈;3分:行走时身体向偏瘫侧倾倒;4分:不能自主行走,意识丧失;5分:死亡。1~4分为造模成功。
1.4.2 脑梗死体积百分比测定:用10%水合氯醛腹腔注射麻醉后,迅速剪开胸腔暴露心脏,经左心室先用100 mL肝素化生理盐水快速灌注,随后立即断头取脑,置于-20 ℃冰箱中冷冻20 min,从脑额极开始,每间隔2 mm作一冠状切片,层厚2 mm。置于2%TTC(2,3,5-氯化三苯基四氮唑)溶液中,严格避光,37 ℃水浴中孵育30 min,梗死区不着色,正常脑组织着红色。随即用4%多聚甲醛液固定,根据苍白区观察梗死灶范围。采用全自动图像分析系统计算每张切片的梗死灶面积及总面积,根据公式V = 2 (A 1 + A 2 + A n)计算梗死体积及总体积,其中2 为切片厚度,A 为面积[6]。脑梗死体积百分比=梗死体积/全脑体积。
1.4.3 组织学观察:断头取脑,取大脑视交叉前缘始向前的2 mm厚冠状切片,置于含4%多聚甲醛溶液中固定,常规脱水、透明、石蜡包埋、连续冠状切片,切片厚度5 μm,切片贴附于预处理的载玻片上。相邻切片分别作Bax 、Bcl-2免疫组化染色。胞浆着色呈棕黄色为阳性细胞。每张切片于高倍镜(×400)下将缺血灶周边区皮质和纹状体的5个视野计数[7]。
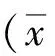
2 结果
2.1 各组神经功能缺损评分、脑梗死体积百分比比较 除假手术组外,其余各组均出现大鼠神经功能缺损。模型组与依达拉奉组比较无显著性差异(P>0.05)。亚低温联合依达拉奉可降低大鼠神经功能缺陷评分,与模型组比较有显著性差异(P<0.01),与依达拉奉组比较亦有显著性差异(P<0.05)。假手术组未出现脑梗死灶。模型组与依达拉奉组比较无显著性差异。亚低温联合依达拉奉组能减小脑梗死体积,与模型组、依达拉奉组比较差异有统计学意义(P<0.05)。见表1。
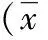
表1 各组神经功能评分、脑梗死体积百分比比较±s)
注:与模型组比较,#P<0.01;与依达拉奉组比较,▲P<0.05;与模型组、依达拉奉组比较,△P<0.05
2.2 免疫组织化学
2.2.1 各组Bax阳性细胞数比较:胞浆着色为棕黄色为Bax阳性细胞。假手术组Bax阳性细胞数为1.64±1.15,模型组为63.80±6.15,依达拉奉组为50.00±7.38,亚低温联合依达拉奉组为35.40±4.20,各组与假手术组比较均有明显差异(P<0.01)。亚低温联合依达拉奉组Bax表达的阳性细胞数与模型组、依达拉奉组比较均有所减少。依达拉奉组Bax阳性细胞数小于模型组。见图1。

图1 不同组Bax阳性细胞数 胞浆染成棕黄色为阳性 Bar is 100 μm.(DAB 染色,×400) A:假手术组 B:模型组 C:依达拉奉组 D:亚低温联合依达拉奉组
2.2.2 Bcl-2阳性细胞数比较:Bcl-2阳性细胞为胞浆着色为棕黄色。假手术组Bcl-2阳性细胞数为1.58±0.84,模型组为30.00±2.10,依达拉奉组为40.62±2.09,亚低温联合依达拉奉组为50.84±3.18,各组与假手术组比较均有明显差异(P<0.01)。亚低温联合依达拉奉组Bcl-2表达的阳性细胞数明显多于模型组、依达拉奉组(P<0.01)。依达拉奉组Bcl-2阳性细胞数与模型组比较差异有统计学意义(P<0.01)。见图2。

图2 不同亚组Bcl-2阳性细胞数 胞浆染成棕黄色为阳性。 Bar is 100 μm.(DAB 染色,×400) A:假手术组 B:模型组 C:依达拉奉组 D:亚低温联合依达拉奉组
3 讨论
以往研究表明,脑梗死后血流下降最严重的是梗死中心区域,细胞发生坏死,周围缺血半暗带区的血流出现不同程度下降,与凋亡密切相关[8]。脑缺血缺氧后有多种蛋白被诱导表达,其中Bax 和Bcl-2是细胞凋亡的重要调控蛋白,Bax表达增加促进细胞凋亡,而Bcl-2是抗凋亡蛋白。Bax 和Bcl-2形成了细胞凋亡的正负调控,两者比例决定了细胞是否趋向凋亡。本研究免疫组化结果显示,Bax、Bcl-2阳性细胞更多的出现于缺血半暗带区,Bax、Bcl-2阳性细胞胞浆染色,胞核尚未着色。结果显示,脑梗死发生后,Bax及Bcl-2阳性细胞明显增多,提示参与了细胞的凋亡,与以往研究结果相一致。依达拉奉是一种自由基清除剂,可清除自由基,抑制脂质过氧化,从而抑制脑细胞、血管内皮细胞、神经细胞的氧化损伤[9]。本实验表明,与模型组相比较,依达拉奉未能降低神经功能缺陷评分及未能减少脑梗死体积,但能通过下调Bax及上调Bcl-2减少细胞的凋亡,对脑细胞有保护作用。亚低温对缺血区域的神经元具有保护作用,其机制可能与降低脑氧代谢率、改善细胞能量代谢、减少兴奋性氨基酸的释放、减少氧自由基的生成、减少细胞内钙超载、减轻脑水肿等有关。文献[10]报道,亚低温能通过下调Bax及上调Bcl-2对脑梗死缺血区域的脑细胞发挥脑保护作用。因此理论上,亚低温联合依达拉奉对缺血脑组织将有更大的保护作用。而本实验的研究结果也证明了该设想,亚低温联合依达拉奉较单用依达拉奉有更好的脑保护作用,体现在能明显降低大鼠功能神经缺陷评分及减小脑梗死体积方面,其机制可能是更大程度的上调了Bcl-2及下调了Bax。
本实验表明,亚低温联合依达拉奉比单用依达拉奉能更大程度的上调Bcl-2及下调Bax,从而降低大鼠神经功能缺陷评分,抑制神经元的凋亡,减小脑梗死体积,阻止脑梗死的进展。
[1] 吴达荣,陈世文,潘经锐,等.亚低温疗法对大鼠脑缺血再灌注损伤的保护作用[J].中国实用神经疾病杂志,2014,17(4):57-59.
[2] Yenari MA,Onley D,Hedehus M,et al.Diffusion- and perfusion-weighted magnetic resonance imaging of focal cerebral ischemia and cortical spreading depression under conditions of mild hypothermia[J].Brain Res,2000,885(2):208-219.
[3] Shinada T,Hata N,Kobayashi N,et al.Efficacy of therapeutic hypothermia for neurological salvage in patients with cardiogenic sudden cardiac arrest:the importance of prehospital return of spontaneous circulation[J].J Nippon Med Sch,2013,80(4):287-295.
[4] Kawai N,Okauchi M,Morisaki K,et al.Effect of delayed intraischemic and postischemic hypothermia on a focal model of transient cerebral ischemic in rats[J].Stroke,2000,31(8):1 982-1 989.
[5] Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[6] Schöller K,Zausinger S,Baethmann A,et al.Neuroprotection in ischemic stroke-combination drug therapy and mild hypothermia in a rat model of permanent focal cerebral ischemia[J].Brain Res,2004,1 023(2):272-278.
[7] Wang GJ,Deng HY,Maier CM,et al.Mild hypothermia reduces ICAM-1 expression,neutrophil infiltration and microglia/monocyte accumulation following experimental stoke[J].Neuroscience,2002,114(4):1 081-1 090.
[8] Vela L,Gonzalo O,Naval J,et al.Direct interaction of Bax and Bak with Bcl-2 Homology domain-3 (BH3)-only proteins in living cells revealed by fluorescence complementation[J].J Biol Chem,2013,288(7):4 935-4 946.
[9] Nakagomi T,Yamakawa K,Sasaki T,et al.Effect of edaravone on cerebral vasospasm following experimental subarachnoid hemorrhage[J].J Stroke Cerebrovasc Dis,2003,12(1):17-21.
[10] Zhang P,Li J,Liu Y,et al.Human neural stem cell tr-ansplantation attenuates apoptosis and improves neurological functions after cerebral ischemia in rats[J].Acta Anaesthesiol Scand,2009,53(9):1 184-1 191.
(收稿2017-04-02)
Protective effects of mild hypothermia combined with edaravone on rats with cerebral ischemic reperfusion injury
WuDarong*,ZengZhifen,TaoEnxiang
*LonggangCentralHospitalofShenzhen,Shenzhen518116,China
Objective To observe protective effects of mild hypothermia combined with edaravone on rats with cerebral ischemic reperfusion injury.Methods Six hours after the establishment of focal cerebral ischemia by suture method,we performed reperfusion.And 24 hours after successful reperfusion injury,neurological functional deficits in sham-operation group,model group,edaravone group and mild hypothermia combined with edaravone group (combined group) were evaluated.Cerebral ischemic volume was measured by TCC staining and the number of positive Bax and Bcl-2 cells was tested by immunohistochemistry method.Results Compared with model group,edaravone group failed to reduce the infarct volume,but managed to decrease cell apoptosis via down-regulating Bax and up-regulating Bcl-2 for the purpose of protective effect.In addition,compared with model group and edaravone group,the combined group significantly lowered the degree of ischemic reperfusion injury and reduced infarct volume through the up-regulation of Bcl-2 and down-regulation of Bax.Conclusion Mild hypothermia combined with edaravone has good effects on rats with cerebral ischemic reperfusion injury.
Mild hypothermia;Cerebral ischemia;Edaravone;Bax;Bcl-2;Rats
深圳市卫生计生系统科研项目(项目编号:201402121);深圳市龙岗区科技计划医疗卫生项目(项目编号:YLWS20140605174929210)
R-332
A
1673-5110(2017)12-0005-03
△通讯作者:陶恩祥,E-mail:taoenxiang@yahoo.com.cn

