奶牛乳腺细胞IL8基因在三种菌落刺激下的表达变化研究
王珍珍,陈仁金,杨章平,毛永江,冀德君
(1 徐州医科大学,江苏 徐州 212004; 2 扬州大学动科学院,江苏 扬州 22500)
奶牛乳腺细胞IL8基因在三种菌落刺激下的表达变化研究
王珍珍1,陈仁金1,杨章平2,毛永江2,冀德君2
(1 徐州医科大学,江苏 徐州 212004; 2 扬州大学动科学院,江苏 扬州 22500)
[目的]研究IL8基因在不同菌落刺激下在奶牛乳腺细胞中的表达变化。[方法]本试验运用SYBR Green实时荧光定量PCR技术进行定量测定。[结果]IL8基因的mRNA水平在E.coli,Streptoc.刺激下表达差异达显示水平,而在S.aureus刺激下无明显变化。[结论]IL8基因在细胞水平上对E.coli,Streptoc.刺激较敏感,为以后进一步研究IL8基因的表达机理奠定基础。
IL8基因;实时定量PCR;奶牛乳腺上皮细胞
乳房炎是奶牛最常见和最复杂的疾病之一,给世界奶牛业造成了巨大的经济损失。除改善母牛营养、加强环境卫生管理和改进挤奶技术外,研究者正试图通过遗传育种和兽医生物技术手段来预防和控制乳房炎。据统计,国外奶牛乳房炎的发病率一般为25%~60%,国内发病率达20%~70%,个别牛群发病率更高[1-2]。由于奶牛乳房炎的高发病率和低治愈率,所以给奶牛业造成巨大经济损失,据不完全统计,全球每年因乳房炎造成的损失高达350亿美元,美国每年损失达20亿美元[3],日本经济损失达300亿日元[4],法国每年损失达30亿法郎[5]。
白细胞介素8 (Interleukin-8, IL-8)是一个多种细胞来源的趋化性细胞因子[6],是一种具有内源性白细胞趋化性和活化性作用的碱基-肝素结合性蛋白质。IL-8对中性粒细胞有激活作用,可以诱导其变形、趋化、脱颗粒、胞浆内钙短暂上升、合成生物活性脂类、整合素上调、以及呼吸爆发等。IL-8对T淋巴细胞和嗜碱性粒细胞也有趋化作用,对炎症和免疫过程有重要的调节作用,IL-8还可引起肿瘤组织内中性粒细胞浸润而具有潜在的抗肿瘤作用。IL-8易于受到外界的刺激而被激活,已研究证明IL-8蛋白和mRNA的表达与奶牛乳房炎有密切的联系[7]。当牛乳房受感染后,IL-8能诱导宿主防御系统抵抗病菌的侵入,同时IL-8会大量聚集。IL8基因的表达量也显著增加[8-10]。本研究拟在细胞水平上对三种菌落(大肠杆菌,葡萄球菌,链球菌)刺激奶牛乳腺上皮细胞,研究IL8的表达变化。
1 材料与方法
1.1 细胞来源
牛的MAC-T的细胞系由哈佛大学孙有平教授惠赠。
1.2 引物设计
根据用于荧光定量的目的基因IL8基因的mRNA序列(GenBank: NM_173925)设计引物,内参基因β-actin引物根据mRNA序列(GenBank:AY141970)设计。引物由上海生工生物工程有限公司合成。引物见表1。
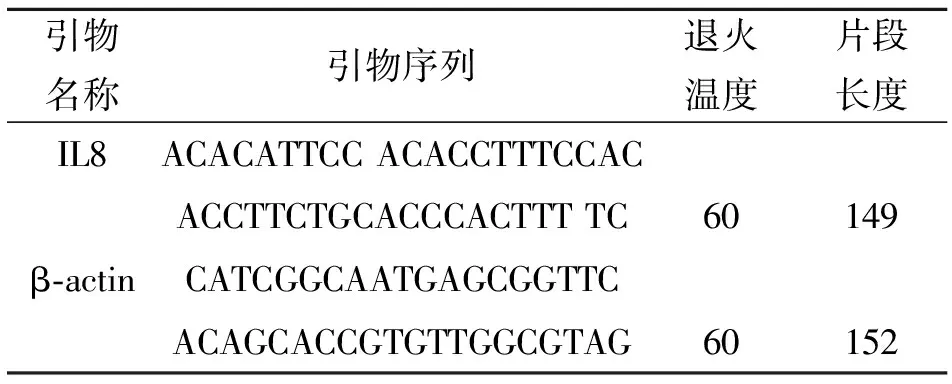
表1 荧光定量PCR引物
1.3 奶牛乳腺细胞的感染
当细胞培养密度为60%左右时,分别加入灭火的三种菌落E.coli,S.aureus,Streptoc,在0 h,1 h,6 h,12 h,24 h检测IL8 mRNA水平。
1.4 RT-PCR
应用TRIZOL提取细胞中总RNA,应用Rnase Free dH2O稀释。作为模板在灭菌的0.2 mL PCR离心管中依次加入以下组分的样品。应用TaKaRa RNA AL PCRTMKit(AMV)反转录试剂盒进行操作,反转录体系为15 μL(反应液在冰上配制):总RNA1 μg,Oligo dT Primer 1 μL,5×PrimeScriptTM Buffer 4 μL,Random primers 1 μL,PrimeScriptTM RT Enzyme Mix I 1 μL,加Rnase Free dH2O至总体积为15 μL。反转录条件如下:37℃ 15 min(反转录反应)85℃ 5sec(反转录酶的失活反应)所得产物即为cDNA,-20℃保存备用。
1.5 实时荧光定量PCR
采用SYBR GreenⅠ染料法进行荧光定量,荧光定量PCR体系为10 μL:
SYBR○R Premix Ex TaqTM(2×)5 μL
PCR Reverse Primer (10 μmol/L) 0.3 μL
PCR Forward primer (10 μmol/L) 0.3 μL
ROX Reference Dye Ⅱ(50×) 0.2 μL
cDNA 1 μL
dH2O 3.2 μL
荧光定量PCR扩增程序:94℃预变性1 min;95℃变性30 s,60℃退火15 s,72℃延伸34 s(data collection),40个循环;为分析扩增产物的特异性,PCR扩增结束后采集多个信息点进行溶解曲线分析,程序为:95℃ 15 s,60℃ 1 min;95℃ 15 s,60℃ 15 s。以上步骤均为冰上操作,每个样本设三个重复。
1.6 统计软件与方法
Excel,SPSS11.0统计分析软件
荧光定量计算采用2-△△CT方法[8]
2 结果与分析
2.1 RNA的提取(图1)
RNA提取后,无明显降解,应用ONEDROP测定其OD260/OD280在1.8左右,纯度较高;经1%琼脂糖凝胶电泳检出3条亮带,从上到下分别为28s,18s和5s,说明提取的RNA完整性良好,无明显降解,可用于后续的实验。
2.2 IL8基因在三种菌落下刺激mRNA的表达变化
E.coli感染奶牛乳腺细胞后,IL8的mRNA水平在12 h后显著高于0 h,1 h与6 h的水平。S.aureus感染奶牛乳腺细胞后,在检测各个时段没有显著变化。Streptoc.感染奶牛乳腺细胞后,IL8的mRNA水平在6 h后显著高于其它时段,达到最高水平(表2,图2)。
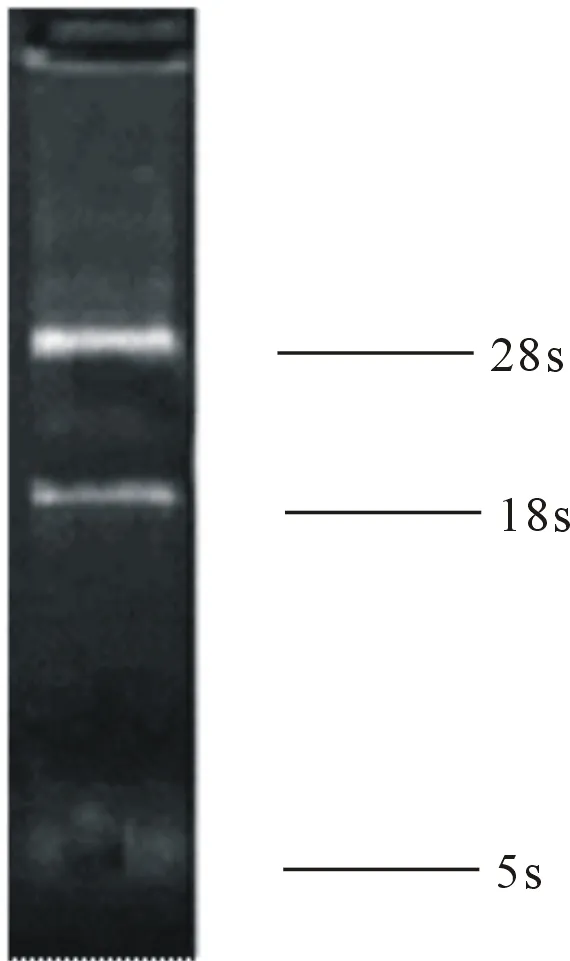
图1 全血总RNA的提取结果
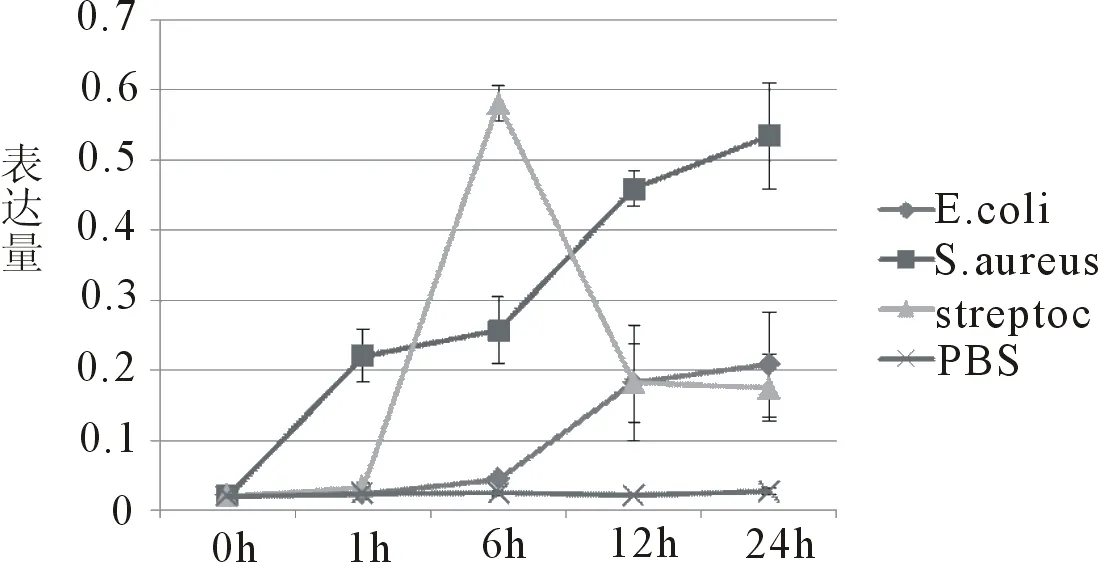
图2 在3种菌的刺激下IL8基因的表达量
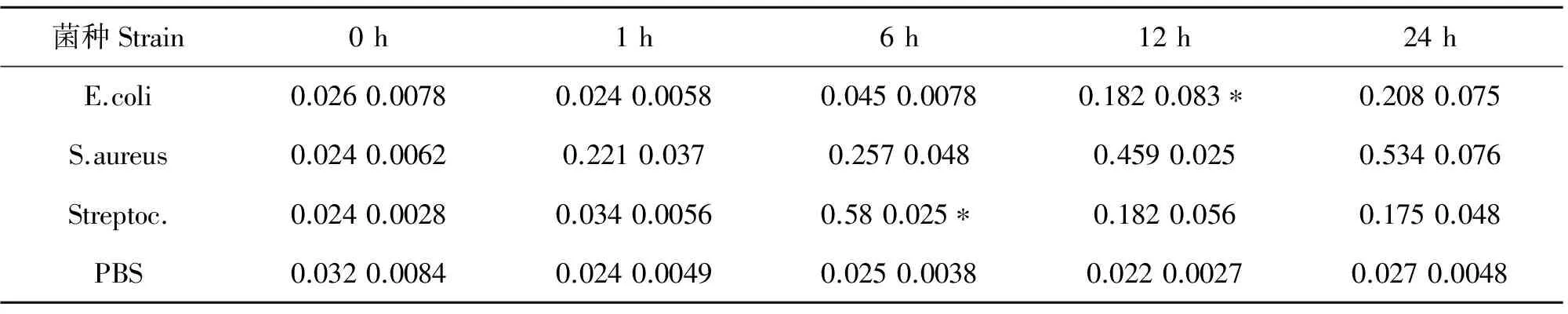
表2 IL8基因在三种菌种刺激下的相对定量值(*p 0.01)
3 讨论
引起奶牛场奶牛隐性乳房炎的主要病原菌为葡萄球菌、大肠杆菌和链球菌,综合牛只的混合感染情况来看,单纯感染某一种主要病原菌所致的隐性乳房炎占总发病情况的43.16%,由2-3种主要病原菌引起的混合感染占总发病情况的54.68%。IL8 是一种重要的趋化因子,具有刺激中性粒细胞、淋巴细胞发生趋化游走,介导细胞在炎症部位聚集、活化以及修复损伤的组织等功[12]。IL8基因易受外界的刺激而被激活,已证明IL8基因的mRNA与蛋白水平与奶牛乳房炎密切相关[13]。
牛的IL8基因位于第6号染色体上,基因序列总长度为3771bp,由四个外显子和3个内含子组成[14]。牛的IL8基因具有丰富的多态性,Legva-Baca等发现IL8基因的2789位点与脂肪量和乳房宽度存在显著相关性[15]。陈仁金等发现IL8基因的多态性与产奶量,乳脂量及体细胞评分存在显著相关[14]。对于人的IL8基因的转录调控已相对清晰,其主要受到NF- B的调控,NF- B的亚基P65结合到IL8基因调控区-94bp到-71bp位置;此外IL2、IL6、IL10等因子作用于IL8基因的-607 bp到 40 bp位置对其转录进行调控[16-18]。对于牛的IL8基因的转录调控研究较少,而对于IL8基因在不同菌落刺激下的表达变化研究较少。本研究在细胞水平上研究IL8在不同菌落刺激下的表达变化,研究显示IL8基因的mRNA水平在E.coli,Streptoc.刺激下表达变化明显,而在S.aureus刺激下无明显变化。此研究为今后进一般研究IL8基因在三种菌落下表达变化机理奠定基础。
[1] 宣小龙, 赵鹏, 张成,等. 奶牛乳腺防御机理研究进展[J]. 农业科学研究, 2005, 26(2): 81-86.
[2] 郭小雅, 束婧婷, 杨章平, 等. 奶牛隐性乳房炎发生规律的调查分析[J]. 中国兽医杂志, 2005, 41(3): 23-25.
[3] Jose A, Aldo CA, Horaco R, et al. Field trials of a vaccine against bovine mastitis: evaluation in heifers[J]. Journal of Dairy Science, 1997, 80: 845-853.
[4] 尹柏双, 李国江. 奶牛乳房炎的研究新进展[J]. 中国畜牧兽医, 2010, 37(2): 182-184.
[5] Hillerton J E and Berry E A. Treating mastitis in the cow-a tradition or an archaism[J]. Journal of Applied Microbiology, 2005, 98: 1250-1255.
[6] Baggiolini M, Dewald B, Moser B. Interleukin-8 and related chemotactic cytokines-CXC and CC chemokines[J]. Advances in Immunology, 1994, 55: 97-179.
[7] Lee J W, Bannerman D D, Paape M J, et al. Characterization of cytokine expression in milk somatic cells during intramammary infections with Escherichia coli or Staphylococcus aureus by real-time PCR[J]. Veterinary Research, 2006, 37(2): 219-229.
[8] Watanabe A, Yagi Y, Shiono H, et al. Effects of intramammary infusions of interleukin-8 on milk protein composition and induction of acute-phase protein in cows during mammary involution[J]. Canadian Journal of Veterinary Research, 2008, 72(3): 291-296.
[9] Bannerman DD, Kauf ACW, Paape M J, et al. Comparison of Holstein and Jersey Innate Immune Responses to Escherichia coli Intramammary Infection[J]. Journal of Dairy Science, 2008, 91(6): 2225-2235.
[10] Günther J, Liu S, Esch K, et al. Stimulated expression of TNF-a and IL-8, but not of lingual antimicrobial peptide reflects the concentration of pathogens contacting bovine mammary epithelial cells[J]. Veterinary Immunology and Immunopathology, 2010, 135(1-2): 152-157.
[11] Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta DeltaC(T)) Method[J]. Methods, 2001, 25(4): 402-408.
[12] Laudanna C, CampbellJJ, Butcher EC. Role of Rho in chemoattractant-activated leukocyte adhesion through integrins. Science, 1996, 271(5251):981-3.
[13] Lee JW, Bannerman DD, Paape MJ, Huang MK, Zhao X.Characterization of cytokine expression in milk somatic cells during intramammary infections with Escherichia coli or Staphylococcus aureus by real-time PCR.Journal of Veterinary Research, 2006 37(2):219-29.
[14] 陈仁金,杨章平,毛永江,等 .中国荷斯坦牛IL8 基因遗传多态性与泌乳性状以及体细胞评分的关联. 遗传, 2010, 32(12):1256-1262.
[15] Leyva-Baca I, Schenkel F, Sharma BS, et al.Identification of single nucleotide polymorphisms in the bovine CCL2, IL8, CCR2 and IL8RA genes and their association with health and production in Canadian Holsteins.Animal Genetics, 2007, 38(3):198-202.
[16] Paape M, Mehrzad J, Zhao X, et al. Defense ofthe bovine mammary gland by polymorphonuclear neutrophilLeukocytes. Journal of Mammary Gland Biology and Neoplasia, 2002,7(2): 109-121.
[17] Mukaida N, Shiroo M, Matsushima K. Genomic structure of thehuman monocyte-derived neutrophil chemotactic factor IL-8. Journalof Immunology, 1989, 143(4): 1366-1371.
[18] Mukaida N, Mahe Y, Matsushima K. Cooperative interaction ofnuclear factor-κB and cis-regulatory enhancer binding protein-likefactor binding elements in activating the interleukin-8 gene bypro-inflammatory cytokines. The Journal of Biological Chemistry,1990, 265(34): 21128-21133.
Study of mRNA Expression Change of IL8 Gene in Cow Mammary Cells under the Stimulation of Three Bacterial Colonies
WANG Zhen-zhen1,CHEN Ren-jin1,YANG Zhang-ping2,MAO Yong-jiang2,JI De-jun2
(1.XuzhouMedicalUniversity,Xuzhou,Jiangsu,212004,P,R,China.2.AnimalScienceandTechnologyCollege,YangzhouUniversity,Yangzhou,Jiangsu, 22500,P,R,China.)
[Objective] This study was conducted to study the changing of IL8 mRNA expression levels in bovine mammary gland cells under the stimulation of different bacterial colonies. [Method] SYBR Green Real-time PCR was used to quantitatively detect the mRNA level. [Result] The mRNA level of IL8 gene were significantly changed under the stimulation of E.coli and Streptocstimulation, but no significant changes was shown under the stimulated of S.aureus. [Conclusion] IL8 gene was sensitive to E.coli and Streptoc stimulation at the cellular level, which would lay a foundation for further research on the expression mechanism of IL8 gene.
IL8 gene; quantitative real-time PCR; mammary epithelial cell of cow
2016-11-20 接收日期:2016-12-25
国家自然科学基金(31172171,31372286),江苏省博士后基金,中国博士后基金(2016M590506)。
王珍珍,(1982-),女,汉,硕士,助理实验师,主要从事实验动物学研究。
S823.2
A
1001-9111(2017)02-0004-03
*通讯作者:杨章平, 汉,教授,主要从事动物遗传资源评价、保护与利用。xzyxdwzx@163.com

