局部进展期中低位直肠癌新辅助治疗后淋巴结变化及与预后的关系
左志贵 王颢 高显华 于志奇 张畅 柴瑞傅 传刚
●论著
局部进展期中低位直肠癌新辅助治疗后淋巴结变化及与预后的关系
左志贵 王颢 高显华 于志奇 张畅 柴瑞傅 传刚
目的研究新辅助治疗对局部进展期中低位直肠癌患者术后淋巴结检出数及阳性淋巴结数的影响,探讨肿瘤T分期与放疗灵敏度的关系及淋巴结状况与预后的关系。方法回顾性研究216例采用直肠全系膜切除术(TME手术)治疗的中低位直肠癌患者的临床资料,将其中接受新辅助治疗后再手术的106例患者设为观察组,未行新辅助治疗直接手术的110例患者设为对照组,比较两组临床资料及术后淋巴结检出情况,同时研究新辅助治疗后肿瘤T分期与放疗灵敏度之间的关系,采用生存曲线分析新辅助治疗后淋巴结情况与预后的关系。结果观察组患者术后标本淋巴结检出数[6.5(4.5,15.0)枚]及阳性淋巴结检出数[1.0(0,4.0)枚]均少于对照组[11.0(8.5,17.5)、2.5(1.5,5.0)枚],差异均有统计学意义(U=11.60、2.05,均P<0.05)。肿瘤T分期与放疗灵敏度相关(r=0.97,P<0.01)。观察组淋巴结阴性患者5年生存率(78.0%)高于淋巴结阳性患者(50.4%),两者比较差异有统计学意义(χ2=8.84,P<0.01),观察组淋巴结阴性患者中检出淋巴结总数≥12枚患者5年生存率(80.8%)高于<12枚患者(63.0%),但差异无统计学意义(χ2=0.164,P>0.05)。结论新辅助治疗使中低位直肠癌患者术后总淋巴结及阳性淋巴结数减少,肿瘤T分期与放疗灵敏度相关,新辅助治疗后淋巴结阳性患者预后不良,增加淋巴结检出数可能提高新辅助治疗后淋巴结阴性患者总体生存率。
直肠肿瘤新辅助治疗淋巴结状况
淋巴结评估不仅是直肠癌患者术后病理分期和判断预后的重要指标,也是辅助治疗的主要依据。局部进展期中低位直肠癌术前新辅助治疗可影响直肠癌原发肿瘤及系膜淋巴结的病理评估,因此有研究认为新辅助治疗后中低位直肠癌患者系膜淋巴结的浸润转移总体状况与治疗前相比已发生改变,故与预后无关[1],但也有研究显示虽然淋巴结总体状况在中低位直肠癌行新辅助治疗后发生了改变,但淋巴结总数及转移情况仍与预后相关[2]。本研究分析新辅助治疗对中低位直肠癌患者术后淋巴结检出数的影响及其与预后的关系,现将研究结果报道如下。
1 对象和方法
1.1 对象选取第二军医大学附属长海医院2000年1月至2007年12月收治的中低位直肠癌216例。其中接受新辅助治疗后手术联合术后辅助放化疗(观察组)106例,未行新辅助治疗而直接行手术治疗联合术后辅助放化疗(对照组)110例。观察组男68例,女38例,年龄32~71(41.6±10.5)岁;保肛手术65例,不保肛手术41例;高中分化79例,低分化及未分化15例,病理完全消退12例(无术后病理资料);肿瘤距肛门距离(5.95± 0.18)cm。对照组男68例,女42例,年龄30~75(43.0± 13.6)岁;保肛手术62例,不保肛手术48例;高中分化100例,低分化及未分化10例;肿瘤距肛门距离(5.63± 0.19)cm。两组患者性别、年龄、肿瘤分化程度及肿瘤距肛门距离比较,差异均无统计学意义(均P>0.05)。所有患者均行直肠全系膜切除术(TME手术)并达R0切除。纳入标准:(1)术前活检病理诊断明确为直肠癌;(2)肿瘤远端距肛缘≤10cm;(3)患者年龄≥18岁;(4)依据美国癌症联合会(AJCC)第7版直肠癌TNM分期标准,经盆腔CT或MRI等检查,确诊为T3-4NxM0局部进展期直肠癌患者,即肿瘤侵犯浆膜下或者侵犯无腹膜覆盖的的直肠周围组织(T3),或者直接侵犯其他器官、结构和(或)穿透脏层腹膜(T4),有或无淋巴结转移(N+);(5)临床资料及术后标本组织的石蜡块等病理资料完整。排除标准:(1)治疗前行X线胸片、CT及MRI等检查排除肺部、纵隔、肝脏、腹主动脉旁淋巴结等远处转移者;(2)既往接受过直肠手术、因其他疾病接受过化疗或者盆腔放疗者;(3)合并其他肿瘤患者;(4)姑息性切除或非R0切除者。本研究获第二军医大学附属长海医院伦理委员会审批和同意。
1.2 方法
1.2.1 放疗方法采用美国瓦里安公司CLINAC21EX型6MVX射线医用直线加速器,照射野为盆腔前后野加两个水平侧野或盆腔后野加两个水平侧野。观察组106例患者中,放疗方案分3种:(1)短程高剂量放疗(总剂量25Gy,1次/d,照射5次,单次剂量500cGy),疗程l周,放疗结束1周后手术。接受该方案(短程放疗亚组)患者15例,男9例,女6例,年龄32~71(43.2±11.8)岁。(2)中程中剂量放疗(总剂量30~45Gy,照射10~15次。单次剂量300cGy),疗程2~3周。放疗结束4周后手术。接受该方案(中程放疗亚组)患者54例,男36例,女18例,年龄35~68(44.6±8.5)岁。(3)长程小剂量放疗(总剂量45~54Gy,照射25~30次,单次剂量180cGy),疗程5~6周,放疗结束4~6周后手术。接受该方案(长程放疗亚组)患者37例,男23例,女14例,年龄32~64(40.5±13.5)岁。上述3亚组患者性别、年龄比较差异均无统计学意义(均P>0.05)。观察组106患者中行单纯放疗患者(单纯放化疗亚组)45例,男29例,女16例,年龄40~71(48.0±9.5)岁;行同步放化疗者[同步放化疗亚组,放疗期间希罗达口服同步化疗(825mg/m2,2次/d,每周5或7d)]61例,男38例,女23例,年龄32~65(39.6±13.5)岁。该两亚组患者性别、年龄比较差异均无统计学意义(均P>0.05)。所有患者均按TME手术原则实施手术,术中常规行肠系膜下血管根部淋巴结清扫。
1.2.2 淋巴结检查方法切除肿瘤后标本用甲醛溶液固定,取材。于肿瘤对侧缘沿肠纵轴剖开手术标本,用10%甲醛溶液浸泡,由高年资病理科医师于24h内沿直肠壁浆膜剔除所有直肠系膜。淋巴结采集方法为手工检出法,即采用触摸及视检发现淋巴结,未使用任何脂肪溶解等辅助鉴别淋巴结技术。所有淋巴结经脱水、浸蜡等处理后,行组织块石蜡包埋、切片及染色,淋巴结组织块按照5μm的厚度切片,在每枚淋巴结的最大切面处切取l~2片进行HE染色、制片,镜检确定有无淋巴结转移。所有患者均按照AJCC第7版直肠癌TNM分期标准,以12枚设为直肠癌病理检查的基准(比较两组≤12枚、>12枚患者所占比例及生存率情况)。
1.2.3 肿瘤病理消退分级方法参考目前国际上普遍采用Dworak等[3]制定的直肠癌放疗后病理消退分级标准(TRG):TRG0为肿瘤病理完全无消退,肿瘤细胞无变化;TRG1为肿瘤轻微消退,肿瘤组织伴部分纤维化,但纤维化组织占全部肿瘤组织≤25%;TRG2为病理中度消退,肿瘤组织有较明显纤维化,纤维化细胞占26%~50%;TRG3为为肿瘤消退良好,纤维化细胞≥50%,TRG4为肿瘤完全消退,已经完全找不到肿瘤细胞,仅见纤维组织。将TRG2、TRG3、TRG4计入放疗敏感组,TRG0、TRG1计入放疗不敏感组,按此标准对所有新辅助治疗直肠癌术后标本行病理检查,分为放疗后病理消退不明显(图1)和放疗后病理消退明显(图2)。
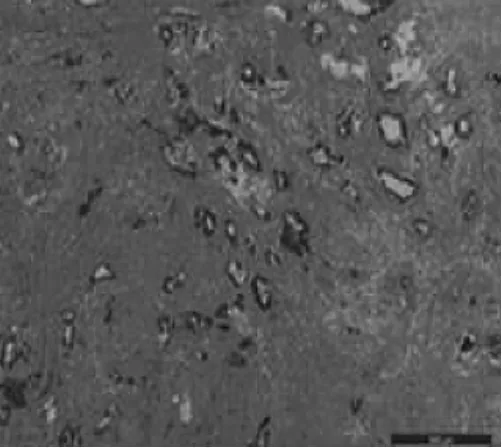
图1 新辅助治疗直肠癌患者术后肿瘤标本。病理消退不明显(HE染色,×50)
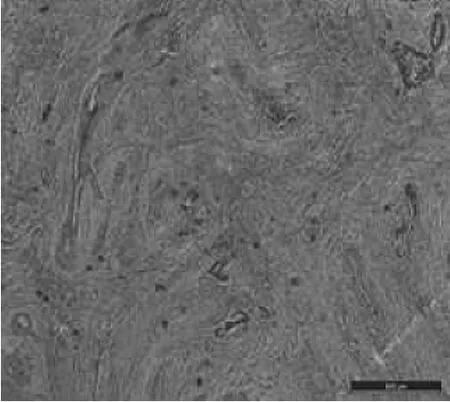
图2 新辅助治疗直肠癌患者术后肿瘤标本。病理消退明显(HE染色,×50)
1.2.4 随访方法随访记录所有患者一般资料、手术情况、术后病理及辅助化疗情况。随访起始时间从患者出院后1个月开始,2年内4次/年,3~5年2次/年,5年后1次/年。生存期从手术后第1天开始计算,随访时间截至2012年12月。
1.2.5 观察指标记录两组患者手术标本的淋巴结总数、阳性淋巴结数、病理T分期、肿瘤病理消退情况及生存时间。
1.3 统计学处理使用SPSS17.0统计软件,计量资料采用非参数Kolmogorov-Smirnov检验作正态性检验,符合正态分布的计量资料以表示,组间比较采用独立样本t检验,不同指标间的关系分析采用Pearson相关。不符合正态分布的计量资料以中位数及四分位数表示,两组间比较采用非参数法Mann-Whitney U检验,多组间比较采用非参数法Kruskal-Wallis H检验,不同指标间的关系分析采用Spearman秩相关。计数资料以百分率表示,组间比较采用χ2检验,组间总体生存率比较采用Kaplan-Meier生存分析及log-rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者淋巴结检出情况比较见表1。

表1 两组患者淋巴结检出情况比较
由表1可见,观察组淋巴结检出数、阳性淋巴结检出数均少于对照组,两组比较差异均有统计学意义(U= 11.60、2.05,均P<0.05),观察组患者中淋巴结检出数≥12枚者占比小于对照组,差异有统计学意义(χ2=9.62,P<0.05)。
2.2 不同放疗方案亚组淋巴结检出情况比较见表2和表3。
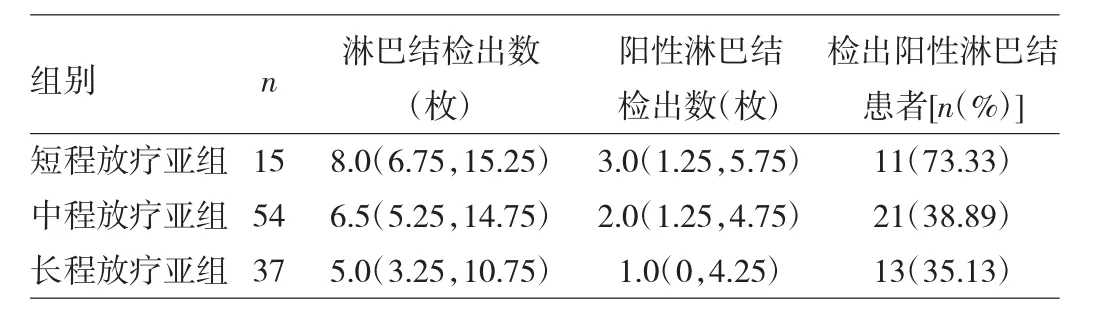
表2 短、中、长程放疗亚组淋巴结检出情况比较
由表2可见,3种不同放疗方案淋巴结检出数、阳性淋巴结检出数比较差异均有统计学意义(H=11.626、8.629,均P<0.05)。3组不同放疗方案患者阳性淋巴结检出率的差异有统计学意义(χ2=6.947,P<0.05)。
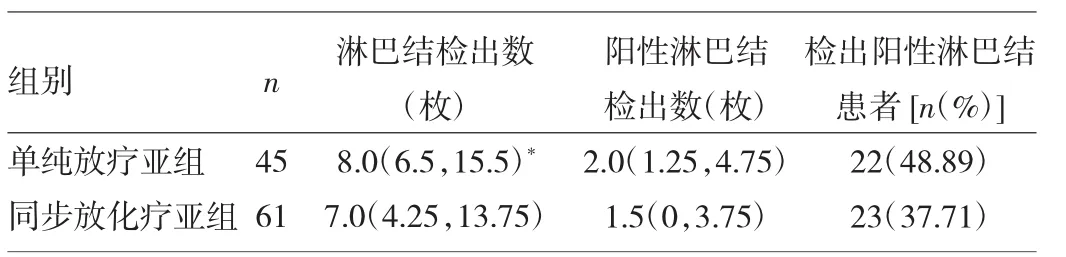
表3 单纯放疗亚组、同步放化疗亚组淋巴结检出情况比较
由表3可见,单纯放疗亚组淋巴结检出数、阳性淋巴结检出数多于同步放化疗亚组,其中两组淋巴结检出数比较差异有统计学意义(U=11.63,P<0.01),而两组阳性淋巴结检出数比较,差异无统计学意义(U=0.457,P>0.05),单纯放疗亚组检出阳性淋巴结患者与同步放化疗亚组比较差异无统计学意义(χ2=1.326,P>0.05)。2.3新辅助治疗后肿瘤T分期与放疗灵敏度的关系观察组术前放化疗患者中,放疗不敏感(TRG0、1)患者61例(57.55%),放疗敏感(TRG2、3、4)患者45例(42.45%),其中完全病理消退10例(9.43%)。进一步分层研究发现T0-1期放疗敏感患者占71.43%(15/21,13例T0期患者其中敏感患者10例,8例T1期患者其中敏感患者5例),而T2-4期放疗敏感患者占35.29%(30/85,23例T2期患者其中敏感10例,62例T3-4期患者其中敏感20例)。Spearman相关分析T分期与放疗灵敏度相关(r=0.97,P<0.01)。
2.4 两组淋巴结阴性与阳性患者生存曲线比较见图3-4。
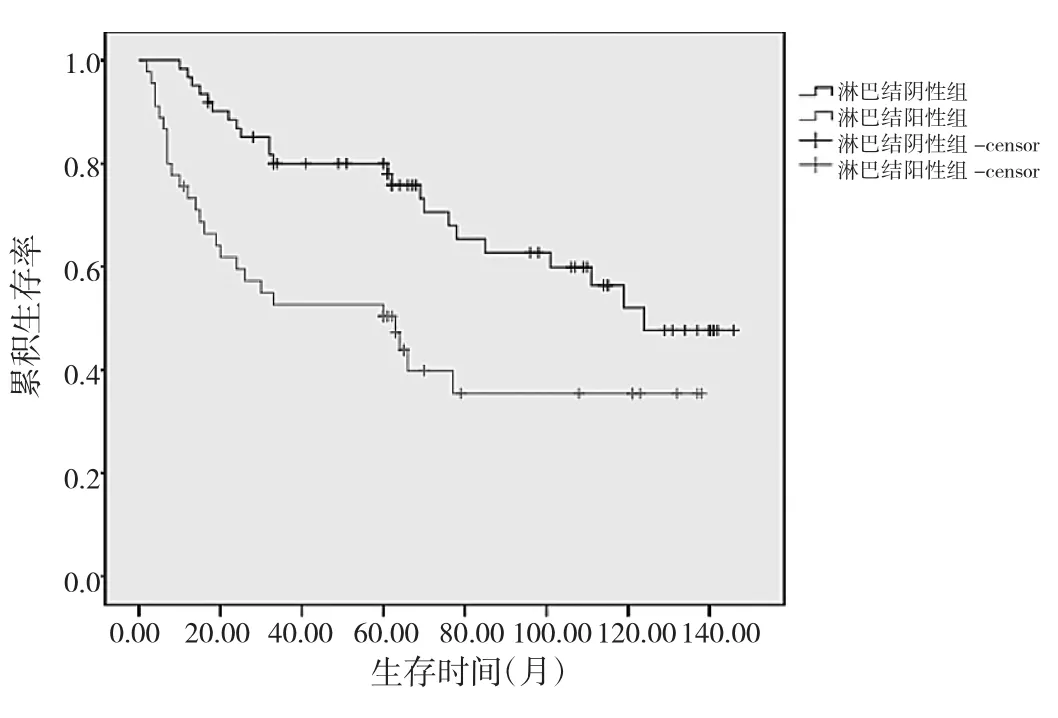
图3 观察组淋巴结阴性与阳性患者生存曲线比较
由图3可见,观察组淋巴结阴性患者5年生存率为78.0%,高于淋巴结阳性患者5年生存率50.4%,差异有统计学意义(χ2=8.84,P<0.01)。进一步计算得出,观察组5年总体生存率66.20%。
由图4可见,淋巴结阴性患者5年生存率为79.40%,高于淋巴结阳性患者5年生存率54.70%,差异有统计学意义(χ2=4.75,P<0.05)。进一步计算得出,对照组5年总体生存率69.3%。
2.5 两组淋巴结阴性患者淋巴结检出数与预后的关系观察组淋巴结阴性患者中淋巴结检出数≥12枚者11例(22.0%),其5年生存率为80.8%,高于50例(78.0%)淋巴结检出数<12枚患者的5年生存率(63.0%)。,但两者比较差异无统计学意义(χ2=0.16,P>0.05)。对照组淋巴结阴性患者中淋巴结检出数≥12枚者23例(38.3%),其5年生存率为86.30%,高于37例(61.7%)淋巴结检出数<12枚患者的5年生存率(68.70%),且差异有统计学意义(χ2=5.16,P<0.05)。
3 讨论
新辅助治疗可减少中低位直肠癌患者局部复发率,使肿瘤缩小降期而提高保肛率,故新辅助治疗联合TME手术及术后辅助化疗已经成为中低位直肠癌患者标准治疗方案[4]。本组患者病理明显消退率为42.45%,其中病理完全缓解率9.43%,显示了新辅助治疗有较好的临床效果。
直肠癌术后标本淋巴结检出数的影响因素包括病变因素(患者及肿瘤特征)、外科因素(手术根治的范围)、病理因素(病理取材方法及病理医师经验)和直肠癌的新辅助治疗。第二军医大学附属长海医院2009年1月起开展直肠癌多学科合作,病理科要求检出结直肠癌淋巴结数量不少于15枚,2009年后病理科医师更注重细致取材以检出更多淋巴结[5],因此本研究中病例选取截至2007年12月以消除病理相关因素的影响。同时选取我科行TME手术和R0切除病例以排除外科手术因素对淋巴结检出的影响。本研究中,两组患者性别、年龄、肿瘤分化程度及肿瘤距肛门距离比较,差异均无统计学意义。因此排除了病变因素的影响,说明淋巴结检出数及阳性淋巴结数的差异为新辅助治疗引起。本研究中观察组与对照组术后淋巴结检出数分别为6.5(4.5,15.0)枚及11.0(8.5,17.5)枚,阳性淋巴结检出数为1.0(0,4.0)及2.5(1.5,5.0)枚,两组比较差异有统计学意义。
淋巴结阳性数与检出淋巴结总数相关性有统计学意义说明更多的淋巴结总数有利于检出阳性淋巴结,有利于更准确的分期。在本研究中,新辅助治疗后淋巴结检出数<12枚患者较多,≥12枚标准的患者仅为19.81%,低于文献报道的数据,考虑部分研究病例较早,当时尚未实施直肠癌病理检查的标准化。也有研究认为新辅助治疗对淋巴结影响较大,因此新辅助治疗后淋巴结检出数限定标准不需要≥12枚[6-7]。
我们进一步研究了新辅助治疗后肿瘤T分期与放疗灵敏度的关系,结果显示肿瘤T分期与放疗灵敏度具有较强的相关性,原发肿瘤T分期越低则肿瘤对放疗越敏感,说明原发肿瘤降期与直肠癌对放疗的灵敏度相关,Kim等[8]的研究也显示了肿瘤T降期与肿瘤消退分期有相关性。
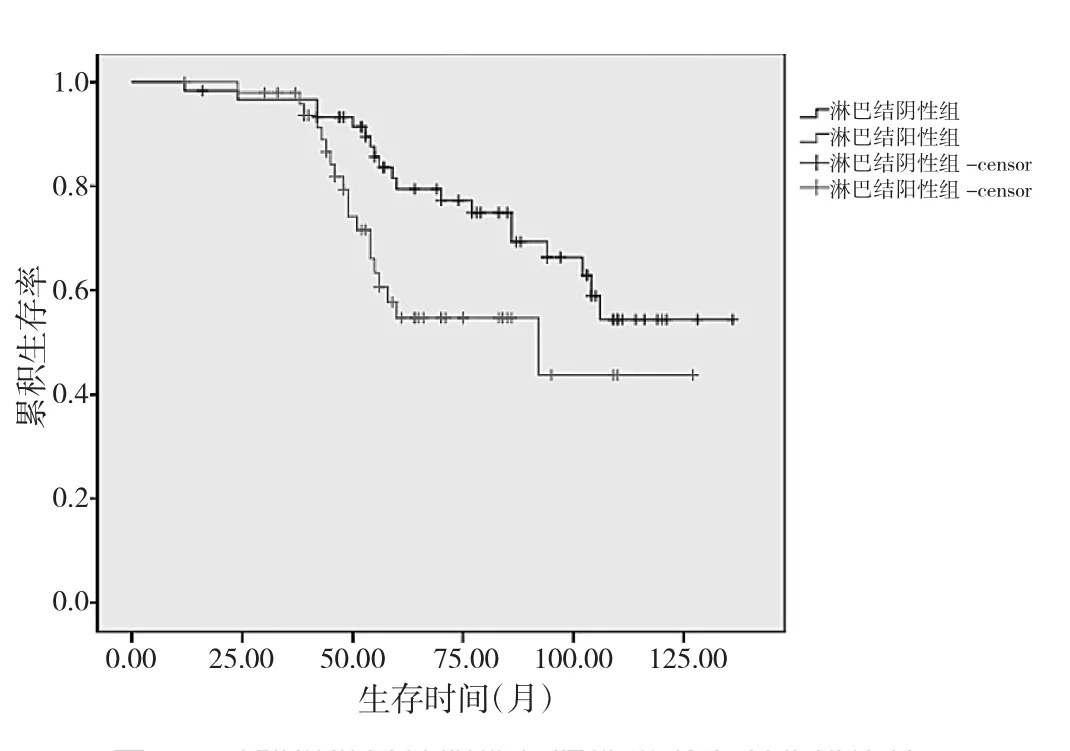
图4 对照组淋巴结阴性与阳性患者生存曲线比较
在未行新辅助治疗的直肠癌患者中淋巴结阳性往往提示预后不良,我们对对照组淋巴结阴性组与阳性组的生存分析也证实了这一结果,为了明确新辅助治疗后淋巴结阳性对预后的影响,进一步研究结果显示观察组新辅助治疗后淋巴结阴性患者5年总体生存率同样明显高于淋巴结阳性患者,说明和未行新辅助治疗的对照组一样,新辅助治疗后中低位直肠癌患者淋巴结转移仍然是一个预后不良的因素[2]。
本研究显示在未行新辅助治疗组淋巴结阴性患者中淋巴结检出数≥12枚患者5年生存率明显高于淋巴结检出数<12枚患者,观察组同样显示淋巴结阴性患者中淋巴结检出数≥12枚患者5年生存率明显高于淋巴结检出数<12枚患者,但差异均无统计学意义。Tsai等[9]研究发现新辅助治疗后淋巴结阴性患者淋巴结检出数≥12枚仍然是一个独立的预后因素,因此新辅助治疗后中低位直肠癌患者仍有需要检出更多的淋巴结以提高对患者预后的判断。
[1]Doll D,Gertler R,Maak M,et al.Reduced lymph node yield in rectal carcinoma specimen after neoadjuvant radiochemotherapy has no prognostic relevance[J].World Journalof Surgery,2009,33 (2):340-347.
[2]Chang G J,Rodriguez-Bigas M A,Eng C,et al.Lymph node status after neoadjuvant radiotherapy for rectal cancer is a biologic predictor of outcome[J].Cancer,2009,115(23):5432-5440.
[3]Dworak O,Keilholz L,Hoffmann A.Pathological features of rectal cancer after preoperative radiochemotherapy[J].Int J Colorectal Dis,1997,12(1):19-23.
[4]Rodel C,Liersch T,Becker H,et al.Preoperative chemoradiotherapy and postoperative chemotherapy with fluorouracil and oxaliplatin versus fluorouracil alone in locally advanced rectal cancer:initialresultsoftheGermanCAO/ARO/AIO-04 randomised phase 3 trial[J].Lancet Oncol,2012,13(7):679-687.
[5]王颢,傅传刚,郑建明,等.病理科医师细致取材对直肠癌根治术后淋巴结检出数量的影响[J].中华胃肠外科杂志,2009,12(6):569-572.
[6]Pan C J,Ziogas A,Buchberg B,et al.Timing of radiation therapy, lymph node retrieval,and survival in rectal cancer[J].Diseases of the colon and rectum,2011,54(5):526-534.
[7]Luna-Perez P,Rodriguez-Ramirez S,Alvarado I,et al.Prognostic significance of retrieved lymph nodes per specimen in resected rectaladenocarcinomaafterpreoperativechemoradia tion therapy[J].Archives ofMedicalResearch,2003,34(4):281-286.
[8]Kim D W,Kim D Y,Kim T H,et al.Is T classification still correlated with lymph node status after preoperative chemoradiotherapy for rectalcancer?[J].Cancer,2006,106(8):1694-1700.
[9]Tsai C J,Crane C H,Skibber J M,et al.Number of Lymph Nodes Examined and Prognosis Among Pathologically Lymph Node-Negative Patients After Preoperative Chemoradiation Therapy for RectalAdenocarcinoma[J].Cancer,2011,117(16):3713-3722.
Prognostic value of lymph node status after neoadjuvant chemoradiation therapy in patients with locally advanced mid-low rectal cancer
ZUO Zhigui,WANG Hao,GAO Xianhua,et al.Department of Colorectal Surgery,the First Affiliated Hospital of Wenzhou Medical University,Wenzhou 325000,China
ObjectiveTo investigate the associationof lymph node status after neoadjuvant chemoradiation therapy (NCRT)in patients with locally advanced rectal cancer(LARC).MethodsClinical data of 216 patients with LARC receiving radical tumor resection were analysized retrespectively,including 106 patients(study group)with NCRT followed by radical tumor resection 110 patients(control group)undergoing primary surgery without NCRT.The total lymph nodes(LNs)retrieval and the number of positive LNs was compared between the two groups.The correlation between T stage and radiosensitivity was analysized,and the association of LN status with prognosis of patients was evaluated with Kaplan-Meier survival curve.Results The number of total LNs and positive LNs harvested from each resected specimen in the control group were 10.62±0.36 and 2.32±0.33,while those were 8.12±0.38 and 0.84±0.12 in study group(P<0.001 and P=0.04).T stage was associated with the tumor pathological response after NCRT(r=0.97,P<0.01).In study group,the 5-year overall survival rate in patients with negative LNs was significantly higher than that in patients with positive LNs(78.0%vs 50.4%,χ2=8.836,P=0.003),however,there was no significant difference in the overall survival between patients with≥12 Lns andthose with<12 LNs(80.8%vs 63.0%,χ2=0.164, P=0.686).ConclusionNCRT reduces the number of LNs retrieval and the positive LNs in LARC;negative LNs after NCRT may improve the prognosis of LARC patients.
Rectal neoplasmNeoadjuvant chemoradiation therapyLymph node status
2016-06-07)
(本文编辑:杨丽)
10.12056/j.issn.1006-2785.2017.39.13.2016-830
国家自然科学基金资助项目(30973460,81272561);浙江省医药卫生科技计划资助项目(2015KYA153);温州市科技局科研基金资助项目(Y20140372,Y20150710)
325000上海,第二军医大学附属长海医院肛肠外科(左志贵、王颢、高显华、于志奇、张畅、傅传刚,左志贵系第二军医大学研究生,现在温州医科大学附属第一医院肛肠外科工作);浙江省人民医院肛肠外科(柴瑞)
左志贵,E-mail:zuozg007@126.com

