β-石竹烯通过作用于HMGB1/TLR4/NF-κB通路减轻小鼠局灶性脑缺血再灌注损伤①
杨 梅 安瑞娣 李明航 田晓翠 徐 露 董 志
(重庆医科大学药学院 重庆市生物化学与分子药理重点实验室,重庆400016)
β-石竹烯通过作用于HMGB1/TLR4/NF-κB通路减轻小鼠局灶性脑缺血再灌注损伤①
杨 梅 安瑞娣 李明航 田晓翠 徐 露②董 志
(重庆医科大学药学院 重庆市生物化学与分子药理重点实验室,重庆400016)
目的:研究β-石竹烯(β-caryophyllene,BCP)对脑缺血再灌注损伤(Cerebral ischemia-reperfusion,CIR)小鼠的保护作用及可能的机制。 方法:将C57BL/6 小鼠随机分组为假手术组(Sham)、模型组(CIR)、β-石竹烯组(62、124、248 mg/kg)。采用线栓法建立小鼠CIR损伤模型,缺血1 h,再灌注24 h后,进行神经行为学评分和脑梗死体积测定;TUNEL法观察CIR后缺血区神经细胞的死亡情况;Western blot 法检测脑组织中TLR4和NF-κB(p65)蛋白表达情况;免疫组织化学法检测缺血侧脑NF-κB(p65)的表达;ELISA 法检测CIR小鼠血清中HMGB1和缺血侧脑组织中IL-1β、TNF-α的含量变化。 结果:与模型组相比,BCP(248 mg/kg)可明显改善小鼠神经功能,减少脑梗死体积,降低缺血区神经元的死亡率(P<0.01);降低血清中HMGB1浓度、TLR4的蛋白表达量(P<0.01),抑制炎症通路NF-κB的激活并减少TNF-α、IL-1β的释放(P<0.01)。 结论:BCP能够减轻CIR诱导的小鼠脑组织损伤,其保护作用可能是通过抑制HMGB1/TLR4/NF-κB介导的炎症反应。
β-石竹烯;缺血再灌注损伤;炎症;TLR4;HMGB1
脑缺血是最常见的脑血管疾病,具有极高的发病率、致残率和致死率[1]。目前,采用溶栓法恢复缺血区血流灌注是脑缺血的主要治疗策略,但因其具有严格的时间限制,易引起脑缺血再灌注损伤(Cerebral ischemia-reperfusion injury,CIRI)[2]。越来越多研究表明,高迁移率族蛋白1(High mobility group protein box 1,HMGB1)参与CIRI的病理生理过程,并发挥了重要的作用[3]。在缺血再灌注条件下,HMGB1可从坏死的细胞中被动释放或从激活的胶质细胞中主动分泌,作为一种损伤相关分子模式,识别细胞表面TLR4受体并与之结合,介导炎症反应的发生。
β-石竹烯(β-caryophyllene,BCP)是一种双环倍半萜烯[4],具有强大的抗炎活性,抑制炎症级联反应[5]。研究表明,BCP 能减少大鼠CIR损伤后的脑梗死体积[6],但其潜在机制有待于进一步阐明。本实验拟建立小鼠CIR损伤模型,并给予BCP干预,观察BCP对CIR损伤后小鼠的神经功能、神经细胞死亡以及HMGB1/TLR4/NF-κB炎症通路的影响,探讨其可能的保护作用机制。
1 材料与方法
1.1 药品材料、试剂 β-石竹烯(纯度>80%)、2,3,5-氯化三苯基四氮唑(TTC)购自美国Sigma-Aldrich公司;TLR4、NF-κBp65抗体购自中国Proteintech 公司;TUNEL 细胞凋亡检测试剂盒购自中国Vazyme公司; ELISA试剂盒购自美国USCN公司;SP免疫组化检测试剂盒购自中国中杉金桥公司;蛋白印迹其他相关试剂由中国碧云天公司提供。
1.2 实验方法
1.2.1 实验动物与分组 雄性C57BL/6 小鼠(20~25 g)75只,SPF级,由重庆医科大学实验动物中心提供(许可证号:SCXK 渝 2012-0001)。将C57BL/6 小鼠随机分组为假手术组(Sham)、模型组(CIR)、β-石竹烯组(62、124、248 mg/kg)。β-石竹烯用聚氧乙烯蓖麻油(10%,生理盐水)配制,以0.1 ml/kg容量连续7 d灌胃给药。Sham组和CIR组给以相同溶剂(10%聚氧乙烯蓖麻油灌胃)。
1.2.2 小鼠脑缺血再灌注模型的建立 参照Sugo等[7],采用大脑中动脉栓塞法建立小鼠CIR损伤模型。用3%的水合氯醛腹腔注射麻醉小鼠,仰卧固定,在手术显微镜下分离右颈总动脉(CCA)、颈内动脉(ICA)、颈外动脉(ECA)分支,结扎ECA、CCA,动脉夹夹住ICA,用显微镜从CCA剪一切口,插入直径为0.18 mm线栓,缓缓推入线栓进入ICA入颅分支,线栓穿过距ICA、CCA分叉处约0.85 mm,有阻力感后停止进入,固定线栓,缺血1 h后,缓缓将线栓拔出恢复血流,再灌注24 h。假手术组与模型组相同操作(除不插入线栓入ICA外)。
1.2.3 神经行为学评分 再灌注24 h后,采用Longa等[8]5分制评分标准对不同处理的小鼠进行神经行为学评分。
1.2.4 脑梗死体积测定 缺血再灌注24 h后,小鼠麻醉直接取脑,置于-20℃冰箱冰冻10 min,以视交叉为起点冠状切为连续5片(1 mm),置于2%的TTC染色液中37℃避光孵育20 min。孵育结束后,脑切片中梗死区域因脱氢酶活性下降不能反映呈苍白色,非梗死区呈现红色,将脑切片置于4%多聚甲醛溶液中固定后用数码相机拍照。运用图像分析软件 Image-Pro Plus 5.1分析TTC染色脑切片梗死面积,并根据切片厚度计算脑梗死体积。
1.2.5 TUNEL法检测缺血侧神经细胞死亡情况 缺血再灌注24 h 后,麻醉小鼠,从心尖部(左心室)灌注生理盐水使流出液清亮,再灌注4%多聚甲醛至小鼠全身僵硬,断头取脑,于4%多聚甲醛中外固定12 h,再分别于20%、30%蔗糖溶液中梯度脱水,包埋于OCT中,-80℃保存。冰冻切片机连续冠状切片[厚度为5 μmol/(Lol·L)],-20℃。取冰冻切片按TUNEL试剂盒说明书进行神经元死亡检测。在荧光显微镜下观察,只有凋亡的细胞核因掺入FITC-12-dUTP 而显绿色荧光。每张切片采集12个具有代表性的视野(200倍),采用图像分析软件Image-Pro Plus计算其死亡阳性率。
1.2.6 Western blot法检测TLR4和NF-κB(p65)的表达 缺血再灌注24 h后,断头取脑,液氮速冻,按说明书提取缺血侧半脑的总蛋白并测定其含量,各组蛋白经12% SDS-PAGE 进行电泳分离,切胶,用湿法转移至PVDF 膜上,5%的脱脂牛奶封闭2 h后加入一抗TLR4(1∶ 200)、NF-κB(p65)于4℃孵育过夜。用TBST洗膜(4×5 min)后,采用三步法,生物素标记二抗结合,再采用辣根过氧化物酶标记的Streptavidin检测。洗膜后,采用增强化学发光液进行曝光显影。应用Image Lab图像分析软件分析条带光密度值,以GAPDH为内参,计算蛋白的相对表达量。
1.2.7 免疫组织化学法检测缺血侧脑组织NF-κB(p65)的表达 缺血再灌注24 h 后,按1.2.5项下操作进行灌流、外固定,再于酒精梯度脱水,二甲苯透明,浸蜡,包埋,切片(5 μm)。取切片烤片,二甲苯脱蜡,酒精梯度水化;0.01 mol/L的枸橼酸钠进行抗原修复,H2O2甲醇溶液避光孵育30 min,PBS清洗,山羊血清封闭,滴加NF-κB(p65)一抗(1∶50),4℃孵育过夜;复温,PBS清洗,加生物素标记的二抗室温孵育30 min,滴加辣根过氧化物酶标记的链霉素卵白素工作液室温孵育30 min。DAB显色,脱水上行,中性树胶封片,显微镜观察并拍照。
1.2.8 ELISA 法检测脑组织中炎症因子(TNF-α、IL-1β)和血清中HMGB1的含量 取缺血侧脑组织匀浆后和取处理好的血清,按ELISA试剂盒说明书步骤进行操作。
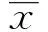
2 结果
2.1 BCP减轻CIR损伤诱导小鼠神经功能缺损和降低脑梗死体积 与假手术组相比,模型组的神经行为学评分升高,出现较严重的神经行为功能缺失。与模型组相比,BCP组可降低由脑缺血再灌注引起的小鼠神经行为学缺失;缺血1 h,再灌注24 h后,小鼠缺血侧脑半球出现大面积的梗死(约36.83%)。而BCP组可减少梗死区域,梗死体积分别为30.52%、19.5%、11.69%。结果表明BCP能减轻小鼠缺血再灌注后损伤,其中BCP(248 mg/kg)药效最佳(表1)。
2.2 BCP对CIR损伤诱导的小鼠脑组织神经细胞死亡的影响 假手术组几乎无凋亡细胞,而CIR后,小鼠缺血侧脑出现大量的凋亡细胞,细胞核呈绿色荧光(图1)。与模型组相比,BCP(248 mg/kg)组凋亡细胞明显减少。
2.3 BCP对小鼠CIR后血清中HMGB1含量的影响 与假手术组相比,模型组血清中HMGB1浓度明显增加(图2)。与模型组相比,BCP(248 mg/kg)组能减低CIR后血清中HMGB1的含量。 各组HMGB1浓度见表2。
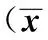

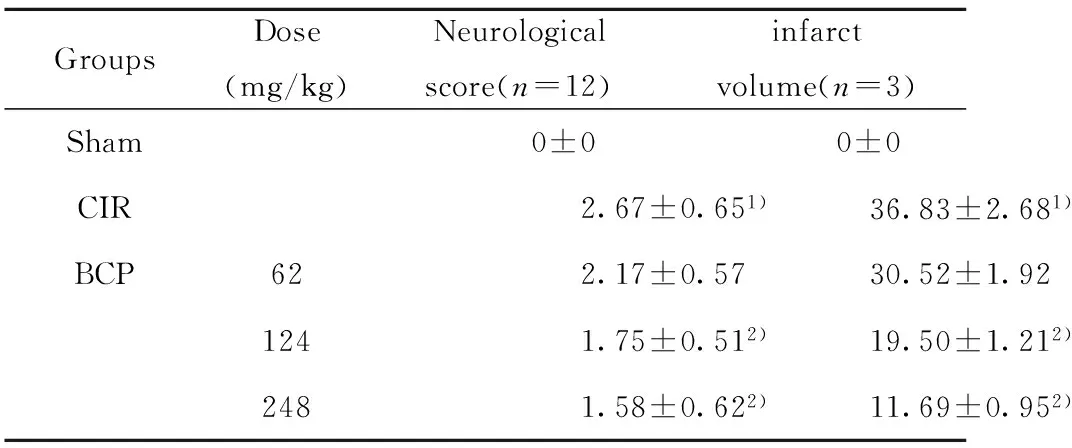
GroupsDose(mg/kg)Neurologicalscore(n=12)infarctvolume(n=3)Sham0±00±0CIR2.67±0.651)36.83±2.681)BCP622.17±0.5730.52±1.921241.75±0.512)19.50±1.212)2481.58±0.622)11.69±0.952)
Note:1)P<0.01,vs Sham;2)P<0.01,vs CIR.
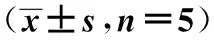

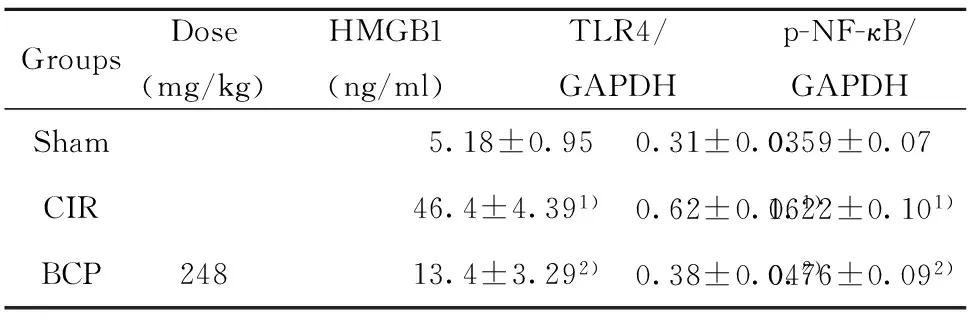
GroupsDose(mg/kg)HMGB1(ng/ml)TLR4/GAPDHp-NF-κB/GAPDHSham5.18±0.950.31±0.030.59±0.07CIR46.4±4.391)0.62±0.061)1.22±0.101)BCP24813.4±3.292)0.38±0.042)0.76±0.092)
Note:1)P<0.01,vs Sham;2)P<0.01,vs CIR.
2.4 BCP对小鼠CIR缺血侧脑TLR4 蛋白表达的影响 与假手术组相比,模型组缺血侧脑组织中的TLR4的蛋白水平表达明显增加(图3)。与模型组相比,BCP(248 mg/kg)组能减低TLR4的蛋白表达。各组TLR4相对表达量见表2。
2.5 BCP对小鼠CIR缺血侧脑NF-κB蛋白表达的影响 模型组NF-κB通路明显激活,NF-κB p65(S536-p)的磷酸化水平明显增加(图4);与模型组相比,BCP组明显减少p-NF-κB(p65)的含量,抑制NF-κB的激活;各组p-NF-κB相对表达量见表2。BCP(248 mg/kg)抑制CIR后的NF-κB(p65)核移位(图5)。
2.6 BCP对小鼠缺血侧脑组织中炎症因子的表达的影响 模型组缺血侧脑组织中促炎因子(TNF-α、IL-1β)含量升高。BCP(248 mg/kg)能明显降低因CIR损伤后炎性因子(TNF-α、IL-1β)的升高。结果见图6。
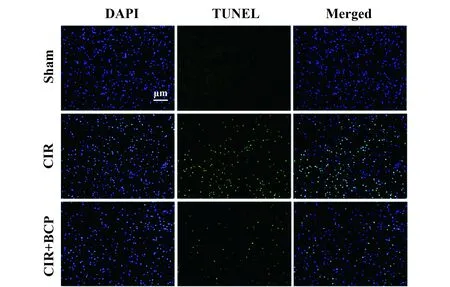
图1 BCP对小鼠CIR损伤后神经细胞死亡的影响Fig.1 Effects of BCP treatment on cell death in mice brain induced by CIRNote: Scale bar 200 μm.

图2 BCP对小鼠CIR后血清中HMGB1含量的影响Fig.2 Effects of BCP treatment on serum HMGB1 levels in mice subjected to CIRNote: **.P<0.01.vs sham,##.P<0.01,vs CIR.
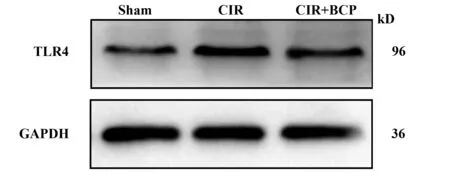
图3 BCP对小鼠缺血侧脑组织TLR4 蛋白表达的影响Fig.3 Effects of BCP treatment on protein levels of TLR4 in mice ischemic brain induced by CIR
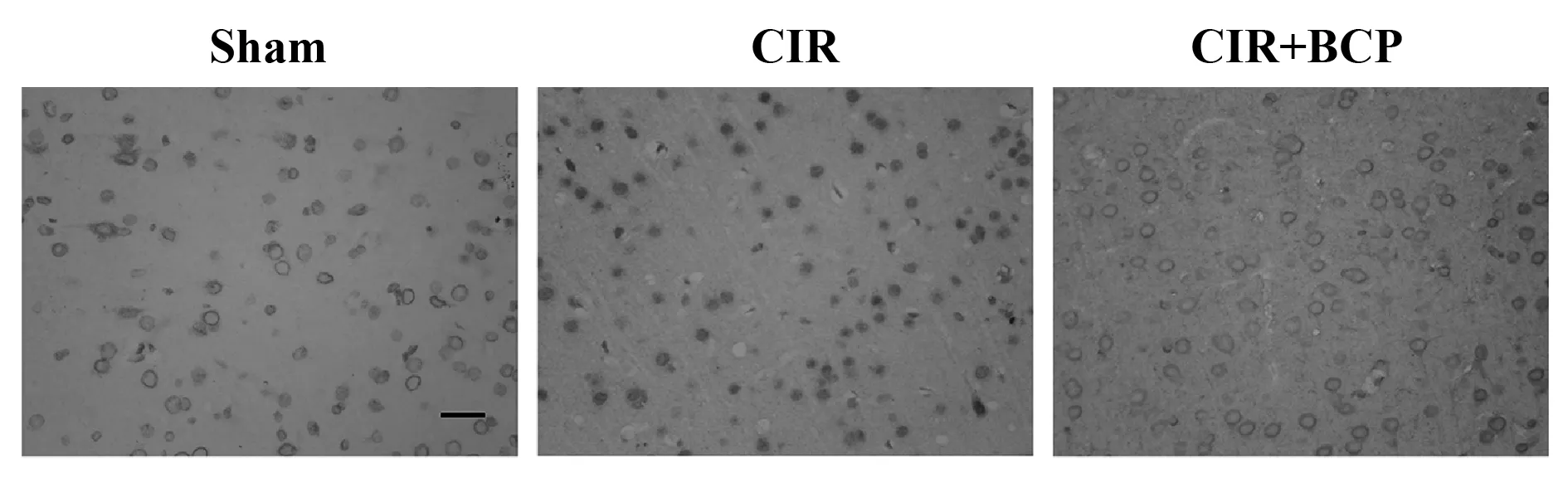
图5 BCP对小鼠缺血侧脑组织NF-κB通路的影响Fig.5 Effects of BCP treatment on NF-κB in mice ischemic brain induced by CIRNote: Scale bar 100 μm.
3 讨论
脑缺血再灌注损伤是一个复杂的病理生理过程,炎症在其中发挥了重要的作用。CIR损伤后,缺血区神经元细胞坏死,释放细胞因子、HMGB1等炎性介质;在这些因素的作用下,缺血区脑组织中小胶质细胞激活,白细胞浸润,进而释放更多的炎性介质,加重脑组织损伤,导致更多的神经元死亡[9,10]。本实验结果表明,BCP处理能明显减少小鼠CIR损伤诱导的神经元死亡和减轻炎症反应。
HMGB1是一种非组蛋白核蛋白,参与调控基因的转录和DNA重组等[11]。在机体损伤或细胞坏死条件下,HMGB1从细胞核移位至胞浆,从坏死的细胞或活化的胶质细胞中释放到细胞外,HMGB1可作为一种损伤相关分子模式与相应的受体识别结合,发挥其生物学效应[12]。HMGB1的受体主要有高级糖化终末产物受体(Receptor for advanced glycation end-products,RAGE)以及Toll样受体(Toll like receptors,TLRs)[13]。与HMGB1相关的TLRs包括TLR2、TLR4。在中枢神经系统中,HMGB1于神经元、星形胶质细胞中均有表达[14]。研究表明,HMGB1在CIR损伤过程中发挥了很重要的作用。

图4 BCP对小鼠缺血侧脑组织NF-κB通路的影响Fig.4 Effects of BCP treatment on NF-κB in mice ischemic brain induced by CIR
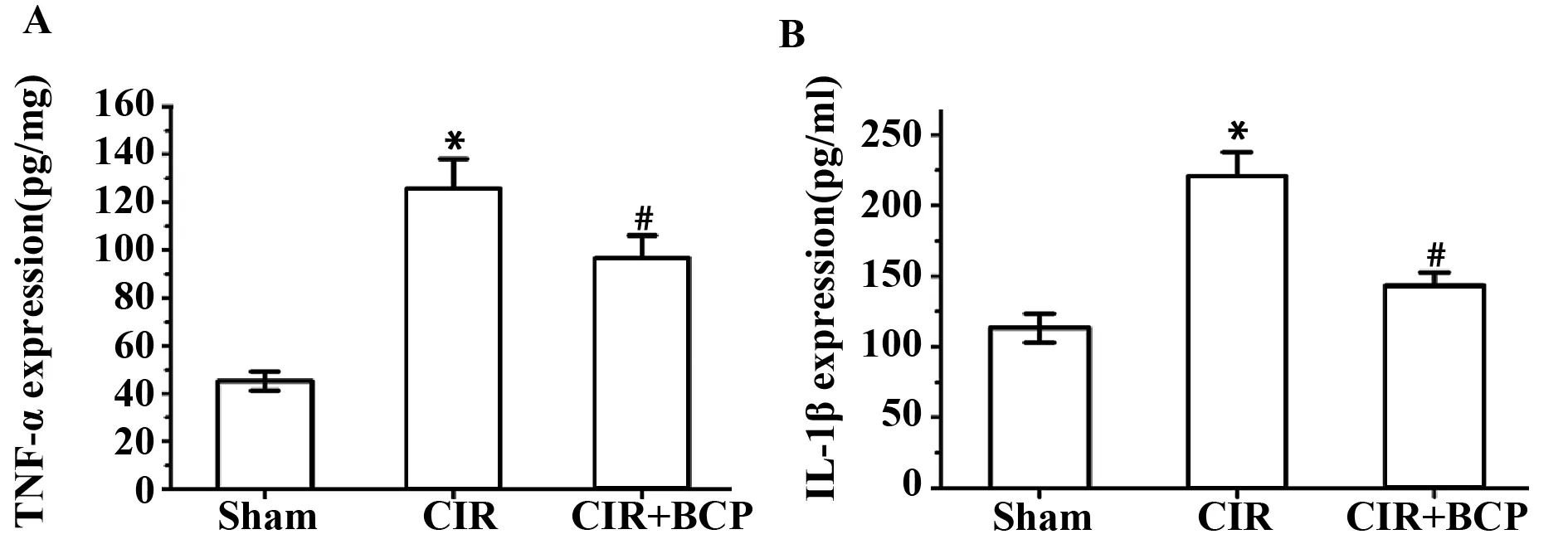
图6 BCP对小鼠CIR后缺血侧脑组织炎性因子(TNF-α、IL-1β)含量的影响Fig.6 Effects of BCP treatment on TNF-α and IL-1β levels in mice ischemic brain induced by ±s,n=6)Note: *.P<0.01,vs Sham;#.P<0.01 vs CIR.
Kim等[15]利用RNA干扰沉默HMGB1的表达能减轻脑中风损伤。Mori等[16]通过静脉注射抗HMGB1单克隆抗体能明显减少脑缺血的梗死体积。本实验结果显示BCP能够降低CIR损伤后血清中HMGB1的含量。
研究证明HMGB1在诱导细胞因子释放和促炎过程中的主要受体是TLR4[17]。TLR4是一种模式识别受体,与之内源性配体HMGB1结合后,激活核转录因子NF-κB等信号通路,促使炎症因子的表达。另外,有研究表明TLR4与脑缺血后损伤和炎症反应密切相关[18]。本实验结果显示,BCP能明显降低TLR4的蛋白表达水平,抑制NF-κB通路的激活,减少炎性因子的分泌。结果表明BCP能通过抑制TLR4/NF-κB通路减轻炎症反应。BCP是许多重要挥发油的组成成分,存在多种植物当中,如肉桂、丁香等[19]。BCP是一种CB2受体激动剂,具有广泛的药理活性[19],包括抗癌、抗氧化及抗炎作用。Gertsch 等[20]证明,BCP能够抑制炎症级联反应,减少炎症因子的表达。另有研究证明,BCP对脑缺血大鼠有神经保护作用,可显著减少大鼠CIR后脑梗死面积[6],减低神经行为学评分,其机制与减少线粒体功能紊乱,减少细胞内氧化应激,以及增加脑源性神经营养因子等相关[21]。但是BCP对CIR损伤的保护机制还有待于进一步研究。本实验研究显示,BCP(124、248 mg/kg)能明显改善CIR损伤后小鼠的神经功能缺陷,能减少脑梗死体积。其中BCP(248 mg/kg)的效果最佳。BCP能减少缺血区神经细胞死亡,降低血清中HMGB1浓度,减少TLR4蛋白表达,抑制NF-κB通路的激活,减轻炎症反应,对小鼠CIR损伤有一定的保护作用。
[1] Flynn RW,MacWalter RS,Doney AS.The cost of cerebral ischaemia[J].Neuropharmacology,2008,55(3):250-256.
[2] Tobin MK,Bonds JA, Minshall RD,etal.Neurogenesis and inflammation after ischemic stroke:what is known and where we go from here[J].J Cereb Blood Flow Metab,2014,34(10):1573-1584.
[3] Li W,Sama AE,Wang H.Role of HMGB1 in cardiovascular diseases[J].Curr Opin Pharmacol,2006,6(2):130-135.
[4] Chicca A,Caprioglio D, minassi A,etal.Functionalization of beta-caryophyllene generates novel polypharmacology in the endocannabinoid system[J].ACS Chem Biol,2014,9(7):1499-1507.
[5] Bento AF,Marcon R,Dutra RC,etal.beta-Caryophyllene inhibits dextran sulfate sodium-induced colitis in mice through CB2 receptor activation and PPARgamma pathway[J].Am J Pathol,2011,178(3):1153-1166.
[6] Lou J,Cao G,Li R,etal.beta-Caryophyllene attenuates focal cerebral ischemia-reperfusion injury by Nrf2/HO-1 pathway in rats[J].Neurochem Res,2016,41(6):1291-1304.
[7] Sugo N,Hurn PD,Morahan MB,etal.Social stress exacerbates focal cerebral ischemia in mice[J].Stroke,2002,33(6):1660-1664.
[8] Longa EZ,Weinstein PR,Carlson S,etal.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[9] Kim SW,Jin Y,Shin J ,etal.Glycyrrhizic acid affords robust neuroprotection in the postischemic brain via anti-inflammatory effect by inhibiting HMGB1 phosphorylation and secretion[J].Neurobiol Dis,2012,46(1):147-156.
[10] Kim SW,Lim CM,Kim JB,etal.Extracellular HMGB1 released by NMDA treatment confers neuronal apoptosis via RAGE-p38 MAPK/ERK signaling pathway[J].Neurotox Res,2011,20(2):159-169.
[11] 刘淑霞,郭慧芳,张玉军etal.高迁移率族蛋白及其TOLL样受体4在系统性红斑狼疮肾脏损害中的作用[J].中国免疫学杂志,2008,24(10):948-951.
[12] 刘淑霞,郝 军,郭慧芳,等.HMGB1/TLR/NF-κB在狼疮性肾炎小鼠肾组织中的表达及意义[J].中国免疫学杂志,2009,25(5):450-453.
[13] Weber DJ,Allette YM,Wilkes DS,etal.The HMGB1-RAGE inflammatory pathway:implications for brain injury-induced pulmonary dysfunction[J].Antioxid Redox Signal,2015,23(17):1316-1328.
[14] Qiu J,Nishimura M,Wang Y,etal.Early release of HMGB-1 from neurons after the onset of brain ischemia[J].J Cereb Blood Flow Metab,2008,28(5):927-938.
[15] Kim JB,Sig Choi J,Yu YM,etal.HMGB1,a novel cytokine-like mediator linking acute neuronal death and delayed neuroinflammation in the postischemic brain[J].J Neurosci,2006,26(24):6413-6421.
[16] Mori S,Liu K,Takahashi HK,etal.Therapeutic effect of anti-nucleokine monoclonal antibody on ischemic brain infarction[J].Yakugaku Zasshi,2009,129(1):25-31.
[17] Venereau E,Casalgrandi M,Schiraldi M,etal.Mutually exclusive redox forms of HMGB1 promote cell recruitment or proinflammatory cytokine release[J].J Exp Med,2012,209(9):1519-1528.
[18] Yang QW,Li JC,Lu FL,etal.Upregulated expression of toll-like receptor 4 in monocytes correlates with severity of acute cerebral infarction[J].J Cereb Blood Flow Metab,2008,28(9):1588-1596.
[19] Di Sotto A,Mazzanti G,Carbone F,etal.Inhibition by beta-caryophyllene of ethyl methanesulfonate-induced clastogenicity in cultured human lymphocytes[J].Mutat Res,2010,699(1-2):23-28.
[20] Gertsch J,Leonti M,Raduner S,etal.Beta-caryophyllene is a dietary cannabinoid[J].Proc Natl Acad Sci U S A,2008,105(26):9099-9104.
[21] Choi IY,Ju C,Anthony Jalin AM,etal.Activation of cannabinoid CB2 receptor-mediated AMPK/CREB pathway reduces cerebral ischemic injury[J].Am J Pathol,2013,182(3):928-939.
[收稿2016-12-28 修回2017-03-17]
(编辑 许四平 刘格格)
β-caryophyllene mitigates cerebral ischemia reperfusion injury in mice by inhibiting HMGB1/TLR4/NF-κB pathway
YANGMei,ANRui-Di,LIMing-Hang,TIANXiao-Cui,XULu,DONGZhi.
ChongqingKeyLaboratoryofBiochemistryandMolecularPharmacology,SchoolofPharmacy,ChongqingMedicalUniversity,Chongqing400016,China
Objective:investigate the effect of β-caryophyllene(BCP)on cerebral ischemia-reperfusion(CIR)injury in mice.Methods: Mice were subjected to CIR with or without BCP(62,124,248 mg/kg).At 24 h of reperfusion,ischemic degrees were determined according to neurologic dysfunction score and cerebral infarct volume.The protein expression of Toll-like receptor(TLR)4 was measured by Western blot.Nuclear factor κB(NF-κB)p65 were measured by immunohistochemistry and Western blot.IL-1β,tumor necrosis factor-α(TNF-α)and serum high-mobility group box 1(HMGB1)levels were measured by ELISA kit.Results: Compared to the CIR group,BCP(248 mg/kg)reduced the neurological score and cerebral infarct volume.BCP reduced neuronal death in mice brain subjected to cerebral I/R.In addition,BCP also inhibited the activation of NF-κB pathway and decreased increases in TLR4,HMGB1,TNF-α,IL-1β levels by CIR(P<0.01).Conclusion: BCP protects mice brain against CIR injury,its neuroprotective mechanisms may involves HMGB1/TLR4/NF-κB pathway.
β-caryophyllene;Ischemia-reperfusion injury;Inflammation;Toll-like receptor 4;High-mobility group box 1
10.3969/j.issn.1000-484X.2017.07.011
杨 梅(1993年-),女,在读硕士,主要从事神经药理学方向的研究。
及指导教师:董 志(1960年-),男,博士,教授,主要从事神经药理学方面的研究,E-mail:dongzhi5904@163.com。
R965
A
1000-484X(2017)07-1009-05
①本文为重庆市自然科学基金重点项目(KJ1600235, CSTC20 16jcyjA0258)。
②通讯作者,E-mail: xulu8792@163.com。

