Nutlin-3促进肝癌细胞SMMC-7721发生焦亡的作用①
石新丽 刘景利 于 琨 梁 婕 牛晓莉
(河北中医学院基础医学院 河北省中西医结合肝肾病证重点实验室,石家庄050200)
·生物治疗·
Nutlin-3促进肝癌细胞SMMC-7721发生焦亡的作用①
石新丽 刘景利②于 琨 梁 婕 牛晓莉
(河北中医学院基础医学院 河北省中西医结合肝肾病证重点实验室,石家庄050200)
目的:探讨MDM2拮抗剂Nutlin-3促进肝癌细胞SMMC-7721发生焦亡的作用及相关机制。方法:Western blot检测细胞中活化caspase-1(p20)及IL-1β的表达,LDH法检测SMMC-7721细胞焦亡情况,ELISA检测细胞上清中IL-1β释放情况。结果:Nutlin-3提高SMMC-7721细胞活化caspase-1(p20)及IL-1β的蛋白表达水平。Nutlin-3处理显著提高了 SMMC-7721 细胞培养上清中的LDH 及IL-1β的表达水平(P<0.05)。结论:Nutlin-3激活了caspase-1,诱导肝癌细胞SMMC-7721发生焦亡,并促进IL-1β释放。
Nutlin-3;原发性肝细胞癌;细胞焦亡;caspase-1;IL-1β
原发性肝细胞癌(Hepatocellular carcinoma,HCC)的发病率在男性肿瘤中占第五位,女性中居第七位,死亡率高居癌症的第三位,同时缺乏有效的治疗措施。大约有50%的HCC细胞具有野生型p53,故重新激活p53的活性成为一种有希望的治疗策略。p53是维持细胞基因组稳定的重要分子,失活、突变或活性抑制等p53活性变化的形式均与肿瘤进展有关。HCC细胞中的p53常被鼠双微基因2(Murine double minute 2,MDM2)抑制。p53与MDM2之间形成自动调节的负反馈抑制环[1]。因此,MDM2抑制剂成为激活p53治疗HCC的新策略[2]。
Nutlin-3是MDM2拮抗剂,能激活p53。本课题组发表的文章已证实,Nutlin-3能诱导肝癌细胞SMMC-7721凋亡[3]。Nutlin-3能拮抗MDM2对p53的N-末端的结合作用,从而释放p53,使p53能结合C-末端的修饰分子,如干扰素γ诱导蛋白(Inter-feron-γ inducible protein 16,IFI16)等。IFI16是一种调控细胞凋亡、衰老、自噬及自身免疫病等过程的多功能蛋白。近年研究发现,IFI16作为DNA感受器,能组装炎性体(inflammasome),活化caspase-1,诱发细胞焦亡(pyroptosis)及释放IL-1β等细胞因子[4]。本课题组发表的文章也证实,Nutlin-3使SMMC-7721细胞核中的IFI16部分移位到细胞质中,并且IFI16的移位与p53活性相关[5]。
本研究拟探索Nutlin-3能否激活caspase-1前体,促进SMMC-7721细胞发生焦亡。本研究将为恢复p53功能的HCC化疗提供新策略。
1 材料与方法
1.1 材料
1.1.1 细胞系 人肝癌细胞株SMMC-7721为本室保存。
1.1.2 主要试剂和抗体 Nutlin-3、DMSO均购自美国Sigma公司;兔抗人IL-1β抗体(ab2105)购自美国Abcam公司;兔抗人caspase-1抗体(#2225)购自美国CST公司;兔抗人β-actin抗体(BA2305)购自博士德(Boster)公司;山羊抗兔IgG-HRP(sc-2004)抗体购自Santa Cruz公司。
1.2 方法
1.2.1 细胞培养 用含10%小牛血清、1%青链霉素双抗的DMEM(高糖)培养基作为完全DMEM培养基。细胞接种后置5%CO2孵箱中37℃连续培养。
1.2.2 细胞分组及药物处理 ①NC组:10 μmol/L DMSO处理48 h;②Nut组:10 μmol/L Nutlin-3处理48 h。
1.2.3 Western blot检测IL-1β及caspase-1蛋白表达 细胞接种6孔板(3 × 105个细胞/孔),培养48 h,适量1×SDS上样缓冲液裂解上述各组SMMC-7721细胞,吸取细胞裂解液于EP管中,98℃煮5~10 min,离心后的上清为蛋白样品。样品进行SDS-PAGE电泳后将蛋白转至PVDF膜上,5%脱脂牛奶封闭;一抗(1∶1 000)4℃孵育过夜,洗膜后与二抗(1∶5 000)室温孵育30 min;洗膜后加ECL显影液,放入凝胶分析系统中曝光,拍照存储并用Quantity One软件分析计算各条带的灰度值,以每组目的蛋白和内参蛋白灰度值的比值表示各组蛋白的表达水平。
1.2.4 乳酸脱氢酶(Lactic dehydrogenase,LDH)细胞毒性试剂盒检测释放到细胞培养上清中LDH的含量 细胞接种到96孔板,经药物处理到达预定时间后,将细胞培养板用多孔板离心机1 500 r/min离心5 min。分别取各孔的上清液120 μl,加入到一新的96孔板相应孔中,随即进行样品测定。用酶标仪测量OD450值,根据标准曲线求出相应的LDH含量。具体步骤按试剂盒说明书操作。试剂盒购自碧云天(Beyotime)公司(C0016)。
1.2.5 人IL-1β定量酶联检测试剂盒检测细胞培养上清中IL-1β含量细胞接种6孔板(3 × 105个细胞/孔),经药物处理后,收集细胞培养上清,先用标准品绘制标准曲线,然后按试剂盒说明书步骤进行操作,用酶标仪测量OD450值,根据标准曲线求出相应的IL-1β含量。试剂盒购自上海森雄科技实业有限公司(SXM024)。

2 结果
2.1 Nutlin-3处理激活了caspase-1 活化caspase-1是介导细胞焦亡的关键分子。caspase-1前体被激活后,产生由p20和p10两个亚单位组成的活化caspase-1。为判断Nutlin-3对caspase-1前体活性的影响,Western blot检测p20的表达水平。结果显示,Nutlin-3提高了SMMC-7721细胞中活化caspase-1的表达水平(图1),说明Nutlin-3能激活caspase-1。
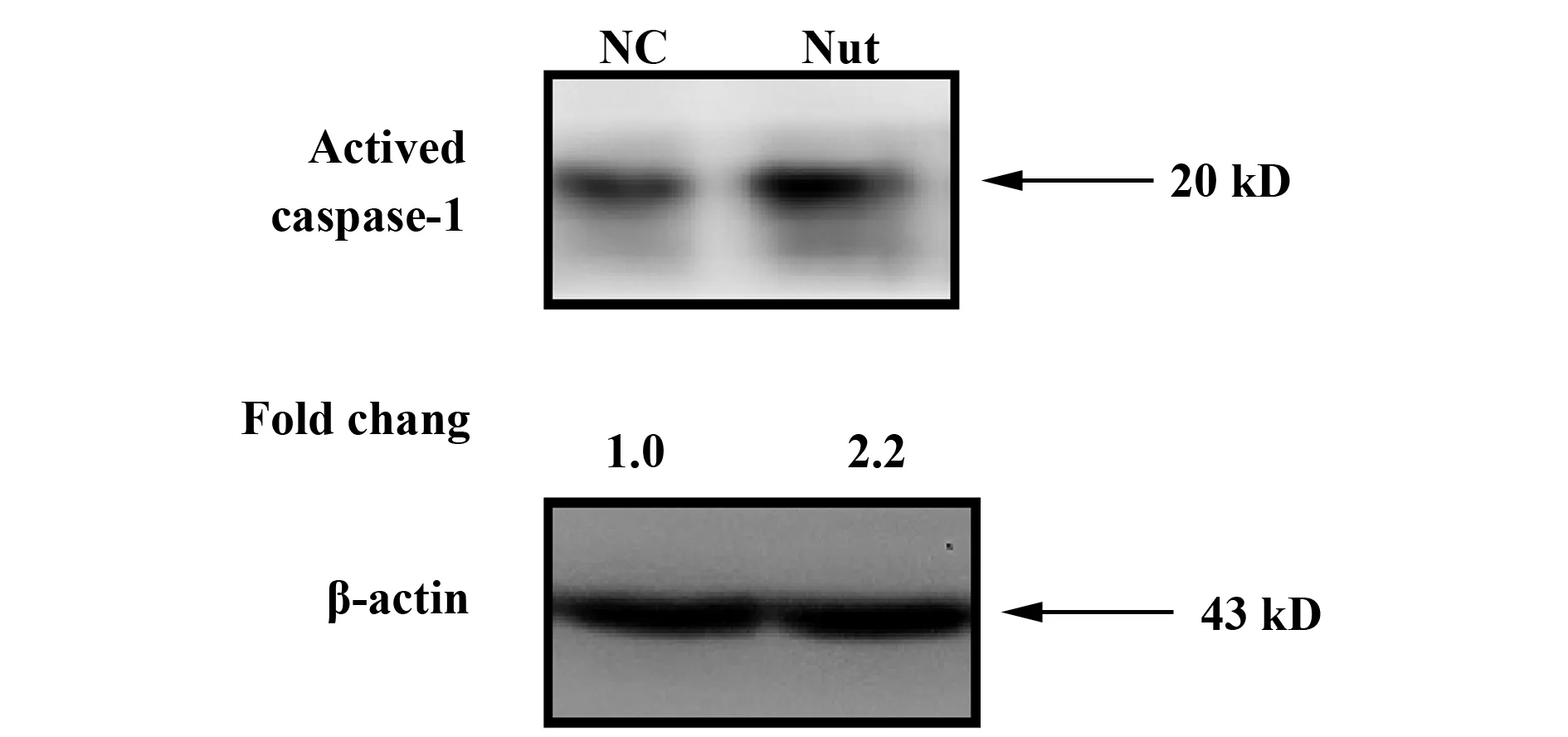
图1 Western blot检测SMMC-7721细胞中活化caspase-1的表达水平Fig.1 Western blot was performed for protein expression of actived caspase-1Note: β-actin was used as loading control.

图2 乳酸脱氢酶细胞毒性试剂盒检测释放到细胞培养上清中LDH的含量Fig.2 Content of LDH in cell culture supernatant was analyzed by LDH Cytotoxicity Assay Kit
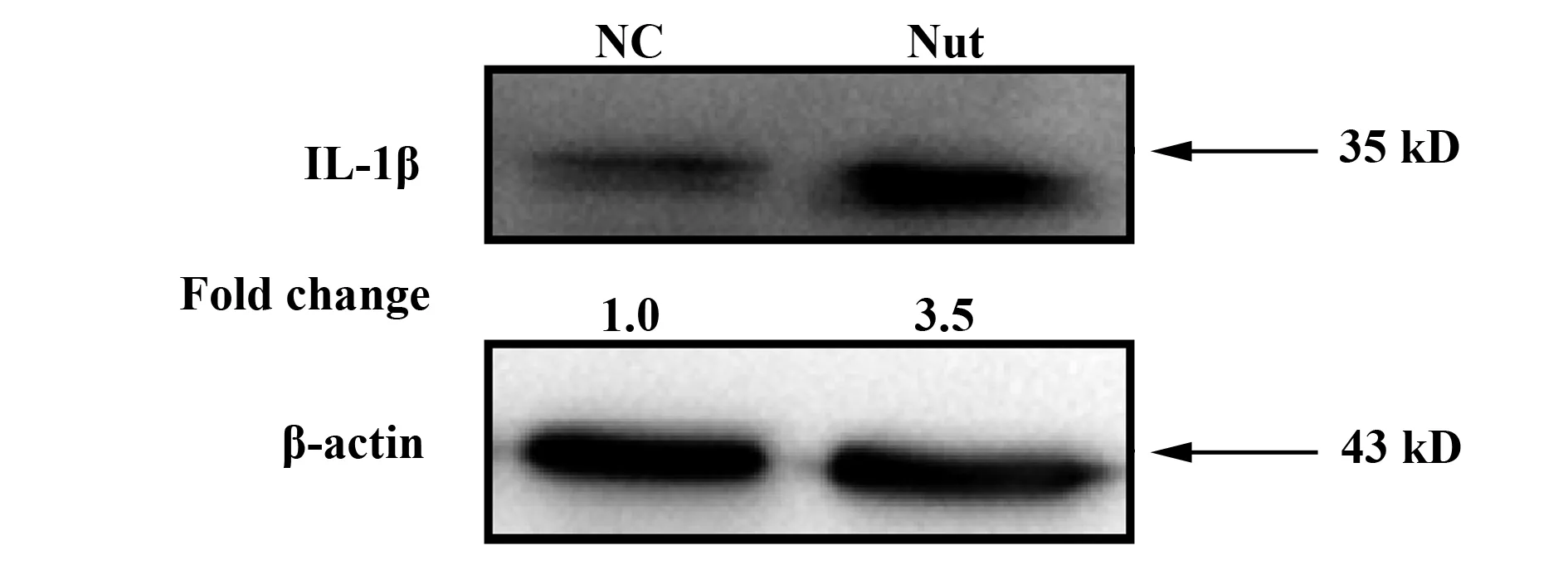
图3 Western blot检测Nutlin-3处理SMMC-7721细胞24 h后,细胞总蛋白中活化IL-1β的表达水平Fig.3 Western blot was performed for protein expression of actived IL-1β in SMMC-7721 cells after Nutlin-3 treatmentNote: β-actin was used as the loading control.
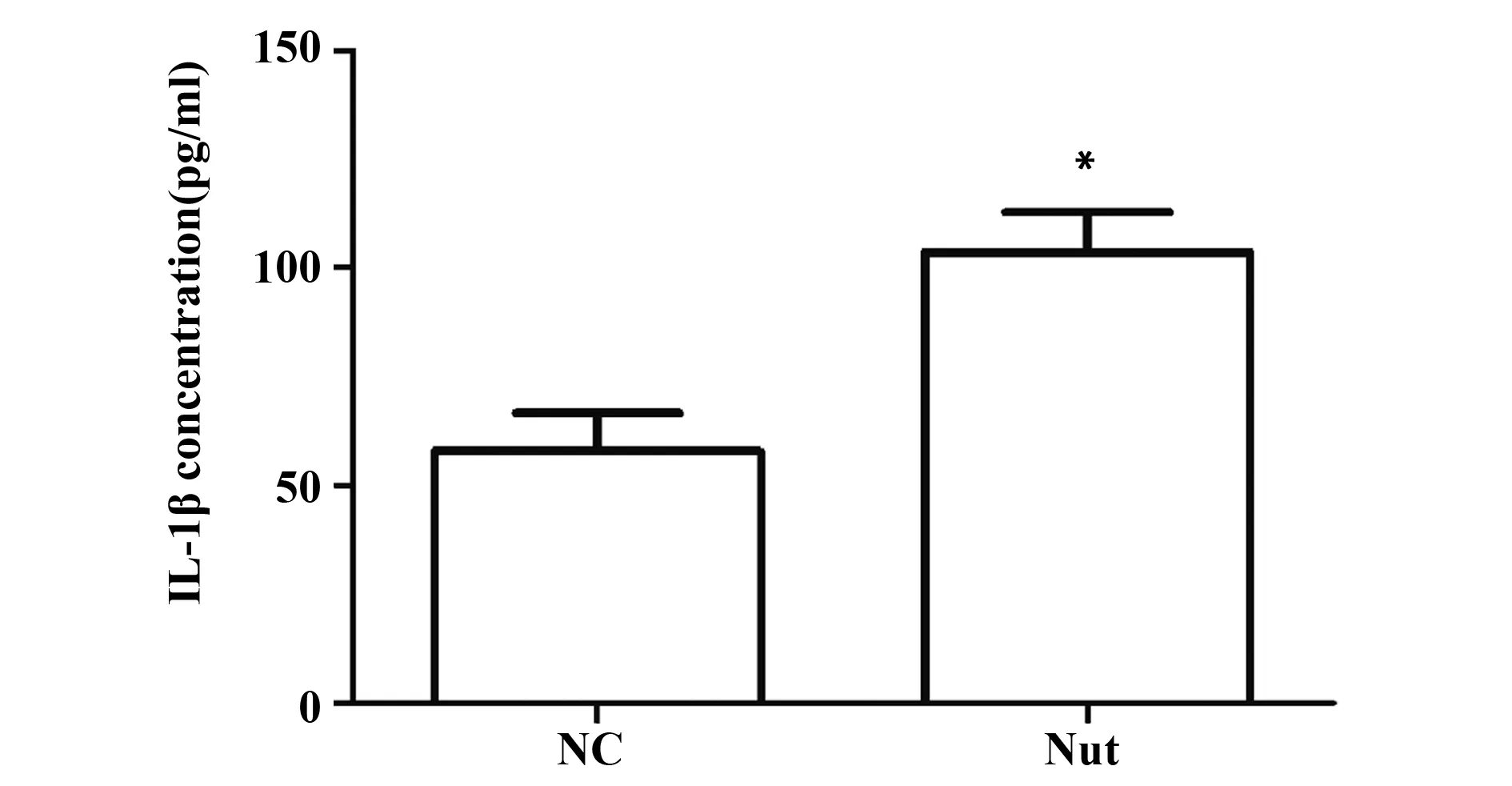
图4 IL-1β定量酶联检测试剂盒检测细胞培养上清中IL-1β含量Fig.4 IL-1β Quantitative Enzyme-linked Detection Kit was used to quantify IL-1β content in cell culture supernatantNote: ).*P<0.05 vs NC group.
2.2 Nutlin-3 促使细胞质中的LDH释放到培养上清中 活化的caspase-1触发细胞焦亡,造成细胞膜崩解,释放细胞内容物。细胞质中的LDH酶活较稳定,细胞焦亡会使LDH释放到细胞培养液中。经检测,发现Nutlin-3处理24 h后细胞培养上清中LDH酶活为(15.4±0.6)U/L,比未处理组的LDH酶活(8.6±0.9)U/L提高了1.8倍(图2),差异具有统计学意义(P<0.05)。此结果提示,Nutlin-3能促进SMMC-7721细胞释放LDH,发生细胞焦亡。
2.3 Nutlin-3提高SMMC-7721细胞中活化IL-1β表达水平 活化caspase-1除了可以促进细胞焦亡外,还可以促进IL-1β剪切。为判断Nutlin-3影响IL-1β活化情况,Western blot检测成熟IL-1β的表达(图3)。结果显示,Nutlin-3提高了SMMC-7721细胞中活化IL-1β的表达水平。说明,Nutlin-3促进了SMMC-7721细胞中IL-1β的剪切。
2.4 Nutlin-3 增加了细胞培养上清中IL-1β的表达水平 活化的caspase-1在促发细胞焦亡的同时,还通过剪切加工的方式裂解IL-1β前体,释放具有生物学活性的IL-1β。ELISA法检测结果显示,与NC 组细胞(57.9±8.8)pg/ml相比较,Nutlin-3处理显著提高了SMMC-7721细胞上清中IL-1β的表达水平(P<0.05),其值为(103.5±9.4)pg/ml(图4)。此数据表明,Nutlin-3能促进SMMC-7721细胞释放IL-1β。
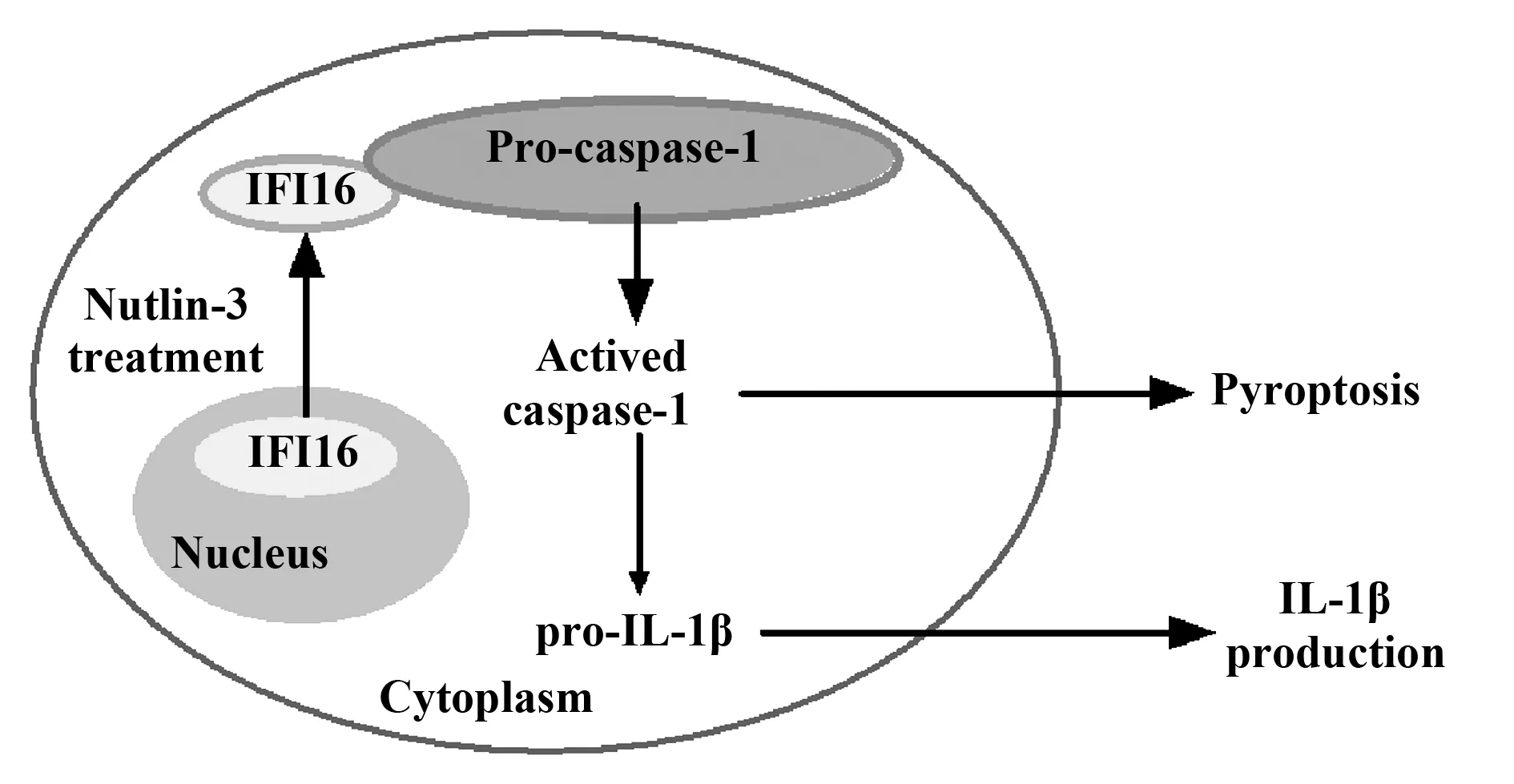
图5 Nutlin-3诱导SMMC-7721细胞发生焦亡并释放IL-1β的示意图Fig.5 Proposed model for pyroptosis and IL-1β release by Nutlin-3 treatment in SMMC-7721 cells
3 讨论
细胞焦亡是一种特殊的依赖于活化caspase-1介导的细胞程序性死亡方式,表现为质膜破裂和炎性细胞内容物的释放[6]。焦亡的细胞同时具备细胞凋亡及细胞坏死的部分形态特征。细胞焦亡在慢性炎症的形成中发挥重要作用[7,8],与肝细胞损伤[9]、脂肪性病变[10]、炎症及纤维化等多种肝脏疾病的发生发展相关[8]。脓毒症小鼠急性肝损伤模型的动物实验也证实,抑制肝细胞焦亡减弱了盲肠结扎穿孔(Cecal ligation and puncture,CLP)造成的急性肝损伤[11]。本研究首次发现Nutlin-3处理导致肝癌细胞SMMC-7721发生焦亡。我们认为,Nutlin-3促使caspase-1活化,诱发细胞焦亡,并促使IL-1β的释放(图5)。
活化caspase-1的产生是细胞焦亡过程中的重要事件[6]。有研究用caspase-1抗体对3例肝癌及其配对癌旁组织进行免疫组化,结果显示肝癌组织中caspase-1低表达[12]。本研究发现,Nutlin-3能激活SMMC-7721细胞的caspase-1并促进细胞焦亡的发生。不同组织和细胞中的caspase-1活化后发挥的作用不同。例如,巨噬细胞中炎性体组装后引发的caspase-1活化会诱导细胞发生细胞焦亡而死亡;HeLa细胞(整合有HPV全基因组)中caspase-1活化却促其存活[13]。另外,IL-1β作为细胞焦亡下游通路中的一个效应因子,是体内调节免疫和炎症反应的核心介质[14]。例如,放化疗导致EBV相关的鼻咽癌细胞发生焦亡,产生的IL-1β招募中性粒细胞积聚到肿瘤细胞周围,抑制了肿瘤的生长[15]。有研究发现,肝非实质细胞发生的细胞焦亡会导致严重的炎症及肝纤维化,表现为中性粒细胞的渗入及活化肝星状细胞引发的胶原沉积[16]。与此一致的是,也有研究发现在肝癌组织和肝癌细胞系,缺氧诱导的高caspase-1活性及随后产生的多种炎症因子可促使癌细胞侵袭和转移[17]。
Nutlin-3是一种新型的小分子MDM2拮抗剂[18],常被用作p53激活剂[19]。Nutlin-3直接结合p53 N-末端上与MDM2相互作用的结构域,而释放p53的N-末端,令p53能结合其他的修饰物,活化p53并阻止MDM2对p53的负调节作用[18]。有研究发现Nutlin-3通过活化p53和p73两种方式诱导HCC细胞凋亡及周期阻滞[20]。与其他化疗药物相比较,Nutlin-3除了常规给药途径外,还可口服[18]。因此,Nutlin-3对具有不同TP53基因型HCC治疗具有重要价值。
本研究发现的p53激活剂Nutlin-3诱发HCC细胞焦亡及促进IL-1β释放的现象,将为HCC治疗提供新策略。我们认为细胞焦亡在肝癌化疗过程中可能具有“双刃剑”(double-edged sword)作用。因此,Nutlin-3与细胞焦亡之间的关系在HCC治疗中的作用及其机制有待进一步研究。
[1] Wade M,Li YC,Wahl GM.MDM2,MDMX and p53 in oncogenesis and cancer therapy[J].Nat Rev Cancer,2013,13(2):83-96.
[2] Vassilev LT.MDM2 inhibitors for cancer therapy[J].Trends Mol Med,2007,13(1):23-31.
[3] Shi X,Liu J,Ren L,etal.Nutlin-3 downregulates p53 phosphorylation on serine392 and induces apoptosis in hepatocellular carcinoma cells[J].BMB Rep,2014,47(4):221-226.
[4] Veeranki S,Choubey D.Interferon-inducible p200-family protein IFI16,an innate immune sensor for cytosolic and nuclear double-stranded DNA:regulation of subcellular localization[J].Mol Immunol,2011,49(4):567-571.
[5] Shi X,Yang J,Mao N,etal.Nutlin-3-induced redistribution of chromatin-bound IFI16 in human hepatocellular carcinoma cells in vitro is associated with p53 activation[J].Acta Pharmacol Sin,2015,35(2):252-258.
[6] Miao EA,Rajan JV,Aderem A.Caspase-1-induced pyroptotic cell death[J].Immunol Rev,2011,243(1):206-214.
[7] Strowig T,Henao-Mejia J,Elinav E,etal.Inflammasomes in health and disease[J].Nature,2012,481(7381):278-286.
[8] Szabo G,Csak T.Inflammasomes in liver diseases[J].J Hepatol,2012,57(3):642-654.
[9] Lebeaupin C,Proics E,Bieville CH,etal.ER stress induces NLRP3 inflammasome activation and hepatocyte death[J].Cell Death Dis,2015,6(9):e1879.
[10] Miura K,Kodama Y,Inokuchi S,etal.Toll-like receptor 9 promotes steatohepatitis by induction of interleukin-1β in mice[J].Gastroenterology,2010,139(1):323-334.
[11] Chen YL,Xu G,Liang X,etal.Inhibition of hepatic cells pyroptosis attenuates CLP-induced acute liver injury[J].Am J Trans Res,2016,8(12):5685-5695.
[12] Chu Q,Jiang Y,Zhang W,etal.Pyroptosis is involved in the pathogenesis of human hepatocellular carcinoma[J].Oncotarget,2016,7(51):84658-84665.
[13] Gurcel L,Abrami L,Girardin S,etal.Caspase-1 activation of lipid metabolic pathways in response to bacterial pore-forming toxins promotes cell survival[J].Cell,2006,126(6):1135-1145.
[14] Franchi L,Eigenbrod T,Muoz-Planillo R,etal.The inflammasome:a caspase-1-activation platform that regulates immune responses and disease pathogenesis[J].Nat Immunol,2009,10(3):241-247.
[15] Chen LC,Wang LJ,Tsang NM,etal.Tumour inflammasome-derived IL-1β recruits neutrophils and improves local recurrence-free survival in EBV-induced nasopharyngeal carcinoma[J].EMBO Mol Med,2012,4(12):1276-1293.
[16] Wree A,Eguchi A,McGeough MD,etal.NLRP3 inflammasome activation results in hepatocyte pyroptosis,liver inflammation,and fibrosis in mice[J].Hepatology,2014,59(3):898-910.
[17] Yan W,Chang Y,Liang X,etal.High-mobility group box 1 activates caspase-1 and promotes hepatocellular carcinoma invasiveness and metastases[J].Hepatology,2012,55(6):1863-1875.
[18] Vassilev LT,Vu BT,Graves B,etal.In vivo activation of the p53 pathway by small-molecule antagonists of MDM2[J].Science,2004,303(5659):844-848.
[19] Shangary S,Wang S.Small-molecule inhibitors of the MDM2-p53 protein-protein interaction to reactivate p53 function:a novel approach for cancer therapy[J].Annu Rev Pharmacol,2009,49:223-241.
[20] Wang J,Zheng T,Chen X,etal.MDM2 antagonist can inhibit tumor growth in hepatocellular carcinoma with different types of p53 in vitro[J].J Gastroen Hepatol,2011,26(2):371-377.
[收稿2017-01-08 修回2017-03-17]
(编辑 张晓舟)
Nutlin-3 promotes pyroptosis in SMMC-7721 cells
SHIXin-Li,LIUJing-Li,YUKun,LIANGJie,NIUXiao-Li.
DepartmentofPathobiologyandImmunology,HebeiUniversityofChineseMedicine,Shijiazhuang,Hebei050200,China
Objective:To evaluate the effect of Nutlin-3,a MDM2 antagonist,on the pyroptosis in SMMC-7721 cells.Methods: The expression of actived caspase-1(p20) and IL-1β was detected using Western blot analysis.Pyroptosis was investigated by a standard lactate dehydrogenase release assay(LDH).IL-1β content in the cell culture supernatant was quantified by ELISA.Results: Nutlin-3 up-regulated the expression level of actived caspase-1 and IL-1β in SMMC-7721 cells.Meanwhile,Nutlin-3 increased significantly the content of LDH and IL-1β in the cell culture supernatant(P<0.05).Conclusion: Nutlin-3 activated pro-caspase-1,promoted pyroptosis and IL-1β release in SMMC-7721 cells.
Nutlin-3;Hepatocellular carcinoma;Pyroptosis;caspase-1;IL-1β
10.3969/j.issn.1000-484X.2017.07.012
①本文为河北省自然科学基金资助项目(H20174230011)、河北省中西医结合肝肾病证重点实验室开放课题、河北省教育厅青年基金项目(No.QN2014012)和河北中医学院博士科研基金项目(No.BSZ2015006)。
石新丽(1976年-),女,博士,副教授,硕士生导师,主要从事抗感染免疫与免疫调节方面的研究,E-mail:sxlsunshine@sina.com。
R735.5
A
1000-484X(2017)07-1014-04
②中国人民解放军白求恩医务士官学校医学技术系装备维修教研室,石家庄050081。

