大豆GmCOL1和GmCOL13启动子和基因组基因的克隆与生物信息学分析
韩英英 陈福禄 傅永福 张晓玫
(中国农业科学院作物科学研究所 国家农作物基因资源与遗传改良重大科学工程农业部北京大豆生物学重点实验室,北京 100081)
大豆GmCOL1和GmCOL13启动子和基因组基因的克隆与生物信息学分析
韩英英 陈福禄 傅永福 张晓玫
(中国农业科学院作物科学研究所 国家农作物基因资源与遗传改良重大科学工程农业部北京大豆生物学重点实验室,北京 100081)
以大豆天隆1号为材料提取基因组DNA,分别克隆到长2 631 bp的 GmCOL1启动子和2 809 bp的GmCOL13启动子。此外,还克隆到GmCOL1和GmCOL13基因组基因长度分别为3 488 bp和2 798 bp,它们分别编码含348个和366个氨基酸的蛋白质。利用PlantCARE分析GmCOL1和GmCOL13的启动子序列发现,它们均含有以下调控元件:生物钟元件(Circadian)、光响应元件(ACEG-box等)、ABA响应元件(ABRE)、干旱诱导元件(MBS)、低温响应元件(LTR)。ProtParam分析表明,GmCOL1和GmCOL13蛋白质的分子量分别为38.47 kD和40.91 kD,并且都是亲水性蛋白。GOR分析显示,GmCOL1和GmCOL13的二级结构含有Alpha helix,Extended strand和Random coil。在线网站PROSITE的分析说明,GmCOL1和GmCOL13有两个Zinc finger B-box和一个CCT domain(CO,CO-LIKE and TOC1 domain)结构域。
大豆;GmCOL1;GmCOL13;基因克隆;生物信息学分析
种子萌发、营养生长、开花、受精、胚胎发育、种子形成等一系列发育事件构成了高等植物的生活周期,其中成花转变是指营养生长向生殖生长转换的过程。成花转变过程由植物自身遗传因子和外界环境因素两方面共同决定,受错综复杂的网络信号传导途径的调控。近年来利用分子遗传学方法对拟南芥等植物开花突变体进行研究表明,植物中存在5条主要的开花促进途径:光周期途径(Photoperiod pathway)、春化途径(Vernalization pathway)、赤霉素途径(GA pathway)、自主途径(Autonomous pathway)和年龄途径(Aging pathway)[1,2],其中光周期途径是目前为止研究得较为清楚的一条途径。研究表明,CO(CONSTANS)是光周期途径中的关键基因[3,4],它位于光受体下游和生物钟的输出途径,是生物钟和开花时间基因之间监测日照长度的重要元件,它可以整合光信号和生物钟信号[5,6],并激活下游基因FT(FLOWERING LOCUS T)基因的表达从而诱导植物开花[7]。因此,CO基因的突变导致植物晚花[8,9]。
在长日照植物拟南芥中,CO的表达模式在很大程度上受到生物钟基因FKF1(FLAVIN-BINDING,KELCH REPEAT,F-BOX1)、GI(GIGANTEA) 和CDF(CYCLING DOF FACTOR)) 的 调 控[3,10-12]。在早晨,CDF和GI形成的复合体会结合在CO的启动子区从而抑制CO的转录;而在傍晚,FKF1和 GI会形成蛋白复合体去降解CDF蛋白[10,11]。CO蛋白在傍晚通过光稳定,并在早晨或在黑暗中降解[13]。在早晨,光敏色素B(PHYB)促进CO蛋白的降解,而PHYA和隐花色素(CRY1和CRY2)在LD条件的下午稳定CO蛋白[13-15]。SPA1(Suppressor of phya proteins)、SPA3和 SPA4和COP1(Constitutivephotomorphogenesis 1)复合物在夜间降解CO蛋白[16-18]。HOS1(High expression of osmotically responsive genes 1)也在上午负调节CO蛋白[19]。
在逆境下(旱、盐碱、热、冷、冻),植物体内脯氨酸的含量显著增加。植物体内脯氨酸含量在一定程度上反映了植物的抗逆性,抗旱性强的品种往往积累较多的脯氨酸。1-Pyrroline-5-carboxylate synthase(P5CS)酶是调控脯氨酸合成的限速步骤,在拟南芥中有两个编码P5CS的基因:AtP5CS1和AtP5CS2[20]。ACS10(ACC SYNTHASE 10)是乙烯合成的关键酶。CO基因的过表达促进AtP5CS2和ACS10基因的表达[7],说明CO基因可能参与植物抗逆的调节。
本研究克隆大豆GmCOL1和GmCOL13启动子以及基因组基因(包含5′和3′非翻译区、完整的外显子、内含子和终止子),并通过生物信息学的方法预测启动子和基因编码蛋白所含的功能元件,为进一步研究基因的功能提供基本材料和理论依据。
1 材料与方法
1.1 材料
1.1.1 植物材料 大豆品种天隆1号由中国农业科学院武汉油料所周新安老师惠赠。种植在中国农业科学院作物科学研究所温室中,培养条件为长日(16 h光照/8 h黑暗),光照强度为100-300 μmol/(m2·s),温度为恒定25℃。
1.1.2 菌株和载体 实验中所用大肠杆菌(Escherichia coli)菌株DH5α为本实验室保存;启动子入门载体Fu76、基因入门载体 Fu79及表达载体Fu39-2-GUS[21]为本实验室保存。
1.1.3 主要试剂 限制性内切酶购自NEB;PrimeSTAR®HS DNA Polymerase购自TaKaRa;DNA Ligation Kit Ver.2.1购 自TaKaRa;普 通Taq DNA polymerase购自北京泽星生物科技有限公司;基因组DNA提取试剂盒购天根生化科技(北京)有限公司;琼脂糖凝胶回收试剂盒购自天根生化科技(北京)有限公司。
1.2 方法
1.2.1 启动子的克隆及载体构建 参照天根植物基因组DNA提取试剂盒提取大豆天隆1号基因组DNA。根据Phytozome网站上Glycine max Wm82.a2.v1数据库中Glyma08g28370(GmCOL1)和Glyma19g05170(GmCOL13)的基因组序列设计引物(表1)。选取5′ UTR上游3 kb作为启动子。以大豆天隆1号全基因组DNA为模板进行PCR扩增。PCR体系:2×PrimeSTAR GC Buffer 25 μL,dNTP Mixture 4 μL,正反向引物各1 μL(10 μmol/L),模板0.5 μL(200-400 ng),PrimeSTAR HS DNA Polymerase 0.5 μL,用灭菌水补足至50 μL。PCR 反应程序为:94℃ 3 min;98℃ 10 s,60℃ 30 s,72℃ 1 min,35个循环;72℃ 10 min。用1.0%琼脂糖凝胶电泳检测扩增产物。回收PCR 产物,与Fu76载体连接;连接产物转化大肠杆菌DH5α,挑取单克隆,通过菌落PCR 鉴定阳性克隆。阳性克隆委托北京睿博兴科生物技术有限公司测序,序列测序正确的质粒通过LR 反应到表达载体Fu39-2-GUS,转化大肠杆菌DH5α,挑取单克隆,通过菌落PCR 鉴定阳性克隆。阳性克隆委托北京睿博兴科生物技术有限公司测序。
1.2.2 基因的克隆及载体构建 提取基因组DNA、PCR反应程序、以及菌液PCR检测过程见方法1.2.1。我们将3′ UTR下游1 kb作为终止子,引物见表1。

表1 所用引物列表
1.2.3 生物信息学分析 使用PlantCARE(http:// bioinformatics.psb.ugent.be/webtools/plantcare/html)分析启动子元件。通过ProtParam(http://web.expasy.org/ protparam/)分析蛋白质的分子量、分子式、等电点、脂肪系数、不稳定系数、半衰期、平均亲水系数以及氨基酸组成。ProtScale 程序(http://web.expasy. org/protscale)进行疏水性分析。通过SingalP4.1(http://www.cbs.dtu.dk/services/SignalP) 分 析 蛋 白质中的信号肽。用TMHMM2.0(http://www.cbs.dtu. dk/services/TMHMM)分析蛋白质的跨膜区。通过NetPhos 3.1 Server(http://www.cbs.dtu.dk/services/ NetPhos)预测磷酸化位点。通过在线的PROSITE(http://prosite.expasy.org)进行蛋白质结构域分析。通过在线的二级结构预测网站GOR(https://npsaprabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_gor4. html)分析二级结构。通过STRING(http://string-db. org)推测与可能与GmCOL1或GmCOL13有直接或间接相互作用的蛋白质。
2 结果
2.1 基因的克隆
2.1.1 大豆GmCOL1和GmCOL13启动子的克隆 根据Phytozome网站上Glycine max Wm82.a2.v1数据库中Glyma08g28370(COL1)和Glyma19g05170(COL13)的基因组序列设计引物。选取5′ UTR上游3 kb作为启动子,以大豆天隆1号全基因组DNA为模板进行PCR扩增,得到约3 kb的条带(图1)。将扩增得到的目的片段连接在Fu76载体,并进行测序,测序结果得到的GmCOL1为2 631 bp,GmCOL13为2 809 bp。它们分别与Glycine max Wm82.a2.v1中的Glyma08g28370和Glyma19g05170序列一致。
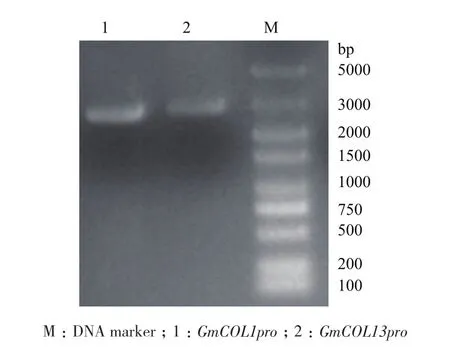
图1 GmCOL1和GmCOL13的启动子扩增

图2 GmCOL1和GmCOL13的启动子元件分析
2.1.2 大豆GmCOL1和GmCOL13的启动子元件分析 将扩增得到的序列在PlantCARE中进行分析,发现GmCOL1和GmCOL13的启动子区均含有以下重要元件:Circadian(生物钟元件);光响应元件(ACE,G-box等);ABA响应元件(ABRE);干旱诱导元件(MBS);LTR(低温响应元件)。其中GmCOL13还含有GA响应元件(GARE,P-box和 TATC-box),表明GmCOL1和GmCOL13可能受到生物钟、ABA和干旱的影响,GmCOL13还会受到GA的影响。拟南芥AtCO的启动子元件中也含有Circadian、光响应元件、ABA、干旱诱导元件、GA响应元件,不包括LTR。说明GmCOL1和GmCOL13和拟南芥AtCO的启动子元件基本一致(图2,表1)。2.1.3 大豆GmCOL1和GmCOL13基因组基因(gDNA)扩增 根据Phytozome网站上Glycine max Wm82.a2.v1数据库中Glyma08g28370(GmCOL1)和Glyma19g05170(GmCOL13)的基因组序列设计引物。我们将gDNA分成两部分,第一部分为5′ UTR+编码区;第二部分为3′ UTR+终止子。在这两部分之间分别插入3xHA和3xFLAG标签,用于后续试验中蛋白表达分析。将序列与Fu79连接进行测序,测序得到GmCOL1的5′ UTR+编码区为2 559 bp,3′UTR+终止子为928 bp;GmCOL13的5′ UTR+编码区为2 115 bp,3′ UTR+终止子为682 bp(图3)。测序结果与Glycine max Wm82.a2.v1中的序列基本一致,个别碱基差异之处由品种间差异所致,表明克隆得到的基因是大豆天隆1号中的COL基因。
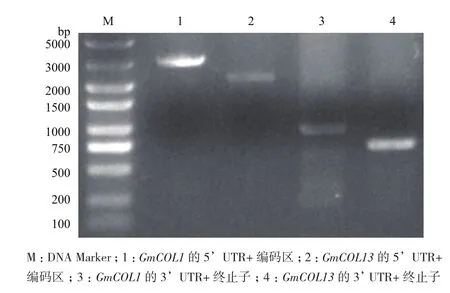
图3 GmCOL1和GmCOL13的基因组DNA扩增
2.2 大豆GmCOL1和GmCOL13蛋白质的生物信息学分析
2.2.1 大豆GmCOL1和GmCOL13蛋白质的氨基酸组成及亲疏水性分析 GmCOL1编码348个氨基酸。ProtParam分析结果(表2)表明,该蛋白质的分子量为38.47 kD,分子式为C1670H2569N489O525S18,等电点为5.88;带负电荷的氨基酸残基数(Asp+Glu)为45个,带正电荷的氨基酸残基数(Arg+Lys)为34个;脂肪系数为67.04;不稳定系数为28.46,此蛋白为稳定蛋白(标准40 以下为稳定蛋白);理论推导半衰期大约为30 h;平均亲水系数为-0.434。在GmCOL1蛋白的氨基酸组成中,含量较高的氨基酸有:Ala(10.9%)、Ser(8.9%)、Val(7.8%)、Arg(6.0%)。
GmCOL13编码的氨基酸有366个,ProtParam分析结果(表2)表明该蛋白质的分子量为40.91 kD,分子式为C1775H2736N508O563S22,等电点为5.47;带负电荷的氨基酸残基数(Asp+Glu)为52,带正电荷的氨基酸残基数(Arg+Lys)为38;脂肪系数为65.77;不稳定系数为47.50,此蛋白为不稳定蛋白;理论推导半衰期大约为30 h;平均亲水系数为-0.507。在GmCOL13蛋白的氨基酸组成中,含量较高的氨基酸有:Ala(10.9%)、Ser(8.9%)、Val(7.8%)。
用ProtScale 在线工具进行疏水性分析(图4),同样可得出这两个蛋白为亲水性蛋白。
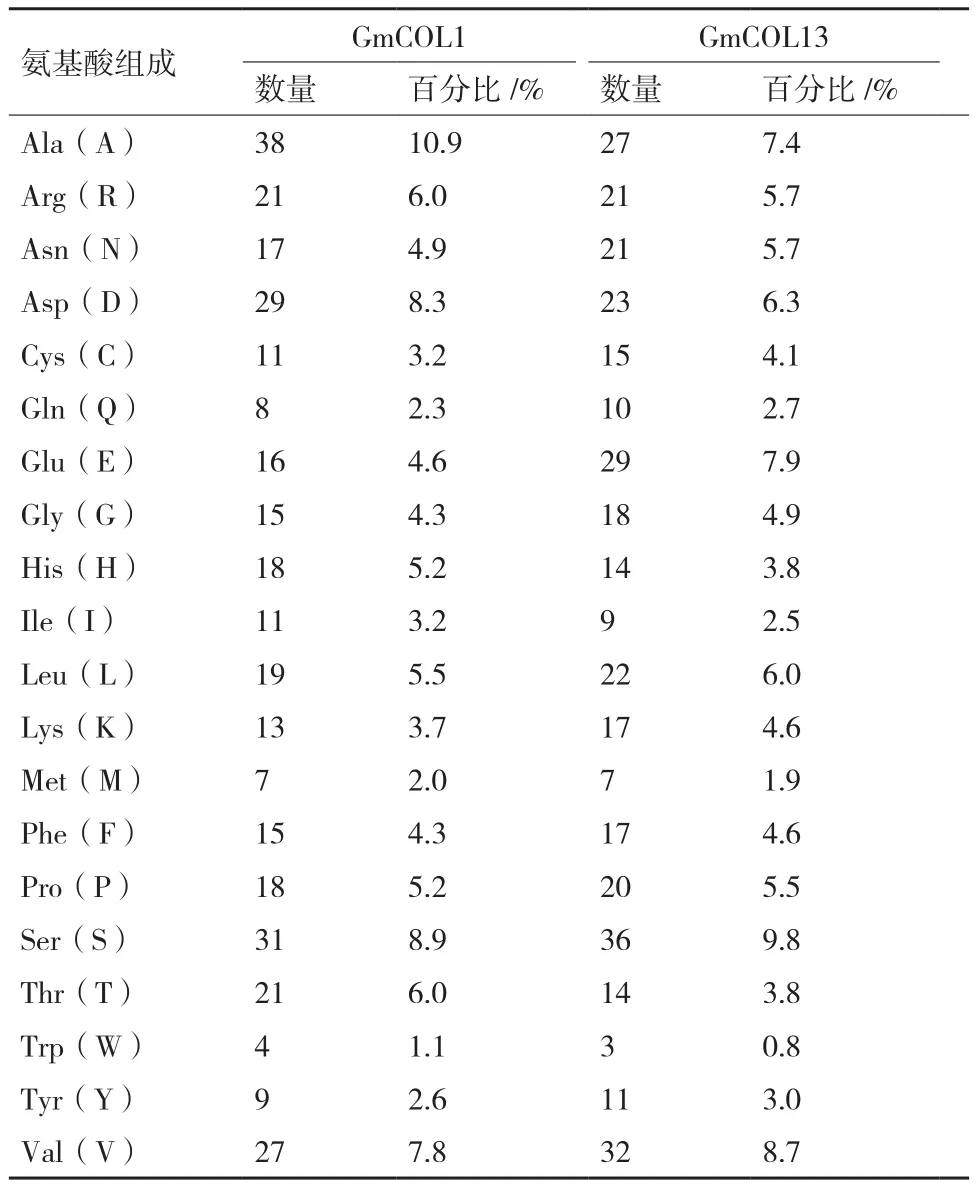
表2 GmCOL1和GmCOL13的氨基酸含量
2.2.2 大豆GmCOL1和GmCOL13的信号肽、跨膜区和磷酸化位点预测 通过SingalP4.1分析发现GmCOL1和GmCOL13的蛋白质中没有信号肽。用TMHMM2.0分析GmCOL1和GmCOL13的蛋白质也不存在跨膜区。通过NetPhos 3.1 Server预测GmCOL1和GmCOL13含有广泛的磷酸化位点(图5)。表明GmCOL1和GmCOL13会受到磷酸化修饰,从而影响其活性。
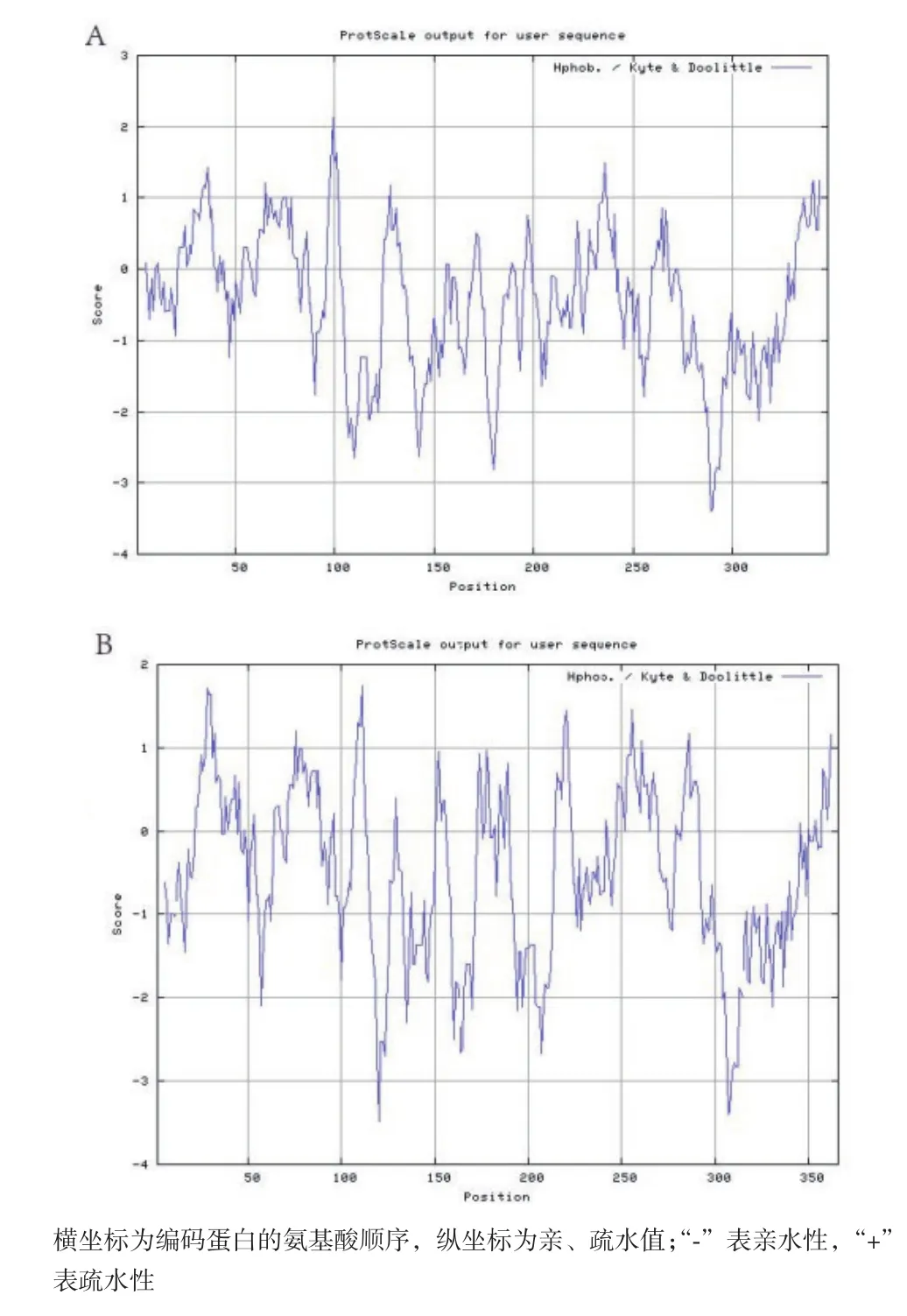
图4 GmCOL1(A)和GmCOL13(B)的氨基酸疏水性分析
2.2.3 不同物种中COL的进化树分析 分别用COL1和COL13的蛋白质序列通过UniProt的BLAST查找大豆、木豆、苜蓿、豌豆、可可、烟草、拟南芥、马铃薯、水稻、玉米、二穗短柄草和小麦的同源基因,然后通过MEG6构建系统发育树。结果(图6)表明,GmCOL1和GmCOL13与其他豆科植物的CO(如MtCOLa、PsCOLa、CaCOL2)亲缘关系较近。
2.2.4 大豆GmCOL1和GmCOL13的功能结构域分析 通过在线的PROSITE进行蛋白质结构域分析,发现GmCOL1和GmCOL13均有两个Zinc finger B-box和一个CCT domain,且所在的位置也类似(图7)。Zinc finger B-box是一个大约有40个氨基酸的结构域,它通常存在于转录因子、核糖核蛋白类和原癌基因蛋白类。但是这个结构域并没有详细的功能研究。CCT(CONSTANS,CO-like,and TOC1)domain是大约43个氨基酸的高度保守的基本元件,存在于参与光信号诱导的植物蛋白的C端,并且会与其他结构域互作,例如B-box zinc finger、GATA-type zinc finger和ZIM motif或相应调节结构域。已有研究表明CCT domain参与核定位,也可能参与蛋白质与蛋白质之间的互作。
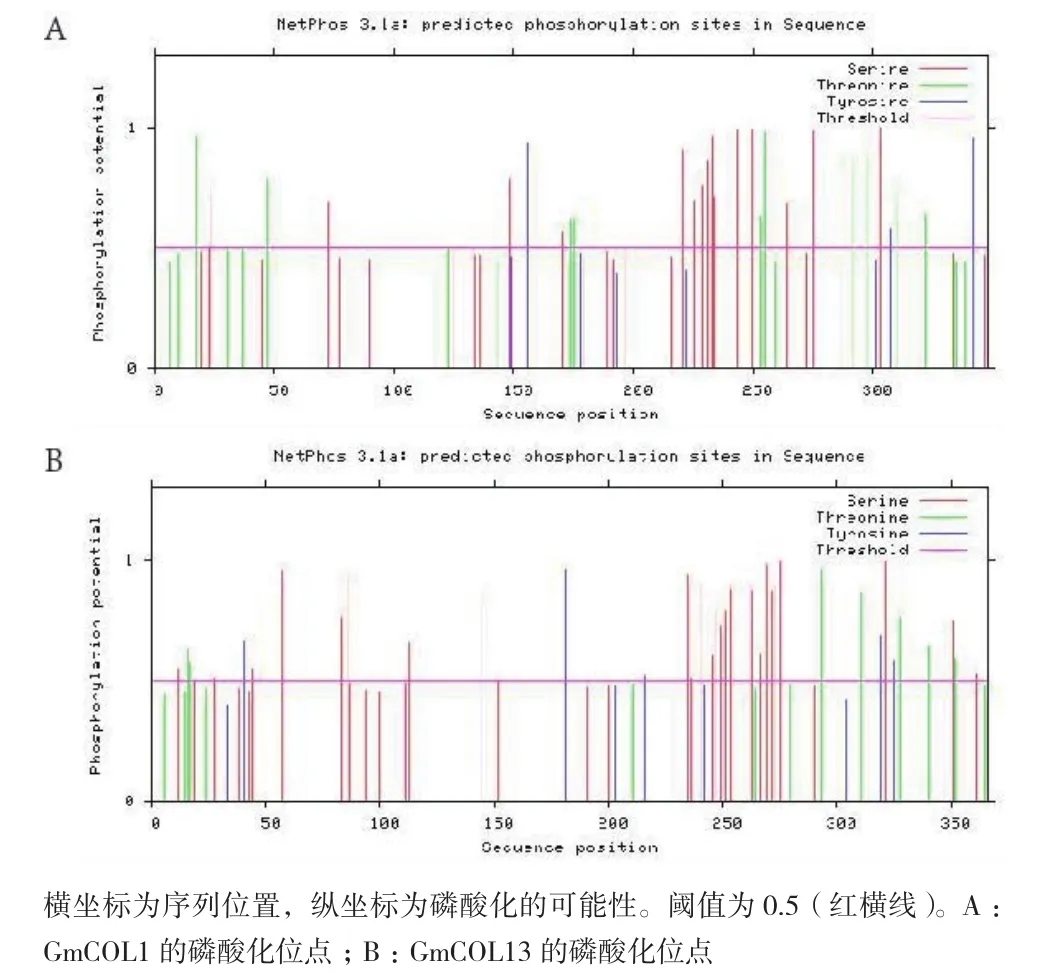
图5 GmCOL1和GmCOL13的磷酸化位点预测
GmCOL1在N端有两个Zinc finger B-box,分别位于第10-54位(TWARMCDTCRSAPSSVFCRAHTAF LCATCDARLHASLTWHERVWV)和第50-97位氨基酸(ERVWVCEACERAPAAFLCKADAASLCASCDADI HAANPLASRHHRVPI);C端有一个CCT domain,在第279-321位氨基酸(REARVLRYREKKKTRKFEKT IRYASRKAYAETRPRIKGRFAKR)。GmCOL13的两个Zinc finger B-box分别位于第17-64位(TWSRVCDTC LSAPCVLYCHADSAYLCSSCDARVHAANRVASRHKRV WV)和第60-107位氨基酸(KRVWVCEACERAPAAF LCKADAASLCSSCDADIHSANPLASRHNRVPI);C端有一个CCT domain,位于第297-339位氨基酸(REA RVLRYREKKKTRKFEKKIRYASRKAYAETRPRIKGRFAKR)。
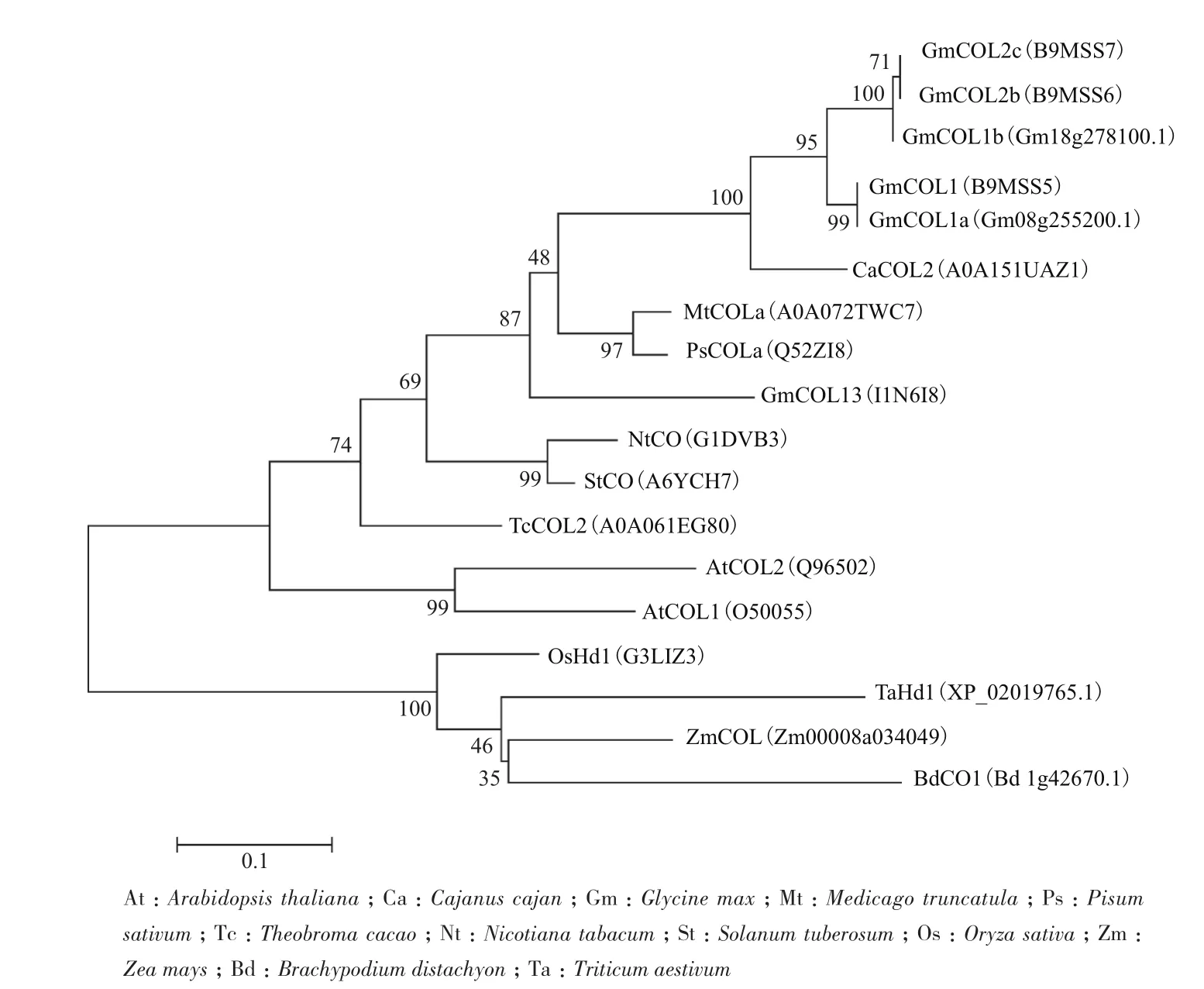
图6 GmCOL1和GmCOL13蛋白质的进化树分析
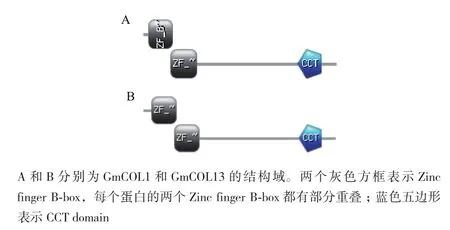
图7 GmCOL1和GmCOL13的结构域示意图
2.2.5 大豆GmCOL1和GmCOL13的二级结构分析 通过在线二级结构预测网站GOR的分析(图8)表明,GmCOL1和GmCOL13的二级结构只存在Alpha helix(Hh)、Extended strand(Ee)和Random coil(Cc)。GmCOL1中 分 别 有73个Alpha helix(20.98%),64个Extended strand(18.39%) 和211个Random coil(60.63%);GmCOL13中分别有92个Alpha helix(25.14%),67个Extended strand(18.31%)和207个Random coil(56.56%)。
2.2.6 大豆GmCOL1和GmCOL13的蛋白质互作关系预测 在拟南芥中,CO的转录水平高低与FLAVIN-BINDING、KELCH REPEAT、F-BOX 1(FKF1)-GIGANTEA(GI)复合物的量紧密相关。这个复合物以蓝光依赖的方式通过泛素蛋白酶体降解CO转录抑 制 物CYCLINGDOF FACTORs(CDFs)[3,10,11]。GI也会直接结合在CO的启动子区,而当GI与EARLY FLOWERING 4(ELF4)互作时会离散核体进而影响CO的表达水平[22]。以上研究表明CO与GI能够通过直接或间接方式互作。
CO蛋白质的降解方式主要是通过E3泛素连接酶介导的泛素化,而SCF复合体的泛素化活性依赖于其4个组成成分:RBX1、Skp1-like、cullin和F-box蛋白。此外,cullin必须经过结合RUB/NEDD8泛素化来修饰后才能具有活性[23]。综上所述,NEDD8通过直接或间接方式与CO互作进而使CO蛋白降解。
本研究通过STING推测可能与GmCOL1或GmCOL13有直接或间接相互作用的蛋白质(图9)。 如GmGIa(GIGANTEA) 和GmGIL1(Glyma20G170000),通过光周 期 调控开花;Glyma01G41590和Glyma11G03840是 含 有 ELYS domain,具有泛素蛋白转移酶活性;Glyma02G43540和Glyma14G05430是含有RING和WD40结构域,具有泛素蛋白连接酶活性;LFY(Glyma04G37900)是 含 有FLO-LFY domain(Floricaula/leafy protein),它调控转录,调节开花时间;Glyma05G15210和Glyma19G22450含有PINT domain,是COP9信号小体的组成成分,参与泛素依赖的蛋白催化过程和deneddylation(neddylation是一种新型的类泛素化修饰)。通过与这些蛋白质的相互作用,GmCOL1和GmCOL13可能参与光周期开花途径、泛素化修饰以及neddylation。

图8 GmCOL1和GmCOL13的蛋白质二级结构示意图
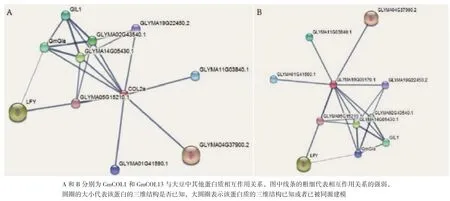
图9 GmCOL1或GmCOL13与大豆中其他蛋白质相互作用关系图
3 讨论
CO在拟南芥开花调节的光周期响应机制中具有主要作用。启动子区有许多调控元件,通过分析这些元件可以预测基因受哪些外界条件诱导,可能受哪些调控因子的调控。本研究中分析了GmCOL1和GmCOL13的启动子元件,发现这两个基因可能受生物钟调控。前期工作表明,GmCOL1的表达峰值在黎明,此后直到傍晚表达量一直很低;在短日条件下,GmCOL13的表达峰值在ZT12,长日条件下有两个表达峰,一个在ZT4另一个分别在ZT12和ZT16[24]。本研究还发现,GmCOL1和GmCOL13的启动子还受ABA、干旱以及低温的影响,GmCOL13还可能受到GA的影响。
GmCOL1蛋白质较稳定,这个物理性质不同于拟南芥CO;而GmCOL13则是不稳定蛋白质,与拟南芥CO类似。拟南芥CO蛋白的稳定性受到一些光受体的影响,在傍晚通过一些蓝光受体使其稳定,而在早晨或在黑暗中被降解[13]。
通过进化树分析,GmCOL1和GmCOL13与豆科植物的MtCO、StCO的同源关系较近。在拟南芥中,尽管AtCOL1和AtCOL2与AtCO的氨基酸序列高度相似,但是AtCOL1和AtCOL2都与光周期开花没有关系[25]。MtCOLa对开花没有影响[26]。StCO对开花时间的影响也很弱[27]。因此,GmCOL1和GmCOL13对大豆的光周期开花调节的功能有待进一步研究。
GmCOL1和GmCOL13有多个位点能够被磷酸化,表明这两个蛋白质的活性可能会受到磷酸化的影响。蛋白质磷酸化也是一种翻译后修饰方式,这个过程影响转录因子的稳定性和活性[28]。有研究表明,磷酸化会影响黑暗和光照条件时AtCO蛋白的稳定性,从而与光周期开花调节相关[29]。
STRING互作分析表明,GmCOL1和GmCOL13可能与开花基因GI和LFY互作,从而调节大豆开花。而且GmCOL1和GmCOL13蛋白可能与泛素修饰及neddylation(一种新型的类泛素化修饰),说明GmCOL1和GmCOL13蛋白代谢调节是一个复杂的过程。
4 结论
本研究分别克隆到了GmCOL1和GmCOL13的启动子和基因组基因,其序列在天隆1号和Williams没有明显差异。GmCOL1和GmCOL13基因的表达可能受到生物钟、干旱和低温的影响,GmCOL13的表达还可能受到GA的影响。GmCOL1可能不参与调控光周期开花,但是GmCOL13基因可能参与植物生物钟节律途径。GmCOL1和GmCOL13的蛋白质代谢可能与磷酸化、泛素化及neddylation有关。
[1]Komeda Y. Genetic regulation of time to flower in Arabidopsis thaliana[J]. Annu Rev Plant Biol, 2004, 55:521-535.
[2]Simpson GG, Dean C. Arabidopsis, the Rosetta stone of flowering time?[J]. Science, 2002, 296(5566):285-289.
[3]Imaizumi T, Schultz TF, Harmon FG, et al. FKF1 F-box protein mediates cyclic degradation of a repressor of CONSTANS in Arabidopsis[J]. Science, 2005, 309(5732):293-297.
[4]Kobayashi Y, Weigel D. Move on up, it’s time for change--mobile signals controlling photoperiod-dependent flowering[J]. Genes & Development, 2007, 21(19):2371-2384.
[5]Turck F, Fornara F, Coupland G. Regulation and identity of florigen:FLOWERING LOCUS T moves center stage[J]. Annual Review of Plant Biology, 2008, 59:573-594.
[6]Song YH, Ito S, Imaizumi T. Flowering time regulation:photoperiodand temperature-sensing in leaves[J]. Trends Plant Sci, 2013, 18(10):575-583.
[7]Samach A, Onouchi H, Gold SE, et al. Distinct roles of CONSTANS target genes in reproductive development of Arabidopsis[J]. Science, 2000, 288(5471):1613-1616.
[8]Koornneef M, Hanhart CJ, van der Veen JH. A genetic and physiological analysis of late flowering mutants in Arabidopsisthaliana[J]. Mol Gen Genet, 1991, 229(1):57-66.
[9]Rédei GP. Supervital mutants of Arabidopsis[J]. Genetics, 1962, 47(4):443-460.
[10]Sawa M, Nusinow DA, Kay SA, et al. FKF1 and GIGANTEA complex formation is required for day-length measurement in Arabidopsis[J]. Science, 2007, 318(5848):261-265.
[11]Fornara F, Panigrahi KC, Gissot L, et al. Arabidopsis DOF transcription factors act redundantly to reduce CONSTANS expression and are essential for a photoperiodic flowering response[J]. Developmental Cell, 2009, 17(1):75-86.
[12]Song YH, Smith RW, To BJ, et al. FKF1 conveys timing information for CONSTANS stabilization in photoperiodic flowering[J]. Science, 2012, 336(6084):1045-1049.
[13]Valverde F, Mouradov A, Soppe W, et al. Photoreceptor regulation of CONSTANS protein in photoperiodic flowering[J]. Science, 2004, 303(5660):1003-1006.
[14]Liu B, Zuo Z, Liu H, et al. Arabidopsis cryptochrome 1 interacts with SPA1 to suppress COP1 activity in response to blue light[J]. Genes & Development, 2011, 25(10):1029-1034.
[15] Zuo Z, Liu H, Liu B, et al. Blue light-dependent interaction of CRY2 with SPA1 regulates COP1 activity and floral initiation in Arabidopsis[J]. Current Biology:CB, 2011, 21(10):841-847.
[16]Laubinger S, Marchal V, Le Gourrierec J, et al. Arabidopsis SPA proteins regulate photoperiodic flowering and interact with the floral inducer CONSTANS to regulate its stability[J]. Development, 2006, 133(16):3213-3222.
[17]Jang S, Marchal V, Panigrahi KC, et al. Arabidopsis COP1 shapes the temporal pattern of CO accumulation conferring a photoperiodic flowering response[J]. The EMBO Journal, 2008, 27(8):1277-1288.
[18]Liu B, Kanazawa A, Matsumura H, et al. Genetic redundancy in soybean photoresponses associated with duplication of the phytochrome A gene[J]. Genetics, 2008, 180(2):995-1007.
[19]Lazaro A, Valverde F, Pineiro M, et al. The Arabidopsis E3 ubiquitin ligase HOS1 negatively regulates CONSTANS abundance in the photoperiodic control of flowering[J]. The Plant Cell, 2012, 24(3):982-999.
[20]Strizhov N, Abraham E, Okresz L, et al. Differential expression of two P5CS genes controlling proline accumulation during saltstress requires ABA and is regulated by ABA1, ABI1 and AXR2 in Arabidopsis[J]. The Plant Journal, for Cell and Molecular Biology, 1997, 12(3):557-569.
[21]Wang X, Fan C, Zhang X, et al. BioVector, a flexible system for gene specific-expression in plants[J]. BMC Plant Biol, 2013, 13(1):198.
[22]Kim Y, Lim J, Yeom M, et al. ELF4 regulates GIGANTEA chromatin access through subnuclear sequestration[J]. Cell Rep 2013, 3(3):671-677.
[23]Hotton SK, Callis J. Regulation of cullin RING ligases[J]. Annual Review of Plant Biology, 2008, 59:467-489.
[24]Fan C, Hu R, Zhang X, et al. Conserved CO-FT regulons contribute to the photoperiod flowering control in soybean[J]. BMC Plant Biology, 2014, 14:9.
[25]Ledger S, Strayer C, Ashton F, et al. Analysis of the function of two circadian-regulated CONSTANS-LIKE genes[J]. The Plant Journal, for Cell and Molecular Biology, 2001, 26(1):15-22.
[26]Wong AC, Hecht VF, Picard K, et al. Isolation and functional analysis of CONSTANS-LIKE genes suggests that a central role for CONSTANS in flowering time control is not evolutionarily conserved in Medicago truncatula[J]. Frontiers in Plant Science, 2014, 5:486.
[27]González-Schain ND, Díaz-Mendoza M, Zurczak M, et al. Potato CONSTANS is involved in photoperiodic tuberization in a grafttransmissible manner[J]. The Plant Journal, for Cell and Molecular Biology, 2012, 70(4):678-690.
[28]Sugiyama N, Nakagami H, Mochida K, et al. Large-scale phosphorylation mapping reveals the extent of tyrosine phosphorylation in Arabidopsis[J]. Molecular Systems Biology, 2008, 4:193.
[29]Sarid-Krebs L, Panigrahi KC, Fornara F, et al. Phosphorylation of CONSTANS and its COP1-dependent degradation during photoperiodic flowering of Arabidopsis[J]. The Plant Journal:for Cell and Molecular Biology, 2015, 84(3):451-463.
(责任编辑 朱琳峰)
Cloning and Bioinformatics Analysis of Promoters and Genomic Genes of GmCOL1 and GmCOL13 in Soybean
HAN Ying-ying CHEN Fu-lu FU Yong-Fu ZHANG Xiao-mei
(MOA Key Lab of Soybean Biology(Beijing),National Key Facility for Crop Gene Resources and Genetic Improvement,Institute of Crop Science,Chinese Academy of Agricultural Sciences,Beijing 100081)
In the present study,the promoters and genomic genes of GmCOL1 and GmCOL13 were cloned from soybean cultivar Tianlong 1. The lengths of GmCOL1 and GmCOL13 promoters were 2 631 bp and 2 809 bp,while their genomic genes were 3 488 bp and 2 798 bp encoding 348 amino acids and 366 amino acids,respectively. Analysis by PlantCARE demonstrated that some important elements in the promoters of both GmCOL1 and GmCOL13:circadian,cis-acting regulatory element involved in light response,cis-acting element involved in ABA response,MYB binding site involved in drought-induction,and cis-acting element involved in low-temperature response. ProtParam analysis showed that GmCOL1 and GmCOL13 proteins were 38.47 kD and 40.91 kD,respectively,and both were hydrophilic. GOR analysis revealed that their secondary structure included mainly alpha helix,extended strand and random coil. Online PROSITE investigation displayed that GmCOL1 and GmCOL13 both had two zinc finger B-boxes and one CCT domain.
soybean;GmCOL1;GmCOL13;gene cloning;bioinformatics analysis
10.13560/J.cnki.biotech.bull.1985.2017-0201
2017-03-17
国家自然科学基金项目(31371703,31570289),转基因专项(2016ZX08004-005,2016ZX08009001-001)
韩英英,女,硕士,研究方向:植物分子生物学与基因工程;E-mail:hyy747319085@163.com
张晓玫,女,博士,研究方向:植物分子生物学与基因工程;E-mail:zhangxiaomei@caas.cn

