羧肽酶A的脱毒功能及其应用前景
熊露王晓云梁志宏,2
(1. 中国农业大学食品科学与营养工程学院,北京 100083;2. 农业部农业转基因生物安全评价(食用)重点实验室,北京 100083)
羧肽酶A的脱毒功能及其应用前景
熊露1王晓云1梁志宏1,2
(1. 中国农业大学食品科学与营养工程学院,北京 100083;2. 农业部农业转基因生物安全评价(食用)重点实验室,北京 100083)
赭曲霉毒素A(Ochratoxin A,OTA)是由曲霉菌和青霉菌产生的一种真菌毒素,谷物、豆类、葡萄酒和咖啡等制品常常受到其污染,对食品安全构成了极大的威胁。随着全球气候的变化,OTA的污染情况日益严重,为保障人类及畜禽动物的安全,不少研究人员正致力于脱除或降解食品及其原料中的OTA。目前很多真菌和细菌被报道能降解OTA,然而它们产生的降解酶很少被定性和纯化,降解产物也不明确,无法应用于工业中。羧肽酶A(Carboxypeptidase A,CPA)对OTA的脱毒能力已被广泛证明,同时它的性质、结构及作用机理都极为清晰,降解产物也对人体无害,是脱除OTA的理想产品。因此通过基因工程和蛋白质工程大量表达获得稳定并效率高的羧肽酶A是降解OTA的新途径。将从OTA的污染状况及其生物脱毒机制、CPA的脱毒能力、CPA作为脱毒剂的发展前景等方面进行综述,旨在为真菌毒素降解酶制剂的开发和应用奠定理论基础。
赭曲霉毒素A;生物脱毒;羧肽酶A
羧肽酶(Carboxypeptidase,CPs)是一种专一性地从肽链的C端逐个降解、释放游离氨基酸的一类肽链外切酶[1],发挥着许多重要的功能,参与食物的消化、神经内分泌肽的合成、蛋白的修饰及成熟等。广泛应用于医药、食品工业等领域,可去除食品和饲料中的赭曲霉毒素,同时也可用于脱苦。羧肽酶在动物、植物、微生物中均存在,然而目前人们主要从动物器官组织中生产获得商业化的羧肽酶,成本高、量少、操作困难,造成其售价比较昂贵,限制了羧肽酶功能的开发与应用。目前市场上污染赭曲霉毒素A的农产品包括粮食谷物、畜禽肉、奶制品等,不仅造成重大的经济损失,还严重威胁着人类的健康,如何去除这些毒素已然成为了当前的研究热点,而酶降解技术是最适合工业化的,利用基因工程和蛋白质工程获得大量的重组酶并对酶进行修饰以期获得稳定、效率高的羧肽酶是未来OTA脱除的另一发展方向。
1 赭曲霉毒素A的简介
赭曲霉毒素(Ochratoxins,OTs)是继黄曲霉毒素后又一个引起世界广泛关注的霉菌毒素。它是由7种曲霉菌(Aspergillus.spp)和6种青霉菌(Penicillium.spp)产生的一组世界范围内重要的污染食品的真菌毒素。毒素有A、B、C和D四种,其中OTA危害性最大。OTA分子式为C20H18ClNO6,由异香豆素和L-苯丙氨酸通过酰胺键形成,结构式如图1所示。OTA的相对分子质量为403.8,是一种无色的晶体状化合物。该毒素能溶于极性有机溶剂和稀的碳酸氢盐水溶液中,微溶于水,呈弱酸性。在有机溶剂和碱水中,OTA对空气和光不稳定,尤其在潮湿环境中,短暂的光照就能使之分解,但在乙醇溶液中低温条件下可保存一年。在紫外下能发出蓝色荧光。OTA具有耐热性和化学稳定性[2],谷物产品中的赭曲霉毒素 A 在高温条件下保存 3 h,仍能保持35%的毒性[3],焙烤只能使其毒性减少20%,蒸煮对其毒性无影响。
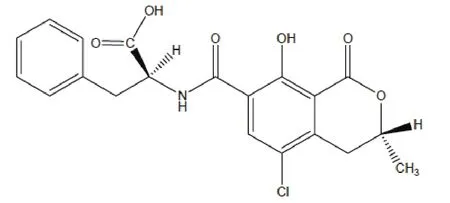
图1 赭曲霉毒素A的化学结构
1.1 赭曲霉毒素A对食品的污染
OTA具有肾脏毒性[4]、肝脏毒性[5],还有致畸[6]、致突变[7]和致癌作用[8],并有免疫抑制作用[9],1993年被认定为2B类致癌物[10],严重危害食品及饲料的食用/饲用安全。全世界每年有25%的粮食受到已确认的真菌毒素的污染[11],粮食的真菌毒素污染问题已成为全球粮食问题的热点。我国是粮食生产和消费大国,有报道显示,赭曲霉毒素 A 在全国粮食类食品中的检出阳性率为 2.47%[12]。OTA污染最严重的是谷物及其制品,人类OTA 摄入量的50%也来源于谷物及相关产品,有报告显示在饲料霉菌毒素中,黄曲霉毒素因管控严格会渐渐淡化而赭曲霉毒素由于污染范围较广有可能成为我国未来几年霉菌毒素危害的“后起之秀”[13]。其次OTA还污染葡萄及其制品,人们从葡萄酒中摄取的OTA含量占总量的13%。因此OTA对食品质量安全的影响不容小视。
1.2 赭曲霉毒素A的生物脱毒机制
OTA脱毒主要有两种途径,即吸附和降解,其方法可分为物理化学法和生物方法。物理化学方法包括水洗、高温加热处理、放射线辐射、物理吸附(常见的为蒙脱石,膨润土)、化学试剂的处理及臭氧氧化等[14]。物理化学方法对复杂的体系脱毒率不高,且处理后原料的营养价值可能发生改变,试剂的残留还可能造成二次污染,因此物理化学方法并不是脱除真菌毒素的有效手段,也不是脱毒的发展方向。生物防霉主要是通过防霉剂杀灭或抑制霉菌,主要应用于饲料脱毒。防霉剂对霉菌的杀灭作用,是通过其孢子的细胞膜进入细胞内,消灭孢子或阻止其发芽以达到防止霉菌生长的目的。但防霉剂的效果并非一成不变,受微生物、湿度、温度等因素影响,实际应用中难以控制。粮食中防霉剂的去除也难以实现。因此,利用微生物或酶制剂降解的生物脱毒方法成为控制真菌毒素污染的理想方法。
OTA的生物脱毒途径也是吸附和降解,前者主要是一些菌体的细胞壁如酵母细胞壁能吸附毒素,降低毒素在食品原料中的含量。降解是利用菌体产生的酶,将OTA水解成无毒的产物。OTA的生物降解与两条途径相关[15]:(1)断裂连接L-β-苯丙氨酸和OTɑ之间的酰胺键,生成无毒产物 L-β-苯丙氨酸和OTɑ(图2);(2)水解打开OTA的内酯环,生成最后的降解产物内酯环打开的OTA(OP-OTA)(图3)。
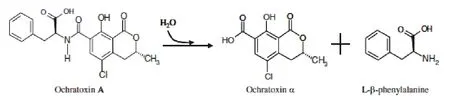
图2 OTA水解成OTα和L-苯丙氨酸
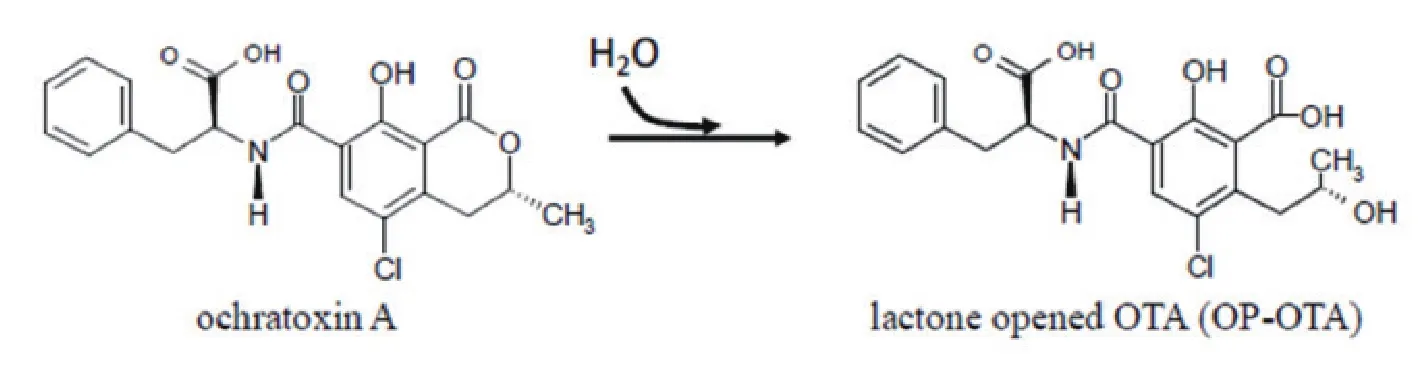
图3 OTA开环形成OP-OTA
2 羧肽酶A的简介
根据催化机制的不同,羧肽酶可分为3类:丝氨酸羧肽酶(EC 3.4.16)、金属羧肽酶(EC 3.4.17)、半胱氨酸羧肽酶(EC 3.4.18)[16]。前者在酸性条件下具有末端蛋白水解酶和酯酶、脱酰胺酶的活性,同时还可参与多肽和蛋白质的加工、修饰和降解[17]。金属羧肽酶存在于细胞外,主要帮助蛋白质的消化,在中性或弱碱性条件下具有很高的活性,根据整体结构域及氨基酸序列相似性的差异,金属羧肽酶可分为2个亚家族:CPA/B、CPN/E亚家族。CPA是一种锌依赖羧肽酶,在1973年被分离得到,该酶由307个氨基酸残基组成,存在于哺乳动物的胰脏中,常见的是牛胰脏和猪胰脏羧肽酶,其在体内首先以无活性的酶原表达,经胰蛋白酶消化后成为成熟的酶。CPA主要作用于C末端是芳香族和较大空间的脂肪类氨基酸残基,不能作用于末端是碱性氨基酸残基和脯氨酸残基的肽键,而羧肽酶B优先作用于C末端的碱性氨基酸残基,随后又能作用于非碱性氨基酸残基[18]。
2.1 羧肽酶A对OTA的降解能力
羧肽酶A的应用领域十分广泛,不仅能测定蛋白质的序列,还可作为发酵食品的发酵增强剂,促进酱油、奶酪等产业的发展[19],同时还可对受OTA污染的饲料、葡萄酒等进行脱毒。羧肽酶A对OTA的脱毒能力已经得到广泛的证实,在多篇研究OTA降解的文献中,被用作对照物[20]。Abrunhosa等[20]在筛选能降解OTA的黑曲霉的实验中,以CPA作为降解对照酶发现,羧肽酶能降解99.8%的OTA。其中来自牛胰脏的羧肽酶A是研究最早也是最透彻的蛋白酶,早在1969年Pitiou[21]就已经发现羧肽酶(CPA)能将OTA降解为OTα和L-苯丙氨酸。随后Deberghes等[22]在产赭曲霉毒素的液体培养基中加入不同酶活单位的牛胰脏羧肽酶A发现,一定时间内 5U的羧肽酶A就可以完全降解OTA。
2.2 羧肽酶A的活性结构
CPA是一类水解芳香族和脂肪族C端氨基酸残基的含锌金属蛋白酶,牛胰脏羧肽酶是目前研究较为彻底的蛋白酶。CPA含有307个氨基酸残基,Gly 207、Ile243和Ile255是底物结合位点,其中Ile255决定该酶的底物特异性。在酶的催化中心,Zn2+与His69、Glu72和His196紧密结合,其他氨基酸残基,如Arg127、Asn144、Arg145、Tyr248、Glu270等与催化功能有关[23],其中最重要的活性部位是Zn2+和Glu270的γ-羧基。Plummer等[24]报道牛胰脏羧肽酶的活性中心肽段,其核心区域由12个氨基酸构成,其一级结构的氨基酸顺序为:Thr-Ile-Tyr-Gln-Ala-Ser-Gly-Gly-Ser-Ile-Asp-Trp。
3 羧肽酶A脱毒发展前景
羧肽酶应用广泛,然而商业化的产品主要来源于牛、猪等胰腺组织,由于受提取率、数量、价格、稳定性等因素的限制,还不能实际应用于饲料、葡萄酒、咖啡等污染严重的产品上,因此如何在体外获得大量且催化效率高的羧肽酶已经成为当下急需解决的问题。目前主要有两种途径,一是利用基因重组技术体外表达羧肽酶;二是对酶进行修饰。
3.1 羧肽酶A的重组表达
应用生物技术手段将酶的基因转化到合适的载体上进行表达是生产酶制剂的主要方法,目前许多羧肽酶已经在体外被成功表达。师磊等[25]成功在毕赤酵母中表达了牛胰脏羧肽酶酶原A,蛋白含量为150 mg/L,当OTA质量浓度为4 μg/mL时,降解率可达72.3%,这是运用基因克隆技术首次获得具有降解活性的重组CPA;随后王晓云等[26]用响应面法对表达条件进行了优化,CPA蛋白平均表达量可达325 mg/L。李树刚等[27]利用大肠杆菌表达系统(E.coli BL21)实现了对羧肽酶G2的表达,通过纯化工艺后,蛋白纯度高于95%,其酶活力达400 U/mg。陈丹等[28]利用毕赤酵母表达系统对米曲霉羧肽酶O进行了表达,该酶以糖蛋白的形式存在,产量约为20.4 nKat/mL,且具有良好的热稳定性,能提高大豆分离蛋白和酪蛋白的水解度,明显降低其苦味。Yu等[29]通过毕赤酵母GS115表达羧肽酶Y,摇瓶培养168 h后,羧肽酶Y的产量为605 mg/L,重组酶经过纯化,在最适条件下(30℃,pH6.0)活性可达305 U/mg,这是第一次成功在体外表达获得具有高活性的羧肽酶Y。尽管,包括羧肽酶A在内的许多羧肽酶和其他霉菌毒素降解酶已经陆续在体外被成功表达,但产物表达量、稳定性、活性、纯度等并不理想,不能应用于大规模的发酵生产,后期需要进一步探索和优化酶的表达条件。
3.2 羧肽酶A的修饰
当CPA实际应用于粮食、饲料、葡萄酒等的脱毒时,会受到温度、pH、原料中各种成分等因素的影响,酶的结构、活性发生变化,使得OTA的降解效果并不理想,因此蛋白酶的修饰对稳定酶的结构、提高酶的活性有很重要的研究意义。酶的修饰主要包括分子化学修饰和基因工程修饰。
1981年,Mock等[30]将羧肽酶A中的Zn2+替换成Ca2+,改变了其底物特异性,提高了含硫环状多肽的水解能力。李康等[31]用琥珀酸酐、丙酸酐、乙酸酐对脂肪酶进行修饰,相对于原酶其活性分别提高24%、33.9%、31.4%,同时酸酐修饰后的脂肪酶热稳定性、pH稳定性和有机溶剂的耐受力均得到提高。化学修饰简单方便,但是既提高酶活又提高热稳定性比较困难,修饰剂的选择,修饰条件的优化是酶修饰的关键因素。
定点突变技术是氨基酸置换修饰和核苷酸置换修饰常用的方法。Chen等[32]利用错意多态性改变人羧肽酶E的基因,从而达到了改变酶活的目的;Rasekh等[33]对来自于芽孢杆菌属的漆酶进行定点突变,不仅热稳定性得到提高,而且将188位的谷氨酸突变成非极性氨基酸,如丙氨酸、异亮氨酸、亮氨酸、缬氨酸和带正电的氨基酸如赖氨酸、精氨酸时,漆酶在甲醇、乙醇等有机溶剂中的稳定性都会提高,且替代为非极性氨基酸时C50值(当酶活为原来的50%时,有机溶剂的浓度)显著性的提高、热灭活率也大大降低;王小燕[34]等设计突变位点,在毕赤酵母重组表达的β-葡萄糖苷酶(PGUS-P)中引入具有芳香增强序列(Enhanced aromatic sequence,EAS)序列特征的新N-糖基化位点,获得的突变酶PGUS-P-35和PGUS-P-259对底物甘草酸的催化效率提高了23.9%和12.65%,两者在65℃处理90 min后,剩余的酶活>90%。
牛胰脏CPA的结构、氨基酸序列都已经完全清楚,但对于该酶的修饰却并没有很多的研究,要得到适合工业应用的酶,选择合适的修饰方法很重要。利用基因突变技术获得理想新性状的突变酶,是最常见的方法,对于CPA来说,可以先从自然存在的等位基因变异入手,设计引物通过聚合酶链式反应(PCR)设计定点突变,有目的地改变CPA的某一氨基酸残基,得到具有新性状的酶,增强酶的底物亲和性、催化特性及热稳定性。很多蛋白酶的结构都存在loop区,研究证明删除loop区能提高酶的稳定性,Damnjanovic等[35]设计删除了来自链霉菌磷脂酶D的由10个氨基酸构成的loop区,得到两个突变酶△37-45DYR、△38-46DYR,两个突变体的耐热性均得到提高,但70℃分别处理10 min、40 min,△38-46DYR突变体剩余酶活是△37-45DYR的3.1和4.1倍,因此选择合适的loop删除位点很重要。CPA同样存在loop区,删除该区域也是一种提高酶活的有效方法。
4 展望
OTA主要污染粮谷类,涉及到小麦、玉米、大麦、燕麦、黑麦、水稻和黍类等。此外,豆类、咖啡、葡萄、葡萄干、水果、果汁、酒及调味品中也存在OTA污染,动物摄食被OTA污染的饲料后,会导致体内OTA蓄积,因此在动物性食品中,尤其是猪的肝脏、肾脏、肌肉、肉质品及奶和奶制品,也常常被OTA污染。OTA污染的农产品范围广,超过国家标准限量的产品只能弃用,由此造成的经济损失不可估量,但其中相当一部分可以通过生物化学等方法将OTA降解为无毒产物后再投入市场,其中酶降解就是最安全最有效的脱毒方法。尽管目前市场上脱除霉菌毒素主要应用吸附剂,但有些毒素并不能被其吸附,且吸附效果受温度、pH的影响会产生解吸的现象。随着全球环境的变化,霉菌毒素的污染日益严重,隐蔽毒素逐渐被关注,吸附剂很难满足未来的需求,因此酶解技术已经成为继吸附剂和微生物发酵法脱除霉菌毒素后新的研究热点和发展趋势。酶制剂特异性强,不影响产品的营养价值,不仅可以避免同吸附剂一样造成毒素的蓄积从而污染环境,也可避免微生物发酵产生二次代谢污染物。CPA作为唯一一种研究非常透彻并能降解OTA的酶,对于粮食谷类及葡萄酒等行业的发展有着十分重要的意义。实际生产中,可以制备食品原料或饲料的解毒添加剂;或者作为葡萄酒的生物沥滤材料,去除其中毒素。
被OTA污染的产品组分复杂,CPA在脱毒应用过程中存在酶活降低甚至完全丧失的可能,所以选择体外表达系统重组表达蛋白酶,再对重组酶进行修饰,是其商品化不可或缺的步骤。到目前为止我国只批准了一种解毒酶产品-黄曲霉毒素解毒酶,因此,降解酶制剂的生产是科研人员面临的巨大挑战。CPA工业化的应用将为食品原料和饲料中真菌毒素的生物脱毒的可持续发展提供一个新思路,以期最大限度地保证食品原料及饲料制品的安全。
[1]吴静, 闵柔, 邬敏辰, 等. 羧肽酶的研究进展[J]. 食品与生物技术学, 2012, 31(8):793-801.
[2]Boudra H, Le BP, LE BJ. Thermostability of Ochratoxin A in wheat under two moisture conditions[J]. Applied and Environmental Microbiology, l995, 61(3):1156-1158.
[3]United states department of health and human services, 11th report on carcinogens[EB/OL].
[4]Krogh P, Hald B, Pedersen EJ. Occurrence of ochratoxin A and citrinin in cereals associated with mycotoxic porcine nephropathy[J]. Acta Pathologica Microbiologica Scandinavica. Section B:Microbiology and Immunology, 1973, 81(6):689-695.
[5]孙蕙兰, 牛钟相. 荧光抗体技术对鸡组织器官中赭曲霉毒素残留检测的研究[J]. 山东农业大学学报, 1991, 22:347-350.
[6]Kuiper-goodman T, Scott PM. Risk assessment of the mycotoxin ochratoxin A[J]. Biomedical and Environmental Sciences, 1989, 2(3):179-248.
[7]Obrecht-pfumio S, Chassat T, Dirheimerg G, et al. Genotoxicity of Ochratoxin A by salmonella mutagenicity test after bioactivation by mouse kidney microsomes[J]. Mutation Resear, 1999, 446(1):95-102.
[8]Boorman GA, Mcdonald MR, Imoto S, et al. Renal lesions induced by Ochratoxin A exposure in the F344 Rat[J]. Toxicologic Pathology, 1992, 20(2):236-245.
[9]Harvey RB, Elissalde MH, Kubena LF, et al. Immunotoxicity of ochratoxin A to growing gilts[J]. American Journal of Veterinary Research, 1992, 53(10):1966-1970.
[10]Maaroufi K, Achour A, Hammami M, et al. Ochratoxin A in human blood in relation to nephropathy in Tunisia[J]. Human and Experimental Toxicology, 1995, 14(7):609-615.
[11]Devegowda G, Raju MVLN, Afzali N, Swami HVLN. Mycotoxin picture worldwide:novel solutions for their counteraction[M]// Lyons TP, Jacques KA. Biotechnology in the Feed Industry, Proceedings of the 14th Annual Symposium. Nottingham UniversityPress, 1998:241-255.
[12] 杨家玲. 我国主要食品中赭曲霉毒素A调查与风险评估[D].杨凌:西北农林科技大学, 2008.
[13]杜洁茹. 未来赭曲霉毒素将取代黄曲霉毒素成为饲料真菌毒素中“后起之秀”[J]. 北方牧业, 2012(17):14.
[14]曹慧英, 伍松陵, 沈晗, 等. 粮食中真菌毒素的控制策略[J].粮油食品科技, 2012, 20(6):45-48.
[15]Karlovskyp. Biological detoxification of fungal toxins and its use in plant breeding, feed and food production[J]. Natural Toxins, 1999, 7(1):1-23.
[16]吴静, 闵柔, 邬敏辰, 等. 羧肽酶的研究进展[J]. 食品与生物技术学报, 2012, 31(8):793-801.
[17]冯英, 刘庆坡, 贾佳等. 拟南芥丝氨酸羧肽酶类蛋白家族的基因组分析[J]. 遗传学报, 2005, 32(8):864-873.
[18]Segundo BS, Martínez MC, Vilanova M, et al. The severed activation segment of porcine pancreatic procarboxypeptidase A is a powerful inhibitor of the active enzyme[J]. Biochimica et Biophysica Acta, 1982, 707(1):74-80.
[19] 罗灿. 激肽释放酶、胰蛋白酶和糜蛋白酶联产工艺的研究[D].成都:四川大学, 2007.
[20] Abrunhosa L, Venâncio A. Isolation and purification of an enzyme hydrolyzing ochratoxin A from Aspergillus niger[J]. Biotechnology Letters, 2007, 29(12):1909-1914.
[21] Pitout MJ. The hydrolysis of ochratoxin A by some proteolytic enzymes[J]. Biochemical Harmacology, 1969, 18(2):485-489.
[22] Deberghes P, Betbeder AM, Boisard F, et al. Detoxification of ochratoxin A, a food contaminant:prevention of growth of Aspergillus ochraceus and its production of ochratoxin A[J]. Mycotoxin Research, 1995, 11(1):37-47.
[23] Aviles FX, Vendrell J, Guasch A, et al. Advances in metalloprocarboxypeptidases:emerging details on the inhibition mechanism and on the activation process[J]. European Journal of Biochemistry, 1993, 211(3):381-389.
[24] Plumer TH. Isolation and sequence of peptides at the active center of bovine carboxypeptidase B[J]. The Journal of Biological Chemistry, 1969, 244(19):5246-5253.
[25]师磊, 许文涛, 田晶晶, 等. 一种降解赭曲霉毒素A 的羧肽酶酶原在毕赤酵母中的表达[J]. 中国食品学报, 2015, 15(6):39-44.
[26]王晓云, 徐诗涵, 梁志宏, 等. 毕赤酵母表达重组牛胰脏羧肽酶A的响应面法优化[J]. 生物技术通报, 2016, 32(3):190-197.
[27]李树刚, 王勇, 张伟, 等. 重组羧肽酶G2的原核表达、纯化及活性分析[J]. 生物技术通报, 2016, 32(3):184-189.
[28]陈丹, 游子娟, 黄伟谦. 重组米曲霉丝氨酸羧肽酶O的性质鉴定及脱苦应用研究[J]. 广东农业科学, 2015, 42(5):103-198.
[29] Yu XH, Zhai C, Zhang X. High-level expression and characterization of carboxypeptidase Y from Saccharomyces cerevisiae in Pichia pastoris GS115[J]. Biotechnology Letters, 2015, 37(1):161-167.
[30]Mock WL, CHen JT, Tsang JW. Hydrolysis of a thiopeptide by cadmium carboxypeptidase A[J]. Biochemical and Biophysical Research Communications, 1981, 102(1):389-396.
[31] 李康, 尹春华, 乔世伟, 等. 酸酐修饰脂肪酶的研究[J]. 安徽农业科学, 2011, 39(31):19043-19045.
[32]Chen H, Jawahar S, Qian Y, et al. Missense polymorphism in the human carboxypeptidase e gene alters enzymatic activity[J]. Human Mutation, 2001, 18:120-131.
[33]Rasekh B, Khajeh K, Ranjbarr B, et al. Protein engineering of laccase to enhance its activity and stability in the presence of organic solvents[J]. Engineering in Life Sciences, 2014, 14(4):442-448.
[34]王小艳, 樊艳爽, 韩蓓佳. 糖基化改造β基葡萄糖醛酸苷酶的热稳定性[J]. 化工学报, 2015, 66(9):3669-3677.
[35]Damnjanovic J, Nakano H, Iwasaky Y. Deletion of a dynamic surface loop improves stability and changes kinetic behavior of phosphatidylinositol-synthesizing streptomyces phospholipase D[J]. Biotechnology and Bioengineering, 2014, 111(4):674-682.
(责任编辑 李楠)
Functions of Detoxification and Application Prospect of Carboxypeptidase A
XIONG Lu1WANG Xiao-yun1LIANG Zhi-hong1,2
(1. College of Food Science &Nutritional Engineering,China Agricultural University,Beijing 100083;2. Key Laboratory of Safety Assessment of Genetically Modified Organisms(Food Safety),Ministry of Agriculture,Beijing 100083)
Ochratoxin A(OTA)is one of mycotoxins produced by Aspergillus and Penicillium,by which many products,such as cereals,beans,wines and coffees,are contaminated,and these contaminated foods possesses serious threats to food safety. In recent years,with the change of global climate,the food contaminated by OTA has become increasingly serious. In order to guarantee safety of humans and animals,many researchers are committing to detoxifying and degrading OTA in food and food raw materials. Currently,it is reported that OTA can be degraded by many fungi and bacteria,but few enzymes produced by them are characterized and purified,and degraded substances of OTA are unknown,thus they can’t be used in industry. Carboxypeptidase A(CPA)is an ideal product to degrade OTA because the detoxification ability of CPA to OTA is widely proved,its feature,structure and mechanism are very clear,and degraded product has no toxicity to human body;therefore,it is a novel approach to degrade OTA through genetic engineering and protein engineering to obtain a lot of stably and efficiently expressed CPA. This paper summarizes the contamination status of OTA in food,and mechanisms of bio-detoxification,the detoxification ability of CPA,and the application prospect of CPA as detoxifying agent,aiming at providing theoretical base for the development and application of mycotoxin agents degrading enzymes.
ochratoxin A;bio-detoxification;carboxypeptidase A
10.13560/j.cnki.biotech.bull.1985.2017-0163
2017-03-05
国家自然科学基金项目(31671947)
熊露,女,硕士研究生,研究方向:食品微生物与安全;E-mail:1183812933@qq.com
梁志宏,女,博士,副教授,研究方向:微生物与食品安全;E-mail:lzh105@cau.edu.cn

