一种利用CRISPR/Cas9 对细胞添加生物条形码的新方法
魏喻周昌阳李艳利
(1. 上海大学生命科学学院,上海 200444;2. 神经学科学研究所,上海 200031)
一种利用CRISPR/Cas9 对细胞添加生物条形码的新方法
魏喻1周昌阳2李艳利1
(1. 上海大学生命科学学院,上海 200444;2. 神经学科学研究所,上海 200031)
旨在利用CRISPR/Cas9对细胞添加不同的生物条形码(Barcode),实现对细胞进行不同的标记。将生物条形码序列、条件诱导性Cas9序列及相应的sgRNA序列通过PB酶整合到细胞中,诱导Cas9表达之后对生物条形码序列测序分析细胞的标记情况。所设计的生物条形码含有6个相互重叠的sgRNA 识别位点,这种设计可以使条形码序列只会被Cas9切割一次。结果显示,所设计的生物条形码序列在N2a细胞中经Dox诱导之后能够高效地被Cas9切割,所挑的9个克隆中,生物条形码序列有9种不同的基因型。含有受loxp-stop-loxp 调控表达Cas9的序列及生物条形码序列的E14胚胎干细胞经Cre诱导之后,挑单克隆测序分析显示,21株细胞中仅2株单克隆细胞生物条形码保持原来的基因型,另外19株有18种不同的基因型。成功建立了可进行时空调控地在细胞内高效添加特异且相对稳定的生物条形码标记的方法。
生物条形码;CRISPR/Cas9;细胞标记
细胞标记在应用于细胞谱系追踪,癌细胞产生过程之中各细胞的异质性追踪等有重要意义。目前细胞标记的方法有多种,如用染料对细胞进行染色标记[1],不同基因背景胚胎的杂交嵌合标记[2],外源性DNA如病毒等插入细胞基因组进行标记[3,4],基因重组进行特异性标记[5,6],多种荧光对细胞进行标记[7],以及自然发生的体细胞突变标记等[8-10]。尽管这些方法已经被应用于各种细胞的标记,然而其存在的一些问题限制了其应用,如标记的种类少,标记效率低下,标记逐渐被稀释,不相关的细胞被标记或者检测太困难等等。
CRISPR/Cas9 在基因编辑领域得到了广泛的应用,Cas9 能够在sgRNA的指导下对基因组进行特异性切割,产生双链断裂,之后通过非同源性末端接合(Non-homologous end joining,NHEJ)或者同源指导修复(Homology directed repair,HDR)对断裂的DNA双链进行随机修复,以此产生多种不同的基因型[11-13]。最近,人们在用于谱系追踪的合成靶标阵列基因组编辑技术(Genome editing of synthetic target arrays for lineage tracing,GESTALT)中利用CRISPR/ Cas9能够对大量的细胞添加不同的生物条形码,实现对不同的细胞进行不同的标记,并且这种标记能够遗传给后代子细胞,同时,对这些不同标记的检测也相对比较简单[14]。GESTALT用于细胞标记时在细胞基因组内插入10个 sgRNA识别位点序列,每个识别位点由3 bp 碱基分开,通过Cas9对这10个相对独立位点不同的切割方式,实现对细胞不同的标记[14]。GESTALT 能对大量细胞添加上千种不同的相对容易检测的标记的特点,使其在应用于对大量细胞的谱系追踪时有着重要的意义。其在研究生长发育过程中各个器官来源及不同发育阶段不同细胞的来源有着很好的应用前景;另外对于研究癌症中不同癌细胞来源、癌细胞迁徙等,GESTALT提供了一个很好的工具。
然而,GESTALT技术的生物条形码有多个连续的Cas9 切割位点,每个切割位点相对独立,Cas9会对细胞中的生物条形码进行多次切割,故而将会导致标记的丢失或者紊乱。我们设计了一种新的含有6 个相互重叠 sgRNA 识别位点的生物条形码序列对细胞进行标记,我们称该方法为 Barcode 技术。通过 Barcode 技术,期望能够高效且稳定地对大量的细胞进行标记,以解决 GESTALT 技术中生物条形码序列被多次切割导致标记紊乱的问题。
1 材料与方法
1.1 材料
DNA胶回收试剂盒、质粒小提试剂盒、质粒中提试剂盒购自天根生物科技有限公司;Taq酶、DNA marker DL2000、DL15000购自南京诺唯赞生物科技公司;T4 ligase、限制性酶切酶购自Thermo Fisher Scientific有限公司;NEBuilder Master Mix重组试剂盒购自NEB生物科技公司;Gibson Assembly® Master Mix重组试剂盒购自NEB;Lipofectamine 3000 Reagent 购自Invitrogen;ClonExpress Entry One Step Cloning Kit购自南京诺为赞生物科技有限公司;PBCMV-mcherry 质粒、PB转座酶质粒、PB-CAG-LSLCas9-T2A-GFP 质粒及Cre表达质粒来自神经神学研究所杨辉组;大肠杆菌感受态DH5α购自2ndLab。
小鼠神经母细胞瘤细胞株N2a、小鼠胚胎干细胞E14购自中国科学院细胞库;E14细胞培养基 中FBS 及Pen/Strep购 自Gibco;DMEM、Non-Essential Amino Acid、Nucleosides、L-glutamine及 2-mercaptoethanol购 自 Millipore;PD0325901、CHIR99021购自 Sellck;N2a细胞培养基为DMEM、FBS加上pen/strep,来源与上述相同。细胞流式分选于神经科学研究所流式细胞分选平台操作。
1.2 方法
1.2.1 引物设计 采用Snapgene软件设计引物,质粒测序由苏州金唯智生物科技有限公司完成,PCR扩增引物由上海华津生物科技有限公司合成。
1.2.2 Barcode V1质粒的构建 Barcode序列被设计成6个重叠的CRISPR/Cas9靶序列,包含23 bp的protospacer序列和PAM序列,其序列为5′-taac agtagccagacctaccaaaggactggcatggatgatccg-3′,设计引物Barcode target-F:5′-ggctctatggcggcgcgcctaacagtagccag acctaccaaaggactggc-3′和 Barcode target-R:5′-caaaac ttttaggcgcgtcggatcatccatgccagtcctttggtagg-3′,通过两条引物进行退火,用重组酶(ClonExpress Entry One Step Cloning Kit)将其插入AscI线性化的PB转座子CMV-mcherry过表达质粒内;分别构建出6个靶向Barcode序列的sgRNA质粒(表1),利用Gibson Assembly® Master Mix重组试剂盒将6个U6-sgRNA序列串联到一起。构建出Barcode V1质粒,元件依次 为PB 5′ arm-6*U6-sgRNA-pCMV-mCherry-WPREPolyA-Barcode-PB 3′ arm。
1.2.3 Barcode V2质粒的构建 将含有6个U6-sgRNA片段和Barcode靶位点序列插入到PB-CAG-LSL-Cas9-T2A-GFP的Cre依赖表达的Cas9过表达载体中,其中LSL为loxp-stop-loxp,这种设计使Cas9的表达受Cre的调控,GFP的强度反映Cas9的表达情况。通过Gibson Assembly® Master Mix重组试剂盒构建Barcode V2质粒,其元件依次为:PB 5′armpCAG-LSL-Cas9-T2A-GFP-WPRE-PolyA-6*U6-sgRNA-pCMV-mCherry-WPRE-PolyA-Barcode-PB 3′arm。

表1 靶向Barcode序列的sgRNA
1.2.4 Barcode 稳转细胞株的建立 利用Lipofectamine 3000 Reagent 试剂盒将Barcode质粒及PB转座酶表达质粒等质粒共转N2a细胞或者E14细胞系。细胞传代至六孔板2 d 生长至较密集状态后,取Opti-MEM 100 μL 与5 μL P3000、3.5 μg Barcode 质粒及1.5 μg PB转座酶质粒混合;取另一EP管加入100 μL Opti-MEM 和5 μL Lipo 3000。进一步将两者混合,孵化5 min。将混合液加入N2a 细胞或者E14细胞中增养12 h 后换液培养。转染72 h 后通过流式分选出m-Cherry阳性细胞,培养5 d 后挑取单细胞克隆测序。
1.2.5 验证Cas9 对Barcode序列的切割 通过Suveryor assay 检测Cas9 序列对Barcode序列的切割[11]。提取E14单克隆细胞的基因组,用Sequencing PCR primer-F:5′-cggacatttaggtgacactataggca-3′及 Sequencing PCR primer-R:5′-acgtaatacgactcactatagggcgg -3′将Barcode序列通过PCR从细胞基因组中扩增出来。进一步用Suveryor nuclease 切割PCR产物,将酶切产物进行琼脂糖凝胶电泳;另取部分PCR产物进行测序分析。
2 结果
2.1 Barcode序列的设计
Barcode序列如图1所示,包含有6 个相互重叠的sgRNAs 靶向位点,当其中一个sgRNA位点被Cas9 切割之后将破坏所有的sgRNA 识别位点,使Barcode序列只能被Cas9 切割一次。6个sgRNA的靶向序列在NCBI中通过Blast比对,确定在小鼠基因组中没有完全匹配的序列,避免了sgRNA切割小鼠内源基因组DNA的可能。
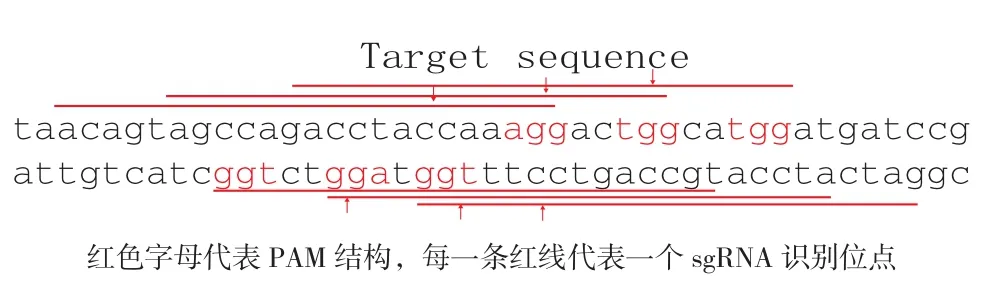
图1 Barcode序列
2.2 Cas9在N2a细胞中能对Barcode序列进行切割
将构建的Barcode V1质粒(图2-A)通过PB转座酶转入到含有Doxycycline 诱导表达Cas9 的N2a细胞中,加入Doxycycline诱导之后,Suveryor assay结果(图2-B)显示Cas9 能够对Barcode序列切割。PCR产物连接T载体,挑取9个单克隆进行测序。测序结果(图2-C)显示6个单克隆产生不同的碱基缺失,3个克隆产生不同的碱基插入。说明Cas9对Barcode序列能够切割并能产生多种基因型。
2.3 Barcode V2稳转胚胎干细胞系的建立
将Barcode V2(图3-A)质粒用PB转座酶转入E14小鼠胚胎干细胞系中,培养72 h 后流式分选。通过荧光显微镜可观察到生长出的单克隆中均有mCherry的表达(图3-B),说明目标序列成功转入细胞之中。通过对挑取的Barcode V2 E14单克隆细胞进行测序(图3-C,成功获得带有Barcode序列的稳转株,称其为Barcode V2 E14稳转株)。
2.4 Cre调控下的对细胞的特异性的标记
将Cre质粒用PB转座酶转入Barcode V2 E14稳转株内,分选出GFP阳性细胞,即Cas9表达的细胞。挑单克隆细胞对Barcode序列进行测序分析显示,所挑的21株单克隆细胞中,2株单克隆细胞的Barcode序列为WT基因型,另外19株有18种不同的基因型(图4)。证明该系统能够高效地在Barcode区域产生不同的基因型,即对细胞产生不同的标记。
3 讨论
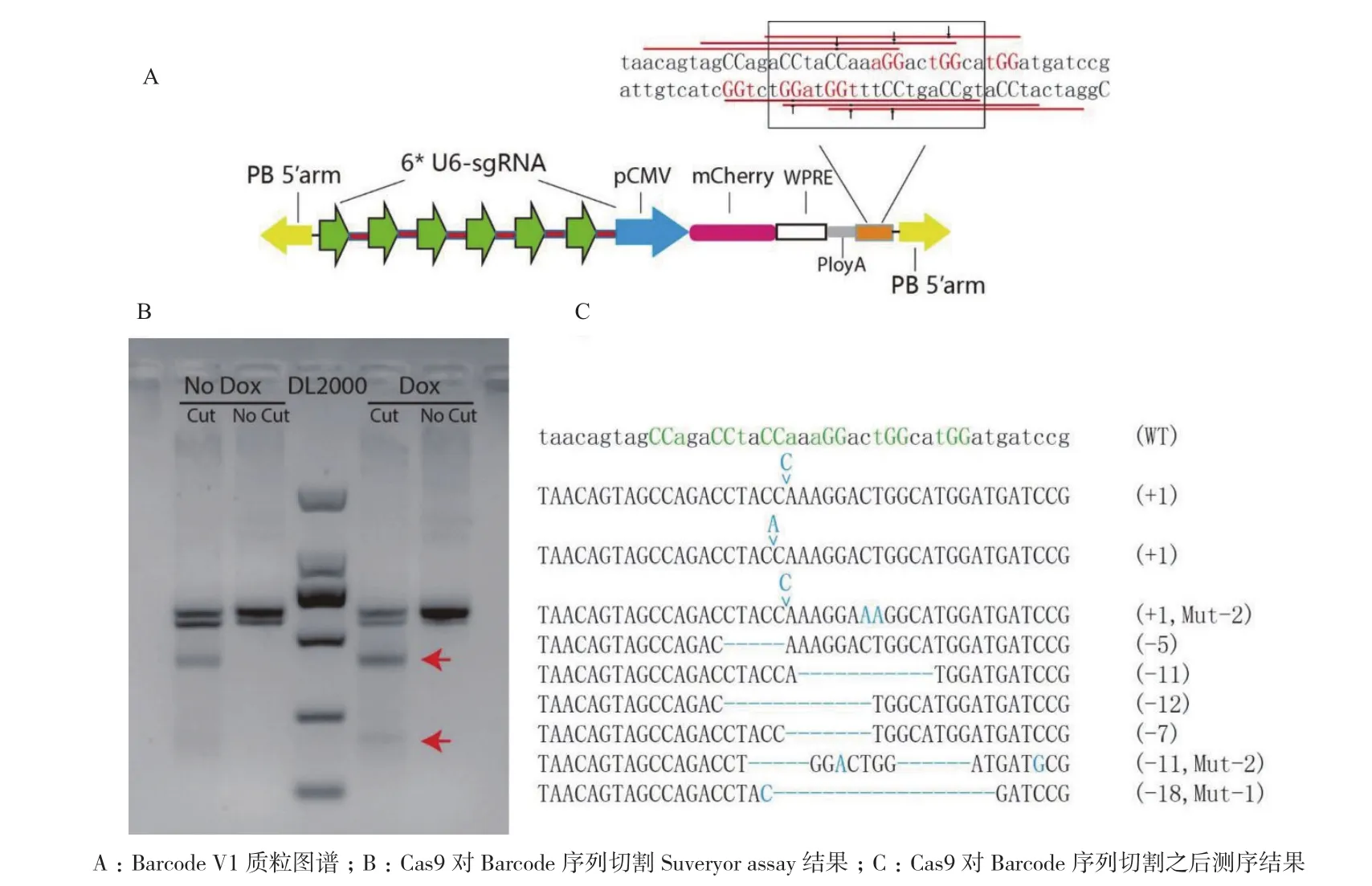
图2 Cas9在N2a细胞中对Barcode序列的切割
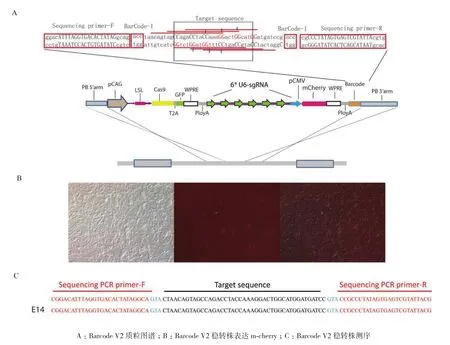
图3 带有Cre 调控的Cas9和Barcode序列的稳转E14细胞株的建立
Barcode技术在细胞内插入一段含有6个相互重叠的sgRNA识别位点的DNA序列,利用Cas9对这段序列不同的切割方式及不同的修复方式,给不同的细胞随机加上不同的标记。通过对这一小段序列的测序即可对细胞的不同来源进行标记。相对于以往的细胞标记方式,Barcode技术有很多种优势:(1)标记效率很高,细胞被特异性标记的概率高达90.5%;(2)标记方式种类多,6种不同的切割方式及多种不同的修复方式可以对大量的细胞进行不同的标记;(3)分析相对很简单,只需对一小段序列进行测序即可识别不同的标记;(4)可以实现对标记的时空调控,如利用Tet-on 或者Cre-loxP 系统条件性控制对细胞的标记。特别是其应用于谱系追踪或发育谱研究时,新设计的Barcode 序列可以给细胞系添加多种稳定的标记,对于长时程及复杂的追踪有重要意义。

图4 Barcode 序列经Cas9切割后的测序结果
Barcode技术与GESTALT相比,都是利用CRISPR/Cas9 对一含有多个sgRNA识别位点的DNA序列——合成靶标阵列进行切割,通过不同的修复方式,从而产生多种不同的细胞标记。其共同的优点有:(1)可以同时对大量的细胞进行标记;(2)这种组合型多样性突变能够在一段密集的CRISPR/ Cas9 识别位点中产生;(3)通过对单个细胞中一小段序列的测序,即可得到大量细胞的标记信息;(4)能够应用于包括细菌、植物及动物等多种生物的细胞中[14]。不同之处在于,GESTALT的合成靶标阵列由10个被3 bp 碱基隔开的sgRNA识别位点构成,而Barcode 技术的合成靶标阵列由6个相互重叠的sgRNA识别位点构成。Barcode技术的这种设计使得合成的靶标阵列被Cas9切割之后产生的标记在细胞后续的生长发育过程之中不会发生变化,即对于每个细胞中的合成靶标阵列,Cas9只会切割一次,不会因为Cas9的多次切割导致标记的丢失或者紊乱,分析相对更加简单。而GESTALT中的合成靶标阵列由于每个sgRNA识别位点相对独立,致使其会被Cas9多次切割,导致标记的紊乱,后续的分析过程将会很复杂。Barcode 技术与GESTALT相比缺点是产生的标记种类相对较少。一个可能的解决方法是在Barcode序列中加入更多的sgRNA 识别位点,或者设计多个不同的Barcode位点进行标记,以此来增加标记种类的多样性,劣势是增加了Cas9多次切割的概率,导致标记的丢失或者紊乱。但是与GESTALT相比,标记的稳定性相对要高很多。可以根据研究目的在标记数量和标记稳定性方面寻求一个平衡,并在标记的时间点及位置上进行控制,以达到精确标记细胞的目的。另外一种解决方法是将两个或者两个以上的Barcode序列插入细胞基因组中不同的位置,这种设计避免了Cas9对同一位点多次切割导致的标记紊乱,同时增加了标记的多样性。
4 结论
利用Barcode技术,可以对大量的细胞进行高效的、多样的、相对稳定的标记,通过对一小段序列的测序可以读出这些不同的标记。利用重组酶Cre来调节Cas9的表达,能够实现对细胞标记的时空调控和小鼠体内的组织特异性调控。
[1]Keller RE. Vital dye mapping of the gastrula and neurula of Xenopus laevis[J]. Dev Biol, 1975, 42(2):222-241.
[2]Le Douarin NM, Teillet M-AM. Experimental analysis of the migration and differentiation of neuroblasts of the autonomic nervous system and of neurectodermal mesenchymal derivatives, using a biological cell marking technique[J]. Dev Biol, 1974, 41(1):162-184.
[3]Porter SN, Baker LC, Mittelman D, et al. Lentiviral and targeted cellular barcoding reveals ongoing clonal dynamics of cell lines in vitro and in vivo[J]. Genome Biol, 2014, 15(5):R75.
[4]Lu R, Neff NF, Quake SR, et al. Tracking single hematopoietic stem cells in vivo using high-throughput sequencing in conjunction with viral genetic barcoding[J]. Nat Biotech, 2011, 29(10):928-933.
[5]Harrison DA, Perrimon N. Simple and efficient generation of marked clones in Drosophila[J]. Curr Biol, 1993, 3(7):424-433.
[6] Ohlstein B, Spradling A. The adult Drosophila posterior midgut is maintained by pluripotent stem cells[J]. Nature, 2006, 439(7075):470-474.
[7] Livet J, Weissman TA, Kang H, et al. Transgenic strategies for combinatorial expression of fluorescent proteins in the nervous system[J]. Nature, 2007, 450(7166):56-62.
[8]Salipante SJ, Horwitz MS. Phylogenetic fate mapping[J]. Proc Natl Acad Sci USA, 2006, 103(14):5448-5453.
[9] Behjati S, Huch M, van Boxtel R, et al. Genome sequencing of normal cells reveals developmental lineages and mutational processes[J]. Nature, 2014, 513(7518):422-425.
[10] Lodato MA, Woodworth MB, Lee S, et al. Somatic mutation in single human neurons tracks developmental and transcriptional history[J]. Science, 2015, 350(6256):94-98.
[11] Cong L, Ran FA, Cox D, et al. Multiplex genome engineering using CRISPR/Cas systems[J]. Science, 2013, 339(6121):819-823.
[12] Wang H, Yang H, Shivalila CS, et al. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering[J]. Cell, 2013, 153(4):910-918.
[13] Hsu PD, Lander ES, Zhang F. Development and applications of CRISPR-Cas9 for genome engineering[J]. Cell, 2014, 157(6):1262-1278.
[14] McKenna A, Findlay GM, Gagnon JA, et al. Whole-organism lineage tracing by combinatorial and cumulative genome editing[J]. Science, 2016, 353(6298):aaf7907.
(责任编辑 李楠)
A Novel Approach to Establish Bio-barcode in Cells by CRISPR/Cas9
WEI Yu1ZHOU Chang-yang2LI Yan-li1
(1. College of Life Sciences,Shanghai University,Shanghai 200444;2. Institute of Neuroscience,Shanghai 200031)
The aim of this study is to add bio-barcode in cells by CRISPR/Cas9 for differentially marking the cells. The bio-barcode sequence,conditional induced Cas9 sequence and the corresponding sgRNA sequence were integrated into the cell through the PB enzyme,and then the cell markers were analyzed by sequencing the bio-barcode after inducing the expression of Cas9. The designed bio-barcode sequence contained 6 sgRNA target sites overlapping each other,which allowed the bio-barcode sequence to be spliced only once by Cas9. As results,the designed bio-barcode sequence in N2a cells after Dox induction was efficiently spliced by Cas9,and there were 9 different genotypes among 9 clones. After Cre inducing the E14 embryonic stem cells containing Cas9 sequence regulated by loxp-stop-loxp and biobarcode sequence,monoclonal sequencing showed that only 2 monoclonal cells of 21 cell lines remained the original genotype,and the rest 19 strains presented 18 different genotypes respectively. In summary,this study established a novel approach to spatio-temporally add bio-barcode markers with high specificity and relative stability into cells.
bio-barcode;CRISPR/Cas9;cell marking
10.13560/j.cnki.biotech.bull.1985.2017-0087
2017-02-10
新药研究国家重点实验室开放基金(SIMM1601KF12)
魏喻,男,硕士,研究方向:细胞重编程与胚胎发育;E-mail:hustweiyu@163.com
李艳利,女,博士,研究方向:肿瘤的分子治疗;E-mail:liyanli@shu.edu.cn

