极端嗜热α-淀粉酶ApkA的高温活性和热稳定性的优化研究
曾静 郭建军 袁林 杨罡 陈俊
(江西省科学院微生物研究所,南昌 330096)
极端嗜热α-淀粉酶ApkA的高温活性和热稳定性的优化研究
曾静 郭建军 袁林 杨罡 陈俊
(江西省科学院微生物研究所,南昌 330096)
旨在获得高温活性和热稳定性提高的α-淀粉酶。通过向α-淀粉酶ApkA中引入目前已知的最稳定的α-淀粉酶PFA的Zn2+结合位点,获得Zn2+结合位点突变体ApkAdsK152H/A166C。酶学性质分析表明,ApkAdsK152H/A166C的高温活性和热稳定性明显提高,最适反应温度由90℃提高至100℃,对应的酶比活力为5 201.08 U/mg。ApkAdsK152H/A166C于90℃的半衰期由5 h延长至10 h,于100℃的半衰期由7.5 min延长至80 min。重组α-淀粉酶中Zn2+含量测定结果显示ApkAdsK152H/A166C结合了一个Zn2+。结果表明,向ApkA中引入Zn2+结合位点有利于提高其高温活性和热稳定性。
极端嗜热α-淀粉酶;Zn2+-结合位点;定点突变;高温活性;热稳定性
α-淀粉酶能切断淀粉的1,4-α-D-葡萄糖苷键,生成短链糊精和少量低分子量糖类,从而降低淀粉糊的粘度,液化淀粉,因此α-淀粉酶又称液化酶[1-4]。α-淀粉酶广泛应用于燃料酒精、淀粉糖浆、传统酿造、食品加工、纺织退浆、饲料等行业,是迄今最早的工业应用酶之一[5-7],占据全球酶制剂生产量约30%的份额[8]。
目前淀粉加工工业常用的α-淀粉酶主要是来自地衣芽孢杆菌(Bacillus licheniformis)的BLA,其最适作用条件为90℃和pH6.0[5],在高于100℃和pH低于6.0的条件下易失活,热稳定性依赖于Ca2+,液化过程中需要加入Ca2+作为保护剂,在液化和糖化过程中需要反复调节pH[9]。从而导致淀粉液化不彻底,生产成本高,工序复杂,造成资源浪费和环境污染。针对目前常用α-淀粉酶所存在的问题,国内外对α-淀粉酶的研究和开发的主要目标是获得最适反应温度在100℃或以上,最适pH在4.0-5.0,不需要添加Ca2+来维持其高温活性和热稳定性的高温酸性α-淀粉酶[10]。
源于极端嗜热微生物的极端嗜热酸性α-淀粉酶具有反应温度高、液化速度快、对Ca2+依赖性小、酶的热稳定性高等特点,在耐热性、最适pH和Ca2+依赖性3个方面的性能均优于BLA,具有较大的应用潜力和开发前景[11,12]。源于极端嗜热古生菌(Thermococcus kodakarensis)KOD1的胞外α-淀粉酶ApkA属于极端嗜热酸性α-淀粉酶,其最适反应温度为90℃,反应pH为5-6.5,在未补加Ca2+的条件下于90℃保温1 h 后保持90%的剩余活性[13]。ApkA具有优良的高温活性和热稳定性,并且耐酸性强,综合性质优于其他α-淀粉酶,在淀粉液化工艺中具有较大的应用潜力。为了满足淀粉液化工艺的要求,需要进一步提高ApkA的高温活性和热稳定性。本研究拟向ApkA中引入目前已知的最稳定的极端嗜热酸性α-淀粉酶PFA的Zn2+结合位点,对ApkA进行改造和优化,为ApkA的开发与应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒 大肠杆菌DH5α、大肠杆菌BL21-CodonPlus(DE3)-RIL、大肠杆菌表达载体pET28a、重组质粒pET28a-ApkAds均由本实验室保存。
1.1.2 培养基 大肠杆菌的培养采用LB培养基,筛选培养基采用含50 μg/mL卡那霉素的LB培养基。
1.1.3 试剂 KOD-Plus-neo DNA聚合酶购自日本Toyobo公司;DNA限制性内切酶、T4 DNA连接酶、DNA Marker、低分子质量蛋白质Marker购自美国Fermentase公司;DNA胶回收试剂盒、质粒抽提试剂盒E.Z.N.A. 购自美国Omega Bio-tek公司;Chelating SepharoseTMFast Flow购 自 美 国 GE Healthcare公司;Bradford法蛋白浓度测定试剂盒购自上海生工生物工程股份有限公司;其他化学试剂均为国产或进口分析纯;基因合成由上海博益生物科技有限公司完成,聚合酶链式反应(Polymerase chain reaction,PCR)引物合成和测序由上海生工生物工程股份有限公司完成。
1.2 方法
1.2.1 分子克隆技术和表达产物的SDS-PAGE分析分子克隆技术和表达产物的SDS-PAGE分析参照文献[14-15]进行。
1.2.2 重组质粒pET28a-ApkAdsK152H/A166C的构建及鉴定 根据QuikChange®点突变试剂盒的原理,结合α-淀粉酶ApkA基因ApkA和拟突变的氨基酸位点设计引物K152H-F、K152H-R。以pET28a-ApkAds为模板,采用引物K152H-F和K152H-R,进行PCR扩增得到包含载体序列和基因序列的线性片段。PCR扩增条件为:94℃ 5 min;94℃ 30 s,55℃ 20 s,68℃ 4 min,35个 循 环;68℃,10 min。扩增产物经DpnⅠ酶处理后,转化大肠杆菌DH5α,卡那霉素抗性平板筛选转化子,经测序鉴定是否为突变基因ApkAdsK152H。在此基础上,以pET28a-ApkAdsK152H为模板,采用引物A166C-F和A166C-R,进行PCR扩增,重复以上实验步骤,获得重组质粒pET28a-ApkAdsK152H/A166C。
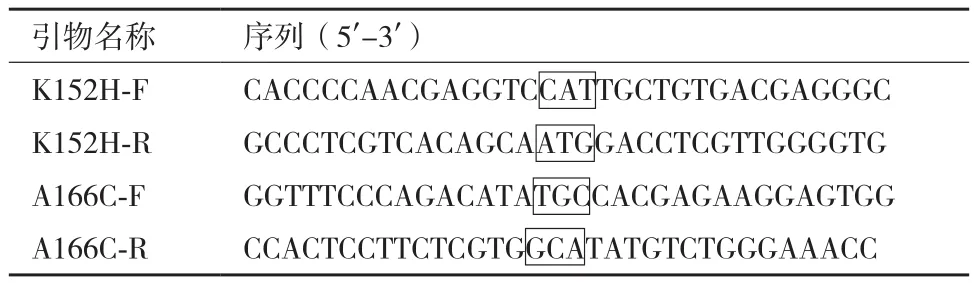
表1 构建重组质粒所用引物
1.2.3 重组α-淀粉酶的诱导表达和纯化 将重组质粒转化大肠杆菌BL21-CodonPlus(DE3)-RIL。从新鲜的转化平板上挑取重组大肠杆菌单菌落,接种于含有卡那霉素的5 mL LB液体培养基中,37℃培养过夜。将过夜培养物以1%接种量转接至含有卡那霉素的50 mL LB液体培养基中,37℃培养至菌液A600nm达到0.5左右。加入IPTG至其终浓度为0.25 mmol/L,继续于16℃培养20 h,12 000 r/min离心5min收集菌体沉淀。
采 用50 mmol/L 2-(N-吗 啡 啉 ) 乙 磺 酸(2-Morpholinoethanesulfonic acid,MES),pH6.5缓冲液重悬并洗涤菌体沉淀,再加入适量50 mmol/L MES,pH6.5缓冲液重悬菌体沉淀,置于冰上用超声波破碎细胞。超声波处理菌体细胞至菌体悬液变为均一的溶液,采用SDS-PAGE检测重组α-淀粉酶的表达情况。
采用Ni2+亲和层析柱对细胞可溶成分中目的蛋白质进行纯化,利用SDS-PAGE检测重组α-淀粉酶的纯度,并采用Bradford法测定重组α-淀粉酶的浓度。
1.2.4 α-淀粉酶的酶活力测定 将10 μL酶液与490 μL 含1%(m/V)可溶性淀粉的50 mmol/L MES,pH 6.5缓冲液混合,于90℃反应30 min后,迅速放入冰水浴中终止反应,然后采用3,5-二硝基水杨酸(3,5-Dinitrosalicylic acid,DNS)法[16]测定反应体系中还原糖量。酶活力单位(U)定义:在一定反应条件下,每分钟催化产生1 μmol还原糖的酶量为一个酶活力单位(U)。
1.2.5 α-淀粉酶的酶学性质 将酶液与不同pH值的1%可溶性淀粉溶液混合,于90℃条件下进行酶活测定。采用不同缓冲液配制不同pH 值的1%可溶性淀粉溶液:50 mmol/L MES(pH4.0-7.0)、50 mmol/L 3-(N-玛琳代)丙磺酸缓冲液(3-Morpholinopropanesulfonic acid,MOPS)(pH 7.0-8.5)。
按照上述反应体系混合酶液和底物,分别于40-120℃反应30 min,测定不同温度条件下酶比活力,并以酶比活力对温度作图,确定其最适反应温度。其中,40-95℃范围内的反应于水浴中进行,100-120℃范围内的反应于甘油浴中进行。高温条件下测定α-淀粉酶活性时,反应样品置于O型环螺旋盖密封管内,以防止水分蒸发。
用50 mmol/L MES(pH 6.5)缓冲液配制不同质量分数可溶性淀粉溶液(0.1%、0.2%、0.5%、1%、1.5%、2%、3%、4%和5%),分别向可溶性淀粉溶液中加入等量的酶液,按照1.2.4节方法测定酶活。根据双倒数作图法以底物浓度的倒数为横坐标,以酶比活力的倒数为纵坐标作图,直线的斜率为Km/Vmax,截距为1/Vmax,计算以可溶性淀粉为底物时的米氏常数Km、反应常数kcat。
将酶液于90℃或100℃保温,分时间梯度取出部分样品,按照1.2.4节方法测定酶活。将未处理的酶液的酶活定义为100%,并以相对酶活的百分比对时间作图,评价酶的热稳定性。
1.2.6 α-淀粉酶中Zn2+含量的测定 向浓度约为1 mg/mL的重组α-淀粉酶中补加EDTA至其终浓度为2 mmol/L,分别将样品于20℃和90℃保温1 h,然后采用透析法除去样品中EDTA。分别取1 mL未经处理的重组α-淀粉酶和处理后的重组α-淀粉酶,采用电感耦合等离子质谱法(ICP-MS)[17]测定样品中Zn2+浓度,并以最后一次透析液作为对照样品。1.2.7 数据统计分析 α-淀粉酶的酶学性质研究实验中,每个实验做3 个平行。运用软件SigmaPlot 11.0对试验数据进行统计分析并作图,数据均以表示。
2 结果
2.1 定点突变位点的选择
采用BLASTP比对ApkA与来源于不同极端嗜热古生菌的α-淀粉酶的氨基酸序列,结果(图1)显示ApkA与PFA、TH_amy1、TO_amy1分别具有89%、86%和86%的氨基酸序列相似性。PFA中参与结合Zn2+的氨基酸残基包括His147、His152和Cys166。在ApkA中,与这些氨基酸残基相对应的氨基酸残基分别是His147、Lys152和Ala166。鉴于该Zn2+结合位点对于PFA热稳定性的重要性,本研究设计ApkA中氨基酸残基K152和A166为突变位点,向ApkA中引入PFA中Zn2+结合位点,构建双位点突变体ApkAdsK152H/A166C。
2.2 重组α-淀粉酶的诱导表达与纯化
将重组质粒pET28a-ApkAds和 pET28a-ApkAdsK152H/A166C分别转 化 大肠杆菌BL21-CodonPlus(DE3)-RIL,获得重组大肠杆菌并进行诱导表达。如图2所示,目的蛋白质ApkAds和ApkAdsK152H/A166C均得到成功表达,其表观分子质量均约为45 kD,大小与理论值相符。
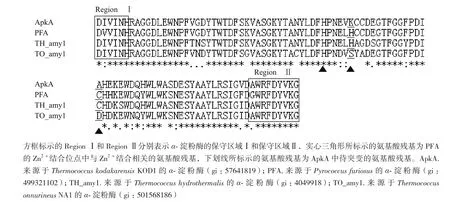
图1 ApkA与其他α-淀粉酶的氨基酸序列比对结果

图2 重组α-淀粉酶的SDS-PAGE检测图
2.3 ApkAds和ApkAdsK152H/A166C的酶学性质比较
2.3.1 pH对重组α-淀粉酶的酶活的影响 以1%可溶性淀粉为底物,于不同pH值条件下测定重组α-淀粉酶ApkAds和ApkAdsK152H/A166C的相对酶活,结果如图3所示。与ApkAds相比,突变体ApkAdsK152H/A166C的最适反应pH值以及pH 4.0-8.5之间的相对酶活均未明显改变。

图3 pH值对酶活的影响
2.3.2 温度对重组α-淀粉酶的酶活的影响 以1%可溶性淀粉为底物,于不同温度条件下测定重组α-淀粉酶ApkAds和ApkAdsK152H/A166C的酶比活力,结果如图4所示。ApkAds的最适反应温度为90℃,在此温度条件下的酶比活力为2 946.75 U/mg;突变体ApkAdsK152H/A166C的最适反应温度为100℃,在此温度条件下的酶比活力为5 201.08 U/mg,并且突变体于120℃仍能保持54.47%的相对酶活,在40-120℃间其酶比活力均明显高于野生型ApkAds的酶比活力。
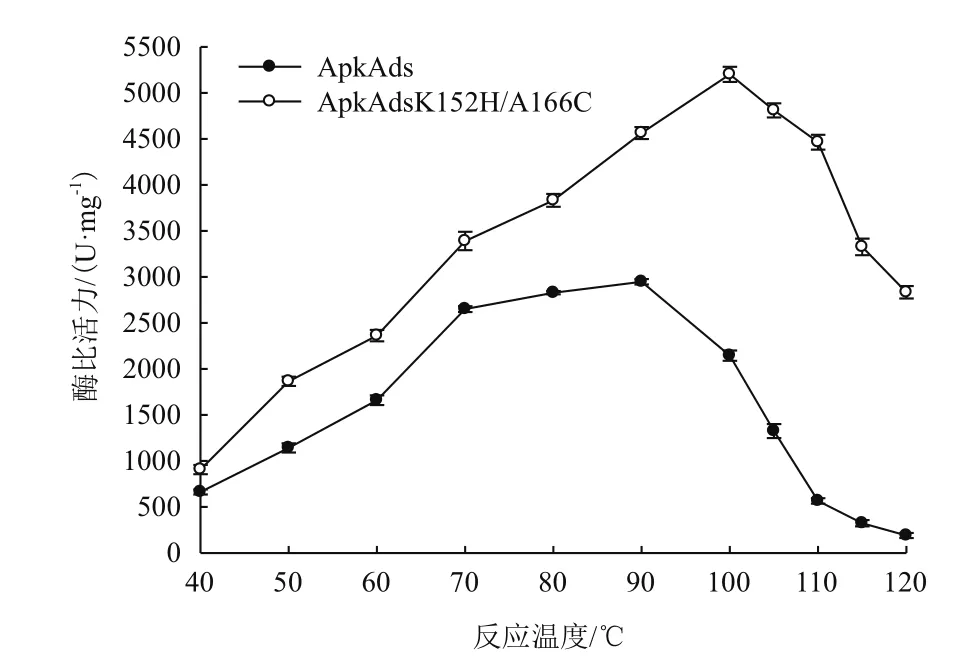
图4 温度对酶活的影响
2.3.3 重组α-淀粉酶的动力学参数 重组α-淀粉酶以可溶性淀粉为底物时的米氏常数Km和反应常数Kcat如表2所示,与野生型ApkAds相比,90℃突变体ApkAdsK152H/A166C的Km未明显改变,Kcat值提高约1.90 倍。即突变体ApkAdsK152H/A166C的底物结合能力未明显改变,以可溶性淀粉为底物时的反应速率明显提高。
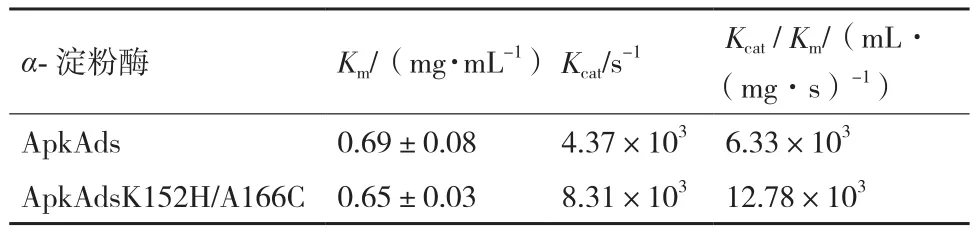
表2 90℃重组α-淀粉酶的动力学参数
2.3.4 重组α-淀粉酶的热稳定性 如图5所示,在90℃和100℃的条件下,突变体ApkAdsK152H/ A166C的热稳定性均高于野生型ApkAds的热稳定性。其中ApkAds于90℃的半衰期约为5 h,ApkAdsK152H/A166C于90℃的半衰期约为10 h;ApkAds于100℃ 的 半 衰 期 约 为7.5 min,ApkAdsK152H/A166C于100℃的半衰期约为80 min,提高了10.67倍。

图5 90℃(A)和100℃(B)重组α-淀粉酶的热稳定性
2.3.5 重组α-淀粉酶中Zn2+含量 采用电感耦合等离子质谱法(ICP-MS)测定重组α-淀粉酶未经EDTA处理以及经EDTA处理后的样品中Zn2+含量,结果如表3所示。未经EDTA处理,突变体ApkAdsK152H/A166C中Zn2+含量明显高于ApkAds中Zn2+含量。ApkAds于20℃或90℃经EDTA处理后,EDTA几乎完全螯合了ApkAds所结合的Zn2+。针对突变体ApkAdsK152H/A166C,于90℃下EDTA才能螯合其所结合的Zn2+。根据所测得的数值,推断ApkAdsK152H/A166C结合了一个Zn2+。
3 讨论
大多数α-淀粉酶属于糖苷水解酶类的第13家族,具有第13家族酶分子结构上的共同特征:(1)酶分子的三级结构由3个结构域组成;(2)酶分子的一级结构含有4个保守区域,这4个保守区域包含酶分子的催化活性位点和底物结合位点;(3)酶分子具有相同或相近的催化机理[1]。此外,α-淀粉酶的高温适应性机制符合蛋白质高温适应性机制的一般规律,包括降低热不稳定的氨基酸残基(如天冬酰胺、谷氨酰胺、半胱氨酸等)的含量、增强非共价作用力、减少溶剂可及的疏水表面、提高二级结构的稳定性、提高酶分子结构的紧凑性、结合金属离子、形成多聚体、翻译后修饰等因素[18]。Linden等[19]通过对比极端嗜热α-淀粉酶PFA与其他低温、中温微生物来源的α-淀粉酶的分子结构发现,PFA分子结构的紧凑性、离子键、Ca2+-Zn2+双金属离子结合位点对于其维持热稳定性非常重要。Machius等[20]和Qin等[21]关于目前工业上广泛应用的α-淀粉酶BLA的热稳定性的研究结果表明,位于结构域A与结构域B之间的Ca2+-Zn2+-Ca2+三金属离子结合位点、结构域A与结构域C之间的Ca2+结合位点对于BLA维持热稳定性非常重要。

表3 重组α-淀粉酶中Zn2+含量
综合以上两点,大多数α-淀粉酶具有共同的结构特征和相似的高温适应性机制,这有利于参照具有优良高温活性和热稳定性的α-淀粉酶的结构特征对其它α-淀粉酶进行分子改造,从而提高其高温活性和热稳定性。例如,Machius等[22]通过向BLA分子表面引入疏水性氨基酸残基,获得了85℃热稳定性提高了约40倍的突变体H133V/N190F/A209V/ N264S/Q265Y。这些氨基酸位点的突变主要是通过提高酶分子结构的紧凑性、增强金属离子的结合、稳定二级结构和增强疏水相互作用来提高BLA的热稳定性。Ghollasi等[23]通过改造来源于Bacillus megaterium WHO的α-淀粉酶的Ca2+结合位点,获得了最适反应温度提高5℃的突变体H77E。柯涛等[24]向高温酸性α-淀粉酶BD5088中引入二硫键,获得了100℃酶活力和酶活力半衰期均提高约1倍的突变体BD5088C2。曾静等[25]向极端嗜热α-淀粉酶ApkA中引入离子键K180-D212,获得了高温活性和热稳定性均得到提高的突变体ApkAdsA180K。
PFA是目前已知的热稳定性最强的α-淀粉酶,其最适反应温度高达100℃,于98℃的半衰期长达13 h[26]。Savchenko等[17]通过比较PFA和其Zn2+结合位点突变体的高温活性和热稳定性,证实Zn2+结合位点有利于PFA维持其热稳定性。此外,Linden等[19]通过对比PFA与其他低温微生物、中温微生物来源的α-淀粉酶的分子结构也发现,PFA中Zn2+结合位点对于其维持热稳定性非常重要。本研究通过向ApkA中引入PFA中与其热稳定性相关的Zn2+-结合位点,获得了高温活性和热稳定性均得到有效提高的突变体ApkAdsK152H/A166C。本研究结果表明该Zn2+-结合位点有利于提高ApkA的反应速率和热稳定性。前期研究已通过分子改造获得了高温活性和热稳定性提高的离子键突变体ApkAdsA180K[26]、酸性条件下酶活和稳定性以及高温活性和热稳定性均得到提高的N-糖基化突变体ApkAdsD182N/G373S[27]。后续工作将已验证的有利突变进行组合,以获得更适于淀粉液化工艺的耐热酸性α-淀粉酶。
4 结论
本研究获得了高温活性和热稳定性均得到提高的突变体ApkAdsK152H/A166C,其最适反应温度由90℃提高至100℃,90℃的酶比活力提高约1.55倍,100℃的酶比活力提高约2.43倍,于90℃的半衰期提高约2倍,于100℃的半衰期提高约10.6倍。重组α-淀粉酶的动力学参数分析显示,ApkAdsK152H/A166C结合可溶性淀粉的能力未发生明显变化,其降解可溶性淀粉的反应速率提高约1.90倍。此外,重组α-淀粉酶中Zn2+含量测定结果表明ApkAdsK152H/A166C结合了一个Zn2+。
[1]Janeček Š, Svensson B, Macgregor EA. α-Amylase:an enzyme specificity found in various families of glycoside hydrolases[J]. Cellular and Molecular Life Sciences, 2014, 71(7):1149-1170.
[2]Rana N, Walia A, Gaur A. α-Amylases from microbial sources and its potential applications in various industries[J]. National Academy Science Letters, 2013, 36(1):9-17.
[3]Zhang Q, Han Y, Xiao H. Microbial α-amylase:a biomolecularoverview[J]. Process Biochemistry, 2017, 53:88-101.
[4]Homaei A, Ghanbarzadeh M, Monsef F. Biochemical features and kinetic properties of α-amylases from marine organisms[J]. International Journal of Biological Macromolecules, 2016, 83:306-314.
[5]Souza PM. Application of microbial α-amylase in industry-a review[J]. Brazilian Journal of Microbiology, 2010, 41(4):850-861.
[6]Kumari A, Singh KM, Kayastha A. α-Amylase:general properties, mechanism and biotechnological applications-a review[J]. Current Biotechnology, 2012, 1(1):98-107.
[7]Atomi H, Sato T, Kanai T. Application of hyperthermophiles and their enzymes[J]. Current Opinion in Biotechnology, 2011, 22(5):618-626.
[8]Prakash O, Jaiswal N. α-Amylase:an ideal representative of thermostable enzymes[J]. Applied Biochemistry and Biotechnology, 2010, 160(8):2401-2414.
[9]Konsoula Z, Liakopoulou-Kyriakides M. Co-production of α-amylase and β-galactosidase by Bacillus subtilis in complex organic substrates[J]. Bioresource Technology, 2007, 98(1):150-157.
[10]Zhou W, You C, Ma H, et al. One-pot biosynthesis of highconcentration α-glucose 1-phosphate from starch by sequential addition of three hyperthermophilic enzymes[J]. Journal of Agricultural and Food Chemistry, 2016, 64(8):1777-1783.
[11]Dalmaso GZL, Ferreira D, Vermelho AB. Marine extremophiles:a source of hydrolases for biotechnological applications[J]. Marine Drugs, 2015, 13(4):1925-1965.
[12]曾静, 郭建军, 邱小忠, 等. 极端嗜热微生物及其高温适应机制的研究进展[J]. 生物技术通报, 2015(9):30-37.
[13]Tachibana Y, Leclere MM, et al. Cloning and expression of the α-amylase gene from the hyperthermophilic archaeon Pyrococcus sp. KOD1, and characterization of the enzyme[J]. Journal of Fermentation and Bioengineering, 1996, 82(3):224-232.
[14]Green MR, Sambrook J. Molecular cloning:a laboratory manual[M]. New York:Cold Spring Harbor Laboratory Press, 2012.
[15]Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227:680-685.
[16]Bernfeld P. Amylases, α and β[J]. Methods in Enzymology, 1955, 1:149-158.
[17] Savchenko A, Vieille C, Kang S, et al. Pyrococcus furiosus α-amylase is stabilized by calcium and zinc[J]. Biochemistry, 2002, 41(19):6193-6201.
[18]Dey TB, Kumar A, Banerjee R, et al. Improvement of microbial α-amylase stability:strategic approaches[J]. Process Biochemistry, 2016, 51(10):1380-1390.
[19]Linden A, Mayans O, Meyer-Klaucke W, et al. Differential regulation of a hyperthermophilic α-amylase with a novel(Ca, Zn)two-metal center by zinc[J]. Journal of Biological Chemistry, 2003, 278(11):9875-9884.
[20]Machius M, Declerck N, Huber R, et al. Activation of Bacillus licheniformis α-amylase through a disorder→ order transition of the substrate-binding site mediated by a calcium-sodium-calcium metal triad[J]. Structure, 1998, 6(3):281-292.
[21]Qin Y N, Fang Z, Pan FG, et al. Significance of Tyr302, His235 and Asp194 in the α-amylase from Bacillus licheniformis[J]. Biotechnology Letters, 2012, 34(5):895-899.
[22]Machius M, Declerck N, Huber R, et al. Kinetic stabilization of Bacillus licheniformis α-amylase through introduction of hydrophobic residues at the surface[J]. Journal of Biological Chemistry, 2003, 278(13):11546-11553.
[23]Ghollasi M, Ghanbari-Safari M, Khajeh K. Improvement of thermal stability of a mutagenised α-amylase by manipulation of the calcium-binding site[J]. Enzyme and Microbial Technology, 2013, 53(6):406-413.
[24]柯涛, 刘征, 杨建伟, 等. A154C/G155C双点突变对嗜热耐酸淀粉酶酶活性及热稳定性的影响[J]. 食品科学, 2012, 33(3):207-211.
[25]曾静, 郭建军, 等. 定点突变提高极端嗜热α-淀粉酶ApkA的高温活性和热稳定性[J]. 食品科学, 2017, 38(2):20-26.
[26]Jørgensen S, Vorgias Ce, Antranikian G. Cloning, sequencing, characterization, and expression of an extracellular α-amylase from the hyperthermophilic archaeon Pyrococcus furiosus in Escherichia coli and Bacillus subtilis[J]. Journal of Biological Chemistry, 1997, 272(26):16335-16342.
[27]曾静, 郭建军, 袁林. N-糖基化修饰对极端嗜热酸性α-淀粉酶ApkA酶学性质的影响[J]. 食品科学, 2017, 38(6):1-6.
(责任编辑 李楠)
Optimization of the Thermal Activity and Stability of Hyperthermophilic α-amylase ApkA
ZENG Jing GUO Jian-jun YUAN Lin YANG Gang CHEN Jun
(Institute of Microbiology,Jiangxi Academy of Sciences,Nanchang 330096)
This work aims to obtain α-amylase with improved thermal activity and stability. Based on the structure analysis of hyperthermophilic α-amylase ApkA and the most thermo-stable α-amylase PFA,a Zn2+-binding site mutant ApkAdsK152H/A166C was constructed by introducing the Zn2+-binding site of PFA into ApkA. The mutant ApkAdsK152H/A166C exhibited effective increase in terms of thermal activity and stability. The optimal temperature of the mutant increased from 90℃ to 100℃ and the corresponding specific activity was 5 201.08 U/mg. The half-life of ApkAdsK152H/A166C prolonged from 5 h to 10 h while incubated at 90℃,and from 7.5 min to 80 min at 100℃. The results of Zn2+content measurement in recombinant α-amylases confirmed that ApkAdsK152H/A166C bound with one Zn2+ion. These results suggested that the introduction of Zn2+-binding site improved the thermal activity and stability of ApkA.
hyperthermophilic α-amylase;Zn2+-binding site;site-directed mutagenesis;thermo-activity;thermostability
10.13560/j.cnki.biotech.bull.1985.2017-0172
2017-03-09
国家自然科学基金青年科学基金项目(31501422),江西省青年科学基金项目(20171BAB214003),江西省科学院资助项目(2014-YYB-08,2014-XTPH1-08)
曾静,女,博士,助理研究员,研究方向:极端嗜热酶的开发与应用;E-mail:zengjingwhu@126.com
袁林,男,博士,副研究员,研究方向:工业微生物的应用;E-mail:yuanlincn2003@aliyun.com

