两种天然产物对B16F10细胞增殖及黑色素合成抑制机理研究
程杏安张淑明周晓武吴波林贤伟秦湘静黄素青刘展眉蒋旭红
(1. 仲恺农业工程学院天然产物化学研究所,广州 510225;2. 中国科学院南海海洋研究所,广州 510301)
两种天然产物对B16F10细胞增殖及黑色素合成抑制机理研究
程杏安1张淑明1周晓武1吴波1林贤伟1秦湘静2黄素青1刘展眉1蒋旭红1
(1. 仲恺农业工程学院天然产物化学研究所,广州 510225;2. 中国科学院南海海洋研究所,广州 510301)
旨在研究10-羟基喜树碱(10-hydroxycamptothecin,HCPT)和白藜芦醇(Resveratrol,Res)对体外培养的小鼠恶性黑色素瘤B16F10细胞的增殖及黑色素合成抑制机理。利用MTT法、显微观察、L-Dopa氧化法、NaOH裂解法分析不同浓度HCPT和Res对细胞增殖、细胞形态、酪氨酸酶活性及黑色素合成含量的影响。荧光半定量PCR方法(Semi-RT-PCR)分析该化合物对黑色素合成关键因子酪氨酸酶(TYR)和小眼相关转录因子(MITF)基因表达的影响。结果表明HCPT(40、80、120、160和200 μmol/L)和Res(80、120、160和200 μmol/L)能够通过诱导细胞凋亡抑制B16F10细胞的增殖,同时对酪氨酸酶活性和细胞黑色素生成具有明显抑制作用(P<0.05),且呈现浓度依赖性。另外,不同浓度的HCPT以及高浓度Res(120和160 μmol/L)能够显著下调B16F10细胞TYR和MITF基因的mRNA水平。HCPT和Res可能通过诱导细胞凋亡抑制B16F10细胞的增殖,同时通过下调MITF基因转录,抑制TYR mRNA的表达及TYR酶活性,进而抑制细胞黑色素的生成。
10-羟基喜树碱;白藜芦醇;酪氨酸酶;黑色素;小眼相关转录因子
10-羟 基 喜 树 碱(10-hydroxycamptothecin,HCPT)是从我国特有珙桐科植物喜树中分离出的天然生物碱,也是一种新型有效的抗肿瘤药物[1],通过抑制拓朴异构酶I(Topoosomerase I,Topo-I)干扰肿瘤细胞的DNA复制,抑制肿瘤细胞生长[2,3]。白藜芦醇(Resveratrol,Res)是广泛分布在葡萄、花生、桑葚、虎杖、决明等植物中的非黄酮类多酚化合物。近年来有报道Res对肝癌、胃癌、自血病、宫颈癌、食管癌等均有较好的抗肿瘤效果,而且对人体正常机体没有明显的毒副作用[4-6]。黑色素瘤是目前位居人类皮肤癌第三位的肿瘤疾病,因其恶性程度高,易转移,导致患者生存率低,引起了研究者的广泛重视[7-9]。因此,不断发掘治疗黑色素瘤的新药物,提高患者的生存率成为当前重要任务。如今医学界已逐渐注重发挥中医学的优势,从天然植物中筛选出具有抗瘤活性的成分作为防治黑色素瘤的重要候选药物[10]。合成黑色素是黑素瘤细胞增殖生长过程中的重要特征,其过程主要由酪氨酸酶基因家族调控。其中,酪氨酸酶(TYR)是黑色素合成的关键限度酶,其基因家族受小眼相关转录因子(MITF)的调节。MITF是黑素细胞的特异性转录因子,可以直接结合并激活酪氨酸酶启动子,上调酪氨酸酶基因的表达,促进黑色素的生成[11-13]。本研究以小鼠黑色素瘤B16F10细胞为模型,研究HCPT和Res对该细胞株增殖及黑色素合成的影响,通过分析药物作用下TYR活性变化、TYR和MITF基因的表达水平,初步阐明两种天然产物抑制B16F10细胞黑色素合成的作用机理,旨为深入研究HCPT和Res抗黑色素瘤机理及其相关药物开发提供理论依据。
1 材料与方法
1.1 材料
小鼠黑色素瘤B16F10细胞购自中国科学院菌种保藏中心;10-羟基喜树碱(纯度98%以上)、白藜芦醇(纯度98%以上)、左旋多巴(L-DOPA)购自阿拉丁试剂有限公司;MTT(四甲基偶氮唑蓝)、DMSO(二甲基亚砜)购自SIGMA;DMEM高糖培养基、胎牛血清、抗生素购自上海立菲生物技术有限公司;PCR试剂盒和RT-PCR试剂盒购自东盛生物科技有限公司,PCR引物由华大基因公司合成。
1.2 方法
1.2.1 细胞培养 用含10%胎牛血清的DMEM培养基在37℃,5% CO2条件下常规培养B16F10细胞,待细胞生长至近融合状态,以500 μL胰蛋白酶消化传代,每3天传代1次。
1.2.2 细胞活力检测 取处于最佳生长状态的B16F10细胞,常规处理,细胞悬浮液密度调整到7×104-9×104个/mL,以每孔100 μL细胞悬液接种于96孔板中,置于37℃、5% CO2培养箱培养。
1.2.2.1 药物溶剂对细胞活力影响实验 24 h后,实验分为3组:实验组为正常培养和终浓度0.5% DMSO的处理组,调零组只加培养液不接种细胞。设1、2、3、4、5和6 d共6个时间点,每个时间点4个重复。到时间点时,每孔加10 μL MTT(5 mg/mL,PBS配制),常规孵育4 h。弃掉培养液,每孔加150 μL DMSO,室温震荡15 min,使紫蓝色结晶物充分溶解。使用酶标仪测定各孔492 nm处吸光度(OD)值。记录结果,OD = OD实验组- OD调零组。
1.2.2.2 药试实验 24 h后,实验分为两组:对照组和实验组(浓度为20、40、80、120、160和200 μmol/L HCPT处理组或浓度40、80、120、160和200 μmol/L Res的处理组)。设24、48、72 h共3个时间点,每个时间点4个重复。到时间点时,每孔加入10 μL MTT,常规孵育4 h。弃掉培养液,每孔加150 μL DMSO,室温震荡15 min,使紫蓝色结晶物充分溶解。使用酶标仪测定各孔492 nm处OD值。记录结果。
细胞抑制率(%)=(1-OD实验组/OD对照组)×100%
1.2.3 倒置生物显微镜细胞形态特征观察 取状态最佳的B16F10细胞以(7-9)×104个/mL的密度铺板于6孔细胞培养板中,24 h后,加HCPT和Res至供试浓度进行处理,48 h后用倒置显微镜观察细胞形态变化并拍片记录。
1.2.4 黑素含量测定 选取处于最佳生长状态的B16F10细胞,常规处理,细胞悬浮液密度调整到7×104-9×104个/mL,以每孔2 mL细胞悬液接种于6孔板中,置于37℃、5% CO2培养箱培养。24 h后换液,实验组分别加入不同浓度HCPT(终浓度为20、40、80、120、160、200 μmol/L)和Res(终浓度为40、80、120、160和200 μmol/L)。药物作用72 h后,收获细胞,将细胞悬浮液离心后用pH=7.2 PBS洗涤两次,加入1 mol/L NaOH,置80℃水浴中30 min,使细胞团块完全溶解,再加入超纯水将NaOH的终浓度稀释至0.2 mol/L。混合均匀,取各组溶液放入96孔板中,每孔100 μL,设立8个重孔。用酶标仪在492 nm测定OD值。黑素含量(%)=(OD实验组/OD对照组)×100%。
1.2.5 酪氨酸酶活性测定 选取处于最佳生长状态的B16F10细胞,常规处理,细胞悬液调整细胞浓度为7×104-9×104个/mL,以每孔100 μL接种于96孔板,置于37℃、5% CO2培养箱中培养24 h。实验分两组:实验组调整HCPT终浓度为20、40、80、120、160和200 μmol/L,Res终浓度为40、80、120、160和200 μmol/L,并设对照组,每一浓度设立4个重复。药物作用72 d后,弃去上清液,用pH 7.2的PBS洗涤,每孔加入1% Triton X-100溶液100 μL,手动平稳震荡5 min,接着在-20℃冰箱冻存1 h。随后在室温中融化,使细胞裂解,37℃预温后每孔加入0.1% L-DOPA溶液(PBS配制)100 μL,37℃反应2 h,用酶标仪在492 nm测定OD值。酪氨酸酶活性激活率(%)=(OD实验组/OD对照组)× 100%。
1.2.6 半定量逆转录- 聚合酶链式反应(Semi-RTPCR)分析法 采用通用RNA提取试剂盒(参照试剂说明书)提取以上述浓度HCPT和Res处理48 h的B16F10细胞总RNA,并反转录成cDNA用于PCR扩增。目的基因PCR引物如下。TYR:上游5′-GGCCAGCTTTCAGGCAGAGGT-3′,下游5′-TGGTGCTTCATGGGCAAAATC-3′。MITF:上游5′-AAGTGGTCTGCGGTGTCTCC-3′,下游5′-GTTGTTGGTAAAGGTGATGG-3′。β-actin:上游5′-CGAGCGGGAAATCGTGCGTGACATTAAGGAGA-3′,下游5′-CGTCATACTCCTGCTTGCTGATCCACATCTGC-3′。其中先以对照组的cDNA为模板,PCR的反应条件为:94℃60 s,64℃ 60 s,72℃ 60 s,设定系列循环数(25、26、27、28、29、31、33和35),通过琼脂糖凝胶中电泳分析,筛选并确定每个基因进行Semi-RTPCR分析的合适循环数,最后再按照该循环数,利用Semi-RT-PCR技术分析各基因mRNA相对表达量。
1.2.7 数据处理 实验结果用ORIGIN7.5统计软件处理,数据用均数±标准差(x-±s)表示,组间比较采用单因素方差分析,P<0.05认为两组间的差异具有统计学意义。
2 结果
2.1 HCPT和Res抑制B16F10细胞增殖
B16F10细胞在接种后第2天完成第1次倍增,进入对数生长阶段。药试试验中,选择铺板培养24 h作为加药起点时间。以0.5% DMSO处理的B16F10细胞,其生长活力与正常生长细胞相比,总体上没有明显差异(图1),表明DMSO在终浓度低于0.5%的情况下对B16F10细胞活力没有显著影响,可作为供试药物的溶剂。
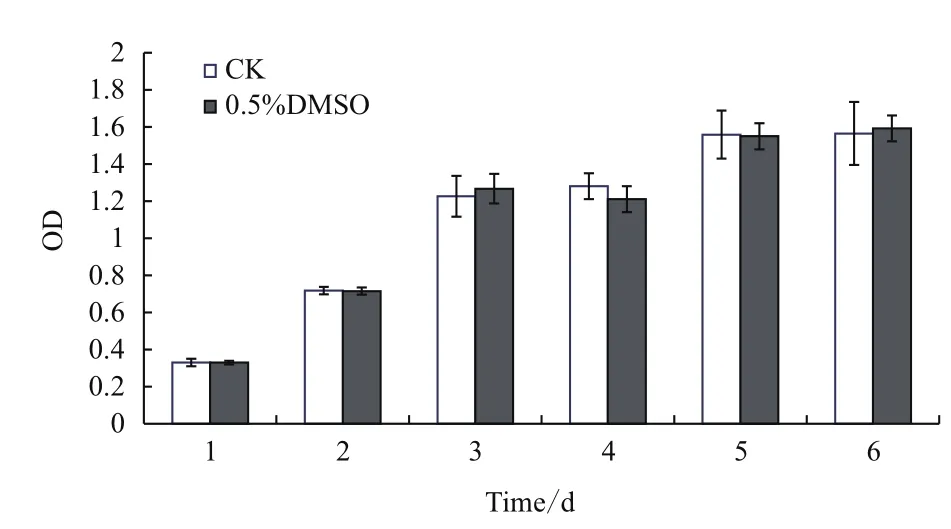
图1 DMSO对B16F10细胞活力的影响(n=4,)
利用MTT法测定不同浓度HCPT和Res对B16F10细胞增值生长的影响。HCPT诱导B16F10细胞24、48和72 h,细胞增殖均受到明显抑制,抑制率50%以上,其中24和48 h处理浓度间抑制率差异不明显;48和72 h处理抑制率比24 h明显增加,表明HCPT对B16F10细胞增殖抑制存在一定时效性;72 h处理,随着HCPT浓度增加,细胞抑制率逐渐增加,处理浓度200 μmol/L时,抑制率达到84.20%,表现出一定浓度依赖性(表1)。Res低浓度(20-40 μmol/L)诱导处理,药物作用24 h后其对B16F10细胞增值有促进作用;处理48和72 h对细胞增值生长没有明显影响。然而,较高浓度Res(80-200 μmol/L)作用下,处理24、48和72 h均对B16F10细胞生长有明显的增值抑制作用,且随着浓度的加大,诱导作用延长,增值抑制作用增加,抑制率最高达到68%(表2)。
表1 HCPT对B16F10细胞增殖抑制率(n=4,)

表1 HCPT对B16F10细胞增殖抑制率(n=4,)
注:*与对照组比较,P<0.05,下同
Concentration/(μmol·L-1)Inhibition rate/% 24 h 48 h 72 h 0 0 0 0 20 50.47 ± 3* 59.20 ± 5* 37.20 ± 4* 40 52.28 ± 2* 71.10 ± 5* 58.00 ± 3* 80 52.10 ± 2* 73.40 ± 3* 74.50 ± 3* 120 48.80 ± 2* 79.70 ± 2* 77.40 ± 4* 160 53.20 ± 3* 79.90 ± 2* 83.40 ± 4* 200 48.40 ± 6* 77.60 ± 2* 84.20 ± 1*
表2 Res对B16F10细胞增殖抑制率(n=4,)
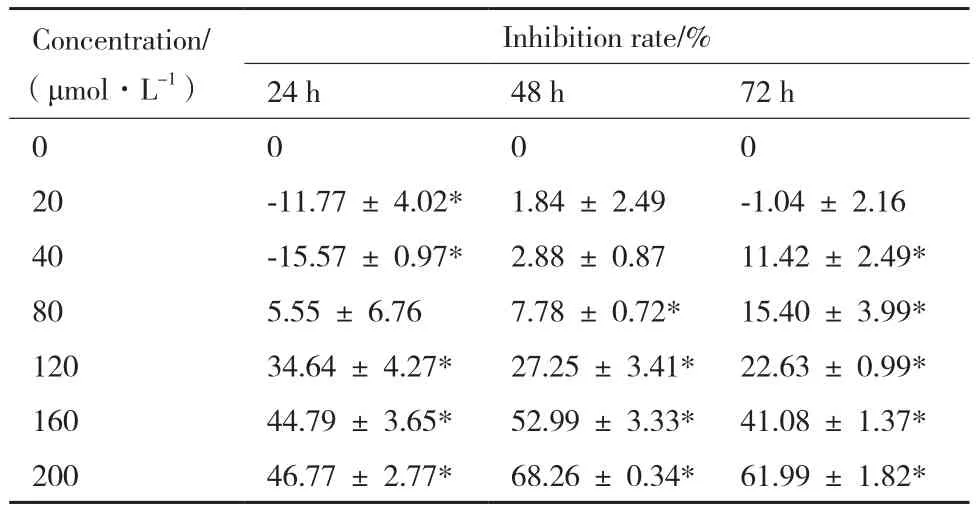
表2 Res对B16F10细胞增殖抑制率(n=4,)
Concentration/(μmol·L-1)Inhibition rate/% 24 h 48 h 72 h 0 0 0 0 20 -11.77 ± 4.02* 1.84 ± 2.49 -1.04 ± 2.16 40 -15.57 ± 0.97* 2.88 ± 0.87 11.42 ± 2.49* 80 5.55 ± 6.76 7.78 ± 0.72* 15.40 ± 3.99* 120 34.64 ± 4.27* 27.25 ± 3.41* 22.63 ± 0.99* 160 44.79 ± 3.65* 52.99 ± 3.33* 41.08 ± 1.37* 200 46.77 ± 2.77* 68.26 ± 0.34* 61.99 ± 1.82*
2.2 HCPT和Res诱导B16F10细胞凋亡
用倒置相差显微镜观察药物诱导B16F10细胞48 h的形态变化。对照组B16F10细胞形态饱满,呈爪形或梭形,细胞膜完整,核区清晰,折光性好,增殖速度快(图2-A,B,C)。40 μmol/L HCPT处理后,部分细胞出现降解,核区皱缩或膨大,细胞贴壁能力差,呈团块状生长,同时出现大量凋亡小体(图2-D)。80和160 μmol/L HCPT处理组,细胞数量大幅度减少,大部分细胞细胞核皱缩,细胞解体成碎片或形成凋亡小体(图2-E,F)。40 μmol/L Res处理组,多细胞未出现明显的形态异常,仍保持良好的增殖状(图2-J),80 μmol/L Res处理组贴壁细胞未见明显减少,部分细胞核区空泡化并逐渐解体,在细胞周围出现颗粒状的凋亡小体(图2-H),160 μmol/L Res处理组只有少数细胞贴壁生长,大部分细胞完全解体为颗粒状凋亡小体或形状不规则碎片,部分细胞核区皱缩,且异常细胞聚集成团(图2-I)。综合观察表明表现HCPT和Res对B16F10细胞具有明显的凋亡诱导作用,其中80 μmol/L以上处理浓度的诱导作用尤为明显,而且HCPT凋亡诱导作用明显优于Res,40 μmol/L的浓度处理细胞已表现出一定的凋亡特征。
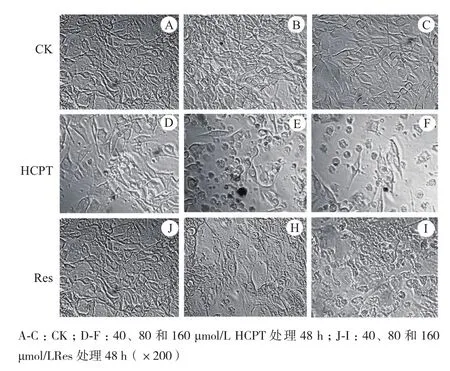
图2 HCPT和Res对B16F10细胞显微形态的影响
2.3 HCPT和Res抑制B16F10细胞黑色素的生成
与对照组相比,HCPT浓度在40和80 μmol/L时对B16F10细胞黑色素合成量具有显著性抑制作用,黑色素生成量分别下降到87.6%和78.4%,呈现一定浓度依赖性;当HCPT浓度大于80 μmol/L后,黑色素合成量有持续下降趋势,但浓度间差异不明显,其中200 μmol/L处理组黑色素合成量为73.1%(图3-A)。Res诱导作用下,B16F10细胞黑色素合成也受到显著抑制,在20-200 μmol/L Res处理下,与对照组比较,细胞黑色素生成量下降到82%-88%,期间增加Res处理浓度,黑色素生成量虽有下降趋势,但浓度间差异不明显(图3-B)。
2.4 HCPT和Res抑制B16F10细胞酪氨酸酶的活性
不同浓度HCPT处理对B16F10细胞中酪氨酸酶活性具有显著性抑制作用,20-200 μmol/L间浓度处理下,随着浓度的增大,抑制效果有逐渐增强趋势,呈现一定浓度依赖性,其中200 μmol/L HCPT处理组,酪氨酸酶活性降低至71.8%(图4-A)。不同浓度Res处理对B16F10细胞中酪氨酸酶活性也具有显著性抑制作用,在20-200 μmol/L Res的诱导下,与对照组相比,酪氨酸酶活性下降到80%-90%,不同浓度处理间,没有明显浓度依赖性(图4-B)。
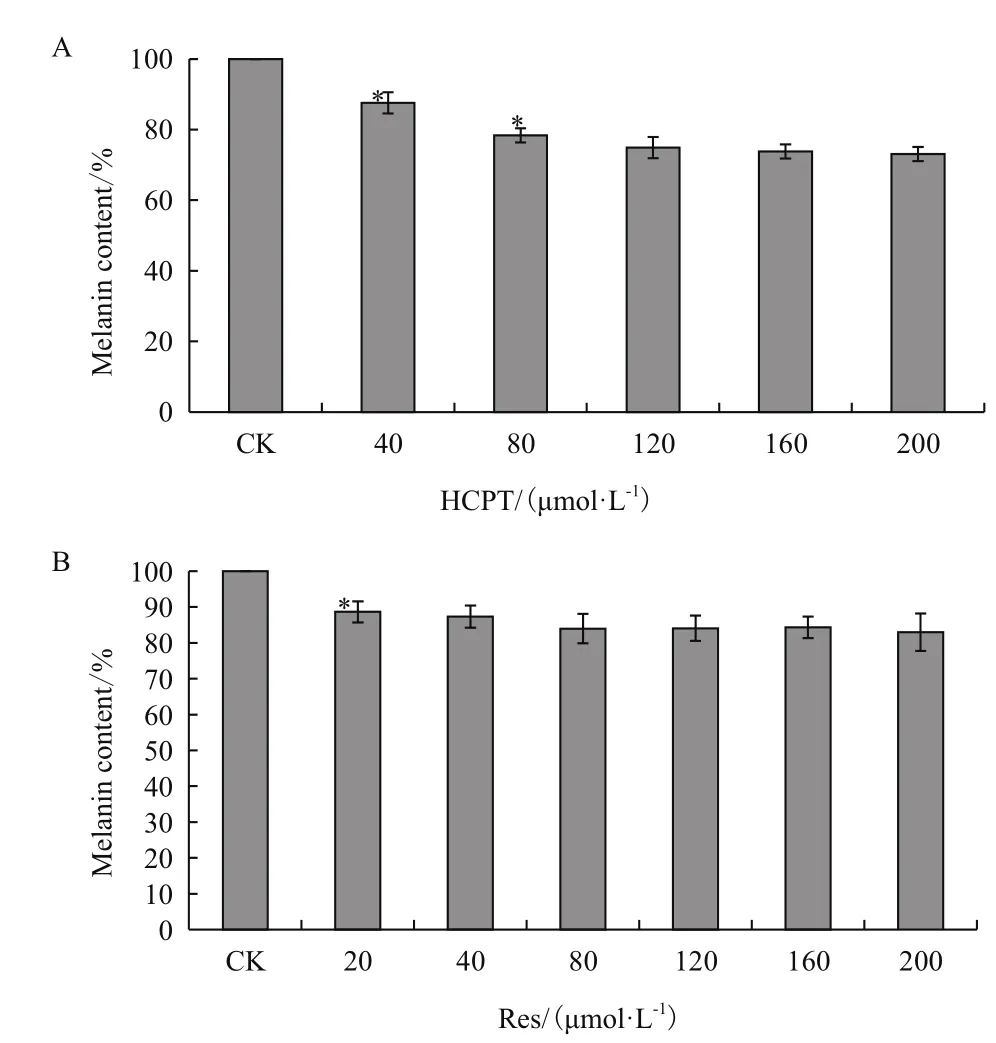
图3 HCPT和Res对B16F10细胞黑色素合成的影响(n=4,)

图4 HCPT和 Res对B16F10细胞酪氨酸酶活性的影响(n=4,)
2.5 HCPT和Res抑制B16F10细胞MITF和TYR基因的转录
在PCR反应中,目标产物的数量随着循环数呈指数级增长。在反应过程中,随着酶活力的下降及体系中各底物浓度的下降,反应速率逐渐变慢,最后反应进入一个平台期,反应产物的浓度不再呈指数级增长。在达到平台期之前,产物的相对浓度一定程度上反映了初始模版的相对浓度。因此,要首先确定内参基因β-actin以及目的基因TYR和MITF扩增过程中的反应平台期。β-actin和TYR基因在31个循环时,扩增达到平台期(图5),因此本实验选择29个循环作为扩增循环数。MITF基因在35个循环时,扩增达到平台期,我们选择33个循环作为扩增循环数。

图5 三基因片段不同循环数的扩增结果
利用Semi-RT-PCR实验检测HCPT诱导B16F10细胞凋亡TYR mRNA的表达量变化。β-actin mRNA的表达量在不同浓度HCPT诱导下保持稳定不变,说明该实验过程中没有其他因素干扰TYR mRNA的表达(图6)。与对照组比较,HCPT(20、40、80、120和160 μmol/L)诱导细胞48 h,MITF和TYR mRNA表达受到显著抑制,其中MITF mRNA表达抑制尤为显著,TYR mRNA随着HCPT浓度增加,表达量总体呈现降低趋势。MITF蛋白是TYR基因的调控因子,结果表明HCPT可能通过抑制MITF mRNA表达下调TYR mRNA的水平,从而降低TYR活性,进而抑制细胞黑色素的生成。
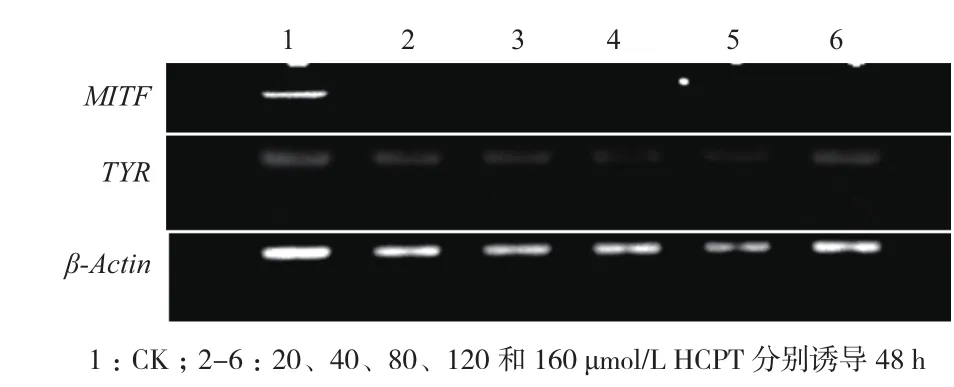
图6 HCPT对B16F10细胞MITF and TYR mRNA相对表达影响
120和160 μmol/L Res分别诱导细胞48 h,MITF mRNA表达量明显下降,低浓度(20、40和80 μmol/L)Res对细胞TYR mRNA表达没有显著影响(图7),表明Res也可能通过抑制MITF mRNA表达下调TYR mRNA的水平,从而降低TYR活性,进而抑制细胞黑色素的生成。

图7 Res对B16F10细胞TYR和MITF mRNA相对表达影响
3 讨论
研究表明HCPT能够通过干扰肿瘤细胞周期,促进肿瘤细胞凋亡,从而抑制其增殖生长[14,15]。HCPT具有抑制拓扑异构酶I的活性而使DNA断裂的独特机制。它能选择性作用于Topo-I,形成稳定的“药物-Topo-I-DNA复合物”。该复合物抑制最初由Topo-I介导的DNA裂解和重新连接反应,使处于细胞周期中S期DNA复制时形成的复制叉与已断裂的DNA链冲突,会造成不可逆的复制叉阻滞、双链DNA断裂和可逆的可解离复合物转变成不可逆的复合物,最终导致肿瘤细胞周期阻滞和细胞凋亡,表现出显著的肿瘤活性[2]。Res对肿瘤也有确切的抑制作用,可作用于肿瘤的起始、促进、发展这3个阶段[16],但其作用机制很复杂,尚未明确。Res可引起细胞生长抑制,细胞周期阻滞及细胞凋亡的生物学变化,而且变化程度与其浓度有关[17]。Res对肿瘤细胞增殖有双相性,低浓度促进细胞增殖,高浓度抑制细胞增殖,其抑制作用呈量效关系[18]。同时,Res还具有抗肿瘤迁移的作用[19]。有研究报道,Res(25-100 μmol/L)可抑制黑色素肿瘤细胞增殖,引起其细胞周期改变[20]。本研究也发现HCPT和Res对小鼠黑色素瘤B16F10细胞均具有显著的增殖抑制作用,同时药物诱导下的细胞形态观察发现两种药物对目标细胞具有显著的凋亡诱导作用,因此这两种药物也很可能通过促进小鼠黑色素瘤B16F10细胞凋亡,抑制其增殖生长,表现出抗肿瘤活性。两者的抗肿瘤具体分子机制仍不清楚,需深入研究。
恶性黑色素瘤是一种恶性程度较高的恶性肿瘤,其具有逃避凋亡、易转移等重要特点。合成黑色素是黑素瘤细胞增殖生长过程的重要特征,其过程主要由黑素合成关键限速酶TYR基因家族调控,而TYR基因家族调节因子MITF可以上调酪氨酸酶基因表达,促进黑色素的生成[11-13]。本研究发现HCPT和Res可能通过抑制MITF mRNA表达下调TYR mRNA的水平,从而降低TYR活性,进而抑制细胞黑色素的生成。也有研究者发现乳酸菌发酵的豆奶提取物可通过抑制B16F0黑素细胞的TYR和MITF活性和表达,从而减少黑色素的合成[21]。该提取物抑制黑色素的作用机制与本研究的结果基本一致。然而,黑色素的合成过程也有酪氨酸酶基因家族中的酪氨酸相关蛋白1(TRP-1)和酪氨酸相关蛋白2(TRP-2)的参与,Res对这两种相关蛋白是否有影响有待研究。
4 结论
本研究发现HCPT和Res对B16F10细胞增殖都有抑制作用,且随着浓度增加,抑制作用增强。HCPT和Res可能通过诱导细胞凋亡抑制B16F10细胞的增殖,同时通过下调MITF基因转录,抑制TYR mRNA的表达及TYR酶活性,进而抑制细胞黑色素的生成。
[1]袁丹, 容如滨, 喻宗沅等. 抗肿瘤药物10-羟基喜树碱的研究与应用进展[J]. 化学与生物工程, 2007, 12:9-11.
[2]Meng GR, Li JJ, Wang GL, et al. Synthesis and cytotoxic activities of the amino acid-conjugates of 10-hydroxycamptothecin[J]. Chinese Journal of Organic Chemistry, 2014, 1:155-160.
[3]代鲁平, 宋春霞, 邵先祥, 等. 抗癌药物喜树碱类衍生物的研究进展[J]. 中国药学杂志, 2010, 23:1813-1815.
[4]王征, 罗泽民, 邓林伟. 白藜芦醇的药理作用机理和合成途径[J]. 天然产物研究与开发, 2003, 15(2):178-181.
[5]刘宏胜, 王金环, 徐新女, 等. 白藜芦醇对U251人脑胶质瘤细胞生长的抑制及相关机制的研究[J]. 中国中药杂志, 2009, 34(8):1027-1031.
[6]卢晨欣, 孙警辉, 伍春莲. 白藜芦醇与紫杉醇联合用药对人喉癌Hep-2细胞凋亡机制的研究[J]. 中国中药杂志, 2016, 41(3):476-483.
[7]吕莎, 李哲, 王显江, 等. 靶向NRP1单克隆抗体对黑色素瘤细胞B16F10的增殖、迁移和凋亡的影响[J]. 中国药学杂志, 2014, 49(20):1806-1812.
[8]曾红梅, 张思维, 郑荣寿, 等. 2003~2007年中国皮肤黑色素瘤发病与死亡分析[J]. 中国肿瘤, 2012, 3:183-189.
[9]唐智柳, 石建伟, 蔡美玉, 等. 中国皮肤黑色素瘤发病及其影响因素分析[J]. 中国肿瘤, 2014, 10:829-833.
[10]杨娴, 刘汝清, 杜德荣, 等. 白花蛇舌草总黄酮对黑色素瘤a375和b16细胞增殖抑制作用的研究[J]. 世界中西医结合杂志, 2011, 10:844-846, 856.
[11]Vance KW, Goding CR. The transcription network regulating melanocyte development and melanoma[J]. Pigment Cell Research, 2004, 17(4):318- 325.
[12]Steingrimsson E, Copeland NG, Jenkins NA. Melanocytes and the microphthalmia-transcription factor network[J]. Annual Review of Genetics, 2004, 38:365-411.
[13]Levy C, Khaled M, Fisher DE. M ITF:master regulator of melanocyte development and melanoma oncogene[J]. Trends in Molecular Medicine, 2006, 12:406- 414.
[14]胡文晋, 胡巍, 方芸. 喜树碱类药物抗肿瘤机制研究进展[J].中国药房, 2012, 27:2581-2584.
[15]张超, 胡巍, 方芸. 雾化吸入羟基喜树碱对小鼠B16黑色素瘤实验性肺转移的影响[J]. 中国中药杂志, 2011, 36(5):618-623.
[16]Shankar S, Singh G, Srivastava RK. Chemoprevention by resveratrol:molecular mechanisms and therapeutic potential[J]. Frontiers in Bioscience, 2007, 12:4839- 4854.
[17]Joe AK, Liu H, Masumi S, et al. Resveratrol induces growth inhibition, S-phase arrest, apoptosis, and changes in biomarker expression in several human cancer cell lines[J]. Clinical Cancer Research, 2002, 8:893-903.
[18]陈家顺, 陶方方, 侯敏, 等. 白藜芦醇对鼠纤维肉瘤S180细胞周期及其机制研究[J]. 南京医科大学学报, 2008, 28(5):570-574.
[19]Bishayee A. Cancer prevention and treatment with resveratrol:from rodent studies to clinical trials[J]. Cancer prevention research(Philadelphia, Pa. ), 2009, 2(5):409-418.
[20]孟德萍, 邹志孟, 许晓群, 等. 白藜芦醇对黑色素瘤细胞增殖的抑制作用[J]. 中华肿瘤防治杂志, 2012, 19(5):328-331.
[21]Chen YM, Shih TW, Chiu CP, et a1. Effects of lactic acid bacteriafermented soy milk on mela nogenesis in B16F0 melanocytes[J]. Journal of Functional Foods, 2012, 5:395-405.
(责任编辑 李楠)
Study on Inhibition Mechanism of Melanogenesis and Melanin Synthesis of B16F10 Cell Induced by Two Natural Products
CHENG Xing-an1ZHANG Shu-ming1ZHOU Xiao-wu1WU Bo1LIN Xian-wei1QIN Xiang-jing2HUANG Su-qing1LIU Zhan-mei1JIANG Xu-hong1
(1. Institute of Natural Product Chemistry,Zhongkai University of Agriculture and Engineering,Guangzhou 510225;2. South China Sea Institute of Oceanology,Chinese Academy of Sciences,Guangzhou 510301)
This study aims to clarify the inhibition mechanism of proliferation and melanin synthesis of B16F10 cell induced by 10-hydroxycamptothecin(HCPT)and resveratrol(Res). MTT cytotoxicity assay,microscope observation-assay,L-Dopa oxidation-assay and NaOH cracking-assay were employed to investigate the proliferation,cellular morphology,tyrosinase(TYR)activity and melanin synthesis of B16F10 cells treated by HCPT and Res at different concentrations,respectively;and semi-RT-PCR to analyze the relative mRNA expression of TYR and microphthalmia associated transcription factor(MITF)in B16F10 cells. It was found that HCPT(40,80,120,160,and 200 μmol/L)and Res(80,120,160,and 200 μmol/L)inhibited B16F10 cell proliferation through inducing apoptosis,and exhibited significantly dose-dependent inhibiting effects on tyrosinase activity and melanin synthesis on B16F10 cell(P < 0.05). In addition,relative mRNA expressions of the TYR and MITF genes in B16F10 cells were depressed remarkably by HCPT at different concentrations and Res at high concentrations(120 and 160 μmol/L). Conclusively,HCPT and Res may inhibit the B16F10 cell proliferation via inducing cell apoptosis,and depress the melanin synthesis in B16F10 cells from down-regulating the transcription of MITF gene and subsequently inhibiting the gene expression of TYR mRNA and activity of TYR.
10-hydroxycamptothecin;resveratrol;tyrosinase;melanin;microphthalmia associated transcription factor
10.13560/j.cnki.biotech.bull.1985.2017-0122
2017-02-22
国家自然科学基金项目(21406274,21376281),广东省大学生创新训练项目(201411347034,201511347056)
程杏安,男,博士,副教授,研究方向:天然产物化学;E-mail:anzai_28@163.com
刘展眉,教授,硕士生导师,E-mail:liuzhanm@21cn.com;蒋旭红,教授,E-mail:jiangxh69@163.com

