假单胞菌趋化性研究概述
李涛

摘 要:趋化是生物体朝向或远离化学物质的一种运动形式。假单胞菌可感受周围化学物质浓度变化,通过极性鞭毛、菌毛驱动表现其群体趋化行为。已知假单胞菌趋化主要是由鞭毛介导和假定菌毛介导两种,本文主要阐述这两种趋化信号转导途径,总结了研究趋化行为的各种定性和定量的常规方法及新方法,以期为假单胞菌趋化性研究提供参考。
关键词:趋化;假单胞菌;信号转导
中图分类号:Q939.11+2 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2017.08.02
Abstract: Chemotaxis was a form of motion in which organisms move toward or away from chemicals. Pseudomonads could sense changes in the concentration of surrounding chemicals, and exhibit a chemotaxis mediated by flagella or pili. Two kinds of chemotaxis pathways has been described in this review, a flagella-mediated pathway and a putative pili-mediated system. This article mainly introduced the two kinds of chemotaxis signal transduction pathway, and summarized the conventional and new methods of qualitative and quantitative assay on chemotaxis, in order to provide a reference for pseudomonas chemotaxis research.
Key words: chemotaxis, Pseudomonads, signal transduction
1 趨化作用及细菌趋化介绍
趋化是生物体朝向或远离化学物质的一种运动形式,这一现象普遍存在于动物、植物及微生物中[1]。趋化作用是生物体为适应周围环境变化,方便其从环境中摄取食物并躲避危害,从而使自身具备生存优势的重要行为。
运动细菌作为微生物中的典型代表,同样具有趋向某些化学引诱剂的正趋化及远离某些化学驱逐剂的负趋化行为[2]。19世纪末,Engelmann等生物学家即发现了细菌向氧气、矿物质及有机营养物质的趋化。他们在显微镜下观察到细菌菌液趋向或远离气泡及化学物质的现象。早期的研究主要集中于趋化现象的观察,对于细菌趋化机制的了解少之又少。直至1969年Adler[3]通过大量实验证实细菌的趋化作用是由趋化物质直接刺激引发,而且是由趋化特异性受体所介导的。自此开始,各国科学家纷纷采用各种技术手段如:平板点滴实验(Drop assay)、游动平板法(Swarm plate assay)、毛细管法(Capillary assay)、数量分析法(Quantification assay)[4]等,分析细菌的趋化行为,并在分子生物学水平上研究参与细菌趋化作用的基因决定簇,阐明其趋化机制。根据趋化信号转导方式将趋化行为分为两大类,即:代谢依赖型趋化(metabolism-dependent chemotaxis)及非代谢依赖型趋化(metabolism-independent chemotaxis)[5]。
2 假单胞菌的趋化作用
假单胞菌(Pseudomonas)为需氧革兰氏阴性棒状菌,属变性菌。其代谢多样性惊人:可降解和代谢多种分子,因此其可能成为病原菌。假单胞菌长约1~5 μm,可被极性鞭毛、菌毛驱动或通过聚集、滑动来表现其群体行为,与细菌相似同样具有趋化作用[6]。目前文献报道其趋化主要是由鞭毛介导和假定菌毛介导两种[7]。
2.1 鞭毛介导的趋化
假单胞菌由鞭毛介导的趋化作用是靠其鞭毛旋转引起的,鞭毛旋转产生的力量可使细菌个体向前移动,其旋转模式为逆时针→顺时针→暂停→逆时针(CCW-CW-P-CCW)。当鞭毛确定对一种化学物质产生响应,其顺时针旋转频率就会降低。已研究清楚的双组分趋化信号转导系统是通过对不同配体的感应,借助与配体结合的受体将信号转换为基于激酶催化的路径,此信号转换引起鞭毛旋转,随后引发一系列与趋化有关的蛋白甲基化。此趋化反应的特异性主要取决于配体结合受体结构域(LBR)。
2.2 假定菌毛介导的趋化
假单胞菌假定抽搐移动机制是基于Ⅳ型菌毛的ETRE(延伸-拘束-收缩-延伸)。当菌体对某种化学物质产生反应,可能基于与大肠杆菌菌毛结构的同源性,假单胞菌以菌毛收缩和伸长抽搐从细胞的一端移向另一端。鞭毛介导的趋化中的双组份信号系统的组成和功能同样适用于菌毛介导的趋化过程。但此趋化过程细节及机理尚不明确,仍需进一步研究。
3 假单胞菌趋化信号转导途径
3.1 鞭毛介导的游动性趋化信号传导途径
此途径最主要的传导元件是cheA组氨酸激酶和两个cheW蛋白,cheW类似支架和cheA一起控制趋化信号的接收。mcp上的LBR感应引诱剂或驱逐剂浓度变化后激活cheA的自体组氨酸激酶活性。引诱剂浓度增加可使cheA活性丧失,鞭毛顺时针旋转频率下降;而驱逐剂浓度增加(或引诱剂浓度减少)会激活cheA活性,鞭毛顺时针旋转频率上升。鞭毛顺时针旋转可随机调整细胞运动方向,逆时针旋转可使细胞在特定时间内在同一方向上移动(即游动),而在谷草芽孢杆菌中与此机制相反。目前不清楚假单胞菌属cheA自激酶活性调节是与大肠杆菌还是枯草芽孢杆菌相似,还是与前两者完全不同。
mcp的甲基化水平由cheR和cheB的竞争作用决定。cheR可使mcp甲基化,而cheB作用相反,其自身活性则靠磷酸化作用调节。cheA的磷酸化可激活cheB-R, cheB可与cheR竞争性地脱去mcp上的甲基。cheY接受cheB上的磷酸基团变为cheY-P,cheY-P与蛋白FliM、FliN相互作用,驱动鞭毛马达顺时针旋转;cheZ可使cheY-P脱磷酸化,cheY可使鞭毛逆时针旋转。图1(a)Swimming中左上侧部分的结构和反应与鞭毛逆时针旋转有关,右上侧部分的结构和反应与鞭毛顺时针旋转有关。
3.2 假定菌毛介导的抽搐性趋化信号传导途径
此途径中的mcp甲基化水平是由类似于具有转甲基化功能的cheR的PilK及类似于具有脱甲基化功能的cheB的ChpB蛋白竞争性地调节。
信号传导组件是由类似于cheA自体组蛋白激酶活性的ChpA和类似于两个cheW的同系物PilI和ChpC组成。其过程与鞭毛介导的游动趋化途径相似,化学效应器mcp可感应到引诱剂和驱逐剂的浓度变化,调节ChpA自体组氨酸激酶活性,ChpA自体磷酸化驱动Ⅳ型菌毛马达从而控制菌体的抽搐移动,磷酸化与脱磷酸化之间是否存在竞争作用还有待于进一步研究。磷酸化的PilG通过作用于ATP酶PilZ和PilB及二鸟苷酸环化酶FimX介导菌毛的延伸,另一方面,磷酸化的PilH作用于ATP酶PilT/V介导菌毛的收缩。
图1(b)Twitching中上半侧部分的结构和反应均与菌毛的伸长和收缩相关,假定菌毛介导的信号传导系统用虚线标注出来。
4 各类趋化物质
趋化现象在各假单胞菌中普遍存在,对应的趋化物质也很多样。除了常见的趋化物质如:丝氨酸、天冬氨酸等氨基酸,半乳糖、麦芽糖等糖类,琥珀酸、苹果酸等有机酸类及二肽和嘧啶,文献报道已有大量的趋化物质被陆续发现。研究发现Pseudomonas aeruginosa能对苹果酸、柠檬酸[8]和咖啡因[9]产生趋化;Pseudomonas fluorescens可趋向于番茄分泌物[10];1990年Harwood等[11]发现 Pseudomonas putida可对氯代苯甲酸产生趋化;1997年Grimm等[12]和2003年Zaval Skii等[13]指出Pseudomonas sp.可对萘和联苯产生趋化;2011年发现了Pseudomonas 属的一些细菌可趋向于芳香烃类物质[14]。能引起趋化反应的效应物按其结构进行划分,能引起正趋化反应的包括:(a)羧酸类、 (b)氨基酸类、(c)芳香族化合物、(d)联苯类、(e)乙烯类、(f)呋喃类、(g)二氯甲烷类、(h)嘧啶碱类、(i)三嗪类 ;能引起负趋化反应的主要为磷脂类和不饱和长链脂肪酸类[7]。
5 趋化试验方法
5.1 趋化定性试验
5.1.1 平板点滴趋化试验 此法取培养好的假单胞菌菌悬液500 mL,8 000 rpm,离心5 min,去上清,使用4 ℃预冷的趋化缓冲液20 mL冲洗2次,最后悬浮于200 mL细菌趋化培养基中,每平板加入20 mL该趋化培养基,进行平板趋化实验。将不同的趋化物质以固体或液体形式加入平板中央,在一定时间内观察趋化现象。
图2为Pseudomonas fluorescens WCS365 对有机酸的平板点滴趋化试验,A平板加入趋化缓冲液,B平板加入40 mmoL·L-1 succinic acid,C平板加入100 mmoL·L-1 malic acid,照片拍摄于30 ℃培养30 min后[10]。
5.1.2 游动平板分析 采用改进的drop assay法:配制稀释LB固体培养基,在其中加入3.0 mmoL·L-1各类趋化物质。收集2 mL LB中培养过夜的假单胞菌菌液,用趋化缓冲液清洗两次后悬浮至1 mL。将固体稀释LB倒平板,待其基本凝固后,在平板正中央滴入菌液,点样量为2 μL,30 ℃培养时间48 h后观察趋化现象。
图3为Pseudomonas fluorescens WCS365、其cheA缺失突变株及无运动性突变株趋化试验[10]。
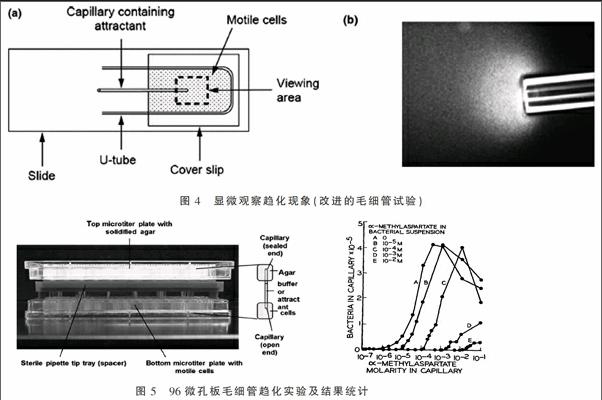
5.1.3 显微观察趋化现象(改进的毛细管试验)
本试验是将5 cm长的两端密封的熔点毛细管进行熔融弯曲成如图4(a)中的U形,将其放置在一片载玻片上,上面覆盖上盖玻片形成小室,小室中充满可移动的菌悬液(收集对数生长期的菌体,洗涤后重悬于趋化缓冲液,缓冲液中需加入EDTA螯合金属离子,还可添加少许甘油延长菌体移动时间),将一支含某种趋化引诱剂的1 μL一次性毛细管放入此U形小室中,此毛细管一端用高温火焰熔封。
可用放大20倍的显微镜计算聚集在毛细管口的菌体数目(即定量)。图4右是用暗视野显微镜放大40倍观察毛细管口的菌体趋化反应,明显看到管口菌体浓度很高如透明云团,此现象可维持1~30 min[7]。
5.2 趋化定量试验
5.2.1 常规毛细管法 采用图4(a)中的方法,将一段熔封的装有趋化引诱剂的毛细管插入菌悬液中,静置30~60 min后将毛细管移去,用无菌水将其表面冲洗干净,将内容物转移至含缓冲液的离心管中,然后将其稀释涂至平板计数,管中趋化物可设置浓度梯度,通过计数可找到相应趋化物的最低及最高趋化浓度。
5.2.2 高通量毛细管法 收集甘油盐中过夜培养至OD660=0.3~0.45的待测菌体,采用4 ℃预冷趋化缓冲液清洗两次后重悬至15 mL。分别吸取300 μL菌液置于每一微孔板小孔中。配制不同浓度的趋化物质溶液,将多根毛细管用3%琼脂糖密封后,在真空条件下充满趋化缓冲液或各類含引诱剂的趋化缓冲液,将此固定在上板中的多根毛细管翻转插入一系列含300 μL游动菌体悬浮液的小孔中,室温下趋化60~120 min[7]。结束后从上板中取下趋化毛细管,将外壁冲洗干净后,倾出内容物至2 mL离心管中。用PBS缓冲液对内容物进行适当梯度稀释后涂布固体LB平板,30 ℃培养36 h后计数。
如圖5右所示,以趋化物质溶液浓度为横坐标,计数所得毛细管中趋化的菌数为纵坐标做图,可得出不同趋化物质的阈值浓度。
6 结论与讨论
假单胞菌感应化学物质浓度梯度后可表现两种趋化途径:鞭毛介导和假定菌毛介导的途径。趋化蛋白可能与一些非趋化功能间存在关联,许多趋化蛋白功能还未可知。随着研究的进一步深入,越来越多的趋化物质被不断发现,研究趋化性的定性和定量方法不断革新。研究假单胞菌的趋化性对于研究其参与动植物的一些重要生理过程如发病机制、生物修复、生物防治等具有重要意义。
参考文献:
[1]JULIUS ADLER. Chemotaxis in bacteria[J]. Science,1966(153):708-716.
[2]JULIUS ADLER. The behavior of bacteria: on the mechanism of sensory transduction in bacterial chemotaxis[J]. Johns hopkins Med J,1979,144(4):121-126.
[3]JULIUS ADLER. Chemoreceptors in bacteria[J]. Science,1969,
166(3913):1588-1597.
[4]MARX R B,AITKEN M D. Quantification of chemotaxis to naphthalene by Pseudomonas putida G7[J]. appl environ Microbiol,1999,65(7):2847-2852.
[5]JEZIORE-SASSOON Y, HAMBLIN P A, BOOTLE-WILBRADAM C A, et al. Metabolism is required for chemotaxis to sugars in Rhodobacter sphaeroides[J]. Microbiology 1998,144 (1):229-239.
[6]HARWWOOD C S, RIVELLI M. ORNSTON L N.Aromatic acids are chemoattractants for Pseudomonas putida. [J] Bacteriol,1984, 160: 622-628.
[7]SAMPEDRO, R PARALES, T KRELL al. Hill. Pseudomonas chemotaxis[J]. FEMS microbiology reviews, 39, 2015, 17-46.
[8]ALVAREZ-ORTEGA C,HARWOOD C S.Identification of a malate chemoreceptor in Pseudomonas aeruginosa by screening forchemotaxis defects in an energy taxis-deficient mutant[J]. Appl environ microbiol,2007,73(23):7793-7795.
[9]DASH S S,SAILAGA N S,GUMMADI S N. Chemotaxis of Pseudomonas sp. to caffeine and related methylxanthines[J]. J basic microbiol,2008,48(2):130-134.
[10]DE WEERT S, VERMEIREN H, MRLDERS I H, et al. Flagella-driven chemotaxis towards exudate components is an important trait for tomato root colonization by Pseudomonas fluorescens[J]. Mol plant microbe interact,2002,15(11):1173-1180.
[11]HARWOOD C S, PARALES R E, DispensA M. Chemotaxis of Pseudomonas putida toward chlorinated benzoates[J]. Appl environ microbiol,1990,56(5):1501-1503.
[12]GRIMM A C, HARWOOD C S. Chemotaxis of Pseudomonas spp. to the polyaromatic hydrocarbon naphthalene[J]. Appl environ microbiol,1997,63(10):4111-4115.
[13]ZAVAL'SKII L,MARCHENKO A I,BOROVIK R V. Bacterial chemotaxis to naphthalene[J]. Mikrobiologiia,2003,72(3):407-413.
[14]LACAL J, MUNOZ-MARTINEZ F, RETES-DARIAS J A, et al. Bacterial chemotaxis towards aromatic hydrocarbons in Pseudomonas[J]. Environ microbiol,2011,13(7):1733-1744.

