纤维环穿刺结合TNF-α注射构建大鼠尾椎间盘退变模型的实验研究*
夏炳江张 磊胡松峰王 宁侯明生
(1.浙江省绍兴市中医院,浙江 绍兴 312000;2.浙江中医药大学,浙江 杭州 310053)
·研究报告·
纤维环穿刺结合TNF-α注射构建大鼠尾椎间盘退变模型的实验研究*
夏炳江1,2△张 磊2胡松峰1王 宁1侯明生1
(1.浙江省绍兴市中医院,浙江 绍兴 312000;2.浙江中医药大学,浙江 杭州 310053)
目的观察X线透视下纤维环穿刺结合肿瘤坏死因子-α(TNF-α)椎间盘内注射构建大鼠尾椎间盘退变模型的可行性。方法取3月龄清洁级SD大鼠96只,随机分为空白对照组(A组)、对照组(B组)和实验组(C组)各32只。C组大鼠在X线透视辅助下,利用0.6mm穿刺针穿刺尾椎5~6椎间隙(Co5/6),穿刺成功后,以微量注射器向椎间盘内注入TNF-α(10 ng/μL)25μL。B组大鼠在椎间盘穿刺成功后注入25μL生理盐水,A组大鼠不做任何处理。采用50%机械性撤足阈值、椎间隙相对高度、椎间盘组织学改变及椎间盘聚蛋白聚糖和Ⅱ型胶原基因表达评价大鼠尾椎间盘退变情况。结果造模后,C组大鼠50%机械性撤足阈值明显降低,椎间隙相对高度逐渐下降,HE染色显示椎间盘出现明显退变表现,椎间盘蛋白聚糖及Ⅱ型胶原mRNA表达下降,表明模型构建成功,与B组大鼠相比,C组大鼠诱发的椎间盘退变过程出现更早,进展更快,程度更重。结论X线透视下纤维环穿刺结合TNF-α椎间盘内注射是一种可行的建立大鼠尾椎间盘退变模型的方法,其所诱发的椎间盘退变过程出现更早,进展更快,程度更重。
椎间盘退变 TNF-α 动物模型 针刺
椎间盘退变性疾病(DDD)因椎间盘退变的病因和病理生理机制尚未完全阐明,故目前尚无理想的治疗方法。建立一种合理、规范的椎间盘退变动物模型能够为研究椎间盘退变发生及发展机制提供有利条件,同时为验证各种干预措施修复退变椎间盘有效性提供良好的实验载体。目前,肿瘤坏死因子-α(TNF-α)作为一种具有多种生物学效应的细胞因子,在椎间盘退变发生发展中的作用越来越受到重视。大量文献证实,退变椎间盘组织中TNF-α表达明显增高[1-2],且与人类盘源性腰痛的发生密切相关[3]。故本研究拟采用传统的纤维环针刺法结合外源性TNF-α椎间盘内注射的方法构建大鼠尾椎间盘退变模型,并采用行为学、放射学、组织学及分子生物学等方法评价椎间盘退变情况,以期建立一种稳定,可重复,且与人类椎间盘退变具有类似表现的动物模型。现报告如下。
1 材料与方法
1.1 实验动物
清洁级SD大鼠96只,12周龄,体质量 (220± 20)g,所有SD大鼠均由浙江中医药大学实验动物中心提供 (实验动物号:SYXK-浙-2008-0115),每笼4只,喂食普通颗粒饲料,室温(20±2)℃,自然光照,保持良好通风,自由进水进食。
1.2 试剂与仪器
Von Frey纤毛仪(美国Stoelting),多光谱小动物活体成像仪(美国Carestream Health),全自动组织脱水机(日本樱花),轮转式切片机(德国Leica),显微镜及显微拍摄系统(德国Leica),BI-2000医学图像分析系统 (成都泰盟科技有限公司),TNF-α(上海生工),Trizol提取液(上海生工),反转录试剂盒(TAKARA,大连),定量试剂盒(TAKARA,大连),PCR引物(上海生工)。
1.3 分组与造模
将96只大鼠,按随机区组设计原则,随机分为空白对照组(A组)、对照组(B组)和实验组(C组)各32只。C组大鼠在X线透视下,采用传统的纤维环针刺法结合外源性TNF-α椎间盘内注射的方法构建尾椎间盘退变模型,具体方法如下:所有SD大鼠术前禁食6 h,利用10%水合氯醛(0.3 mL/100 g)腹腔注射麻醉。取仰卧位,在X线透视引导下,利用0.6mm穿刺针穿刺尾椎5/6椎间隙(Co5/6)。当穿刺针进至椎间盘中心后,以微量注射器向椎间盘内注入TNF-α(10 ng/μL)25μL,停留约10 s后出针。术后肌肉注射青霉素10000 U预防感染,持续3 d,分笼常规饲养,自由活动。B组大鼠在椎间盘穿刺成功后注入25μL生理盐水,其他干预措施同C组大鼠。A组大鼠不做任何处理。
1.4 标本采集及检测
分别于造模前及造模后相应时间点每组各取8只大鼠测定50%机械性撤足阈值、椎间盘相对高度、椎间盘组织学改变及聚蛋白聚糖与Ⅱ型胶原(Col2)mRNA表达水平。
1.4.1 50%机械性撤足阈值测定 采用经典 “Up-Down”方法测定大鼠造模前及造模后1 d、3 d、1周、2周、4周、6周50%机械性撤足阈值,判定其是否产生病理性疼痛,该阈值与疼痛呈负相关[4]。为消除心理环境因素的干扰,测试前先将大鼠置于测试装置内1 h,使其适应环境,等待大鼠完全安静后开始试验。采用不同强度的von Frey hairs分别对大鼠后足足趾施加机械性刺激,测试时保持von Frey hairs垂直、微弯曲,刺激时间为6 s,期间若大鼠出现快速撤足即为阳性反应。若撤足反应为阴性,则增加1级刺激强度,若撤足反应为阳性,则将刺激强度减小1级。如此反复,以第1个转折点的前1点为起点,连续6次的刺激结果为最终的撤足反应模式。通过特定的程序将撤足反应模式转换为相应的撤足阈值。
1.4.2 椎间盘相对高度测量 在造模前及造模后第2、4、6周将大鼠麻醉后,行尾椎X线检查 (距离6.59英寸;曝光时间19 s;电压50 kV)。检查时将大鼠尾保持平直,检测后即时数字化成像,将影像学资料输入计算机系统,采用双盲法对其进行处理。Co5/6椎间盘相对高度测量方法[5]:将椎间盘宽度四等分,测量中点及其两侧各位点相邻椎体及椎间盘的高度,计算椎间盘高度指数 (DHI)=椎间盘高度平均值/椎体高度平均值,以DHI变化率(DHI%)代表椎间盘高度的变化,即DHI%=术后DHI%/术前DHI%×100%。
1.4.3 椎间盘组织学观察 在造模前及造模后第2、4、6周将大鼠Co5/6椎间盘(连同上、下部分椎体)用10%磷酸盐缓冲液甲醛固定72 h,14%EDTA液脱钙14 d,按常规脱水、透明、包埋、石蜡切片,厚约3~4μm,行常规HE染色,光镜下观察椎间盘髓核、纤维环以及交界区的组织学形态。根据纤维环与髓核的退变程度,各自评分(0~3分)。评分标准参考文献[6]执行。其中1分为轻度退变,2分为中度退变,3分为重度退变。
1.4.4 椎间盘聚蛋白聚糖及Ⅱ型胶原mRNA表达水平检测 完整切取大鼠Co5/6椎间盘,利用液氮迅速冷冻后将其研磨成粉。利用Trizol提取液提取总RNA,逆转录成cDNA,再以合成的cDNA作为模板进行PCR扩增。PCR所需引物序列[7]见表1。以GAPDH基因作为内参照,测量聚蛋白聚糖及Ⅱ型胶原mRNA的表达。上述指标均重复测量2次,取其平均值。

表1 RT-PCR引物序列
1.5 统计学处理
应用SPSS 13.0统计软件。多组间的差异比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 动物一般情况
本试验中所有SD大鼠均存活,无意外死亡等情况发生。所有SD大鼠造模前均行X线检查,以排除先天性尾椎畸形及椎间隙狭窄等情况存在。
2.2 各组大鼠造模前后各时间点50%机械性撤足阈值测定结果比较
见表2。造模前各组大鼠50%机械性撤足阈值比较无统计学意义 (P>0.05)。造模后各相应时间点,A组大鼠50%机械性撤足阈值,与基础阈值比较,均无明显改变(P>0.05)。B组大鼠50%机械性撤足阈值在造模后第1天下降,造模后第3天有所回升,7 d后维持在稳定水平至造模后6周,与A组大鼠同时间点阈值相比,差异有统计学意义(P<0.05)。C组大鼠50%机械性撤足阈值从造模后第1天开始下降,至第7天降至最低,并保持在低水平至造模后6周,与A组及B组大鼠同时间点阈值相比,差异有统计学意义(P< 0.05)。
表2 各组大鼠造模前后各时间点50%机械性撤足阈值比较(±s)

表2 各组大鼠造模前后各时间点50%机械性撤足阈值比较(±s)
与A组比较,*P<0.05;与B组比较,#P<0.05;与造模前1 d比较,△P<0.05。下同。
造模后组 别 n 造模前1d 1d 3d 1周 2周 4周 6周A组 8 22.32±8.39 23.12±7.43 21.56±8.22 22.54±7.25 23.02±9.34 22.35±8.72 23.48±9.38 B组 8 24.67±9.79 8.34±2.37*△9.16±3.03*△14.34±3.13*△15.76±2.74*△14.66±3.13*△14.17±3.55*△C组 8 23.02±8.62 5.32±1.11*#△4.33±1.45*#△2.04±0.75*#△3.02±0.72*#△2.36±0.64*#△2.53±0.88*#△
2.3 各组大鼠造模前后各时间点Co5/6椎间盘DHI%测量结果比较
见表3。造模前各组大鼠DHI比较无统计学意义(P>0.05)。造模后各相应时间点,A组大鼠DHI%,与造模前比较,均无明显改变(P>0.05)。B组大鼠DHI%在造模后逐渐下降,与A组大鼠同时间点DHI%相比,差异有统计学意义(P<0.05)。C组大鼠DHI%在造模后明显下降,与A组及B组大鼠同时间点DHI%相比,差异有统计学意义(P<0.05)。
表3 各组大鼠造模前后各时间点Co5/6椎间盘DHI%比较(%,±s)
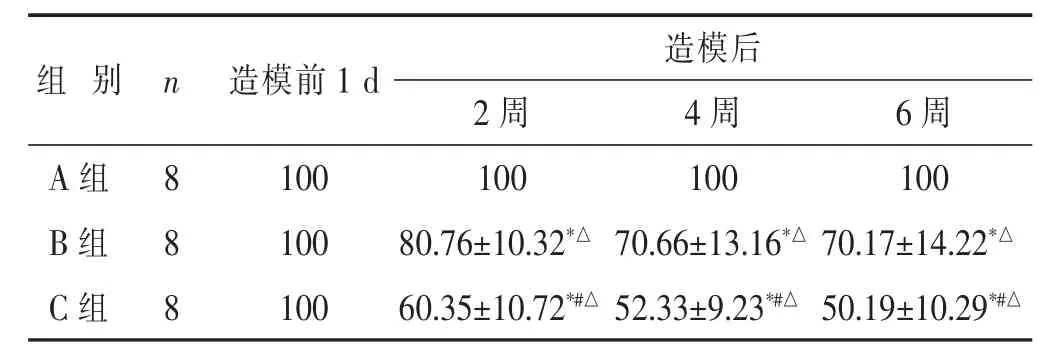
表3 各组大鼠造模前后各时间点Co5/6椎间盘DHI%比较(%,±s)
组别 n 造模前1 d 造模后A组 8 B组 8 2周 4周 6周100 100 100 100 100 80.76±10.32*△70.66±13.16*△70.17±14.22*△C组 8100 60.35±10.72*#△52.33±9.23*#△50.19±10.29*#△
2.4 各组大鼠造模前后各时间点Co5/6椎间盘组织学观察比较
见表4。A组大鼠在造模后第2、4、6周Co5/6椎间盘组织形态学无明显异常改变,纤维环胶原纤维排列有序,髓核与纤维环界限清晰,髓核组织中间可见较多的脊索细胞和类软骨细胞,分布均匀。B组大鼠在造模后2周,Co5/6椎间盘组织HE染色呈大致正常椎间盘组织学表现。造模后4周,开始出现纤维环板层状结构被破坏,髓核呈皱缩状,髓核细胞数量减少,但髓核内仍可见细胞结构和规律的细胞。C组大鼠在造模后2周即开始出现纤维环排列紊乱、裂隙及断裂,纤维环与髓核交界区变窄,髓核组织被破坏,其中部分髓核组织被成纤维结缔组织取代。
表4 各组大鼠造模前后各时间点Co5/6椎间盘HE染色评分比较(分,±s)

表4 各组大鼠造模前后各时间点Co5/6椎间盘HE染色评分比较(分,±s)
组别 n 造模前1 d 造模后A组 8 B组 8 2周 4周 6周0 0 0 0 0 1.00±0.71*△2.40±0.89*△3.00±1.22*△C组 80 3.24±0.83*#△3.84±0.84*#△4.80±1.30*#△
2.5 各组大鼠造模前后各时间点Co5/6蛋白聚糖及Ⅱ型胶原mRNA表达水平检测结果比较
见表5。造模前各组大鼠Co5/6椎间盘蛋白聚糖及Ⅱ型胶原mRNA比较差异无统计学意义(P>0.05)。造模后第2、4、6周,B组与C组大鼠蛋白聚糖及Ⅱ型胶原mRNA,与造模前比较,均有明显下降(P<0.05),其中C组大鼠蛋白聚糖及Ⅱ型胶原mRNA下降更明显,与B组大鼠同时间点相比,差异有显著统计学意义(P<0.05)。
表5 各组大鼠Co5/6椎间盘蛋白聚糖及Ⅱ型胶原mRNA表达比较(±s)
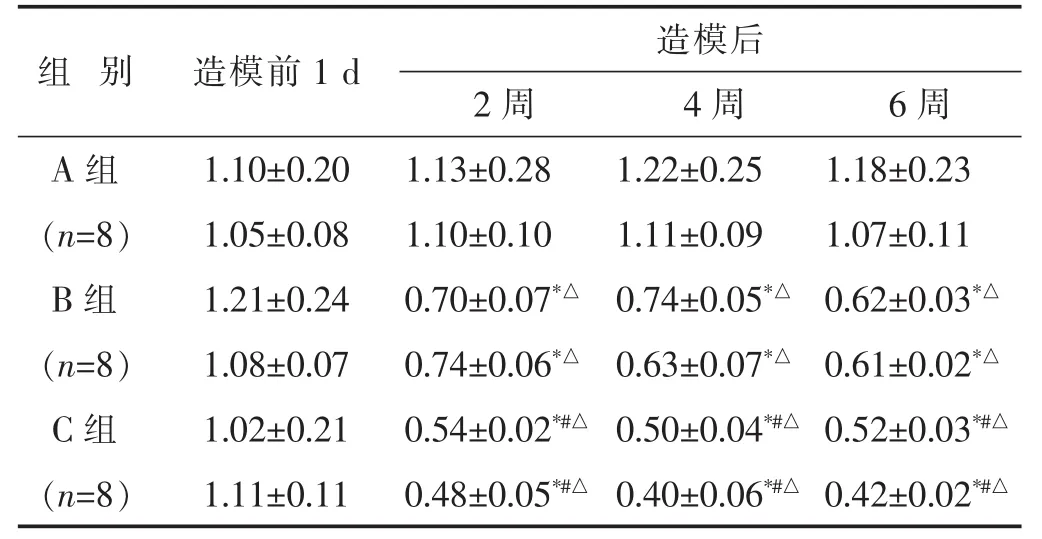
表5 各组大鼠Co5/6椎间盘蛋白聚糖及Ⅱ型胶原mRNA表达比较(±s)
组别 造模前1 d 造模后2周 4周 6周A组 1.10±0.20 1.13±0.28 1.22±0.25 1.18±0.23(n=8) 1.05±0.08 1.10±0.10 1.11±0.09 1.07±0.11 B组 1.21±0.24 0.70±0.07*△0.74±0.05*△0.62±0.03*△(n=8) 1.08±0.07 0.74±0.06*△0.63±0.07*△0.61±0.02*△C组 1.02±0.21 0.54±0.02*#△0.50±0.04*#△0.52±0.03*#△(n=8) 1.11±0.11 0.48±0.05*#△0.40±0.06*#△0.42±0.02*#△
3 讨 论
3.1 椎间盘退变模型构建方法
建立的椎间盘退变动物模型要求与人类的椎间盘退变具有相似性和可比性,应能再现椎间盘退变的客观规律,可重复,且所选动物的解剖结构与生理特点尽可能与人类接近,同时,应考虑经济因素和操作可行性[8]。目前利用大鼠建模较多,价格相对低廉、饲养方便,虽然其椎间盘较小,但解剖结构及生化成份与人类椎间盘相近[9]。在本实验中,作者采用SD大鼠来构建椎间盘退变模型。
纤维环损伤法是目前最常采用的椎间盘退变造模方法,其中以针刺纤维环造模法应用较广泛[10]。目前,TNF-α表达增高是椎间盘退变及下腰痛的重要病理生理学特征[11-12]。
本研究采用在X线透视下纤维环穿刺联合外源性TNF-α椎间盘内注射的方法来建立大鼠尾椎间盘退变模型。该法建立的椎间盘退变模型最大的特点是使用存在于退变椎间盘内的细胞因子TNF-α,能够更好的模拟椎间盘退变的病理生理过程,与单纯纤维环穿刺法相比更接近椎间盘退变的客观规律。
3.2 模型退变的效果评估
3.2.1 疼痛行为学 与椎间盘正常生理性衰老不同,病理性椎间盘退变的重要特征是可诱发疼痛,故对椎间盘退变模型进行疼痛评估,显得非常重要。在本研究中,笔者发现造模大鼠50%机械性撤足阈值从造模后第1天开始下降,至第7天降至最低,并保持在低水平至造模后6周,与A组及B组大鼠同时间点阈值相比,差异有统计学意义。由此,我们认为模型大鼠疼痛阈值降低,与临床椎间盘退变诱发疼痛现象类似,故该模型有助于研究和评估新药物或治疗技术缓解盘源性疼痛的疗效。
3.2.2 影像学指标 椎间盘组织在X线上虽然无法直接显示,但仍可通过间接观察椎间隙高度及椎缘骨质改变来推测椎间盘的变化,以判断椎间盘退变的严重程度[13]。既往研究已证明在X线片上测量到的椎间隙高度改变与椎间盘的组织病理学、免疫组织化学检测结果有较高的相关性[14]。在本研究中,笔者观察到大鼠椎间隙在造模后明显下降(P<0.05),提示造模后椎间盘出现明显退变。与单纯穿刺法相比,C组大鼠椎间隙高度丢失更早、更快及更严重,提示X线透视下纤维环穿刺结合TNF-α椎间盘内注射是一种可行的建立大鼠尾椎间盘退变模型的方法,其所诱发的椎间盘退变过程出现更早,进展更快,程度更重。
3.2.3 组织形态学 通过HE染色和其他不同的特殊染色对椎间盘组织进行评价分析是目前评估椎间盘退变最准确的方法。当椎间盘发生退变时,纤维环,髓核及软骨终板均会出现相应的病理改变[15]。在本研究中,大鼠在造模后2周即开始出现纤维环排列紊乱、裂隙及断裂,纤维环与髓核交界区变窄,髓核组织被破坏,其中部分髓核组织被成纤维结缔组织取代,提示椎间盘退变模型建立成功。此外,我们研究亦发现,与单纯穿刺法相比,联合应用TNF-α椎间盘内注射可更快诱导椎间盘出现退变。
3.2.4 分子生物学 研究表明,椎间盘退变是由细胞外基质的合成代谢与分解代谢的动态平衡被打破造成的,其中分解代谢因素更重要[16]。聚蛋白聚糖是椎间盘中蛋白多糖的主要类型。聚蛋白聚糖的降解,被认为是软骨退变早期的重要指标。聚蛋白聚糖降解可致后续的Ⅱ型胶原纤维降解,后者在稳定椎间盘自身结构及对抗外界压力负荷上具有重要的作用[17]。本研究发现,造模大鼠聚蛋白聚糖及Ⅱ型胶原mRNA明显下降,与对照组大鼠同时间点相比,差异有显著统计学意义,这些改变与人类椎间盘退变的病理过程与生化改变规律类似。
[1] Chen S,Huang Y,Zhou ZJ,et al.Up-regulation of tumor necrosis factor-αand ADAMTS-5 butnotADAMTS-4 in human intervertebral cartilage endplate withmodic changes[J]. Spine(Phila Pa 1976),2014,39(14):E817-825.
[2] You C,Zhu K,Liu X,et al.Tumor necrosis factor-alphadependent infiltration of macrophages into the dorsal root ganglion in a rat disc herniation model[J].Spine(Phila Pa 1976),2013,38(23):2003-2007.
[3] 姜世峰,申才良.腰椎Modic改变中炎性细胞因子的效应[J].中国组织工程研究,2012,16(17):3213-3217.
[4] Chaplan SR,Bach FW,Pogrel JW,et al.Quantitative assessmentof tactile allodynia in the rat paw[J].JNeurosciMethods,1994,53(1):55-63.
[5] Keorochana G,Johnson JS,Taghavi CE,et al.The effect of needle size inducing degeneration in the rat caudal disc:evaluation using radiograph,magnetic resonance imaging,histology,and immunohistochemistry[J].Spine J,2010,10(11):1014-1023.
[6] Sobajima S,Kompel JF,Kim JS,et al.A slowly progressive and reproducibleanimalmodelof intervertebraldisc degeneration characterized by MRI,X-ray,and histology[J].Spine(Phila Pa 1976),2005,30(1):15-24.
[7] Liang QQ,Cui XJ,Xi ZJ,et al.Prolonged upright posture induces degenerative changes in intervertebral discs of rat cervicalspine[J].Spine,2011,36(1):E14-E19.
[8] Masuda K.Biological repair of the degenerated intervertebral disc by the injection ofgrowth factors[J].Eur Spine J,2008,17(Suppl4):441-451.
[9] Rufai A,Ralphs JR,Benjamin M.The development of fibrocartilage in the rat intervertebral disc[J].Anat Embryol,1995,192(1):53-62.
[10]Li D,Yang H,Huang Y,et al.Lumbar intervertebral disc puncture underC-arm fluoroscopy:a new ratmodelof lumbar intervertebral disc degeneration[J].Exp Anim,2014,63(2):227-234.
[11]廖家新,王宸,吴小涛,等.退变腰椎终板MRI表现与其TNF-α的表达及临床疗效的相关性研究[J].现代医学,2008,36(3):201-203.
[12]Weiler C,Nerlich AG,Bachmeier BE,et al.Expression and distribution of tumor necrosis factor alpha in human lumbarintervertebraldiscs:a study in surgicalspecimen and autopsy controls[J].Spine(Phila Pa1976),2005,30(1):44-53.
[13]Brayda-Bruno M,TibilettiM,Ito K,etal.Advances in the diagnosisofdegenerated lumbar discsand theirpossible clinical application[J].Eur Spine J,2014(3):S315-323.
[14]Issy AC,Castania V,Castania M,etal.Experimentalmodelof intervertebral disc degeneration by needle puncture in Wistar rats[J].Braz JMed BiolRes,2013,46(3):235-244.
[15]Daly C,Ghosh P,Jenkin G,etal.A review ofanimalmodelsof intervertebral disc degeneration:pathophysiology,regeneration,and translation to the clinic[J].Biomed Res Int,2016(2016):5952165.
[16]Wang F,Jiang JM,Deng CH,etal.Expression of Fas receptor and apoptosis in vertebral endplates with degenerative disc diseases categorized as Modic type IorⅡ[J].Injury,2011,42(8):790-795.
[17]Nagase H,Kashiwagi M.Aggrecanases and cartilage matrix degradation[J].ArthritisRes Ther,2003,5(2):94-103.
An Experimental Study of the Construction of Caudal Intervertebral Disc Degeneration M odel in Rats by Anulus Fibrosus Puncture Combined w ith TNF-αInjection
XIA Bingjiang,ZHANG Lei,HU Songfeng,etal.Shaoxing Hospital of Traditional Chinese Medicine,Zhejiang,Shaoxing 312000,China.
Objective:To study the feasibility of the construction of caudal intervertebral disc degeneration model in rats by anulus fibrosus puncture combined with TNF-αinjection.M ethods:96 SD rats were divided randomly into the blank group(group A,n=32),the control group(group B,n=32)and the experimental group(group C,n=32).In group C,the coccygeal intervertbral discs in rats at Co5-6 were punctured by 0.06 mm needle and
25μL of TNF-α(10 ng/μL).In group B,the coccygeal intervertbral discs in rats at Co5-6 were punctured by 0.06 mm needle and received 25μL normal saline.In group A,no interventions were taken.The caudal intervertebral disc degeneration was evaluated by 50%mechanicalwithdrawal threshold,intervertebral disc relative height,intervertebral disc histological changes and intervertebral disc proteoglycan and collagen typeⅡgene expression.Results:Aftermodeling,the 50%mechanicalwithdrawal threshold decreased;intervertebral disc relative height reduced;intervertebral disc histological changed,HE staining showed visible disc degeneration;the gene expression of proteoglycan and collagen type II intervertebral disc decreased.All these showed the model was successful.Compared with group B,the process of intervertebral disc degeneration in group C appeared earlier,faster,and more serious.Conclusion:In X-ray fluoroscopy,anulus fibrosus puncture combined with TNF-α injection is a feasiblemethod for the establishment of caudal intervertebral disc degeneration model in rats.The process of intervertebral disc degeneration induced by thismethod appeared earlier,faster,and more serious.
Intervertebral disc degeneration;TNF-α;Animalmodel;Needle puncture
R285.5
A
1004-745X(2017)07-1167-05
10.3969/j.issn.1004-745X.2017.07.011
2017-03-29)
浙江省绍兴市科技计划项目(2015B70060);浙江省中医药科技计划项目(2016ZB132)
△通信作者(电子邮箱:xiabj2006@163.com)

