白芍总苷对全脑缺血再灌注损伤保护作用的研究*
史晴晴杜 欢于红梅黄 宁郭洋洋
(1.河北省廊坊市第四人民医院,河北 廊坊 065700;2.河南省三门峡市中心医院,河南 三门峡 472000)
·研究报告·
白芍总苷对全脑缺血再灌注损伤保护作用的研究*
史晴晴1△杜 欢2于红梅1黄 宁1郭洋洋1
(1.河北省廊坊市第四人民医院,河北 廊坊 065700;2.河南省三门峡市中心医院,河南 三门峡 472000)
目的观察白芍总苷对全脑缺血再灌注损伤的保护作用并初探其机制。方法采用四血管夹闭20min的方法制备大鼠全脑缺血再灌注模型,白芍总苷(50、100、200mg/kg)术前30min灌胃给药。再灌注6 h后,记录各组大鼠翻正反射恢复时间和脑电恢复时间,检测脑组织含水量,HE染色法观察大脑海马CA1区神经元形态结构变化,TUNEL法观察海马CA1区神经元凋亡状况;测定海马组织中炎症细胞因子含量,抗氧化酶活性和丙二醛(MDA)含量。结果中、高剂量白芍总苷能够显著降低全脑缺血再灌注大鼠翻正反射和脑电恢复时间并降低脑组织含水量(P<0.05或P<0.01),明显改善海马CA1区神经元病理性改变和凋亡状况,显著降低凋亡指数(P<0.01),显著降低炎症细胞因子(IL-1β、IL-6、TNF-α)含量(P<0.05或P<0.01),显著改善抗氧化酶(SOD、CAT、GSH-Px)活性并降低MDA含量(P<0.05或P<0.01)。结论白芍总苷对全脑缺血再灌注损伤具有一定的保护作用,可能与其保护海马CA1区神经元、抑制氧化应激和炎症反应有关。
白芍总苷 全脑缺血再灌注 细胞凋亡 炎症 氧化应激
局灶性脑缺血和全脑缺血是缺血性脑血管病的两种类型,前者多由脑血管栓塞所致,而全脑缺血多与心脏骤停、休克、窒息、外科手术所致低压低氧等有关[1-2]。及时恢复血流供应是挽救脑缺血患者的关键,紧急药物溶栓和介入手术是临床上的常用技术手段,但血液灌流恢复后往往出现脑缺血损伤进一步加重的现象,即脑缺血再灌注损伤,病理生理学研究发现炎症反应和氧化应激损伤是导致神经元继发性死亡的主要原因[3-4],因此以抑制炎症反应和氧化应激损伤为切入点,研发有效抑制再灌注损伤的新型药物或许是改善脑缺血疾病治疗效果的有效途径。白芍总苷为传统中药白芍的主要活性成分之一,具有抑制自身免疫、抗炎、抗氧化等多种活性[5],但白芍总苷对全脑缺血再灌注损伤是否具有保护作用的研究报道尚不多见。本实验拟通过制备全脑缺血再灌注大鼠模型并给予白芍总苷进行干预治疗,研究白芍总苷对全脑缺血再灌注损伤的影响并初步探讨其作用机制。
1 材料与方法
1.1 实验动物
健康清洁级SD大鼠 (雌雄不限)100只,体质量200~240 g,由河北医科大学实验动物中心提供,合格证号:SCXK(冀)2013-1-003。
1.2 试药与仪器
白芍总苷胶囊(宁波立华制药有限公司)。TUNEL试剂盒 (北京博奥森生物技术有限公司);白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)试剂盒(美国CST公司);超氧化物歧化酶(SOD)、过氧化氢酶 (CAT)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)试剂盒(安徽欣乐生物技术有限公司)。
1.3 分组与给药
将大鼠随机分为假手术组、模型对照组和白芍总苷低、中、高剂量(50、100、200 mg/kg)组,每组20只。术前30 min,白芍总苷各剂量组分别灌胃给药,假手术组和模型对照组大鼠均给予等体积0.9%氯化钠注射液。精确称量适量白芍总苷加入适量0.9%氯化钠注射液制备浓度为40mg/mL的白芍总苷溶液,并依次稀释制备浓度为20mg/mL、10mg/mL的白芍总苷溶液;各组给药剂量为5mL/kg。
1.4 模型制备
腹腔注射10%水合氯醛(3.0mL/kg)麻醉后,参照PulsinelliWA等[6]报道的四动脉夹闭的方法制备全脑缺血大鼠模型,以脑电图波幅下降到原来的1/4以下,翻正反射消失,瞳孔颜色变得灰白为全脑缺血成功标志,缺血20 min后恢复血流灌注;假手术组行手术通路,但不做夹闭血管处理。
1.5 标本采集与检测
1.5.1 记录翻正反射和脑电恢复时间 观察并记录翻正反射恢复时间;通过生物机能实验系统 (BL-420E型,成都泰盟科技有限公司)监测脑电振幅,达到正常振幅的75%即可认定为脑电恢复,记录所需的时间。
1.5.2 脑含水量的测定 每组随机取6只大鼠,麻醉后断头取脑,去除小脑和低位脑干后称大脑组织质量,即湿质量 (W);110℃恒温烘烤48 h后称重为干质量(D):脑含水量(%)=[(W-D)/W]×100%。
1.5.3 大脑海马CA1区神经元形态及凋亡状况的观察 每组随机取6只大鼠,参照1.5.2的方法取大脑组织,于4%多聚甲醛溶液中固定72 h,然后行石蜡包埋、切片、展片和脱蜡水化处理,行常规HE染色后通过倒置光学显微镜观察大脑海马CA1区神经元形态;行TUNEL染色观察海马CA1区神经元凋亡状况,每张图片随机选取互不重叠的5个视野并分别计数细胞总数和凋亡细胞数,然后计算凋亡指数(AI),AI(%)=(凋亡细胞数/细胞总数)×100%。
1.5.4 炎症细胞因子含量、抗氧化酶活性和MDA含量的测定 每组取剩余的8只大鼠,参照1.5.2的方法取大脑并剥取海马组织,加入适量冷裂解液行研磨匀浆,离心(3000 r/min,10 min)取上清液,按ELISA试剂盒步骤处理后通过酶标仪测定海马组织匀浆液中炎症细胞因子(IL-1β、TNF-α、IL-6)含量;分别按照试剂盒方法步骤处理后通过紫外-可见分光光度计测定SOD、CAT、GSH-Px活性和MDA含量。
1.6 统计学处理
2 结 果
2.1 各组大鼠翻正反射和脑电恢复时间的影响
见表1。模型对照组大鼠翻正反射和脑电均基本恢复需35min;经中高剂量白芍总苷干预治疗能够显著降低全脑缺血再灌注大鼠翻正反射和脑电恢复时间,差异有统计学意义(P<0.05或P<0.01)。模型对照组含水量较假手术组显著升高(P<0.01);经中、高剂量白芍总苷干预治疗能够显著降低全脑缺血再灌注大鼠脑组织含水量(P<0.05或P<0.01)。
表1 各组大鼠翻正反射和脑电恢复时间、脑含水量结果比较(±s)
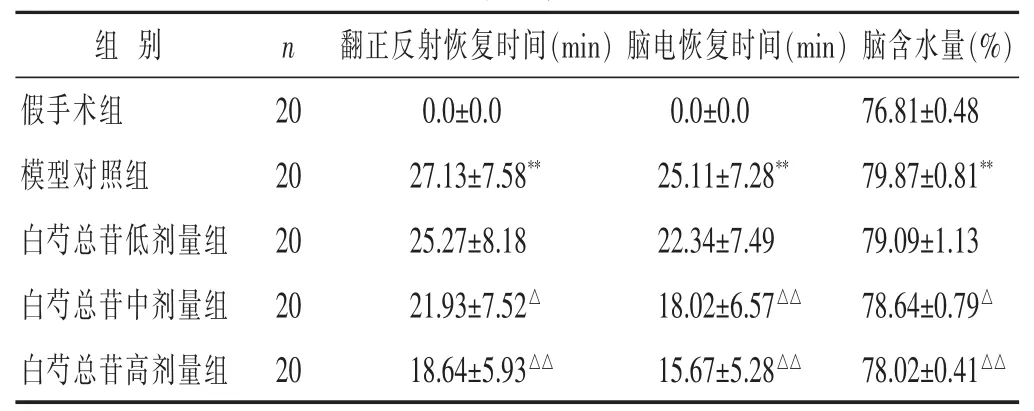
表1 各组大鼠翻正反射和脑电恢复时间、脑含水量结果比较(±s)
与假手术组比较,**P<0.01;与模型对照组比较,△P<0.05,△△P<0.01。下同。
翻正反射恢复时间(min)脑电恢复时间(min)0.0±0.0 0.0±0.0 27.13±7.58**25.11±7.28**25.27±8.18 22.34±7.49白芍总苷中剂量组 20 78.64±0.79△脑含水量(%)假手术组 20 76.81±0.48模型对照组 20 79.87±0.81**白芍总苷低剂量组 20 79.09±1.13组别 n 21.93±7.52△18.02±6.57△△白芍总苷高剂量组 20 18.64±5.93△△15.67±5.28△△78.02±0.41△△
2.2 各组大鼠大脑海马CA1区神经元形态的影响
见图1。假手术组海马CA1区神经元未见异常:层次清晰(3~5层),排列整齐,形态完整,胞质染色均匀,核膜、核仁清晰。模型对照组海马CA1区神经元形态结构呈现明显异常:层次紊乱,神经元数量减少、排列稀疏、间隙增大,胞体肿胀变形,部分神经元胞核固缩或溶解,核仁消失等。与模型对照组比较,白芍总苷各剂量干预治疗组海马CA1区神经元病变呈不同程度减轻,该药理学作用呈现一定的剂量依赖性,以白芍总苷高剂量组效果最为显著。

图1 各组大鼠大脑海马CA1区神经元形态(HE染色,400倍)
2.3 各组大鼠大脑海马CA1区神经元凋亡的影响
见图2。假手术组大鼠大脑海马CA1区仅见少量凋亡细胞(TUNEL染色阳性着色:细胞核黄褐色);模型对照组海马CA1区神经元凋亡细胞数较假手术组明显增多;与模型对照组比较,白芍总苷各剂量干预组海马CA1区凋亡细胞数呈不同程度减少,以白芍总苷高剂量组最为显著。计算并比较各组大鼠大脑海马CA1区神经元凋亡指数(AI):假手术组AI为(2.7±1.1)%,模型对照组AI为(64.9±8.6)%,白芍总苷低、中、高剂量组AI分别为 (59.3±10.4)%、(41.1±6.8)%、(15.6± 3.5)%;模型对照组AI较假手术组显著升高(P<0.01),经中高剂量白芍总苷干预治疗能够显著降低全脑缺血再灌注大鼠海马CA1区神经元AI(P<0.01)。

图2 各组大鼠大脑海马CA1区神经元凋亡状况(TUNEL染色,400倍)
2.4 各组大鼠脑组织炎症细胞因子含量的影响 见表2。模型对照组炎症细胞因子(TNF-α、IL-1β、IL-6)含量显著升高(P<0.01);经中高剂量白芍总苷干预治疗能够显著降低全脑缺血再灌注大鼠炎症细胞因子含量(P<0.05或P<0.01)。
表2 各组大鼠脑组织炎症细胞因子含量比较(nmol/L,±s)
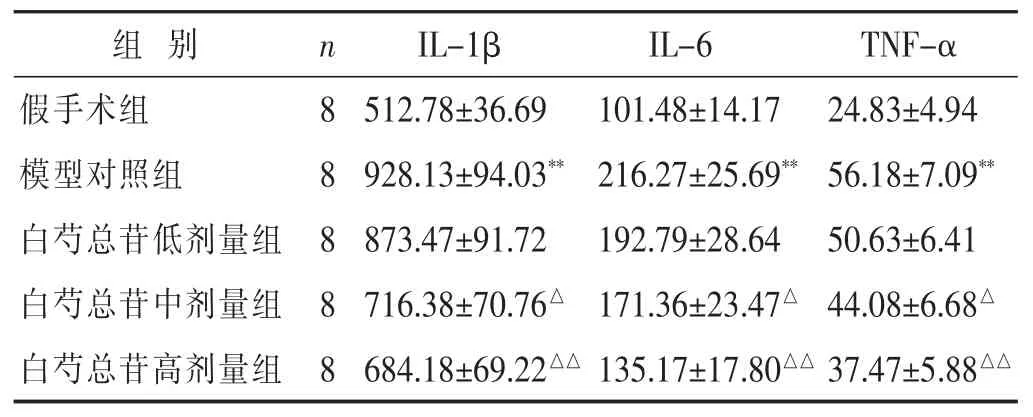
表2 各组大鼠脑组织炎症细胞因子含量比较(nmol/L,±s)
组别 n TNF-α假手术组 8 24.83±4.94模型对照组 8 56.18±7.09**白芍总苷低剂量组 8 50.63±6.41 IL-1β IL-6 512.78±36.69 101.48±14.17 928.13±94.03**216.27±25.69**873.47±91.72 192.79±28.64白芍总苷中剂量组 8 44.08±6.68△716.38±70.76△171.36±23.47△白芍总苷高剂量组 8 684.18±69.22△△135.17±17.80△△37.47±5.88△△
2.5 各组大鼠脑组织抗氧化酶活性和MDA含量的影响
见表3。模型对照组抗氧化酶活性较假手术组显著降低且MDA含量显著升高(P<0.01);经中高剂量白芍总苷干预治疗能够显著提高抗氧化酶(SOD、CAT、GSH-Px)活性并明显降低MDA含量(P<0.05或P<0.01)。
表3 各组大鼠脑组织抗氧化酶活性和MDA含量比较(±s)

表3 各组大鼠脑组织抗氧化酶活性和MDA含量比较(±s)
组别 n假手术组 8模型对照组 8白芍总苷低剂量组 8 SOD(U/mg)CAT(U/mg)173.27±8.86 5.10±1.42 139.15±8.22**2.71±1.04**144.02±8.60 3.04±1.17白芍总苷中剂量组 8 148.57±9.02△3.54±1.54△白芍总苷高剂量组 8 156.68±9.32△△4.01±1.68△△GSH-Px(U/mg)MDA(μmol/g)20.41±4.08 16.76±3.49 9.79±2.73**30.73±4.28**11.28±3.47 26.41±4.08 12.58±3.21△19.77±3.86△15.11±3.96△△17.46±3.17△△
3 讨 论
芍药分为赤芍和白芍,均来源于毛茛科芍药属植物的干燥根[7-8],二者功能主治与临床应用具有一定的差异[9]。但既往王飞等[10]和徐红梅等[11]研究发现,赤芍和白芍均能通过提高体内一氧化氮(NO)并降低内皮素(ET)含量而对血瘀大鼠血液流变学异常具有良好的改善作用,杨煜等[12]发现白芍总苷缩短大鼠体外血栓长度,改善血瘀大鼠血液黏度的药理学作用与赤芍总苷类似,并且白芍对血小板聚集功能的作用优于赤芍[13]。白芍总苷为白芍的主要活性成分,具有多种生物学活性,但白芍总苷对全脑缺血再灌注损伤是否具有保护作用及其可能的作用机制尚未见文献报道。本实验参照的PulsinelliWA等[6]报道的四动脉夹闭法是目前国际公认的全脑缺血动物模型制备方法之一[14],该方法制备的动物模型病理与人脑急性缺血性病变接近,且重复性强、成功率高。脑组织是对缺血缺氧最为敏感的器官,阻断血流后几分钟即可出现无氧酵解而大量生成乳酸,导致酸中毒,其中海马是对脑缺血最敏感的区域之一,而海马CAl区的锥体细胞层最为敏感[15],所以本研究选择大脑海马CA1区为观测区域。炎症细胞因子(TNF-α、IL-1β、IL-6)是临床上监测炎症反应的常用指标。正常生理状态下,体内生产的氧自由基(ROS)在SOD和CAT、GSH-Px的催化作用下最终被还原为对人体无害的H2O和O2[16-17];不饱和脂肪酸是细胞膜的主要组成之一,极易被ROS攻击而氧化最终生成MDA,因此MDA的含量水平能够间接反应机体氧化应激损伤程度[18]。
本研究结果显示,中高剂量白芍总苷干预治疗能够显著降低全脑缺血再灌注大鼠翻正反射恢复时间和脑电恢复恢复时间、降低脑组织含水量、抑制海马CA1区神经元病变并抑制其凋亡;降低海马组织炎症细胞因子(TNF-α、IL-1β、IL-6)含量,改善抗氧化酶(SOD、CAT、GSH-Px)活性并降低MDA含量;提示白芍总苷对全脑缺血再灌注损伤具有一定的保护作用,其作用机制可能与白芍总苷保护海马CA1区神经元、抑制氧化应激和炎症反应有关。
[1] Culman J,Nguyen-Ngoc M,Glatz T,et al.Treatment of rats withpioglitazone in the reperfusion phase of focal cerebral ischemia:Apreclinical stroke trial[J].Exp Neurol,2012,238(2):243-253.
[2] Harukuni I,Bhardwaj A.Mechanisms of brain injury after globalcerebral ischemia[J].NeurolClin,2006,24(1):1-21.
[3] 张予阳,刘岩,付守廷.脑缺血与炎症反应[J].中国药理学通报,2006,22(1):5-9.
[4] 刘超,刘敬霞,任非非,等.中医药保护脑缺血再灌注损伤的实验研究进展[J].中国老年学杂志,2016,36(2):481-484.
[5] 蒋午峻,王巧,李小娜,等.白芍总苷的药理作用和质量控制方法研究进展[J].河北医科大学学报,2006,27(5):500-502.
[6] PulsinelliWA,Brierley JB.A new model of bilateral hemispheric ischemia in the unanestized rat[J].Stroke,1979,10(3):267-272.
[7] Zheng Z,YenariMA.Post-ischemic inflammation:molecular mechanisms and therapeutic implications[J].Neurol Res,2004,26(8):884-892.
[8] 杨柳,许舜军,吴金雄,等.白芍、赤芍的比较研究概况[J].中药新药与临床药理,2011,22(5):577-580.
[9] 张建军,李伟,王丽丽,等.赤芍和白芍品种、功效及临床应用述评[J].中国中药杂志,2013,38(20):3595-3601.
[10]王飞,伍文彬,徐世军,等.赤白芍对血瘀证动物模型内皮功能及血液流变学的影响[J].中药药理与临床,2009,25(4):40-42.
[11]徐红梅,刘青云,戴敏,等.赤芍总苷对大鼠血液流变学的影响[J].中国中医药信息杂志,2002,9(11):17-20.
[12]杨煜,吕文伟,宋瑛士,等.白芍总苷抗血栓形成作用[J].中草药,2006,37(7):1066-1068.
[13]杨琪伟,杨莉,熊爱珍,等.赤芍和白芍抗血小板凝聚作用的UPLC-MS代谢组学初步研究[J].中国中药杂志,2011,36(6):698-701.
[14]赵勇,崔淑芳,汤球.血管性痴呆动物模型研究进展[J].上海实验动物科技学,2005,25(1):54-58.
[15]赵晴,杜建时,韩雪梅,等.大鼠急性全脑缺血再灌注损伤后细胞凋亡及红花保护作用研究[J].中国实验诊断学,2004,8(1):21-23.
[16]Jin Y,Liu K,Peng J,et al.Rhizoma dioscoreae nipponicae polysaccharides protect HUVECs from H2O2-induced injury by regulating PPARγfactor and the NADPH oxidase/ROSNF-κB signal pathway[J].Toxicol Lett,2014,4274(14):1378-1382.
[17]Lartigue A,Burlat B,Coutard B,etal.The Megavirus chilensisCu,Zn-superoxide dismutase:the first viral structure of a typical cellular copper chaperone-independent hyperstable dimeric enzyme[J].JVirol,2015,89(1):824-832.
[18]Kwiecien S,Magierowska K,Magierowski M,et al.Role of sensory afferent nerves,lipid peroxidation and antioxidative enzymes in the carbonmonoxide-induced gastroprotection against stress ulcerogenesis[J].JPhysiol Pharmacol,2016,67(5):717-729.
Protective Effect of Total G lucosides of Paeony on Global Cerebral Ischem ia-reperfusion Injury
SHIQingqing,DU Huan,YU Hongmei,et al. The Fourth People's Hospital of Langfang,Hebei,Langfang 065700,China.
Objective:To study the protective effect of total glucosides of paeony on cerebral ischemia reperfusion injury in rats and explore itsmechanism.Methods:A ratmodel of global cerebral ischemia reperfusion was prepared by clamping four vesselswith 20min.Total glucosides of paeony(50,100,200mg/kg)were administered by intragastric administration 30 min before operation.Six hours after of reperfusion,the recovery time of righting reflex and the recovery time of EEG were recorded,and the water content of brain tissue wasmeasured.HE stainingmethod was used to observe themorphological changes of neurons in CA1 region of hippocampus.The apoptosis of hippocampal CA1 neurons was observed by TUNEL,and the content of inflammatory cytokines,the activity of antioxidant enzymes and the content of malondialdehyde(MDA)in hippocampus were measured.Results:100,200 mg/kg total glucosides of paeony can significantly reduce the righting reflex and the recovery time of brain electricity and reduce the water content of brain tissue in rats with global cerebral ischemia and reperfusion(P<0.05 or P<0.01);it could obviously improve the pathological changes and apoptosis of neurons in CA1 region of hippocampus,and significantly reduce the apoptotic index(AI)(P<0.01);it significantly reduced the levels of inflammatory cytokines(IL-1β、IL-6、TNF-α)(P<0.05 or P<0.01);it significantly improved antioxidant enzymes(SOD,CAT,GSH-Px)activity and decreased MDA content(P<0.05 or P<0.01).Conclusion:Total glucosides of paeony have a protective effect on global cerebral ischemia reperfusion injury,whichmay be related to the protection of neurons in the hippocampal CA1 region and the inhibition of oxidative stress and inflammatory response.
The total glucosides of paeony;Global cerebral ischemic-reperfusion;Apoptosis;Inflammation;Oxidative stress
R285.5
A
1004-745X(2017)07-1172-04
10.3969/j.issn.1004-745X.2017.07.012
2017-04-27)
河北省廊坊市科技支撑计划项目(2016013151)
△通信作者(电子邮箱:lfsysqq@163.com)

